Отраслевой стандарт ОСТ 39-234-89
Вода для заводнения нефтяных пластов. Определение содержания сероводорода
(утв. приказом Министерства нефтяной промышленности от 6 февраля 1989 г. N 100)
(с изменениями от 6 июня 1990 г.)
Дата введения 1 июля 1990 г.
Срок действия 1 января 1991 г.
По информации, приведенной на сайте ФГУП "СТАНДАРТИНФОРМ" (http://www.standards.ru), настоящий ОСТ является действующим
Настоящий стандарт распространяется на пластовые и нефтепромысловые воды с температурой не более 45°С, используемые для закачки с целью заводнения нефтяных пластов.
Стандарт не распространяется на воду, содержащую отработанные сернистые щелочные стоки, а также на воду для щелочного заводнения, с добавкой различных вытесняющих растворов и композиций (растворов ПАВ, ингибиторов коррозии, бактерицидов, полимеров-загустителей и некоторых других реагентов) в случае возможности необратимого химического взаимодействия последних с сероводородом или с реактивами, использующимися при количественном определении сероводорода.
Стандарт также не распространяется на воду после очистки от сероводорода, связанной с его окислением (отдувка воздухом, хлорирование, электрохимическая очистка и т. д.).
Стандарт устанавливает два метода определения содержания сероводорода и его ассоциатов в нефтепромысловых водах: йодиметрический (в двух вариантах) и фотометрический, а также методику расчета содержания недиссоциированного сероводорода с учетом ионной силы раствора.
Стандарт применяется:
при оценке пригодности пластовых вод или их смесей с пресными водами в качестве агента для заводнения продуктивных коллекторов;
при обосновании технологии очистки нефтепромысловых сточных вод от сероводорода;
при разработке мероприятий по борьбе с коррозией нефтепромыслового оборудования;
при выборе источника водоснабжения для технических процессов нефтедобычи;
при разработке мероприятий по защите окружающей среды от загрязнения сероводородом и соблюдению норм техники безопасности.
1. Сущность методов анализа
1.1. Йодиметрический метод
Метод основан на окислении сероводорода и его ассоциатов в кислой среде йодом взятым в избыточном количестве. Количество йода, израсходованного на окисление, определяют по разности между прибавленным количеством йода и его избытком, который оттитровывают тиосульфатом.
Йодиметрическое определение осуществляется в двух вариантах. В первом варианте происходит превращение ассоциатов сероводорода в умеренно кислой среде в сероводород, который при этих условиях количественно титруется йодом с образованием йодид-ионов и элементарной серы:
J2 + Н2S→2J- + S ↓ + 2Н+
Второй вариант анализа характеризуется регенерацией сероводорода из осадка сульфида кадмия, полученного из законсервированной пробы по реакции:
CdS + 2Н+→ Н2S + Cd2+
Выделившийся сероводород сразу же связывается взятым в избытке титрованным раствором йода, как и в первом варианте.
1.1.1. Определению йодиметрическим методом мешает присутствие в воде органических и неорганических веществ, реагирующих с йодом. Наиболее типичным мешающим компонентом является соединения закисного железа. Мешающее действие остальных компонентов обычно проявляется при сравнительно малых концентрациях сероводорода (менее 50 мг/л) и может учитываться при анализе проведением "холостого" титрования в сочетании с консервацией уксуснокислым раствором ацетата кадмия.
1.1.2. Применение йодиметрического метода рекомендуется для концентрации сероводорода и его ассоциатов 5 мг/л и выше (без установления предела концентрации). В зависимости от концентрации анализируемых компонентов относительное стандартное отклонение изменяется в следующих пределах, %:
|
5-25 мг/л |
- 7-3 |
|
25-50 мг/л |
- 3-1,5 |
|
50-150 мг/л |
- 1,5-0,7 |
|
Более 150 - 0,7 мг/л |
-1 |
1.2. Фотометрический метод
Метод основан на образовании метиленовой сини при взаимодействии сероводорода с п-фенилендиамином и его производными в присутствии растворимых солей окисного железа.
Избыток окрашенных ионов окисного железа непосредственно перед измерением оптической плотности связывается фосфорной кислотой в бесцветный комплекс.
1.2.1. При фотометрическом методе анализа мешающее влияние оказывают вещества, непосредственно вступающие в реакцию с сероводородом, коллоидная сера, тиосульфаты, растворимые соединения меди, окрашенные вещества, находящиеся в воде в растворимом или коллоидном состоянии, а также тонкодисперсные эмульсии нефти и нефтепродуктов. Фильтрованием анализируемой воды через достаточно плотный фильтр содержание в ней эмульгированной нефти можно значительно снизить. Влияние окрашенных веществ и тонкодисперсных эмульсий на результат анализа компенсируется холостым замером оптической плотности исследуемой воды после проведения всех операций, за исключением добавки раствора п-фенилендиамина или его производных.
1.2.2. Минимальная концентрация сероводорода и его ассоциатов, определяемая фотометрическим методом - 0,05 мг/л, максимальная - 5 мг/л. Относительное стандартное отклонение в зависимости от концентрации анализируемых компонентов изменяется при этом методе следующим образом: при содержании 1-5 мг/л - от 7 до 3%; менее 1 мг/л - от 15 до 7%.
2. Отбор проб
2.1. В зависимости от целей анализа применяют разовый или серийный отбор проб. При серийном отборе проб каждая проба берется в определенной связи с остальными (зональный отбор, отбор через определенные промежутки времени и т. д.).
2.2. Места и интервалы отбора проб определяются согласно проекту установок систем подготовки воды для заводнения, но могут изменяться или уточняться руководством данных установок после согласования с главным инженером нефтегазодобывающего управления.
2.3. Лица, занимающиеся отбором проб, проходят специальный инструктаж.
2.4. В случае, если анализ пробы непосредственно после отбора невозможен, ее консервируют. Способы консервации и условия их применения приведены в разделе 3 и приложении 4.
2.5. Для отбора и хранения проб следует использовать химически чистые емкости объемом 0,5 л с герметически закрывающимися пробками. Если при отборе проб имеет место консервация раствором ацетата кадмия, то при предполагаемом содержании сероводорода и его ассоциатов 300-800 мг/л пробы следует отбирать в емкости вместимостью 100 мл, а при содержании более 800 мг/л - в емкости вместимостью 50 мл.
2.6. Перед отбором пробы следует слить воду из пробоотборного крана в количестве не менее 10 объемов пробоотборника.
2.7. При отборе проб необходимо избегать контакта воды с воздухом.
Для этого на пробоотборный кран надевают резиновый шланг со стеклянной трубкой на конце. Конец трубки должен доходить до дна емкости, в которую отбирается проба.
2.8. Перед заполнением емкость промыть три раза исследуемой водой. Заполнение проводят достаточно быстро, но без диспергирования пузырьков воздуха.
При предварительной подготовке емкостей для консервации проб добавкой нужных количеств реактивов в лаборатории емкости анализируемой водой не ополаскивать.
2.9. При отборе проб в морозную погоду в емкости с притертой стеклянной пробкой в сосуде следует оставлять небольшое воздушное пространство.
2.10. После отбора проб воды в рабочем журнале указывают следующие сведения:
дата отбора пробы (год, месяц, число, час);
место отбора;
вид и происхождение воды;
температура отбираемой воды;
должность и подпись лица, производившего отбор и подготовку пробы к анализу.
Запись по мере необходимости дополняют указанием особых условий, установленных при отборе пробы, а также способа консервации. Форма журнальной записи при отборе проб приведена в приложении 5.
2.11. Допускается приливать необходимые для анализа проб реактивы на месте отбора, а титрование или колориметрирование проводить в лаборатории.
3. Консервация проб
3.1. Целью консервации проб воды является сохранение ее компонентов и свойств в том же состоянии, что и в момент взятия пробы.
3.2. Консервация проб применяется в тех случаях, когда невозможно выполнить требования, изложенные в п. 4.2.
3.3. Если содержание в анализируемой воде взвешенных соединений железа превышает 1 мг на 1 л воды (в пересчете на элементарное железо), пробу перед консервацией фильтруют через бумажный фильтр средней плотности диаметром 12-15 см или слой ваты, закрепленной в конической воронке. Наличие в пробе взвешенных соединений железа устанавливается визуально (наблюдается черный, а в малых концентрациях - серый осадок) или проверяется путем качественного анализа (см. пп. 6.2.4 - 6.2.6).
3.4. Приготовление консервирующих растворов.
3.4.1. 25% раствор гидроокиси натрия: 125 г гидроокиси натрия (NaOH) растворяют небольшими порциями в дистиллированной воде при постоянном перемешивании и доводят дистиллированной водой до 0,5 л. Раствор хранят в полиэтиленовой емкости.
3.4.2. 40% раствор ацетата кадмия: 400 г кристаллогидрата ацетата кадмия (CH3COO)2Cd ´ 2H2O растворяют в дистиллированной воде, доводят дистиллированной водой до 1 л.
3.4.3. 10% уксуснокислый раствор ацетата кадмия: 100 г кристаллогидрата ацетата кадмия (CH3COO)2Cd ´ 2H2O растворяют в 0,5 л дистиллированной воды, добавляют 300 мл концентрированной уксусной кислоты (CH3COOH) и доводят дистиллированной водой до 1 л.
3.4.4. 10% раствор ацетата цинка: 100 г кристаллогидрата ацетата цинка (CH3COO)2Zn ´ 2H2O растворяют в дистиллированной воде и доводят дистиллированной водой до 1 л.
3.5. Консервация гидроокисью натрия
3.5.1. Консервация проб воды гидроокисью натрия основана на том, что в сильно-щелочной среде сероводород поглощается щелочью с образованием сульфид- и бисульфид-ионов.
3.5.2. Консервация гидроокисью натрия осуществляется следующим образом: в пустые емкости для отбора проб предварительно наливают 25% раствор гидроокиси натрия (из расчета 1 мл на 100 мл пробы). После заполнения емкости исследуемой водой примерно наполовину, содержимому сообщают вращательное движение и заливают воду до пробки, чтобы в емкости по возможности не оставалось пузырьков воздуха.
3.6. Консервация ацетатами кадмия или цинка.
3.6.1. Консервация ацетатами кадмия или цинка основана на осаждении сероводорода, а также растворимых сульфидных и бисульфидных форм сероводорода в виде практически нерастворимых в воде сульфидов кадмия или цинка.
3.6.2. Консервация ацетатами кадмия или цинка осуществляется следующим образом: в подготовленные пустые емкости заранее наливают рассчитанное в соответствии с п. 3.6.3 количество 40% раствора ацетата кадмия, или 5 мл 10% раствора ацетата цинка, или 10 мл 10% уксуснокислого раствора ацетата кадмия (в зависимости от условий, изложенных в приложении 4). Заполнение емкости анализируемой водой проводить в соответствии с п. 3.5.2.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 3.6.3 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
3.6.3. Количество 40% раствора ацетата кадмия (мл), требующееся для консервации анализируемой воды, рассчитывается по формуле
![]() , (1)
, (1)
где C s - предполагаемое суммарное содержание сероводорода и его ассоциатов в пробе воды, мг/л;
Vb - объем емкости, используемой для отбора пробы, мл.
Полученный по формуле (1) результат округляется в большую сторону с точностью до 1 мл.
3.7. Качественные анализы, необходимые для выбора способа консервации, приведены в приложениях 1, 2, 3, 4.
4. Хранение и транспортирование проб
4.1. Следует принимать все меры для сокращения времени между отбором пробы и ее анализом.
4.2. Анализ проб вод, в которых суммарное содержание сероводорода и его ассоциатов по текущим анализам не более 5 мг/л, должен начинаться не позднее 10-15 мин после отбора, а для остальных незаконсервированных проб - не позднее 1 часа.
4.3. При транспортировке емкости с пробами следует устанавливать в ящики с перегородками. Каждую емкость помещать в изолированное отделение. Промежутки между емкостями, а также места их контакта с перегородками прокладывать эластичным материалом (бумагой, войлоком, резиной).
4.4. Транспортировать пробы следует осторожно, доставляя их в лабораторию в течение времени, не превышающего срока хранения проб (см. п. 4.2 и приложение 4).
4.5. Минимальная температура хранения проб определяется температурой замерзания отобранной на анализ воды. При отсутствии данных о температуре замерзания воды, пробы следует хранить при температуре не ниже 0°С и не выше 25°С. Пробы, законсервированные растворами на основе ацетата кадмия, допускается хранить при температуре до 35°С.
4.6. Законсервированные пробы должны анализироваться не позднее срока, указанного в приложении 4. В противном случае качество анализа пробы не гарантируется, а полученный результат считается ориентировочным, что записывается в рабочем журнале.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 4.7 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
4.7. При фотометрическом определении сероводорода (см. п. 7.3.1) обработанную химреагентами пробу воды хранят в темноте не более суток.
5. Средства измерений, оборудование, материалы и реактивы
Для анализа проб используются:
фотоколориметр КФК-2 или спектрофотометры любых марок, позволяющие определять оптическую плотность водных растворов и# диапазоне длин волн 670±25 нм.
Иономер универсальный ЭВ-74 или иономер любых марок с аналогичными техническими характеристиками.
Микрокалькулятор "Электроника БЗ-35" или любой другой, позволяющий рассчитывать степенные функции.
Весы лабораторные технические любых марок.
Электроплитка с закрытой спиралью или колбонагреватель, рассчитанный на круглодонную колбу вместимостью 100 мл.
Колбы мерные исполнения 2 любого класса точности вместимостью 25, 50, 100, 200, 250, 500, 1000, 2000 мл по ГОСТ 1770-74E.
Пробирки П-2-20-0, 2ХС по ГОСТ 1770-74E.
Пробки резиновые по ГОСТ 7852-76.
Ступка фарфоровая (N 1-3) с пестиком (N 1-2) по ГОСТ 9147-80E.
Проволока из конструкционной углеродистой стали диаметром 0,6-1,0 мм по ГОСТ 17305-71.
Бюретки исполнения 1 или 2 любого класса точности на 10, 25 и 50 мл по ГОСТ 20292-74E.
Пипетки вместимостью 1, 2, 5 и 10 мл с делениями (исполнение 4 или 5), а также вместимостью 20, 25, 50 и 100 мл без делений (исполнение 2 или 3) по ГОСТ 20292-74Е.
Воронки делительные типа ВД вместимостью 250 и 500 мл любого исполнения по ГОСТ 25336-82Е.
Воронки лабораторные типа В по ГОСТ 25336-82Е.
Воронки фильтрующие с фильтрующим элементом из стекла марки ТХС ВФ-1-32-ПОР16 и ВФ-1-32-ПОР10 по ГОСТ 25336-82Е.
Колбы для перегонки КП-2-100-29ТХС по ГОСТ 25336-82Е.
Колбы конические любого исполнения вместимостью 100, 250 и 500 мл по ГОСТ 25336-82Е.
Склянка с тубусом типа "Склянка 1-0,5 по ГОСТ 25336-82Е с пробкой резиновой по ГОСТ 7852-76 и краном по ГОСТ 7995-80Е".
Стаканы типа Н исполнения 1 вместимостью 25, 50, 100, 250, 400, 600 и 1000 мл из стекла марки ТХС по ГОСТ 25336-82Е.
Бумага фильтровальная разной плотности.
Капельницы любого исполнения емкостью 50 мл из стекла марки ХС по ГОСТ 25336-82Е.
Палочки стеклянные.
Трубки стеклянные внешним диаметром 5-8 мм.
Вода дистиллированная по ГОСТ 6709-72.
Аммоний надсернокислый по ГОСТ 20478-75.
Аммоний роданистый по ГОСТ 27067-86 (СТ СЭВ 222-85).
Асбест волокнистый, ч, по ТУ 6-09-4010-75.
Бумага реактивная свинцовая по ТУ 6-09-3809-74.
Железо треххлористое, 6-водное, хч, по ГОСТ 4147-74.
Натрия гидроокись по ГОСТ 4328-77.
Кадмий уксуснокислый, 2-водный по ГОСТ 5824-79.
Калий йодистый по ГОСТ 4232-74.
Калий надсернокислый по ГОСТ 4146-74.
Калий роданистый по ГОСТ 4139-75.
Кислота серная, хч по ГОСТ 4204-77.
Кислота соляная, по ГОСТ 3118-77.
Кислота уксусная, по ГОСТ 61-75.
Кислота фосфорная, хч по ГОСТ 6552-58.
Крахмал растворимый, по ГОСТ 10163-76.
Медь (II) сернокислая, ч по ТУ 6-09-4525-77.
Медь (II) сернокислая, 5-водная по ГОСТ 4165-78.
Парафин гомогенизированный, ч по ТУ 6-09-4112-75.
Сера элементарная, осч по ТУ 6-09-2546-77.
Спирт амиловый, ч по ТУ 6-09-3467-79.
Хлороформ по ТУ 6-09-4263-76.
Цинк уксуснокислый 2-водный по ГОСТ 5823-78.
Стандарт-титры по ТУ 6-09-2540-87:
Йод, 0,01 н и 0,1 н;
Калий двухромовокислый, 0,1 н;
Кислота соляная, 0,1 н;
Натрий серноватистокислый, 0,1 н.
При фотометрическом определении общего содержания сероводорода и его ассоциатов (см. п. 7.3) необходим, кроме того, один из следующих реактивов:
п-Фенилендиамин по ТУ 6-09-995-76;
N, N - Диметил-п-фенилендиамин, ч по ТУ 6-09-07-1531-86;
N, N - Диметил-п-фенилендиамин сульфат, ч по ТУ 6-09-07-614-76;
N, N - Диметил-п-фенилендиамин дигидрохлорид по ТУ 6-09-07-1607-87;
N, N - Диэтил-п-фенилендиамин, ч по ТУ 6-09-07-543-86;
N, N - Диэтил-п-фенилендиамин сульфат по ТУ 6-09-07-1263-81.
Реактивы, квалификация которых не указана, должны быть "чистые для анализа" или хч.
6. Йодиметрический метод
6.1. Подготовка к анализу
6.1.1. Приготовление раствора роданистого аммония (NH4SCN) и роданистого калия (KSCN):
50 г роданида растворяют в 50 мл дистиллированной воды.
6.1.2. Приготовление раствора соляной кислоты плотностью 1,12 г/см3.
К 65 мл дистиллированной воды приливают 100 мл соляной кислоты плотностью 1,19 г/см3, не содержащей железа.
6.1.3. Приготовление 0,5% индикаторного раствора крахмала:
смешивают 5 г растворимого крахмала с 50 мл дистиллированной воды и приливают 950 мл кипящей дистиллированной воды. Раствор консервируют прибавлением 2-4 мл консервирующего вещества (амилового спирта или хлороформа).
6.1.4. Приготовление титрованных растворов йода, тиосульфата натрия, бихромата калия и соляной кислоты производится в соответствии с инструкциями, приложенными к комплекту стандарт-титров.
6.1.5. При хранении титрованных растворов тиосульфата натрия и йода их нормальность постепенно уменьшается. Поскольку раствор йода расходуется быстрее, чем раствор тиосульфата натрия, то после приготовления из ампул фиксанала свежей порции титрованного раствора йода производят установку титра раствора тиосульфата натрия по йоду способом, изложенным в приложении 6. Проверка титров растворов проводится один раз в две недели.
6.1.6. При малом расходе раствора тиосульфата натрия его титр проверяется по бихромату калия способом, изложенным в приложении 6.
6.1.7. Хранить титрованные растворы йода и тиосульфата натрия следует в темном прохладном месте в емкостях из темного стекла.
6.2. Качественный анализ
Полный качественный анализ при подготовке пробы к последующему количественному анализу йодиметрическим методом проводится только для случая, указанного в приложении 3, когда ориентировочное содержание сероводорода и его ассоциатов в воде неизвестно. В остальных случаях применяется неполный качественный анализ железосодержащих компонентов. Порядок использования результатов данного анализа приведен в приложениях 1, 2, 3, 4.
Перед выполнением любых видов анализа воду освобождают от пленочной нефти собиранием с помощью фильтровальной бумаги, а при большом количестве нефти для ее отделения используют делительную воронку.
6.2.1. В емкость, заполненную на 3/4 исследуемой водой, между пробкой и горловиной зажимают полоску свинцовой, индикаторной бумаги, смоченной дистиллированной водой. Потемнение бумаги указывает на присутствие свободного сероводорода.
6.2.2. Если анализируемая вода не содержит черного или серого осадка, в широкогорлую колбу на 100 мл вносят 50 мл воды, подкисляют соляной кислотой плотностью 0,12 г/см3 (0,5-1 мл) и проводят испытание со свинцовой бумагой в соответствии с п. 6.2.1. Потемнение бумаги при подкислении воды указывает на присутствие связанного сероводорода.
6.2.3. Если анализируемая вода содержит черный или серый осадок, его отфильтровывают. В фильтрате определяют присутствие связанного сероводорода в соответствии с п. 6.2.2. Если фильтрат вначале прозрачный, а затем начинает темнеть, то это свидетельствует о повышенном содержании железа в анализируемой воде. Вторичное фильтрование в таких случаях не проводится и дальнейший ход анализа остается без изменений, без учета содержания дополнительно выпавшего осадка сульфида железа.
Фильтр с осадком промывают дистиллированной водой, переносят в химический стакан, добавляют 5-10 мл соляной кислоты, плотностью 1,12 г/см3, персульфат аммония или калия (на кончике стеклянной палочки) и 1 мл раствора роданистого аммония или калия, приготовленного в соответствии с п. 6.1.1. Перемешивают. Появление кроваво-красной окраски свидетельствует о наличии сульфида железа в осадке.
Если при качественном анализе сероводород не обнаружен, можно считать, что сероводород и его ассоциаты в данной пробе практически отсутствуют.
6.2.4. Ориентировочное определение содержания железа во взвешенном в анализируемой воде осадке осуществляется следующим образом. Выполняют анализ в соответствии с п. 6.2.3, отмеряя определенный объем исследуемой воды (не менее 20 мл), фильтруют. Осадок на фильтре растворяют соляной кислотой плотностью 1,12 г/см3. Фильтр промывают дистиллированной водой. Полученный раствор доводят дистиллированной водой до объема первоначально профильтрованной анализируемой воды.
6.2.5. 10 мл данного раствора наливают в пробирку, вносят несколько кристаллов персульфата аммония или калия и 0,2 мл раствора роданида аммония или калия. После внесения каждого реактива содержимое пробирки перемешивают. Пробирку с полученным раствором рассматривают сбоку на белом фоне.
6.2.6. В случае появления светло-розовой или более бледной окраски содержание взвешенных соединений железа в пробе из расчета на элементарное железо не превышает 1 мг/л, а если окраска умеренно-розовая или красная, то содержание железа во взвеси больше 1 мг/л.
6.2.7. Пластовые и нефтепромысловые воды, как правило, содержат менее 1 мг/л растворенного железа при суммарной концентрации сероводорода и его ассоциатов более 100 мг/л при условии, если величина рН воды не ниже 5,5. Если эти условия не выполняются или необходимые данные текущих анализов отсутствуют, производится также ориентировочное определение содержания в анализируемой воде ионов двухвалентного железа (Fe(2+)) в соответствии с приведенными ниже операциями.
6.2.8. 10 мл фильтрата анализируемой воды наливают в пробирку и выполняют п. 6.2.5, предварительно добавив в содержимое пробирки 0,15 мл раствора соляной кислоты при перемешивании.
Содержание железа в данном случае определяется в соответствии с п. 6.2.6, но результат относят к содержанию железа в ионной (растворимой) форме.
6.2.9. При суммарном содержании сероводорода и его ассоциатов в воде до 5 мг/л и одновременном присутствии ионов Fe(2+) в количестве более 1 мг/л возможно только ориентировочное определение суммарного содержания сероводорода и его ассоциатов. В этом случае определение проводится йодиметрическим методом (второй вариант) или фотометрическим. При определении йодометрическим методом пробу консервируют 10% уксуснокислым раствором ацетата кадмия. В рабочем журнале в этом случае необходимо делать запись "ориентировочно".
6.3. Количественный анализ. Первый вариант.
6.3.1. Проведение анализа
В коническую колбу вместимостью 250 мл наливают примерно 20 мл дистиллированной воды, вносят около 1 г йодистого калия, прибавляют 1 мл раствора соляной кислоты плотностью 1,12 г/см3, а при консервации пробы щелочью - 2 мл. Полученную смесь перемешивают, приливают к ней 10 мл отмеренного пипеткой титрованного раствора йода и снова перемешивают. Затем добавляют из мерной пипетки, носик которой опущен на дно колбы, определенное количество отобранной воды, которую фильтруют, если это предусматривается схемой анализа, приведенной в приложении 1. В остальных вариантах на анализ берется освобожденный от плавающей нефти верхний слой жидкости, который не фильтруется, за исключением случаев присутствия в воде нерастворимых в воде сульфидов тяжелых металлов (кроме железа). Фильтрование производится тем же способом, что и при консервации проб (п. 3.3).
Количество анализируемой воды для одного количественного определения, а также нормальности титрованного раствора йода следует принимать в соответствии с таблицей 1.
6.3.2. Смесь, полученную по п. 6.3.1, встряхивают и оттитровывают избыток йода раствором тиосульфата натрия с той же нормальной концентрацией, что и у примененного для анализа титрованного раствора йода.
В конце титрования, когда цвет раствора станет соломенно-желтым, добавляют 1 мл 0,5% водного раствора крахмала. Титрование заканчивают при обесцвечивании полученной смеси.
6.3.3. Если наличие избытка йода в подготовленной для титрования смеси вызовет сомнение, в нее сразу добавляют 0,5% раствор крахмала. Если посинения окраски раствора не наблюдается, следует уменьшить объем анализируемой воды или применить титрованный раствор йода с большей нормальностью.
Таблица 1
|
Предполагаемое общее содержание сероводорода и его ассоциатов, мг/л |
Количество анализируемой воды, мл, для титрованного раствора йода с нормальностью |
||
|
0,02 |
0,05 |
0,1 |
|
|
5-25 |
100 |
- |
- |
|
25-50 |
50 |
100 |
- |
|
50-150 |
- |
50 |
100 |
|
150-300 |
- |
25 |
50 |
|
300-800 |
- |
10 |
20 |
|
800-1600 |
- |
5 |
10 |
|
Более 1600 |
- |
- |
5 |
Нумерация пунктов приводится в соответствии с источником
6.3.3. Обработка результатов. Первый вариант
6.3.3.1. Суммарное содержание сероводорода и его ассоциатов (мг/л) в пересчете на недиссоциированный сероводород вычисляется по формуле
![]() , (2)
, (2)
где V1 - количество прибавленного раствора йода, мл;
К1 - поправочный коэффициент для приведения концентрации раствора йода к точному значению;
V2 - количество раствора тиосульфата натрия, израсходованного на обратное титрование, мл;
К2 - поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точному значению;
N - нормальность титрованного раствора тиосульфата или йода (по табл. 1);
Vр - количество исследуемой воды, взятой пипеткой на анализ, мл;
К r - поправочный коэффициент на добавку консервирующего реагента (раствора гидроокиси натрия), равный 1,01. При отсутствии консервации пробы K = 1.
6.3.3.2. За результат анализа принимают среднее арифметическое двух параллельных определений, допустимые расхождения между которыми не должны превышать значений, указанных в таблице 2; доверительная вероятность 0,95.
Промежуточные значения допускаемых расхождений находятся путем линейной интерполяции табличных данных.
Значения относительных стандартных отклонений, приведенные в табл. 2, справедливы при условии, если количество воды, взятой на каждый анализ, не меньше указанного в табл. 1. В противном случае табличные данные увеличиваются во столько же раз, во сколько занижен объем воды по сравнению с оптимальным по табл. 1. Занижение объема не должно превышать 2, 5; в этом случае анализ следует повторить с большим количеством воды.
Таблица 2
|
Пределы изменения концентрации, мг/л |
Допускаемое расхождение, мг/л |
Относительное стандартное отклонение, |
|
5-25 |
1-2 |
7-3 |
|
25-50 |
2 |
3-1,5 |
|
50-150 |
2-3 |
1,5-0,7 |
|
Более 150 |
Не более 2% от установленной концентрации |
0,7-1 |
6.4. Количественный анализ. Второй вариант
6.4.1. Проведение анализа.
Емкость с выпавшим на дно осадком сульфида кадмия откупоривают. Сифоном отсасывают примерно половину прозрачной жидкости. В случае попадания взвеси в жидкость ее следует фильтровать через фильтрующую воронку с целью улавливания следов сульфида. Далее отсасывают следующую порцию жидкости, которую профильтровывают через ту же воронку, оставляя в емкости для отбора проб приблизительно 50 мл концентрированной суспензии для последующего анализа.
Если проба была отобрана в мерные колбы емкостью 50 или 100 мл, с пробой поступают так же, как с концентрированной суспензией.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 6.4.2 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
6.4.2. В отдельную склянку (А) приливают определенное количество 0,1 н раствора йода (мл), рассчитанное по формуле
![]() , (3)
, (3)
где CS - предполагаемое суммарное содержание сероводорода и его ассоциатов в анализируемой воде, мг/л;
VW - объем пробы анализируемой воды, мл.
Полученный по формуле (3) результат округляется в большую сторону с точностью до 1 мл.
Затем в ту же склянку добавляют раствор соляной кислоты плотностью 1,12 г/см3, объем которого равен двум объемам раствора йода, рассчитанного по формуле (3). Склянку закрывают пробкой и перемешивают содержимое.
6.4.3. В емкость с оставшейся после сифонирования суспензией наливают примерно 4/5 приготовленной согласно п. 6.4.2 йодосодержащей смеси, считая на объем и перемешивают. В эту емкость вставляют фильтрующую воронку с осадком сульфида кадмия и обрабатывают осадок на фильтре оставшимся количеством йодосодержащей смеси. Остатки раствора с фильтра смываются в эту же емкость дистиллированной водой. В промежутках времени между всеми операциями, связанными с обработкой осадка сульфида йодосодержащей смесью, фильтр с осадком следует накрывать стеклом, а емкость со вставленной фильтрующей воронкой помещать в темное место. Контроль за полнотой растворения на фильтре осадка сульфида осуществляют визуально. В случае необходимости обработку фильтра повторяют фильтратом.
При отборе проб в емкости вместимостью 50 и 100 мл обработка осадка сульфида кадмия осуществляется аналогичным образом, но без фильтрации взвеси. Содержимое целиком переводится в склянку В вместимостью 0,5 л. Осадок сульфида кадмия, осевший на стенках емкости, в которую была отобрана проба, смывают дистиллированной водой. Если осадок не смывается полностью, его обрабатывают оставшимся количеством йодсодержащей смеси (примерно 1/5 от первоначального объема). Остатки йодсодержащей смеси из склянки А без потерь переводятся в склянку В дистиллированной водой.
6.4.4. Через 5 минут после обработки концентрированной суспензии реактивами проверяют визуально наличие желтого осадка в пристенной области у дна емкости. При отсутствии осадка раствор переливают в склянку А, в которой до этого готовилась йодсодержащая смесь, для последующего титрования. При отборе проб в емкости объемом 50 и 100 мл титрование ведут в склянке В. Избыток йода оттитровывают раствором тиосульфата натрия по крахмалу до обесцвечивания.
Если осадок сульфида полностью не растворился, время обработки осадка йодсодержащей смесью увеличивают.
6.4.5. Если проба консервировалась уксуснокислым раствором ацетата кадмия дополнительно выполняется холостое определение. Отмеряют пипеткой 100 мл фильтрата, полученного после фильтрации через стеклянный фильтр по п. 6.4.1 и проводят титрование как в первом варианте йодиметрического определения, приливая фильтрат к реакционной смеси, содержащей 10 мл 0,1 н раствора йода. Для обратного титрования в данном случае следует использовать раствор тиосульфата с нормальностью 0,02 или 0,05.
6.4.6. Обработка результатов. Второй вариант.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 6.4.6.1 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
6.4.6.1. Суммарное содержание сероводорода и его ассоциатов (мг/л) в пересчете на недиссоциированный сероводород вычисляется по формуле
![]() , (4)
, (4)
где N Na2S2O3 - нормальность титрованного раствора тиосульфата натрия, использовавшегося при основном определении;
V1 - количество прибавленного раствора йода, мл;
К1 - поправочный коэффициент для приведения концентрации раствора йода к точному значению;
V2 - количество раствора тиосульфата натрия, израсходованного на обратное титрование, мл;
К2 - поправочный коэффициент для приведения концентрации раствора тиосульфата натрия к точному значению;
V l - суммарное количество жидкости (с учетом консерванта), залитой в емкость при отборе пробы, мл;
V r - количество прибавленного раствора консервирующего реагента (ацетата кадмия), мл;
С в - величина, соответствующая поправке к величине С s вычисляющаяся в случае проведения холостого определения.
Для вычисления величины С в используется следующая формула
![]() , (5)
, (5)
где NвNa2S2O3 - нормальность раствора тиосульфата натрия, использовавшегося при холостом определении;
V1 - количество прибавленного раствора йода, равное 10 мл;
К1 - поправочный коэффициент для приведения концентрации раствора йода к точному значению;
V в , K в - величины, аналогичные величинам V2 , К2 в формуле (4), но относящиеся к холостому определению;
V s - количество концентрированной суспензии, выделенной из отобранной пробы, мл;
V l , V r - величины, соответствующие величинам V l , V r в формуле (4).
При отборе проб в емкости вместимостью 50 и 100 мл величины Vs и Vl равны между собой, поскольку жидкость в этом случае не сифонируется. Когда холостое определение не проводится, величина Св принимается равной нулю.
6.4.6.2. Достоверность результатов анализа определяется по аналогии с первым вариантом анализа (п. 6.3.3.2), с использованием данных табл. 2. Однако во втором варианте значения относительного стандартного отклонения, приведенные в табл. 2, не зависят от количества воды, взятой на анализ, поскольку количество это в любом случае достаточно велико.
Данные табл. 2 не распространяются на ориентировочный анализ для условий, предусмотренных в п. 6.2.9, поэтому в этом случае за результат анализа принимают среднее арифметическое двух параллельных определений, независимо от того, насколько два первичных результата отличаются друг от друга. При ориентировочном анализе допускается также выдавать результат по единственному определению.
7. Фотометрический метод
7.1. Подготовка к анализу
Все реактивы для анализа готовят на дистиллированной воде, перегнанной в стеклянной посуде.
7.1.1. 0,1 н раствор соляной кислоты готовят из фиксанала на свежепрокипяченной и охлажденной дистиллированной воде.
7.1.2. 0,01 н раствор гидроокиси натрия готовят растворением 0,4 г кристаллической гидроокиси натрия (NaOH) в свежепрокипяченной дистиллированной воде с последующим доведением объема до 1 литра.
7.1.3. Раствор серной кислоты (1:1) готовят осторожным приливанием концентрированной серной кислоты (H2SO4) к дистиллированной воде при непрерывном перемешивании и охлаждении.
7.1.4. Реактив А представляет собой раствор п-фенилендиамина или его производных, указанных в разделе 5, в растворе серной кислоты (1:1) и приготавливается следующим образом: в 100 мл раствора серной кислоты (1:1) растворяют 0,03 г п-фенилендиамина, или N, N-диметил-п-фенилендиамина или N, N-диэтил-п-фенилендиамина. В случае использования сульфат или дигидрохлоридпроизводных N, N-диметил-п-фенилендиамина и N, N-диэтил-п-фенилендиамина отвешивается 0,05 г одного из данных реактивов. Полученный раствор хранят в холодильнике не более двух месяцев.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 7.1.5 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
7.1.5. Реактив В получают растворением 50 г хлорного железа (FeCl3 ´ 6H2O) в дистиллированной воде с последующим доведением объема до 50 мл. После отстаивания раствор декантируют.
7.1.6. Смесь для получения газообразного сероводорода приготавливают смешением порошкообразной серы, измельченной в ступке, с парафином и измельченным асбестом в соотношении 3:5:2 по массе. При нагревании выше 170°С из расплава данной смеси выделяется сероводород. При охлаждении реакция прекращается, но вновь вызывается нагреванием. Исходную смесь можно заготовлять заранее и расходовать по мере необходимости (1 г смеси дает около 150 мл газообразного сероводорода). Получение газообразного сероводорода производят в вытяжном шкафу.
7.1.7. Приготовление стандартных растворов и построение калибровочной кривой для количественного анализа фотометрическим методом.
Приготовление стандартных растворов производится в вытяжном шкафу.
Метод приготовления стандартных растворов основан на насыщении газообразным сероводородом 0,1 н раствора соляной кислоты с последующей нейтрализацией полученного раствора гидратом окиси натрия до рН 11 + 12, при которой происходит образование кислой соли сероводородной кислоты (NaHS).
Применение в качестве поглотителя сероводорода 0,1 н раствора соляной кислоты обусловлено тем, что в солянокислой среде этот газ практически не окисляется кислородом воздуха.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в пункт 7.1.5 настоящего ОСТа внесены изменения, вступающие в силу с 1 ноября 1990 г.
7.1.8. Смесь, полученную по п. 7.1.6, помещают в перегонную колбу емкостью 100 мл, которую закрывают стеклянной пробкой и закрепляют на колбонагревателе или электроплитке с закрытой спиралью на асбестовой прокладке. На отвод перегонной колбы надевают кусок резинового шланга длиной около 0,5 м. Смесь в колбе нагревают до начала выделения из нее газообразного сероводорода, что определяют с помощью смоченной водой свинцовой индикаторной бумаги. После этого сероводород в течение нескольких минут пропускают из шланга, опущенного на дно бутыли емкостью 0,5 л, через раствор соляной кислоты, налитый в эту бутыль (она заполняется раствором примерно наполовину). Вместо бутыли можно также применять склянку с тубусом той же вместимости, что требует, однако, более осторожного выполнения операции. После пропускания сероводорода указанные емкости закрывают пробками и периодически встряхивают через каждые 5-7 минут в течение 0,5 часа. Затем раствор переливают в стакан емкостью 250 мл, в который помещают электроды от подготовленного к измерению рН иономера.
Кислотный раствор в стакане подщелачивают 25% раствором гидроокиси натрия, быстро приливаемым из пипетки до тех пор, пока рН раствора не возрастет до 11 + 12.
Полученный раствор бисульфида натрия (NaHS) сразу же переливают в мерную колбу вместимостью 250 мл и немедленно определяют содержание бисульфида (в пересчете на газообразный сероводород) по первому варианту йодиметрического определения (6.3). После установления точной концентрации бисульфида в растворе (Сs, мг/л) его разбавляют 0,01 н раствором гидроокиси натрия до концентрации 10 мг/л (в пересчете на свободный H2S).
Количество исходного раствора бисульфида натрия (мл), которое нужно взять для получения раствора бисульфида с концентрацией 10 мг/л (по сероводороду) находится по формуле
![]() , (6)
, (6)
Рассчитанное количество раствора бисульфида соответствует кратности разведения в мерной колбе вместимостью 250 мл. Исходный раствор вносится в мерную колбу калиброванной пипеткой либо из бюретки.
7.1.9. Для построения калибровочной кривой в мерных колбах емкостью 100 мл готовят серию стандартных растворов бисульфида натрия с содержанием 0,05; 0,1; 0,2; 0,3; 0,4; 0,5; 0,6 мг связанного сероводорода (H2S) в 1 л раствора.
В мерные колбы добавляют соответственно 0,5; 1; 2; 3; 4; 5 и 6 мл приготовленного раствора бисульфида и разбавляют 0,01 н раствором гидроокиси натрия до метки.
Проводят фотометрическое определение оптической плотности приготовленных стандартных растворов по п. 7.3.
Кроме того, один замер оптической плотности производят с использованием чистой дистиллированной воды (холостая проба), внося в нее требуемые количества реактивов. В качестве раствора сравнения использовать дистиллированную воду. Выбор рабочей длины кюветы должен определяться оптимальным диапазоном измеряемых оптических плотностей и позволять вести измерение оптической плотности наиболее интенсивно окрашенного раствора, соответствующего содержанию сероводорода 0,6 мг/л.
При построении калибровочных кривых на оси абсцисс откладывают значения, соответствующие содержанию связанного сероводорода в стандартных растворах (мг/л), а на оси ординат значения оптической плотности стандартных растворов для области спектра, соответствующего длине волны 670±25 нм.
7.1.10. Приготовление эталона для оценки правильности выбора разведения анализируемой воды (п. 7.3.1).
Готовят насыщенный раствор сернокислой меди (CuSO4) или медного купороса (CuSO4 ´ 5H2O) в дистиллированной воде, который фильтруют и подкисляют серной кислотой (1:1) из расчета 1 мл на 100 мл раствора.
Приготовленный раствор последовательно разбавляют дистиллированной водой до концентрации, соответствующей наибольшей оптической плотности по калибровочной кривой, построенной ранее (см. 7.1.9).
Наибольшей оптической плотности соответствует концентрация сероводорода, равная 0,6 мг/л. Для приготовления эталона полученный раствор заливают в мерную колбу вместимостью 25 мл и плотно закрывают.
Срок хранения раствора при условии полной герметизации практически не ограничен.
7.2. Качественный анализ
Качественный анализ проводят в соответствии с пп. 6.2.1 - 6.2.3.
7.3. Количественный анализ
7.3.1. Фиксирование сероводорода рекомендуется проводить в пробах на месте отбора. В мерную колбу вместимостью 25 мл точной пипеткой отмеривают такое количество профильтрованной исследуемой воды, чтобы после разбавления бидистиллированной водой до метки содержание сероводорода и его ассоциатов в смеси не превышало 0,6 мг/л. Содержимое колбы перемешивают, добавляют 0,3 мл реактива А (см. 7.1.4) и, после перемешивания, 0,15 мл реактива В (7.1.5), затем пробу снова перемешивают, закрывают пробкой и после окрашивания смеси в голубой цвет сравнивают интенсивность окраски смеси и эталона, приготовленного по 7.1.10. Если интенсивность окраски анализируемой смеси больше эталонной или слишком бледная, то фиксирование пробы повторяют соответственно с меньшим или большим объемом исследуемой воды. После этого пробу доставляют в лабораторию для колориметрирования. В период доставки проба должна находиться в темноте.
7.3.2. В лаборатории пробу нагревают в течение 5 минут на водяной бане при температуре 80-90°С в той же колбе, в которую отбиралась анализируемая вода, предварительно закрыв горловину колбы ватой. После этого колбу охлаждают до комнатной температуры и колориметрируют ее содержимое в соответствии с п. 7.3.4.
7.3.3. При анализе проб, законсервированных ацетатом цинка по п. 3.6.2, отобранная вода подкисляется при перемешивании водным раствором серной кислоты (1:1) из расчета 4 мл раствора на 100 мл содержимого пробы. Дальнейший анализ полученной смеси ведется в соответствии с п. 7.3.1.
7.3.4. Колориметрирование производится через 30 минут после добавки реактивов. Непосредственно перед колориметрированием к смеси добавляют 0,5 мл фосфорной кислоты плотностью 1,70-1,72 г/см3 с последующим перемешиванием.
7.3.5. Обработка результатов
7.3.5.1. Суммарное содержание сероводорода и его ассоциатов (мг/л) в пересчете на недиссоциированный сероводород вычисляется по формуле
![]() , (7)
, (7)
где а - суммарная концентрация сероводорода и его ассоциатов, найденная по калибровочному графику, мг/л;
V g - вместимость применяемой для анализа мерной колбы, мл (в нашем случае V = 25 мл);
V w - количество исследуемой воды (мл), разбавленное в мерной колбе до 25 мл;
K r - поправочный коэффициент на добавку консервирующего реагента (раствора ацетата цинка) и разбавленной серной кислоты, равный 1,05. При отсутствии консервации пробы величина К r = 1.
7.3.5.2. За результат анализа принимают среднее арифметическое результатов параллельных определений, допустимые расхождения между которыми не должны превышать значений, указанных в табл. 3; доверительная вероятность 0,95.
Промежуточные значения допускаемых расхождений находятся путем линейной интерполяции табличных данных.
Таблица 3
|
Пределы изменения концентрации, мг/л |
Допускаемое расхождение, мг/л |
Относительное стандартное отклонение, % |
|
0,05-1,0 |
0,02-0,2 |
15-7 |
|
1,0-5,0 |
0,2-0,4 |
7-3 |
8. Методика расчета содержания недиссоциированного сероводорода
Данную методику рекомендуется применять в практике научно-исследовательских и проектных работ, а также в промысловой практике при необходимости снятия характеристик процессов, в которых принимает участие преимущественно недиссоциированный (газообразный) сероводород. К таким процессам относятся, например, отдувка сероводорода химически инертными по отношению к нему газами; процессы, связанные с оценкой коррозионной агрессивности вод, разработкой мероприятий по защите окружающей среды от загрязнения сероводородом, а также соблюдением норм техники безопасности.
8.1. Исходные данные, их определение и граничные условия применимости.
8.1.1. Химический шестикомпонентный состав пластовой воды, G1, G2...G6, выраженный в мг-экв/л.
8.1.1.1. G1 - содержание ионов кальция Са(2+). Определяется комплексонометрическим методом, изложенным в сборнике: "Унифицированные методы исследования качества вод", Ч.1 - М. Издательский отдел Управления Секретариата СЭВ. - 1977, - 832 с., с.210-215.
8.1.1.2. G2 - содержание ионов магния Mg(2+). Определяется комплексонометрическим или фотометрическим методом, изложенным в сборнике Управления Секретариата СЭВ (п. 8.1.1.1), с. 285-295.
8.1.1.3. G3 - суммарное содержание ионов натрия Na(+) и калия К(+). Определяется расчетным методом по разности между суммарным содержанием анионов и катионов.
8.1.1.4. G4 - содержание бикарбонат-ионов HCO3(-). Определяется ацидиметрическим методом по методике, изложенной в сборнике Управления Секретариата СЭВ (п. 8.1.1.1), с. 222-230.
8.1.1.5. G5 - содержание хлорид-ионов Сl(-). Определяется аргентометрическим или меркуриметрическим методами, изложенными в сборнике Управления Секретариата СЭВ (п. 8.1.1.1), с. 743-749.
8.1.1.6. G6 - содержание сульфат-ионов SO4(2-). Определяется по ГОСТ 4389-72.
Содержание указанных выше ионов шестикомпонентного состава ограничивается условием, изложенным в соответствии с п. 8.2.3.
8.1.2. Показатель содержания водородных ионов - величина рН по прибору (рНпр). Определяется в соответствии с паспортом универсального иономера ЭВ-74. Величина рНпр ограничивается следующим условием: истинное значение рН воды с учетом поправок согласно п. 8.2.4 не должно превышать девяти.
8.1.3. Температура анализируемой воды в момент отбора пробы, t, °С. Определяется в соответствии с рекомендациями, изложенными в сборнике Управления Секретариата СЭВ (п. 8.1.1.1), с. 642-643.
При температуре воды в момент отбора выше 45°С, вычисление содержания недиссоциированного сероводорода не проводится. В этом случае возможно лишь ориентировочное определение суммарного содержания сероводорода и его ассоциатов после охлаждения пробы.
8.1.4. Плотность пластовой воды (масса удельная) ро, г/см3. Определяется ареометром или с помощью пикнометра, а также мерных колб по методике, изложенной в сборнике Управления Секретариата СЭВ (п. 8.1.1.1), с. 300-303. Величина плотности анализируемой воды ограничивается условием в соответствии с п. 8.2.3.
8.1.5. Суммарное содержание сероводорода и его ассоциатов в анализируемой воде в пересчете на недиссоциированный сероводород Cs, мг/л. Определяется после обработки результатов анализов по пп. 6.3.3, 6.4.6, 7.3.5.
8.2. Порядок расчета
8.2.1. Химический состав воды, выраженный в мг/экв/л, переводится в г-и/1000 г H2O по формуле
![]() , (8)
, (8)
где G i - концентрация иона, мг-экв/л;
z i - заряд иона в целых положительных числах;
В - общее содержание растворенных в воде солей, г/л.
8.2.2. При отсутствии готового расчетного значения величины В по данным шестикомпонентного анализа, она рассчитывается по формуле
![]() , (9)
, (9)
где M i - масса иона, а. е.;
в i - содержание в анализируемой воде одного из шести компонентов, указанных в пп. 8.1.1.1-8.1.1.6, г/л.
8.2.3. Определяется ионная сила раствора, создаваемая солевыми компонентами пластовой воды:
![]() , (10)
, (10)
где mNa(+) + К(+), mCa(2+) и т. д. - концентрация ионов в воде, г-и/1000 г Н2О. Полученное значение m не должно превышать 6, 7, иначе дальнейший расчет становится невозможным.
8.2.4. Находится рНи - истинное значение рН воды при ионной силе m:
рНи = рНпр + рНпр (11)
где рНпр - значение рН воды, снятое на иономере;
рНпр - поправка к величине рНпр, которая определяется по приложению 7 в зависимости от величины ионной силы.
8.2.5. Содержание недиссоциированного сероводорода (мг/л) в пластовой воде вычисляется по формуле
 , (12)
, (12)
где gН+ - коэффициент активности ионов водорода, определяемый по ионной силе раствора (см. приложение 7);
![]() - отрицательный логарифм концентрационной
константы первой ступени ионизации сероводородной кислоты.
- отрицательный логарифм концентрационной
константы первой ступени ионизации сероводородной кислоты.
Величина ![]() вычисляется по приложению
8 в зависимости от температуры и истинной величины рНи анализируемой воды.
Пример вычисления содержания недиссоциированного сероводорода приведен в приложении
9.
вычисляется по приложению
8 в зависимости от температуры и истинной величины рНи анализируемой воды.
Пример вычисления содержания недиссоциированного сероводорода приведен в приложении
9.
9. Требования безопасности
9.1. Общие требования по безопасному ведению работ на месторождениях, в газе которых объемное содержание сероводорода не превышает 6%, должны соответствовать "Инструкции по безопасности работ при разработке нефтяных, газовых и газоконденсатных месторождений, содержащих сероводород", утвержденной Госгортехнадзором СССР 5 декабря 1977 г.
Свойства и действие сероводорода на человека, оказание доврачебной помощи пострадавшим при отравлении сероводородом, приборы для контроля концентрации и средства индивидуальной защиты приведены в приложениях 1, 2, 3 и 5 "Инструкции по безопасности работ при разработке нефтяных, газовых и газоконденсатных месторождений, содержащих сероводород", утвержденной Госгортехнадзором СССР 5 декабря 1977 г.
9.2. На месторождениях, где объемное содержание сероводорода в газе превышает 6%, следует принимать дополнительные меры предосторожности согласно "Инструкции по безопасному ведению работ при разведке и разработке нефтяных, газовых и газоконденсатных месторождений с высоким содержанием сероводорода и других вредных и агрессивных веществ", утвержденной Госгортехнадзором СССР 17 июня 1982 г.
9.3. Лица, занимающиеся отбором проб, должны пройти специальный инструктаж.
9.4. Все работы, проводимые в химических лабораториях, должны осуществляться в соответствии с "Основными правилами работы в химических лабораториях". - М.: Химия, 1979 г. - 88 с.
9.5. Категорически запрещается получение газообразного сероводорода вне вытяжного шкафа или в условиях неисправной работы вентиляции.
9.6. Следует помнить, что реактив А содержит серную кислоту.
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в настоящее приложение внесены изменения, вступающие в силу с 1 ноября 1990 г.
Приложение 1
(обязательное)
Схема анализа воды при суммарном содержании сероводорода и его ассоциатов по текущим анализам более 5 мг/л
(с изменениями от 6 июня 1990 г.)

"Схема анализа воды при суммарном содержании сероводорода и его ассоциатов по текущим анализам более 5 мг/л"
Изменением N 1, утвержденным приказом Министерства нефтяной и газовой промышленности СССР от 6 июня 1990 г. N 256 в настоящее приложение внесены изменения, вступающие в силу с 1 ноября 1990 г.
Приложение 2
(обязательное)
Схема анализа воды при суммарном содержании сероводорода и его ассоциатов по текущим анализам менее 5 мг/л
(с изменениями от 6 июня 1990 г.)
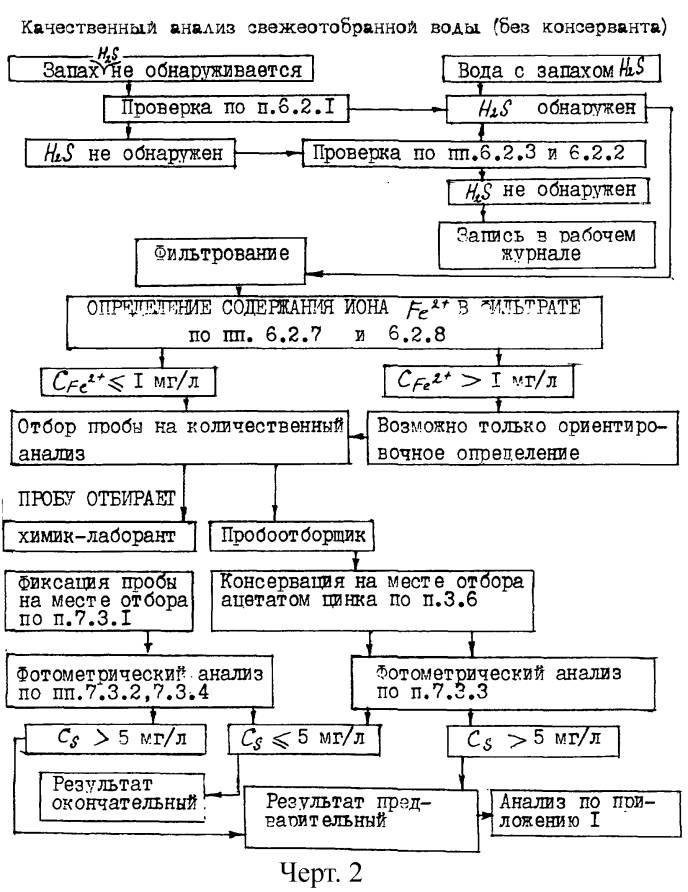
"Схема анализа воды при суммарном содержании сероводорода и его ассоциатов по текущим анализам менее 5 мг/л"
Приложение 3
(обязательное)
Схема анализа воды для случая, когда ориентировочное содержание сероводорода и его ассоциатов в анализируемой воде неизвестно
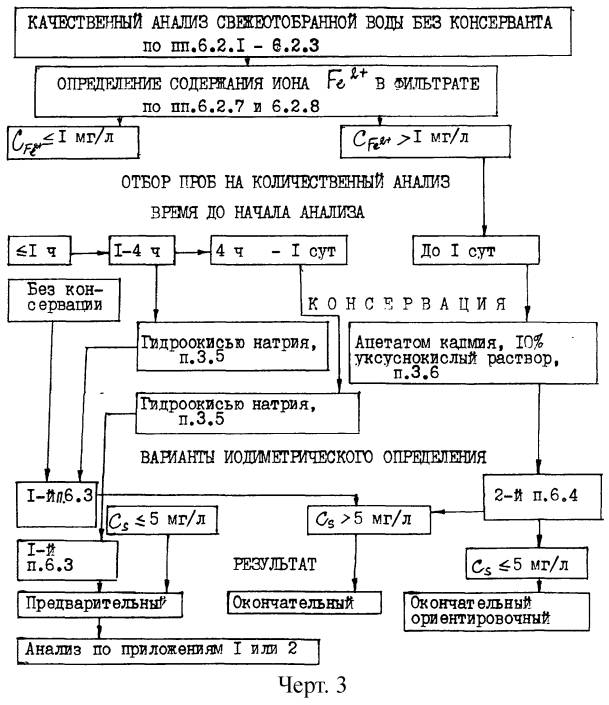
Схема анализа воды для случая, когда ориентировочное содержание сероводорода и его ассоциатов в анализируемой воде неизвестно
Приложение 4
(обязательное)
Способы консервации проб перед анализом
|
Способ консервации |
Условия применения |
Предельное время до начала анализа, ч |
Метод химанализа |
|
1. Гидроокисью натрия по п. 3.5 |
Сs > 5 мг/л C(Fe(2+J)) £ 1 мг/л |
4 |
Йодиметрический, 1-й вариант, п. 6.3 |
|
2. 40% раствором ацетата кадмия по п. 3.6 |
То же |
24 |
Йодиметрический, 2-й вариант, п. 6.4 |
|
3. 10% уксуснокислым раствором ацетата кадмия по п. 3.6 |
Сs £ 100 мг/л C(Fe(2+J)) > 1 мг/л |
То же |
То же |
|
4. 10% раствором ацетата цинка по п. 3.6 |
Сs £ 5 мг/л |
_"_ |
Фотометрический, п. 7.3 |
Примечания: 1. Во 2-й графе таблицы Cs - общее содержание сероводорода и его ассоциатов в пробе; С(Fe(2+)) - содержание ионов двухвалентного железа в фильтрате.
2. При выборе способа консервации следует учитывать, что в случае применения способов 2, 3, 4 время на проведение анализа и его сложность возрастают.