|
ФЕДЕРАЛЬНОЕ АГЕНТСТВО |
||
|
|
НАЦИОНАЛЬНЫЙ |
ГОСТ Р МЭК |
ИСПЫТАНИЯ НА ВОЗДЕЙСТВИЕ ВНЕШНИХ ФАКТОРОВ
Часть 2-10
Испытания. Испытание J и руководство:
Грибостойкость
IEC 60068-2-10:2005
Environmental testing -
Part 2-10:
Tests - Test J and guidance: Mould
growth
(IDT)
|
|
Москва Стандартинформ 2010 |
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря
Сведения о стандарте
1 ПОДГОТОВЛЕН Техническим комитетом по стандартизации ТК 303 «Изделия электронной техники, материалы и оборудование» на основе собственного аутентичного перевода на русский язык стандарта, указанного в пункте 4
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 303 «Изделия электронной техники, материалы и оборудование»
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому
регулированию и метрологии от 11 декабря
4 Настоящий стандарт идентичен международному стандарту МЭК 60068-2-10:2005 «Испытания на воздействие внешних факторов. Часть 2-10. Испытания. Испытание J и руководство: Грибостойкость» (IEC 60068-2-10:2005 «Environmental testing - Part 2-10: Tests - Test J and guidance: Mould growth»).
При применении настоящего стандарта рекомендуется использовать вместо ссылочных международных стандартов соответствующие им национальные стандарты Российской Федерации, сведения о которых приведены в дополнительном приложении ДА.
Настоящий стандарт распространяется на изделия электронной техники народно-хозяйственного назначения
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
Содержание
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
|
ИСПЫТАНИЯ НА ВОЗДЕЙСТВИЕ ВНЕШНИХ ФАКТОРОВ Часть 2-10 Испытания. Испытание J и руководство: Environmental testing. Part 2-10. Tests. Test J and guidance: Mould growth |
Дата введения - 2011-01-01
1 Область применения
Настоящий стандарт устанавливает метод определения стойкости изделий к росту плесневых грибов и влияния развития плесневых грибов на рабочую характеристику и другие соответствующие свойства изделия.
Поскольку рост плесневых грибов происходит при высокой относительной влажности, это испытание применимо к изделиям, предназначенным для транспортирования, хранения и использования во влажных условиях не менее двух суток.
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ИСО/МЭК 17025:19991) Общие требования к компетентности испытательных и калибровочных лабораторий (ISO/IEC 17025:1999, General requirements for the competence of testing and calibration laboratories)
ИСО 846:1997 Пластмассы. Оценка действия микроорганизмов (ISO 846:1997, Plastics-Evaluation of the action of microorganisms)
Инструкция по биологической безопасности в лабораториях, 2-е изд., ВОЗ 1993, ISBN 92.41544503
MIL-STD-
Если приведена дата издания документа, то используют только указанное издание. Если дата издания не указана, то применяют самое последнее издание документа (с учетом всех изменений).
3 Общие положения
Данное испытание предусматривает заражение изделий спорами культур плесневых грибов с последующей инкубацией (выдержкой в термостате) в условиях, благоприятных для прорастания спор и роста плесневых грибов.
Приведены два варианта испытания на грибостойкость. Вариант 1 испытания предусматривает заражение образцов спорами плесневых грибов без питательной среды. Вариант 2 предусматривает заражение суспензией спор плесневых грибов с питательным раствором, способствующим росту плесневых грибов.
Для оценки степени защищенности применяемых конструкционных материалов от влияния роста плесневых грибов желательно использовать методики испытания, приведенные в ИСО 846 для пластмасс.
Примечание - Лаборатории по проведению микробиологических испытаний технической продукции должны быть аккредитованы (официально признаны) в соответствии с ИСО/МЭК 17025. Подробности см. в приложении F.
1) Заменен. Действует ИСО/МЭК 17025:2005.
Поверхностные загрязнения образцов пылью, грязью, конденсированными летучими питательными веществами или смазкой могут быть обусловлены хранением, эксплуатацией или транспортированием совместно с теми изделиями, которые уже находились под воздействием среды или транспортировались без защитного покрытия. Эти загрязнения поверхности могут вызывать усиленный рост колоний грибов, что может приводить к повреждению изделия. Последствия воздействия такого загрязнения могут быть оценены проведением испытания по варианту 2.
Из-за трудности поддержания необходимых условий испытания в испытательной камере очень большого объема крупную сборную аппаратуру, как правило, испытывают по секциям (блокам). В любом случае это снижает стоимость испытания, так как несколько секций (блоков) могут быть настолько похожи по конструкции, что достаточно испытать только одну из них.
4 Опасность для здоровья исследователей
Настоящий метод испытания основывается на применении жизнеспособных спор плесневых грибов и создании условий, благоприятных для их развития.
Поэтому прежде, чем приступить к каким-либо работам с культурами плесневых грибов или выполнению этапов испытания, необходимо изучить приложения к настоящему стандарту:
Приложение А Опасность для персонала.
Приложение В Методы посева.
Приложение С Рекомендуемые меры безопасности.
Приложение D Методики обеззараживания.
Инструкция по биологической безопасности в лабораториях, второе издание, Всемирная организация по здравоохранению, 1993, ISBN 92.41544503 содержит общие основные положения по безопасности для технических устройств, соприкасающихся с грибами.
5 Варианты испытаний
5.1 Вариант 1 испытания
После инкубационного периода в 28 сут определяют:
- степень роста плесневых грибов внешним осмотром;
- физические дефекты, вызванные ростом плесневых грибов;
- в случае роста плесневых грибов влияние на функциональные и (или) электрические характеристики, если это требуется соответствующими нормативными документами (НД).
Период инкубации следует продлевать до 56 сут, если в соответствующих НД предусмотрены проверка функции и измерение электрических характеристик.
5.2 Вариант 2 испытания
После обработки имитирующими загрязнение питательными веществами, за которой следует инкубационный период в 28 сут, определяют:
- степень роста плесневых грибов внешним осмотром;
- физические дефекты, вызванные ростом плесневых грибов;
- воздействие роста плесневых грибов на функционирование и (или) электрические характеристики, если требуется соответствующими НД.
Сопротивляемость поверхности образца снижается при применении питательных веществ для имитации загрязнения без роста плесневых грибов. Этот эффект необходимо учитывать при контроле функции и (или) измерении электрических характеристик.
Из-за применения питательных веществ происходит рост плесневых грибов; в случае его отсутствия необходимо рассматривать фунгицидное воздействие.
6 Реактивы и материалы
6.1 Культуры или споры. Поставка и условия
При выполнении испытания необходимо использовать плесневые грибы, приведенные в таблице 1. В качестве руководства указан характер ожидаемого воздействия каждого гриба. Споры всех культур, однако, следует использовать совместно в смешанной суспензии независимо от свойств образца.
Культуры или замороженные высушенные споры получают из сбора известных микологических культур и поставляют в контейнерах с нанесенной на них датой посева культуры.
Сертификат должен подтверждать соответствие культуры с грибами и номера штамма указанным в таблице 1 и (или) в приложении Е.
Таблица 1 - Испытательные грибы
|
Наименование |
Номер штамма3) |
Материал |
Примечание |
|
1 Aspergillus niger |
АТСС 6275 |
Многие материалы |
- 1), 2) |
|
2 Aspergillus terreus |
АТСС 10690 |
Пластмассы |
- 1), 2) |
|
3 Chaetomium globosum |
АТСС 6205 |
Целлюлоза |
- 1), 2) |
|
4 Cormoconic resinae |
DSM 1203 |
Смазочные материалы на основе углеводорода |
- |
|
5 Paecilomyces variotii |
АТСС 18502 |
Пластмассы и кожа |
- 1), 2) |
|
6 Penicillium funiculosum |
АТСС 36839 |
Многие материалы, особенно текстиль |
- 1), 2) |
|
7 Scopulahopsis brevicaulis |
АТСС 36840 |
Резина |
-1), 2) |
|
8 Trichoderma virens |
АТСС 9645 |
Целлюлоза, текстиль и пластмасса |
-2) |
|
1) Также приведены в ИСО 846. 2) Также приведены в таблице 508.5-1 MIL-STD- 3) См. также приложение Е. |
|||
С культурами и замороженными высушенными спорами следует обращаться и хранить их согласно рекомендациям поставщика и соответствующим требованиям настоящего стандарта. При подготовке культуры в испытательной лаборатории из фонда культур или из замороженных высушенных спор на контейнере с культурой должна быть указана дата посева.
Культуры используют для приготовления испытательной споровой суспензии, если они хорошо спорулированы.
Это достигается в большинстве случаев через 7-14 сут инкубации при температуре (29 ± 1) °С.
Примечание - Поставщик культур или замороженных высушенных спор может рекомендовать другие условия для развития культур.
Если культуры не предназначены для немедленного использования, их следует хранить в холодильнике при температуре от 5 °С до 10 °С не более шести недель, начиная хранение не раньше чем через 14 сут и не позднее чем через 28 сут с даты посева, указанной на контейнере.
Крышку контейнера не допускается открывать до начала приготовления споровой суспензии. Из открытого контейнера следует приготовлять только одну суспензию.
6.2 Приготовление споровой суспензии
6.2.1 Общие положения
Суспензия должна быть приготовлена в стерилизованной дистиллированной воде, к которой добавлен смачивающий агент в концентрации от 0,005 % до 0,01 %. Для этой цели подходит агент на основе N-метилтаурида или диоктил-Nа-сульфосукцината. Смачивающий агент не должен содержать вещества, способствующие развитию плесневых грибов или подавляющие его.
К каждой культуре необходимо осторожно добавить 10 мл воды, содержащей смачивающий агент.
Стерилизуют платиновую или нихромовую проволоку, нагревая в пламени до красного каления, и дают ей охладиться. Этой проволокой осторожно очищают поверхность культуры, чтобы освободить споры.
Жидкость слегка встряхивают, чтобы отделить споры от фрагментов мицелия, осторожно сливают и профильтровывают суспензию через тонкий слой стерильной стекловаты или через воронку с микрофильтром с порами размером от 40 до 100 мкм в стерилизованную трубку центрифуги.
Отфильтрованную споровую суспензию обрабатывают на центрифуге и сливают всплывшую на поверхность жидкость. Остаток снова разводят в не менее чем 10 мл стерилизованной дистиллированной воды и снова обрабатывают на центрифуге. Споры промывают таким образом три раза.
6.2.2 Подготовка варианта 1 испытания
Помещают получившийся осадок спор каждой культуры в емкость, содержащую:
- раствор минеральных солей в соответствии с 6.3, но без сахарозы, если в соответствии с требованиями НД проводят только внешний осмотр (см. 5.1);
- стерилизованную дистиллированную воду, если в соответствии с требованиями НД контролируют функционирование или измеряют электрические характеристики (см. 5.1), - и регулируют концентрацию спор от 1×106 до 2×106 /мл, определяя ее с помощью счетной камеры или способом турбиметрии.
Смешивают одинаковые объемы отдельных суспензий, достаточные для соответствующей методики посева, для получения окончательной суспензии смеси спор, готовой для посева. Споровую суспензию в растворе минеральной соли следует использовать в течение 48 ч после приготовления. Споровую суспензию в стерильной дистиллированной воде следует использовать в течение 6 ч после приготовления.
Примечание - Приготовляют общие объемы около 100 мл для посева распылением или около 500 мл для посева нанесением или погружением.
6.2.3 Подготовка варианта 2 испытания
Разводят полученный осадок спор каждой культуры в объеме питательного раствора по 6.3, регулируют концентрацию спор от 1×106 до 2×106 /мл, определяя ее с помощью счетной камеры или турбиметрией.
Смешивают одинаковые объемы отдельных суспензий, достаточные для соответствующей методики посева, чтобы получить окончательную суспензию смеси спор, готовую для посева. Споровую суспензию используют в течение 6 ч после приготовления.
Примечание - См. 6.2.2.
6.3 Контрольные полоски
В качестве контрольных полосок, необходимых для проведения испытания, используют полоски чистой белой фильтровальной бумаги или водонепроницаемой хлопчатобумажной ткани.
Питательный раствор, используемый при приготовлении контрольных полосок, готовят растворением в дистиллированной воде перечисленных ниже реактивов.
|
Реактив |
г/л |
|
Калий фосфорнокислый однозамещенный (KН2РО4) |
0,7 |
|
Калий фосфорнокислый двузамещенный (K2НРО4) |
0,3 |
|
Магний сернокислый (MgSО4×7Н2О) |
0,5 |
|
Натрий азотнокислый (NaNО3) |
2,0 |
|
Калий хлористый (KCl) |
0,5 |
|
Железо сернокислое (FeSО4×7Н2О) |
0,01 |
|
Сахароза |
30,0 |
рН должен быть от 6,0 до 6,5 при температуре 20 °С. При необходимости его регулируют 0,01 молярным раствором NaOH. Раствор стерилизуют в автоклаве при температуре (120 ± 1) °С в течение 20 мин.
Непосредственно перед посевом (см. 11.2) контрольные полоски помещают в насыщенный питательный раствор, вынимают из него и дают стечь каплям.
7 Описание испытательной аппаратуры
7.1 Заражение распылением
Предпочтительно применять сверхзвуковую аэрозольную установку, используемую в терапии для ингаляций, совместно с камерой для безопасного посева (см. приложение В).
7.2 Инкубация образцов небольших размеров
Следует использовать стеклянные или пластмассовые контейнеры с крышками, имеющими устройства для установки или подвешивания образцов и контрольных полосок.
Контейнер должен быть таких размеров и формы, чтобы получилась открытая поверхность воды, достаточная для поддержания внутри контейнера относительной влажности воздуха выше 90 %.
Приспособления для установки или подвешивания должны быть такими, чтобы образцы и контрольные полоски не соприкасались с водой и не забрызгивались ею.
Контейнеры помещают в камеру с равномерной по всему рабочему объему температурой от 28 °С до 30 °С для инкубации образцов и контрольных полосок. Любое циклическое изменение температуры, обусловленное работой термостата, не должно превышать 1 °С/ч.
7.3 Инкубация образцов больших размеров
Для инкубации образцов, слишком больших для контейнеров, указанных в 7.2, используют соответствующую камеру влажности. У камеры влажности должна быть хорошо герметизированная дверь для предотвращения воздухообмена между рабочим объемом камеры и лабораторией.
Относительная влажность воздуха внутри камеры должна быть выше 90 %. Не допускается стекание конденсата со стенок или с крышки камеры на образцы и контрольные полоски. В рабочем объеме камеры поддерживают равномерную температуру от 28 °С до 30 °С. Любое циклическое изменение температуры, обусловленное работой термостата, не должно превышать 1 °С/ч.
Для того чтобы установленные влажность и температура поддерживались постоянными во всех точках рабочего объема камеры, допускается принудительная циркуляция воздуха. Скорость потока воздуха над поверхностью образца (образцов) не должна превышать 1 м/с.
8 Степень жесткости
Степень жесткости каждого варианта испытания определяется длительностью инкубации. Для варианта 1 испытания:
- степень жесткости 1 - 28 сут;
- степень жесткости 2 - 56 сут
в соответствии с требованиями технических условий на изделия конкретных типов. Для варианта 2 испытания:
- степень жесткости 1 - 28 сут.
9 Первоначальный контроль
Проводят внешний осмотр образцов и проверяют их электрические и механические характеристики по требованиям соответствующих НД.
10 Предварительная выдержка
10.1 Очистка
Испытанию подвергают образцы в состоянии поставки. Как правило, их не подвергают специальной очистке.
Если предусмотрено в соответствующих НД, перед испытанием допускается промывать половину партии образцов этиловым спиртом или деминерализованной водой, содержащей моющее средство, затем промывают деминерализованной водой без моющего средства, а другую половину оставляют в состоянии поставки. Таким образом, любой рост плесневых грибов, вызванный использованием негрибостойких материалов в конструкции изделия, можно отличать от роста плесневых грибов, вызванного загрязнением его поверхности.
Если считают, что степень развития плесневых грибов 0 баллов (вариант 1 испытания), рассматривают необходимость очистки образцов перед испытанием, так как наличие загрязнения может способствовать росту грибов.
Примечание - Определение степени развития плесневых грибов приведено в 12.3.
10.2 Хранение во влажном тепле
Образец (образцы) непосредственно перед посевом следует хранить в условиях инкубации не менее 4 ч при температуре (29 ± 1) °С и относительной влажности выше 90 % и ниже 100 %.
11 Выдержка
11.1 Применение
Применение варианта испытания, установленного в НД, осуществляют в соответствии с представленным ниже методом.
11.1.1 Вариант 1 испытания
Если в соответствии с НД требуется проводить контроль функционирования и измерение электрических характеристик, следует использовать две группы образцов.
Группа 1. Образцы заражают споровой суспензией и инкубируют.
Группа 2. Отрицательные контрольные образцы обрызгивают дистиллированной водой или наносят на них дистиллированную воду, или погружают в нее в соответствии с методом посева, используемым для группы 1, и хранят при температуре и относительной влажности, требуемой для инкубации, в стерильной среде.
Если в НД отсутствуют требования к контролю функционирования и измерению электрических характеристик, следует использовать только группу 1.
11.1.2 Вариант 2 испытания
Должно быть две группы образцов.
Группа 1. Образцы обрабатывают суспензией спор в питательном растворе и инкубируют.
Группа 2. В соответствии с группой 2 варианта 1 испытания.
Примечание - Отрицательные контрольные образцы испытывают при заданных условиях выдержки в отдельной камере без образцов, зараженных суспензией спор грибов. Для исключения всякого роста плесневых грибов на отрицательных контрольных образцах камера должна быть стерилизована одним из методов, приведенных в D.1.1 (Приложение D). Результат испытания считают действительным, если плесневые грибы не развиваются как на испытуемых, так и на отрицательных контрольных образцах.
11.2 Заражение
Заражение испытательных образцов и контрольных полосок (см. 6.3) споровой суспензией (см. 6.2) следует осуществлять распылением, если в соответствующих НД не оговорено иное.
Если распыление не подходит из-за размеров, конструкции или других характеристик образца, допускается проводить заражение споровой суспензией погружением или нанесением, как указано в соответствующих НД.
Примечание - При распылении аэрозоля или споровой суспензии с помощью сверхзвуковой аэрозольной установки в камере для безопасного посева (см. приложение В) получается очень равномерное распределение спор по испытуемой поверхности, что приводит к высокой воспроизводимости результатов испытания. Этот способ должен быть предпочтительным.
11.3 Инкубация
Инкубацию проводят при температуре (29 ± 1) °С и относительной влажности более 90 % и менее 100 %. Эти условия поддерживают для образцов небольших размеров в контейнере, а для образцов больших размеров - в камере влажности для инкубации (см. 7.3).
Сразу же после заражения образцы небольших размеров и не менее трех контрольных полосок помещают в контейнер на достаточном расстоянии друг от друга и без ограничения требуемой относительной влажности. После этого контейнер помещают в инкубационную камеру.
В случаях, когда это возможно, отрицательные контрольные образцы размещают в таких же контейнерах, как для зараженных образцов, без контрольных полосок, но стерилизованных. Затем эти контейнеры помещают в инкубационную камеру.
Для образцов больших размеров в камеру с образцами помещают соответствующее число контрольных полосок. Все отрицательные контрольные образцы располагают в отдельной заново стерилизованной камере (см. Приложение D), используемой предпочтительно только для отрицательных контрольных образцов.
Контейнеры и камеру влажности следует открывать только для:
- обследования контрольных полосок после 7 сут, обращая внимание на состояние спор и поддержание условий инкубации;
- подачи в контейнеры кислорода один раз в каждые 7 сут до полного завершения предписываемой длительности инкубации;
- выполнения промежуточного контроля внешнего вида в соответствии с 12.3.
Открывание должно занимать только несколько минут.
После 7 сут инкубации должен быть виден невооруженным глазом рост плесневых грибов более чем у одного штамма на каждой контрольной полоске. В противном случае испытание считают недействительным и его следует возобновлять. В этом случае можно использовать те же самые образцы.
Любые перерывы инкубации допускаются только для внешнего осмотра не более чем на 10 мин в каждом случае, а так же если это требуется соответствующими НД. Во время инкубации должно быть предписано проведение не более двух внешних осмотров. Длительность внешнего осмотра устанавливают в соответствующих НД.
12 Заключительный контроль
12.1 Внешний осмотр
Сразу же после изъятия из контейнера или из камеры влажности образцы подвергают осмотру (см. 12.3), измерениям и фотографированию (если требуется в технических условиях на изделия конкретного типа), так как внешний вид плесневых грибов может изменяться при высыхании. Рекомендуемые меры безопасности при проведении испытаний приведены в приложении С.
После внешнего осмотра и определения фактического роста плесневых грибов следует тщательно удалять мицелий 70 %-ным (объемная доля) раствором этилового спирта с поверхности, которую затем осматривают под микроскопом, чтобы оценить характер и степень любого воздействия (например, травление) на образец. Рекомендуемые меры безопасности при удалении роста плесневых грибов приведены в приложении С.
12.2 Воздействие плесневых грибов
Если в соответствии с НД предусмотрен контроль электрических и (или) механических параметров в условиях влажности (после инкубации), то необходимо, чтобы относительная влажность среды, окружающей образцы, чрезмерно не изменялась, пока не проведен данный контроль. Поэтому контроль для образцов небольших размеров следует проводить при их нахождении в контейнере с закрытой крышкой и без воды. Для образцов больших размеров контроль проводят, пока они находятся в камере влажности.
Примечание - В случае проведения работ с образцами под электрической нагрузкой или при открытых крышках контейнеров и дверцах камер влажности персонал должен соблюдать надлежащие меры безопасности.
Рекомендуемые меры безопасности при проведении испытаний приведены в приложении С. При проведении операции в условиях влажного тепла следует соблюдать требования изготовителя, изложенные в инструкции.
На образцах, зараженных споровыми суспензиями, и образцах, обработанных только водой, проводят аналогичные измерения. Считают, что сколько-нибудь существенная разница в результатах измерений обеих групп обусловлена воздействием плесневых грибов в сочетании с повышенной влажностью.
После проведения испытания образцы извлекают из камеры, подвергают внешнему осмотру в соответствии с 12.1 и определяют окончательную степень воздействия плесневых грибов на образцы в соответствии с 12.2.
Если необходимо проведение контроля после восстановления, образцы изымают из контейнера или камеры, затем осматривают по 12.1 и подвергают воздействию специальных условий восстановления в течение 24 ч, после чего проводят контроль.
12.3 Степень роста плесневых грибов
Образцы осматривают сначала невооруженным глазом, а затем, при необходимости, под микроскопом с номинальным (приблизительно) 50х увеличением.
Степень развития плесневых грибов оценивают и выражают в соответствии со следующей шкалой: Степень
0 - При номинальном увеличении 50х рост плесневых грибов отсутствует.
1 - Следы роста плесневых грибов отчетливо видны под микроскопом.
2а - Рост спор, видимый невооруженным глазом и (или) под микроскопом, распространяется или локализуется в нескольких местах, охватывая в целом не более 5 % испытуемой поверхности.
2b - Рост спор, видимый невооруженным глазом и (или) под микроскопом, распределен более или менее равномерно на многих участках, охватывая в целом не более 25 % испытуемой поверхности.
3 - Рост отчетливо виден невооруженным глазом и охватывает более 25 % испытуемой поверхности.
Примечание - В случае если образцы состоят из нескольких блоков с разной степенью развития плесневых грибов, то грибостойкость каждого блока оценивают отдельно. Для варианта 2 испытания нулевой балл оценки степени роста плесневых грибов задают, только если требуется выявить фунгицидное воздействие.
13 Данные, приводимые в технических условиях на изделия конкретного типа
Должны быть указаны следующие данные.
|
|
Пункт, раздел, подпункт |
|
а) Вариант 1 или 2 испытания |
|
|
b) Длительность варианта 1 испытания (степень жесткости) |
|
|
с) Первоначальные измерения электрических или механических характеристик и функциональный контроль (только если необходимо определять ухудшение характеристик) |
|
|
d) Предварительная очистка образцов |
|
|
е) Метод посева (если не распылением) |
|
|
f) Перерывы в инкубации для проведения промежуточного внешнего осмотра |
|
|
q) Заключительные измерения |
|
|
h) Допустимая степень роста (если требуется) |
14 Минимальные данные, приводимые в протоколе испытания
a) Испытательная лаборатория (наименование, адрес и аккредитация).
b) Покупатель (наименование и адрес).
c) Описание образцов.
d) Стандарт на испытание, издание и вариант испытания.
e) Степень жесткости для варианта 1 испытания.
f) Виды грибов для испытания (если отличаются от указанных в стандарте).
q) Первоначальные, промежуточные и заключительные обследования (подробно).
h) Очистка образцов (если применяется).
i) Метод инкубации.
j) Условия инкубации (если отличаются от указанных в стандарте).
k) Рост плесневых грибов на контрольных полосках (после 7 сут инкубации).
l) Результаты испытания (включая характерные особенности).
m) Критерий испытания (допустимая степень развития плесневых грибов, если она задана).
n) Оценка рабочей характеристики (на основании критериев испытания).
Приложение А
(справочное)
Опасность для персонала
А.1 Общие положения
По мнению микологов и патологов проведение испытания на грибостойкость может представлять опасность для здоровья персонала, если не принимать особых мер безопасности.
Меры безопасности, подробно представленные в приложениях А, В, С и D, основаны на знаниях микробиологических методов и наличии навыков работы со специальной аппаратурой. Персонал, проводящий это испытание, должен быть обучен работам в микробиологической лаборатории.
Для проведения испытания на грибостойкость должна быть предусмотрена микробиологическая лаборатория.
Для проведения отдельных этапов методики рекомендуется использовать микробиологический вытяжной шкаф (МВШ).
Разносимые воздухом споры плесневых грибов непрерывно проникают в организм человека через нос и рот, но они, как правило, не представляют опасности для здоровья. Однако повторное вдыхание спор грибов некоторых видов, в том числе и используемых при испытаниях на грибостойкость, может вызывать реакцию у некоторых индивидуумов с повышенной чувствительностью, поэтому особое внимание следует обращать на меры безопасности, которые должен выполнять персонал при проведении испытания. Эти меры приведены в приложении С.
Во время периода инкубации на местах инкубации и (или) образцах может происходить развитие посторонних плесневых грибов и других микроорганизмов. Некоторые из этих грибов или других микроорганизмов могут быть опасны для организма человека.
Персоналу, привлекаемому к проведению этого испытания, необходимо получить письменное заключение медработника по месту работы или собственного врача с разрешением на участие в проведении испытания. Мнение медицинского работника необходимо учитывать.
Персонал, проводящий испытание, должен быть уведомлен о возможной опасности, которой будет подвергаться в зависимости от состояния здоровья в настоящее время.
Следует выполнять национальные стандарты по требованиям безопасности,
А.2 Инструкция для медицинского персонала
Испытание представляет собой опасность при вдыхании или внедрении спор через места травм.
Рекомендуемые меры безопасности указаны в приложении С и предназначены для сведения к минимуму опасности заражения.
Особенная опасность существует для лиц с повышенной чувствительностью, к которым относятся, например:
- особо чувствительные лица, у которых наблюдается аллергия к пыльце, домашней пыли, шерсти животных и т.п., и которые, страдают от насморка, астмы или других аллергических симптомов. Опасность заключается в развитии аллергии к спорам плесневых грибов по типу I, но при некоторых обстоятельствах могут развиваться реакции по типу III (заболевание легких у фермеров);
- лица с хроническими заболеваниями легких, например воспалением бронхов, хроническими бронхитами, саркоидами, эмфиземами и т.д. Накопление спор плесневых грибов в полостях легких может приводить к прорастанию и развитию, главным образом Aspergillis spec, в виде грибного шара или аспергиломы. Туберкулезные поражения являются возможным местом прорастания спор и роста плесневых грибов;
лица, проходящие в настоящее время лечение антибиотиками, получающие лекарства, которые подавляют иммунную систему организма, включая кортикостероиды, или принимающие другое назначенное химико-терапевтическое лечение, так как нарушение нормальной бактериальной флоры дыхательных и алиментарных трактов иногда позволяет грибам развиваться обширно, а подавление иммунной системы может еще более повысить восприимчивость организма к грибковой инфекции.
Хотя опасность заражения спорами плесневых грибов, возникающую при проведении испытания по стандартизованным методикам, считают небольшой, не рекомендуется привлекать к испытанию людей вышеперечисленных категорий.
Приложение В
(обязательное)
Методы посева (см. также 11.2)
В.1 Общие положения
Перед началом посева следует изучить приложение С «Рекомендуемые меры безопасности». Как правило, применяют метод распыления споровой суспензии на образцы.
В.2 Метод посева распылением аэрозоля (А/М)
В.2.1 Общие положения
При использовании для посева пульверизатора происходит более неравномерное распределение спор по поверхности, чем при использовании распыления аэрозоля.
Результаты испытания при использовании А/М более воспроизводимы и объяснимы благодаря очень однородному распределению спор по поверхности(ям) образца.
А/М более применим также к образцам с поверхностью, плохо смачиваемой споровой суспензией.
Пригодными для безопасного заражения являются объемы размерами 500×500×500 мм. Материалом емкости должен служить полиметилметакрилат.
В.2.2 Описание
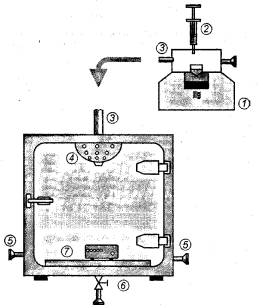
Метод заражения распылением аэрозоля (А/М) показан на рисунке В.1.
1 - сверхзвуковая аэрозольная установка; 2 - градуированный шприц; 3 - трубка; 4 - воронка с отверстиями; 5 - фильтры; 6 - дно емкости; 7 - образец
Рисунок В.1 - Метод заражения аэрозолем (А/М)
Споровую суспензию распыляют аэрозолем с помощью сверхзвуковой аэрозольной установки, которую применяют для терапевтической обработки путем ингаляции аэрозольных лекарств 1.
Точно измеренное количество споровой суспензии допускается ввести в распылитель сверхзвуковой аэрозольной установки шприцем с делениями 2.
Аэрозоль со спорами поступает через трубку 3 в емкость для посева со слабым потоком воздуха, производимым сверхзвуковой аэрозольной установкой.
Аэрозоль распределяют в емкость через воронку с отверстиями 4, встроенную в стенку емкости.
Образец помещают перед воронкой на дно емкости, чтобы основные испытуемые участки находились в направлении поступления аэрозоля.
Давление внутри емкости компенсируется через два вентиляционных отверстия, снабженных микробиологическими фильтрами 5, находящимися с противоположных сторон камеры.
После окончания обработки аэрозолем и осаждения аэрозоля емкость вентилируют потоком воздуха от ультразвуковой аэрозольной установки через трубку в дне емкости 6, снабженную вентилем и микробиологическим фильтром в конце.
Перед тем как открыть дверцу емкости, герметично закрытую во время операции, следует остановить поток воздуха от сверхзвуковой аэрозольной установки.
В.2.3 Обеззараживание и очистка
После изъятия образца 7 следует сразу же закрыть и обеззаразить всю систему распылением аэрозоля дезинфицирующего вещества, например раствора уксусной кислоты.
Для одинаковых споровых суспензий допускается выполнение нескольких операций посева, одну за другой, в один и тот же день без обеззараживания перед ними.
Если споры были распределены в растворе минеральной соли (см. вариант 1 испытания, 6.2.2) или в питательном растворе минеральной соли (см. вариант 2 испытания, 6.2.3), распыляющий сосуд, трубку между ультразвуковой аэрозольной установкой и инкубационной емкостью, распределяющую воронку и внутренние поверхности емкости следует после обеззараживания очищать дистиллированной водой.
В.2.4 Калибровка системы А/М
Количество спор суспензии, нанесенное на заданную поверхность, зависящее от регулируемой рабочей характеристики ультразвуковой установки и других характеристик, допускается оценивать взвешиванием чашек Петри из полистирена на аналитических весах перед выдержкой на дне инкубационной емкости во время обработки аэрозолем и после нее. Вместо споровой суспензии распыляют раствор минеральной соли (см. 6.3).
Примечание - Рекомендуется осаждать (100 ± 20) мг/см2 аэрозоля.
В.3 Заражение образцов небольших размеров погружением
Быстрым и эффективным методом заражения образцов небольших размеров считают погружение в споровую суспензию при условии, что споры могут прилипать к поверхности.
В.4 Заражение образцов больших размеров распылением или нанесением
Образцы больших размеров, если это возможно, разделяют на блоки в соответствии с 7.3.
Однако если образец все-таки еще слишком велик для заражения в имеющемся микробиологическом вытяжном шкафу (МВШ) или в безопасной емкости для посева, рассматривают возможность установления временного вытяжного шкафа над образцом. Это создаст приблизительно одинаковые условия для воздушного потока и будет обеспечивать ту же самую микробиологическую вытяжную систему, требуемую для МВШ. С другой стороны, допускается помещать образец большого размера в камеру влажности, в которой проводят заражение, и затем наносить споровую суспензию. Несмотря на то, что этим методом невозможно произвести аэрозоль, во время посева должна работать рекомендуемая вытяжная система, присоединенная к камере влажности. Во время посева распылением вытяжная система не должна работать во избежание дополнительного движения воздуха и дверь должна быть закрыта, чтобы свести к минимуму выпуск спор.
Рекомендуется проводить посев в МВШ из-за возможности образования аэрозоля.
При аэрозольном методе посева МВШ заменяют безопасной емкостью для посева (см. рисунок В.1).
Приложение С
(справочное)
Рекомендуемые меры безопасности
Следует соблюдать меры безопасности для уменьшения вдыхания спор плесневых грибов и их соприкосновения с кожей, в частности около ногтей.
Вдыхание спор плесневых грибов может происходить при транспортировании или исследовании инкубированных образцов или контрольных полосок, или при движении вокруг них воздуха, например при открывании или закрывании дверцы камеры и крышки контейнера. Риск увеличивается при высыхании плесневых грибов, когда небольшие отделяющиеся частицы могут легче проникать в воздух. Больший риск существует также, если образцы заражают методом распыления, за исключением метода аэрозольного заражения (А/М), использующего емкость для посева (см. приложение В).
Непосредственную защиту от вдыхания спор плесневых грибов можно получать, используя стандартные респираторы, снабженные противопылевым фильтром от частиц пыли размером от 1 до 10 мкм, или респираторы, применяемые при биологических или радиологических работах. Марлевая или неплотно прилегающая маска не обеспечивают достаточную защиту. Однако предпочтительным методом является использование МВШ.
Для уменьшения риска контакта плесневых грибов с кожей используют защитные перчатки при обращении со всеми культурами, заражающими веществами и испытательными образцами после посева и инкубации. Предпочтительно пользоваться защитными перчатками и обеззараживать их перед снятием.
Все операции с открыванием контейнеров с культурами плесневых грибов от приготовления суспензии спор до заражения образцов и контроля, если их не проводят в инкубационной емкости (А/М), и исследования, и измерения инкубированных образцов выполняют внутри МВШ, учитывая следующие меры предосторожности:
a) использование соответствующего смачивающего агента (см. 6.2.1) во время подготовки споровой суспензии;
b) протирание внешних поверхностей инкубационного контейнера 70 %-ным этиловым спиртом перед перенесением его из МВШ в инкубационную камеру;
c) протирание или промывание образцов 70 %-ным этиловым спиртом после завершения испытания во время их нахождения в МВШ. Это выполняют для предотвращения развития плесневых грибов перед заключительным обеззараживанием и уничтожением;
d) при использовании метода заражения распылением аэрозоля (А/М) конструкция инкубационной емкости и ее работа должны соответствовать приложению В, чтобы предотвратить утечку аэрозоля, содержащего споры.
Если образец слишком велик для помещения в отдельный контейнер, его заражают в инкубационной камере, при этом споры могут попадать в воздух из-за перемещения потока воздуха при открывании и закрывании дверцы камеры.
Вытяжная система с микробиологическими фильтрами к наружной среде может препятствовать просачиванию спор при открывании дверцы. При закрытой дверце вытяжная система не должна работать для предотвращения усиленного движения воздуха или отрицательного давления в камере.
Микробиологические фильтры следует обеззараживать или заменять после окончания инкубации. Перед открыванием дверцы вентиляция должна быть уменьшена, чтобы свести к минимуму распределение спор.
При использовании инкубационной камеры, позволяющей в нее войти, следует носить защитную одежду и полностью закрытый колпак с респиратором или с соответствующей подачей воздуха через трубку к колпаку.
Все камеры или установки, используемые для испытаний на грибостойкость, следует обеззараживать сразу же после использования в соответствии с приложением D.
Образцы и контрольные полоски могут быть покрыты большим наростом плесневых грибов в конце испытания, поэтому следует соблюдать осторожность при их уничтожении.
Контрольные полоски перед окончательным уничтожением погружают в емкость, содержащую раствор гипохлорита натрия (см. Приложение D). Образцы сначала обрабатывают в соответствии с перечислением с) настоящего приложения перед заключительным обеззараживанием методом, выбранным из приведенных приложении D.
Перед началом испытания камеру и аппаратуру рекомендуется стерилизовать, если имеются сомнения относительно их стерильности, и каждый раз, когда после стерилизации прошло более 28 сут.
В испытательной лаборатории не разрешается есть, пить и курить.
Защитную одежду, которую носят в лаборатории для испытания на грибостойкость, не допускается носить в других местах.
Приложение D
(справочное)
Методики обеззараживания
Контейнеры и камеры влаги, используемые в качестве инкубаторов во время испытания на грибостойкость, могут загрязняться как испытательными плесневыми грибами, так и грибами случайных видов. Поэтому необходима процедура обеззараживания. Эта процедура должна быть эффективной как против испытательных организмов, так и против грибов случайных видов. После нее не должно быть остатков дезинфицирующих средств, которые могут влиять на рост испытательного гриба. Кроме того, она должна представлять собой минимальный риск для персонала.
D.1 Рекомендуемые процедуры обеззараживания
D.1.1 Применение активных химических растворов
Применяют промывание раствором гипохлорита натрия или погружение в него. Раствор готовят из гипохлорита натрия, содержащего от 500×10-6 до 1000×10-6 растворенного в воде хлора.
Загрязненные при инкубации участки, контейнеры или аппаратуру смачивают или, если возможно, погружают в раствор, обеспечивая его проникновение во все трещины. Не ранее чем через 30 мин после этого изделие прополаскивают в чистой воде.
Климатические камеры обеззараживают при повышенной температуре до 60 °С - 70 °С от 1 до 2 ч и затем начисто промывают мыльным раствором гипохлорита натрия.
Через 30 мин после нанесения раствор удаляют, промывая или прополаскивая чистой водой.
Гипохлорит натрия оказывает сильное отбеливающее воздействие. Поэтому для некоторых материалов применение этого обеззараживающего раствора недопустимо.
Очень эффективный дезинсектор, применяемый вместо раствора гипохлорита натрия, основан на органических азотных смесях, таких как н-октил-диметил-бензиламмониумацетат, бензетониумацетат или метилбензе-тониумацетат.
Следует использовать только дезинсекторы, испытанные аккредитованной лабораторией на эффективность против грибов и токсическую безопасность.
D.1.2 Выдержка в автоклаве
Данный метод пригоден для небольших изделий, стойких к высоким температурам, а также для культур грибов. В автоклаве устанавливают давление 10 кПа (1 бар) и температуру 121 °С в течение 20 мин.
D.1.3 Полоскание или обрызгивание 70 %-ным (объемная доля) этиловым спиртом
Все поверхности, которые могли находиться в контакте со спорами или споровой суспензией, тщательно смачивают 70 %-ным (объемная доля) этиловым спиртом. Длительность воздействия должна быть не менее 15 мин.
D.1.4 Применение летучих дезинсекторов
Применения летучих дезинсекторов, например формальдегида, следует избегать. Пары формальдегида являются эффективным дезинсектором, но их невозможно затем полностью удалить, что приводит к увеличению паров формальдегида в замкнутых объемах, которые препятствуют росту испытательных плесневых грибов.
Более того, формальдегид токсичен.
Имеются другие летучие вещества, убивающие бактерии, но они взрывоопасны и (или) токсичны и влияют на безопасность, особенно при использовании больших камер. Во многих случаях подходящим методом для дезинфекции может быть обработка загрязненного объема аэрозолем 0,05 %-ного (объемная доля) раствора уксусной кислоты.
D.2 Уничтожение
Перед уничтожением зараженных материалов, споровых культур, споровых суспензий и пр. их следует дезинфицировать методом D.1.1 или D.1.2.
Примечание - Обильный нарост на питательной среде (культуры) предпочтительно обеззараживать в автоклаве. Разлитую суспензию спор и стекло из разбитой пробирки, и другие вредные инфекционные материалы следует дезинфицировать, покрывая за несколько часов до уничтожения целлюлозой, насыщенной раствором гипохлорита натрия или другим дезинсектором, указанным в D.1.1.
Приложение Е
(справочное)
Данные об испытательных грибах
Е.1 Перечень идентичных штаммов
Таблица Е.1 - Перечень идентичных штаммов
|
Наименование |
Номер штамма |
Идентичные штаммы1) |
|
1 Aspergillus niger |
АТСС 6275 |
CBS 131.52 CMI 45551 DSM 1957 NBRC 6341 NRRL 334 QM 324 QM 324458 IAM 3001 CBS 377.64 CMI 45543 DSM 1958 |
|
2 Aspergillus terreus |
АТСС 10690 |
NBRC 6346 NRRL 571 QM82j IAM3004 |
|
3 Chaetomium globosum |
АТСС 6205 |
CBS 148.51 CMI 45550 DSM 1962 NRRL 1870 QM 459 NBRC 6347 IAM 8059 |
|
4 Hormoconis resinae |
DSM 1203 |
NRRL 2778 NBRC 100535 |
|
5 Paecilomyces variotii |
АТСС 18502 |
CBS 284.48 CMI 40025 DSM 1961 NRRL 1115 QM 6764 IAM 5001 NBRC 33284 IAM 13426 |
|
6 Penicillium funiculosum |
АТСС 36839 |
CDS 631.66 CMI 114933 DSM 1944 IAM 7013 NBRC 33285 JCM 5594 |
|
7 Scopulariopsis brevicaulis |
АТСС 36840 |
CMI 49528 DSM 9122 QM 9958 BRC 100536 |
|
8 Trichoderma virens |
АТСС 9645 |
DSM 1963 IAM 5061 NBRC 6355 |
|
1) Допускается использовать другие идентичные вещества. 14 |
||
Е.2 Рекомендуемые питательные среды для хранения культур
Всю среду с агаром (таблица Е.2) в течение 15 мин необходимо стерилизовать в автоклаве при (120 ± 1) °С.
Таблица Е.2 - Рекомендуемые питательные среды
|
Испытательные грибы |
Питательная среда |
|
1 Aspergillus niger |
Экстракт солода для микробиологии с добавлением 25 г/л дистиллированной воды. Экстракт солода для микробиологии с добавлением
от |
|
2 Aspergillus terreus |
|
|
4 Hormoconis resinae |
|
|
5 Paecilomyces variotii |
|
|
6 Penicillium funiculosum |
|
|
3 Chaetomium globosum |
Минеральная соль-глюкоза-агар в растворе, приведенном в 6.3*, с добавлением от 15 до 20 г/л агара |
|
7 Scopulariopsis brevicaulis |
|
|
8 Trichoderma virens |
|
|
* Chaetomium globosum со стерильной полоской фильтровальной бумаги, лежащей на поверхности. |
|
Слой питательной среды, зараженный спорами культур испытательных грибов и затем инкубированный, допускается использовать для проверки жизнеспособности в течение 7 сут. Однако его не допускается использовать для того, чтобы установить, могут ли условия по температуре и относительной влажности в инкубационной камере в достаточной степени поддерживать рост плесневых грибов так, как это определяют с помощью контрольных полосок (см. 6.3).
Приложение F
(справочное)
Руководство
F.1 Механизмы заражения
Грибы развиваются в почве или на широко распространенных материалах многих типов, или внутри них. Они распространяются воспроизводством спор, которые отделяются от основной колонии, прорастают и образуют новую колонию.
Эти споры малы (от 1 до 10 мкм) и легко переносятся потоком воздуха. Они также прилипают к частицам пыли и с ними проникают в аппаратуру.
Таким образом, все части аппаратуры, в которую проникает воздух, могут быть заражены спорами. Заражение может также происходить при контакте с руками, например, споры могут переноситься отпечатками пальцев.
Кроме того, заражение может быть вызвано клещами, которые способны проникать в очень маленькие щели (до 25 мкм) и переносить споры плесневых грибов на своих телах. Погибшие тела и экскременты клещей создают пленку питательной среды, которая способствует распространению плесневых грибов из спор.
F.2 Прорастание и развитие спор
Влага способствует прорастанию спор там, где на поверхности присутствует пыль или другой гигроскопичный материал, который может из среды поглощать влагу.
При относительной влажности ниже 65 % прорастание или развитие плесневых грибов не происходит. Чем выше относительная влажность воздуха, тем быстрее будут развиваться грибы. Однако споры могут быть жизнеспособными в течение продолжительных периодов при очень низкой влажности и даже, если прекратился основной рост. Они могут прорастать и начинать расти, как только относительная влажность станет благоприятной для их роста.
Кроме высокой влажности среды для спор необходимо, чтобы на поверхности изделия находился слой материала, поглощающего влагу. При наличии влаги органические материалы выделяют достаточно питательной среды для поддержания небольшого роста спор. Собственно органическая пыль содержит достаточно питательных веществ для роста плесени. Росту плесени способствуют застоявшийся воздух и отсутствие вентиляции.
Оптимальная температура прорастания большинства грибов, которая может приводить к отказу аппаратуры, находится в пределах от 20 °С до 30 °С. Однако отдельные виды плесневых грибов могут прорастать при температуре ниже 0 °С, а некоторые при такой высокой, как 40 °С.
Многие споры не разрушаются длительной выдержкой при температурах ниже 0 °С и при высоких температурах до 80 °С включительно.
F.3 Воздействия роста грибов
F.3.1 Основные воздействия
Плесневые грибы могут жить на большинстве органических материалов, но некоторые из этих материалов намного чувствительнее к воздействию. Развитие, как правило, происходит только на поверхностях, подвергаемых воздействию воздуха. Поверхности, абсорбирующие или адсорбирующие влагу, более чувствительны к воздействию.
Даже если происходит незначительное воздействие влаги на материал, образование путей электрической проводимости по поверхности из-за слоя влажного мицелия может сильно снижать сопротивление изоляции между электрическими проводниками.
При развитии влажного мицелия под воздействием электромагнитного поля электронной схемы, чувствительной к изменению параметров, могут возникать серьезные изменения частотных и импедансных характеристик схемы.
Очень чувствительны к воздействию плесневых грибов кожа, шерсть, хлопчатобумажные ткани, целлюлоза, шелк и другие натуральные материалы. Большинство пластмасс менее восприимчивы, но также подвержены воздействию плесневых грибов.
Пластмассы могут содержать неполимеризованные мономеры, олигомеры и (или) добавки, способные мигрировать к поверхности и служить питательной средой для грибов и их обильного роста.
Воздействие грибов на материалы приводит к уменьшению механической прочности и (или) изменению других физических свойств.
Длительность эксплуатации некоторых материалов зависит от наличия пластификаторов. Питаясь пластификаторами, грибы делают материал хрупким.
F.3.2 Второстепенные воздействия
Рост плесневых грибов приводит к образованию кислотных продуктов метаболизма и других веществ, которые оказывают вторичное воздействие на материал.
Данное воздействие может приводить к электролитическому эффекту или старению, в результате этого процесса может нарушаться прозрачность стекла. Окисление или изменение состава может усиливаться в присутствии энзимов, выделяемых грибами.
При развитии грибы выделяют неприятный запах и ухудшают внешний вид изделий.
F.3.3 Воздействия, связанные с конструкцией аппаратуры
Из-за модульной конструкции и наличия внутренних соединений аппаратуры рост плесневых грибов в одном месте может ужесточить воздействие на другой блок, в котором рост плесневых грибов недопустим.
Поэтому следует оценивать возможное воздействие на характеристику в целом, учитывая основные или второстепенные воздействия на отдельные блоки и компоненты.
Следует обращать внимание на то, что все элементы, служащие для идентификации материала или аппаратуры, как-то этикетки, маркировка и др., должны быть доведены до того же уровня защиты, что и собственно изделие.
F.4 Предотвращение роста плесени
С целью предотвратить вредное воздействие плесневых грибов применяют следующие способы защиты:
Все применяемые изолирующие материалы выбирают с учетом высокой устойчивости к воздействию плесневых грибов, увеличивая таким образом время, требующееся для роста мицелия, и уменьшая любые повреждения материала, являющиеся следствием такого роста.
Для получения требуемой характеристики или продолжительности работы изделия часто необходимо использовать смазочные материалы, лаки, финишные обработки и др. Такие материалы следует выбирать с учетом их устойчивости к росту плесневых грибов. Для защиты некоторых материалов рекомендуется применять фунгициды.
Следует избегать зазоров, которые во время сборки оборудования скапливают влагу, и в этих условиях могут развиваться грибы. Примером являются зазоры между неплотно сочлененными штекерами и розетками или между основанием печатных плат и углами соединителей в отдельных положениях.
Наиболее эффективным способом предотвращения роста плесневых грибов считают полную герметизацию аппаратуры с сухой чистой средой внутри. Непрерывное рассеивание тепла в корпусе может гарантировать достаточно низкую относительную влажность для избежания роста плесени.
Работа аппаратуры в соответствующих контролируемых условиях может предотвращать вредный рост плесневых грибов.
Регулярно применяемые дезинсекторы в частично герметизированной аппаратуре могут поддерживать относительную влажность, достаточную для предотвращения вредного роста плесневых грибов.
Периодическая и тщательная чистка закрытой аппаратуры для удаления скопившихся плесневых грибов и пыли (питательный слой) предотвращает порчу оборудования.
Фунгициды, введенные, например, в лаки в виде таблеток или распыляемые непосредственно, могут предотвращать на время рост плесневых грибов (см. F.7).
В тех случаях, когда материал и условия работы аппаратуры позволяют такую обработку, для стерилизации применяют ультрафиолетовое излучение или озон.
Протекающие через части аппаратуры воздушные потоки при соответствующей скорости могут замедлять в этих частях развитие плесени.
Развитие клещей могут предотвратить акарициды.
Применение защитных покрытий, например эпоксидной смолы, кремниевых полимеров, акрилов или параполиксилилена, на схемах печатных плат уменьшает смачивание поверхности любыми испарениями конденсированной воды и, следовательно, подавляет рост плесени, если непосредственно защитное покрытие устойчиво к росту плесени.
F.5 Применение испытаний на грибостойкоость
Проведение испытаний на грибостойкость, как правило, должно быть ограничено проверкой правильности применения используемых компонентов и материалов, так как испытание на грибостойкость готовой аппаратуры в целом является чрезмерно дорогим или может давать сомнительные результаты.
Большинство требуемых данных может быть более легко и точно получено при испытании материалов, компонентов, блоков, небольших составных секций и т.п. (см. F.4).
Проведение проверки грибостойкости материалов следует выполнять в соответствии со специальными стандартами, например, ИСО 846, и поручать лабораториям, компетентным в этом отношении.
Примечание - Лаборатории по проведению микробиологических испытаний технической продукции должны быть аккредитованы в соответствии с ИСО/МЭК 17025.
Испытание по варианту 1 предназначено для полной проверки на стадии разработки, когда проведен рациональный выбор заранее испытанных материалов и когда не предполагается развитие грибов.
В тех случаях, когда может происходить поражение грибами, следует использовать как вариант 1, так и вариант 2 для оценки работоспособности пораженных и не пораженных грибами образцов.
Эти испытания не заменяют рациональный выбор материалов. Невозможно разработать простые испытания, которые заменяют тщательные предварительные испытания материалов и экспертную оценку их результатов.
Выбор предварительно испытанных материалов считают одной из самых важных мер предосторожности, которые принимают, при разработке аппаратуры для работы во влажных условиях окружающей среды.
В тех случаях, когда сильного заражения изолирующей поверхности не происходит, такой выбор материалов часто является единственной мерой предосторожности, которую следует принимать, и обеспечивает стойкость изделий в самых жестких условиях.
Если аппаратура работает в условиях, благоприятных для роста плесневых грибов, только незначительное время или если приняты меры предосторожности, например такие, как герметизация или непрерывное нагревание для уменьшения внутренней влажности, то проводить испытание на грибостойкость нет необходимости, при условии, что материалы выбраны правильно и применены надежные принципы конструирования.
Если такие принципы не были применены, испытание не позволяет установить все возможные причины дефектов.
При испытании J, применяемом в качестве заключительного контроля, используют только небольшой набор культур, выбираемых для воздействия на материалы, которые слабо устойчивы к росту плесневых грибов.
Поэтому данное испытание выявляет характер любого вредного воздействия на правильно сконструированное изделие.
На изделиях несовершенной конструкции и с непригодными материалами эти испытания не могут выявить все потенциальные дефекты.
F.6 Основные типы воздействий
F.6.1 Степень роста и воздействия на поверхность после 28 сут инкубации
F.6.1.1 Вариант 1
Испытание данного вида проводят наиболее часто. По степени роста контролируют, стойкие ли материалы использованы. Местонахождение плесневых грибов указывает участки, в которых можно ожидать повреждения и, где необходимо, предусмотреть наибольшие зазоры или расстояния утечки.
Рост плесневых грибов на поверхности указывает участки, где наиболее вероятно произойдет физическое повреждение.
F.6.1.2 Вариант 2
Несмотря на то, что изделие стойкое, рост плесени возможен в результате загрязнения поверхности питательными средами.
В этом случае возможны вторичные воздействия, например воздействие метаболитами, производимыми ростом плесени или физическим проникновением мицелия гриба.
Вариант 2 используют для оценки воздействий роста плесневых грибов на материалы или на рабочую характеристику изделий, когда рост плесневых грибов вызван сильным загрязнением поверхности питательными средами.
Вариант 2 допускается также использовать для оценки эффективности обработки изделия фунгицидами (см. F.7.2).
Вариант 2 непригоден для воспроизведения условий очень интенсивного загрязнения поверхности, например, из-за большого количества органической пыли или погибших насекомых.
Для подтверждения того, что были использованы устойчивые материалы и рациональные принципы конструирования, образцы, подвергаемые испытанию по варианту 2, должны соответствовать требованиям варианта 1.
В этом случае необходимо выполнять вариант 1 испытания, используя отдельные образцы.
F.6.2 Воздействие на рабочую характеристику влажного тепла после 28 сут инкубации (вариант 2) или после 28 или 56 сут инкубации (вариант 1)
Данное испытание позволяет получить представление о порядке и ожидаемом характере изменения рабочей характеристики при работе изделий в условиях роста плесневых грибов.
Непосредственно присутствие влажности приводит к изменению рабочей характеристики, и важно выполнение двух серий измерений: одной - на не зараженных грибами образцах и другой - на зараженных образцах.
Разница между результатами этих двух серий и будет результатом воздействия влажного мицелия.
Компоненты питательного раствора, требуемые для варианта 2, могут непосредственно влиять на рабочую характеристику образца, например, уменьшая стойкость поверхности.
Точная оценка разницы может быть затруднена из-за роста плесени на незараженных образцах (отрицательных контрольных образцах) и при заражении спорами с самого начала или во время испытания.
Во избежание самопроизвольного роста плесневых грибов необходимы особые меры предосторожности.
F.6.3 Влияние на рабочую характеристику после восстановления в течение 24 ч
Данное испытание позволяет получить представление о порядке и характере изменения рабочей характеристики из-за присутствия мицелия, который вырос за время высокой относительной влажности и не развивается после этого при низкой относительной влажности.
Данная методика предназначена для изделий, которые должны храниться в условиях обильного развития плесневых грибов и позднее должны быть установлены и работать в помещении с кондиционированием воздуха.
Необходимы две серии измерений, чтобы различать постоянные воздействия, вызванные влажностью и наличием мицелия.
F.7 Применение фунгицидов
Для обеспечения дополнительной устойчивости изделий к вредному воздействию плесневых грибов применяют соответствующий фунгицид, служащий для сдерживания или предотвращения роста плесневых грибов.
F.7.1 Ограничение применения
При выборе фунгицида для защиты аппаратуры учитывают нижеследующее.
Фунгицид не должен приводить к увеличению содержания токсичных веществ в атмосфере, которые будут угрожать здоровью обслуживающего персонала во время работы или проведения испытаний. Металлоорганические компаунды, используемые в качестве фунгицида, токсичны, например летучие органические ртутные компаунды.
Летучие компоненты фунгицида не должны приводить к разрушению составных частей аппаратуры, например электролитической коррозии металлических частей, понижению сопротивления изоляции или падению напряжения на поверхности изолятора, образованию или осаждению изолирующей пленки на контактах переключателей, выключателей и т.д.
В тех случаях, когда в аппаратуру включены светочувствительные элементы, летучие компоненты фунгицида не должны создавать светопоглощающих слоев на окнах компонентов.
F.7.2 Характеристика воздействия фунгицидов
Фунгицид должен быть стабилен и жизнестоек при самой высокой температуре, возможной при эксплуатации аппаратуры.
Он должен быть устойчив к выщелачиванию повторяющейся конденсацией влаги на внутренних поверхностях.
Он не должен быть настолько летучим, чтобы полностью испариться до окончания необходимой продолжительности защиты.
Если требуется длительное воздействие фунгицида, давление его паров должно быть достаточным для поддержания эффективной концентрации каждый раз, когда рост плесневых грибов может приводить к увеличению вредных эффектов.
Если фунгицид предназначен для длительной защиты, в результате эволюционных изменений отбирают виды грибов, устойчивых к применяемому фунгициду. Поэтому, если требуется постоянная защита, фунгицид не только периодически обновляют, но и заменяют его на фунгицид другого типа.
F.7.3 Длительность защиты и проведение испытания
Допускается выбирать фунгицид для защиты в течение нескольких месяцев во время транспортирования во влажной окружающей среде или для защиты в течение длительного времени. Если фунгицид применяют для кратковременной защиты во время транспортирования, испытание по варианту 1 необходимо проводить с помощью активного фунгицида, вложенного в транспортную тару. Если требуется долговременная защита и (или) возможно загрязнение поверхности, то следует также использовать испытание по варианту 2.
Для проверки постоянства свойств фунгицида перед проведением испытания на грибостойкость могут потребоваться испытания при высокой температуре и (или) при высокой влажности. Если такая программа признана необходимой, то она должна быть установлена в соответствующих НД.
Приложение ДА
(справочное)
Сведения о соответствии ссылочных международных стандартов ссылочным национальным стандартам Российской Федерации
Таблица ДА.1
|
Обозначение ссылочного международного стандарта |
Степень соответствия |
Обозначение и наименование соответствующего национального стандарта |
|
ИСО/МЭК 17025:1999 |
- |
* |
|
ИСО 846:1997 |
- |
* |
|
MIL-STD 810 F-2000 Метод 508.5 Грибы |
- |
* |
|
* Соответствующий национальный стандарт отсутствует. До его утверждения рекомендуется использовать перевод на русский язык данного международного стандарта. Перевод данного международного стандарта находится в Федеральном информационном фонде технических регламентов и стандартов. |
||
Ключевые слова: испытание J и руководство, грибостойкость, воздействие внешних факторов, методы испытаний, образцы, применение, заражение, инкубация, внешний осмотр, воздействие плесневых грибов, степень роста плесневых грибов, методы посева, меры безопасности, методики обеззараживания