|

|
|
«УТВЕРЖДАЮ»
|
|
|
Руководитель
Департамента ветеринарии
|
|
|
Минсельхоза
России
|
|
|
___________________
Е.А. Непоклонов
|
|
|
«11» 05 2004 г.
|
|
|
№ 13-5-02/1043
|
|
МИНИСТЕРСТВО
|
|
|
|
СЕЛЬСКОГО
ХОЗЯЙСТВА
|
|
|
|
РОССИЙСКОЙ
ФЕДЕРАЦИИ
|
|
|
|
(Минсельхоз
России)
|
|
|
|
ДЕПАРТАМЕНТ
ВЕТЕРИНАРИИ
|
|
|
|
107139, Москва, Орликов пер., 1/11
|
|
|
|
Для телеграмм: Москва, 84
|
|
|
|
Минроссельхоз
|
|
|
|
Факс: (095) 975 58 50, тел: (095) 207 80 00
|
|
|
|
E-mail: chief@devet.mcx.ru
|
|
|
|
http://www.mcx.ru
|
|
|
|
|
|
|
|
11.05.2004 г. № 13-5-02/1043
|
|
|
|
на № ____________________
|
|
|
Методические рекомендации
«Выделение
и идентификация бактерий
желудочно-кишечного тракта животных»
ОБЩИЕ ПОЛОЖЕНИЯ
Методические рекомендации «Выделение и идентификация
бактерий желудочно-кишечного тракта животных» разработаны для
научно-исследовательских и учебных ветеринарных учреждений, ветеринарных
лабораторий и других организаций и предназначены для выделения, количественного
учета, идентификации и изучения биологических свойств условно-патогенных,
патогенных и полезных бактерий желудочно-кишечного тракта животных, а также
определения потенциальной этиологической значимости выделенных микроорганизмов
при желудочно-кишечных болезнях животных.
В методических рекомендациях изложены количественные и
качественные методы исследований микрофлоры кишечника животных, позволяющие
рационализировать и упростить бактериологический анализ с целью прижизненной
постановки диагноза на желудочно-кишечные болезни и дисбактериоз, экономить
материальные средства и сократить затраты труда, что позволит проводить
обследование большого поголовья животных в короткие сроки и охарактеризовать
этиологическую структуру острых кишечных болезней в хозяйстве, а также дать
оценку степени защищенности животных полезной микрофлорой и определять
лечебно-профилактическую эффективность различных препаратов.
СОДЕРЖАНИЕ
В последние годы с несомненностью установлена
полиэтиологичность острых кишечных заболеваний человека и животных с
существенным удельным весом возбудителей, относящихся к условно-патогенным
бактериям. Между тем причины желудочно-кишечных болезней животных часто
остаются нерасшифрованными, что затрудняет анализ, учет заболеваемости и
проведение лечебно-профилактических мероприятий. В результате, невозможно
целенаправленно конструировать специфические биологические препараты и
объективно оценивать их эффективность.
Выделение, количественный учет и точная идентификация
условно-патогенных, патогенных и полезных бактерий желудочно-кишечного тракта
животных вызывают определенные затруднения. Существующие на сегодняшний день
методики определения микробного состава содержимого кишечника предусматривают,
как правило, проведение качественного анализа с использованием, для
биохимической идентификации бактерий, набора жидких дифференциально-диагностических
сред. Это не позволяет полноценно характеризовать микробный биоценоз и не
всегда обеспечивает стандартность получаемых результатов. Описанный ранее метод
количественного анализа микрофлоры кишечника (Р.В. Эпштейн-Литвак, Ф.К.
Вильшанская, 1969, модифицированный К.Я. Соколовой, 1972) дает исчерпывающий
ответ. Однако трудоемкость этого метода ограничивает его практическое
применение, особенно в условиях крупных животноводческих хозяйств. Метод можно
использовать при углубленных исследованиях или при динамическом наблюдении за
приживляемостью в кишечнике лакто- и бифидобактерий, при
лечебно-профилактическом применении соответствующих препаратов.
Представленные в данных методических рекомендациях методы
исследований фекалий животных, а также выделения и идентификации бактерий,
позволяют рационализировать и упростить бактериологический анализ, с целью
прижизненной постановки диагноза на желудочно-кишечные болезни и дисбактериоз.
Нами предложен сокращенный метод количественной оценки
состава микрофлоры желудочно-кишечного тракта животных для проведения широкого
обследования поголовья и характеристики этиологической структуры острых
кишечных болезней в хозяйстве, а также для оценки степени защищенности животных
полезной микрофлорой по количеству лакто- и бифидобактерий. За счет
обоснованного выбора критериев оценки микробного состава, число разведений
материала для количественного бактериологического анализа сокращено вдвое, что
уменьшает затраты труда, количество лабораторной посуды и питательных сред.
На этапе идентификации выделяемых бактерий мы рекомендуем
использовать коммерческие тест-системы ПБДЭ (пластины биохимические
дифференцирующие энтеробактерии) или СИБ (системы индикаторные бумажные).
Использование стабильных тест-систем обеспечивает унификацию исследований,
экономию материальных средств и сокращение затрат времени. Тест-системы удобны
для транспортировки, хранения, особенно незаменимы при работе в экспедиционных
условиях.
Для определения потенциальной этиологической значимости при
желудочно-кишечных болезнях выделенных бактерий, наряду с установлением их
видовой принадлежности, количественной характеристикой и серотипированием, мы
рекомендуем использовать выявление одного из существенных признаков
патогенности некоторых микроорганизмов - адгезивной активности.
С организмом животного ассоциированы, как правило, десятки и
сотни видов различных микроорганизмов. Многие микроорганизмы обнаруживаются в
разных областях тела, изменяясь лишь количественно, в зависимости от вида
млекопитающих. Однако большинству животных свойственны общие усредненные
показатели микрофлоры.
В таблице 1 представлены группы микроорганизмов, выявляемые
в содержимом кишечника нижних отделов желудочно-кишечного тракта животных.
Таблица 1
Микрофлора
нижних отделов желудочно-кишечного тракта животных
|
Название
микробных групп (родов или видов)
|
Количество
микроорганизмов в 1 г материала из кишечника
|
|
Эшерихии
|
107
|
|
Бифидобактерии
|
107
- 109 (до 1010)
|
|
Лактобактерии
|
106
- 107
|
|
Энтерококки
|
106
- 107
|
|
Бактероиды
|
1010
(до 1011)
|
|
Эубактерии
|
104
- 105
|
|
Клостридии
|
104
- 105
|
|
Klebsiella, Proteus,
Citrobacter, Enterobacter
|
0
- 105
|
|
Псевдомонады
|
0
- 108
|
|
Стафилококки (S. epidermidis, S. aureus
и др)
|
103
- 104
|
|
Стрептококки (S. mitis, S. salivarius
и др)
|
до
107
|
|
Дифтероиды
|
0
- 106
|
|
Аэробные бациллы (B. subtilis, B. licheniformis
и др)
|
103
- 104
|
|
Грибы, актиномицеты
|
103
|
В настоящее время установлено, что на
долю анаэробных и факультативно-анаэробных видов микроорганизмов в кишечнике
приходится 95 - 99 %, а все аэробные бактерии составляют 1 - 5 %.
При анализе количественного и качественного состава
микрофлоры фекалий животных разных видов необходимо учитывать, что вся
микрофлора желудочно-кишечного тракта условно подразделяется на нормальную
(полезную), условно-патогенную и патогенную (табл. 2).
Таблица 2
Количество
микроорганизмов в 1 г фекалий здоровых телят
|
Микрофлора
|
Вид
микроорганизма
|
Количество,
кл/г
|
|
|
Е. соli
|
106
- 107
|
|
Нормальная
|
Споровые анаэробы
|
103
- 105
|
|
микрофлора
|
Lactobacillus
|
106
- 107
|
|
|
Bifidobacillus
|
107
- 109
|
|
|
Staphylococcus
|
до
103
|
|
Условно-патогенная
|
Enterococcus
|
до
103
|
|
микрофлора
|
Streptococcus
|
до
103
|
|
|
C. albicans
|
до
103
|
|
|
P. mirabilis, P. vulgaris
|
102
- 103
|
|
|
M.morganii
|
102
|
|
|
E. coli со слабо выраженными ферментативными свойствами
|
103
|
|
|
K. pneumoniae
|
103
|
|
|
Р. rettgeri, Р. alcalifaciens,
|
103
|
|
|
С. freundii, С. diversus
|
102
|
|
|
Н. alvei
|
102
|
|
|
Erwinia
|
102
|
|
|
Shigella
|
0
|
|
|
Serratia
|
0
|
|
|
E. cloacae, E. aerogenes
|
0
|
|
|
E. agglomerans
|
0
|
|
|
Salmonella
|
0
|
|
Патогенная
|
Yersinia
|
0
|
|
микрофлора
|
E. coli энтеропатогенная
|
0
|
|
|
Токсигенные клостридии
|
0
|
Нормальные бактерии,
представленные, в основном, непатогенной Е. соli,
Lactobacillus, Bifidobacillus и споровыми анаэробами, у здоровых животных
должны содержаться в концентрациях 106 - 107 и выше м.
кл. в 1 г фекалий. При размножении, данные бактерии вырабатывают биологически
активные вещества защищающие организм животных от других микроорганизмов и их
токсинов, а также занимают экологическую нишу патогенных бактерий. При
уменьшении концентрации полезных бактерий в желудочно-кишечном содержимом
животных развивается дисбактериоз, на фоне которого может возникнуть то или
иное заболевание.
Условно-патогенные бактерии, такие как Е. соli со слабо выраженными ферментативными свойствами,
Enterococcus, Proteus, Klebsiella и др., могут постоянно находиться в
желудочно-кишечном тракте животных и не вызывать нарушений пищеварения. Однако
на фоне дисбактериоза, дефицита полезной микрофлоры, низкой резистентности
организма и других причин, условно-патогенные бактерии приобретают вирулентные
свойства и вызывают желудочно-кишечные болезни, проявляющиеся диареей,
интоксикацией, обезвоживанием организма и др.
Как следует из таблицы 2,
допустимая концентрация условно-патогенных бактерий в 1 г фекалий телят не
должна превышать 102 - 103 м. кл, а патогенные
микроорганизмы не должны обнаруживаться в кишечнике животных.
Патогенные бактерии, как правило, обладают вирулентными
свойствами и при попадании в организм животных могут вызвать заболевание. При
выделении из фекалий животных таких бактерий как Е. соli
энтеропатогенная (вызывающая гемолиз эритроцитов, обладающая адгезивными
свойствами и др.), Salmonella, Yersinia и др. эти микроорганизмы можно
рассматривать как этиологический фактор возникновения и развития болезни у
животного.
У разных видов животных и птиц соотношение полезной,
условно-патогенной и патогенной микрофлоры в желудочно-кишечном тракте может
быть различным. Даже у одного и того же вида животных в норме микробный пейзаж
может отличаться, в зависимости от содержания и кормления, качества кормов,
индивидуальных особенностей организма и др.
При проведении бактериологических исследований фекалий
животных для прижизненной постановке диагноза при желудочно-кишечных болезнях
необходимые
- бактериологические пробирки или пенициллиновые флаконы,
стерильные с резиновой пробкой и лопаточками дли забора материала. Вес пробирки
(флакона) указан на этикетке из лейкопластыря;
- чашки Петри, ГОСТ-25336-82;
- пипетки градуированные, ГОСТ-20292-74
на 1 мл, 10 мл;
- бактериологическая петля из проволоки никелевого сплава,
диаметром 0,5 - 0,5 м;
- груша резиновая малая;
- предметные стекла;
- пробирки агглютинационные, ГОСТ-25336-82;
- спирт этиловый для горения спиртовок, обжига шпателя;
- раствор хлорида натрия изотонический, pH = 7,2 - 7,4
(ИХН);
- агары: Эндо, Плоскирева, 5 %-ный кровяной, висмут-сульфит
агар, солевой агар; СТБС (специальная среда для выделения иерсиний);
- среда обогащения (селенитовый бульон или хлормагниевая
среда, или среда Мюллера);
- среда Блаурокка жидкая;
- среда МРС-2 полужидкая;
- мясопептонный 2 %-ный агар в пробирках по 5 мл;
- стерильное вазелиновое масло;
- растворы консервантов (см. приложение № 1);
- комбинированные среды типа Олькеницкого, Ресселя,
Клиглера;
- наборы стабильных тест-систем для идентификации
микроорганизмов по биохимическим свойствам (ПБДЭ или СИБ);
- наборы диагностических сывороток для серологической
диагностики эшерихий, сальмонелл и других энтеробактерий.
Рецептура питательных сред, консервантов, характеристика
ПБДЭ и СИБ дана в приложении.
При заборе материала необходимо исключить возможность
загрязнения его микроорганизмами из окружающей среды. Для бактериологического
исследования целесообразно брать пробы до начала фаго- и антибиотикотерапии.
Исследуемый материал (фекалий около 1 г) забирают в
стерильные, предварительно взвешенные бактериологические пробирки или пенициллиновые
флаконы. В сопроводительном документе необходимо указать вид и номер животного,
его возраст, клиническое состояние, когда и какие виды бактериофагов,
антибиотиков или других антибактериальных препаратов применяли, дату и время
взятия пробы, первичность или повторность анализа. Исследуемый материал
суспендируют в изотоническом растворе хлорида натрия (ИХН) pH - 7,2 - 7,4 в
отношении 1:10 (из расчета 1 г материала и 9 мл ИХН) и высевают на питательные
среды не позднее двух часов с момента взятия пробы.
При использовании консервантов материал пригоден для
исследования в течение 12 - 24 ч. В качестве консервантов используют
глицериновую смесь (pH - 7,8), буферный глицериново-солевой раствор,
фосфатно-буферный раствор (pH - 8,0), ИХН (pH - 7,2 - 7,4) (см. приложение № 1).
Вес взятого для анализа материала определяют по разнице
весов флакона с материалом (или флакона с материалом и консервантом) и веса
пустого флакона (или флакона с консервантом).
Для приготовления материала в разведении 1:10 требуемое
количество ИХН определяют по пересчетной таблице № 3. При использовании
консерванта от установленного по таблице № 3
объема ИХН следует вычесть объем консерванта. Хранят материал при температуре 4
± 1 °С.
I день исследований - Исследуемый материал
(содержимое кишечника, фекалии) разводят физиологическим раствором 1:10,
согласно пересчетной таблице № 3.
Готовят разведения исследуемого материала от 10-1
до 10-8. Из каждого разведения делают посевы на пластинчатые
питательные среды Эндо, висмут-сульфит агар, желточно-солевой агар, агар Плоскирева,
кровяной агар), на среду МРС-2 и Блаурокка и инкубируют при температуре 37 °С
18 - 24 часа. Из разведения 1:10 делают также посев на среду обогащения
(селенитовая среда) для выделения сальмонелл и инкубируют при температуре 37 °С
16 - 18 часов.
Таблица 3
|
Вес,
мг
|
Кол-во
ИХН, мл
|
Вес,
мг
|
Кол-во
ИХН, мл
|
Вес,
мг
|
Кол-во
ИХН, мл
|
|
200
|
1,80
|
370
|
3,33
|
530
|
4,77
|
|
210
|
1,89
|
380
|
3,42
|
540
|
4,86
|
|
220
|
1,98
|
390
|
3,51
|
550
|
4,95
|
|
230
|
2,07
|
400
|
3,60
|
560
|
5,04
|
|
240
|
2,16
|
410
|
3,69
|
570
|
5,13
|
|
250
|
2,25
|
420
|
3,78
|
580
|
5,22
|
|
260
|
2,34
|
430
|
3,87
|
590
|
5,31
|
|
270
|
2,43
|
440
|
3,96
|
600
|
5,40
|
|
280
|
2,52
|
450
|
4,05
|
610
|
5,40
|
|
290
|
2,61
|
460
|
4,14
|
620
|
5,58
|
|
300
|
2,70
|
470
|
4,23
|
630
|
5,67
|
|
310
|
2,79
|
480
|
4,32
|
640
|
5,76
|
|
320
|
2,88
|
490
|
4,41
|
650
|
5,85
|
|
330
|
3,06
|
500
|
4,50
|
660
|
5,94
|
|
350
|
3,15
|
510
|
4,59
|
670
|
6,03
|
|
360
|
3,24
|
520
|
4,68
|
680
|
6,12
|
|
690
|
6,21
|
790
|
7,11
|
900
|
8,10
|
|
700
|
6,30
|
800
|
7,20
|
910
|
8,19
|
|
710
|
6,39
|
810
|
7,29
|
920
|
8,2,8
|
|
720
|
6,46
|
820
|
7,38
|
930
|
8,37
|
|
730
|
6,57
|
830
|
7,47
|
940
|
8,46
|
|
740
|
6,66
|
840
|
7,56
|
950
|
8,55
|
|
750
|
6,75
|
850
|
7,65
|
960
|
8,64
|
|
760
|
6,84
|
860
|
7,74
|
970
|
8,82
|
|
770
|
6,93
|
870
|
7,83
|
990
|
8,91
|
|
780
|
7,02
|
880
|
7,92
|
1000
|
9,00
|
II день
исследований - С пластинчатых питательных сред отбирают изолированные
колонии и делают посевы на среды для первичной идентификации микроорганизмов
(среда Олькеницкого или среда Клиглера). Проводят количественный учет колоний.
Делают посевы со среды обогащения на пластинчатые питательные среды (агар
Плоскирева и висмут-сульфит агар), с дальнейшей родовой и видовой идентификацией.
Все посевы инкубируют при температуре 37 ºС 18 - 20 часов.
III день исследований -
Проводят учет результатов первичной идентификации бактерий. Делают посевы на
среды минимального дифференцирующего ряда для определения рода. Проводят
серологическую идентификацию с агглютинирующими и адгезивными сыворотками к
сальмонеллам и энтеропатогенным E. coli (ЕРЕС). Используют диагностические
бактериофаги.
IV день исследований - Делают заключение о родовой и
видовой принадлежности микроорганизмов. Проводят постановку дополнительных
тестов для идентификации некоторых видов энтеробактерий. Готовят мазки со сред
Блаурокка и МРС-2 и просматривают их под микроскопом. Проводят серологическую
идентификацию выделенных микроорганизмов в реакции агглютинации на стекле с использованием
диагностических сывороток.
V день исследований - Окончательное определение
видов, биоваров, количественная характеристика выделенных микроорганизмов.
При посеве материала для выделения чистой культуры
используют пластинчатые селективно-дифференциальные среды, для выделения
сальмонелл - среды обогащения.
Для количественной характеристики аэробной микрофлоры
проводят дозированный посев на пластинчатые среды из четырех диагностически
значимых разведений исходного материала (10-4, 10-5, 10-6,
10-8). Разведения готовят в пяти бактериологических пробирках. В две
пробирки наливают по 9,9 мл изотонического раствора хлорида натрия (для
разведений 10-3, 10-8), в три пробирки - 4,5 мл (для
разведений 10-4, 10-5) и последовательно переносят взвесь
из предыдущего разведения в последующее в объемах, указанных на рис. 1.
Всю работу проводят с соблюдением стерильности, со сменой
пипеток при переходе от предыдущего разведения к последующему. Каждую взвесь
хорошо перемешивают.
Перед работой пластинчатые среды подсушивают в сушильном
шкафу при температуре 60 ± 1 °С в течение 20 мин, при 40 = 1 °С в течение 45
мин. На поверхности агара не должно оставаться конденсационной влаги.
Целесообразно использовать следующий набор сред,
обеспечивающих выделение патогенных и условно-патогенных энтеробактерий:
- селективная среда Плоскирева, для выделения сальмонелл
(посев проводят петлей из разведения 10-1 и 10-4);
- дифференциально-диагностическая среда Эндо, для выделения
клебсиелл, протеев, энтеробактеров, гафний (посев проводят пипеткой в объеме
0,05 мл из разведения 10-8);
- дифференциально-диагностическую среду Эндо для выделения энтеробактерий
(посев проводят пипеткой, мерно, из разведений 10-5 и 10-6
в объеме 0,05 мл с последующим растиранием шпателем);
- 5 %-ный кровяной агар для выделения гемолитических форм
микроорганизмов (проводят посев суспензий чистых культур микроорганизмов и
посев из разведений 10-5; 10-6, пипеткой в объеме 0,05 мл
с последующим растиранием шпателем).
Для выделения сальмонелл используют жидкие среды обогащения:
хлор-магниевую, Мюллера, селенитовый бульон. Посев проводят пипеткой в объеме 1
мл из исходного (10-1) разведения в 5 мл среды обогащения с
последующим высевом петлей через 16 - 18 ч на дифференциально-диагностические
среды.
Для выявления лакто- и бифидобактерий используют жидкие
среды:
- Блаурокка - для обнаружения бифидобактерий (посев делают
из разведения 10-8 в объеме 1 мл);
- МРС-2 - для выявления лактобактерий (посев проводят из
разведения 10-8 в объеме 0,05 мл). Следует обратить внимание на
необходимость создания анаэробных условий культивирования бактерий на среде
Блаурокка и МРС-2, так как бифидо- и лактобактерии являются факультативными
анаэробами. При посеве пипетку с микробной взвесью опускают на дно пробирки и
осторожно выливают содержимое, стараясь не допускать появления пузырьков
воздуха в пробирке.
Все посевы инкубируют в термостате при 37 ± 1 °С:
- среды Плоскирева, Эндо, селенитовый бульон, магниевую
среду - 18 - 24 ч;
- 5 %-ный кровяной агар - 48 ч;
- среды МРС-2 и Блаурокка - 3 - 4 суток;
- висмут-сульфит агар - 48 ч.
При пересеве клеток микроорганизмов с одной среды на другую
все манипуляции всегда проводят вблизи пламени горелки (но не в пламени!), по
возможности быстро, чтобы не загрязнять культуру посторонними микроорганизмами.
При взятии материала, пробирки (колбы) необходимо удерживать в наклонном
положении, чтобы гарантировать стерильность культуры. Если держать их
вертикально, то возможно попадание в культуру посторонней микрофлоры.
Если микроорганизмы высевают на плотную скошенную
питательную среду, то бактериологической петлёй или иглой с культурой, по
поверхности среды проводят прямую или волнообразную черту (лёгким движением, не
разрезая среды). Такой способ называется «посев штрихом». Зигзагообразный штрих
проводят в тех случаях, когда необходимо получить больше посевного материала
(для смывов и т.д.). Если культуру высевают в столбик питательной среды, то
иглу или петлю вводят в центральную часть, в толщу среды до дна пробирки. Такой
способ называется «посев уколом».
Культуру помещают в термостат, проводят наблюдения за её
развитием и описывают характер роста микроорганизмов.
Если посев делают в жидкую среду (или из жидкой среды),
лучше пользоваться пипеткой или петлёй. Пробирки держат слегка наклонив, чтобы
не замочить их края и пробки. Перед тем как закрыть пробирки, пробки и края
пробирок обжигают в пламени.
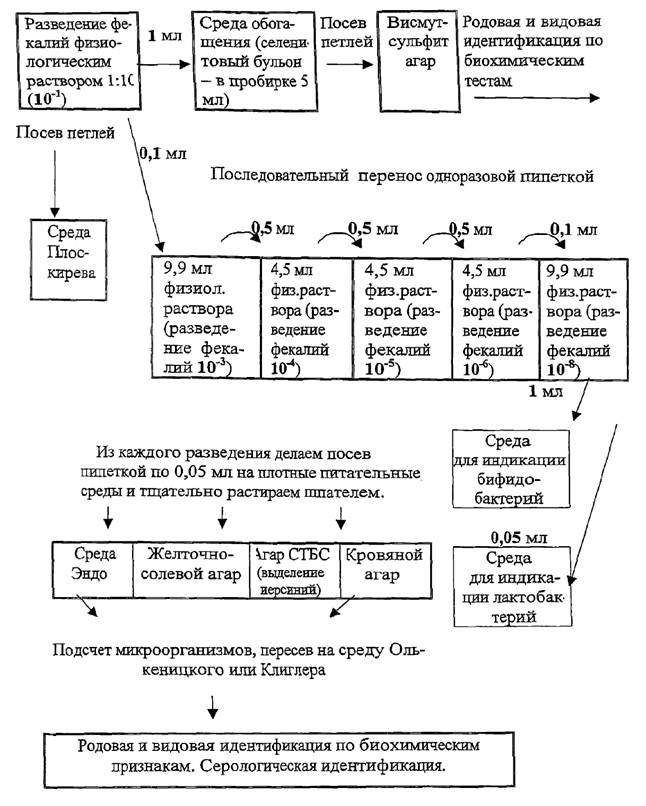
Рис. 1. Схема
сокращенного метода исследований
микрофлоры кишечника животных
При посеве материала на плотные питательные среды необходимо
получить рост изолированных колоний, в противном случае идентификация бактерий
невозможна. Чашки с посевом просматривают невооруженным глазом.

Рис. 2. Характеристика колоний:
|
Форма колоний: а - округлая, б -
неправильной формы, в - амебовидная,
г - ризоидная, д -
мицелиальная;
Профиль колоний: а - плоский, б -
выпуклый, в - кратерообразный,
г - конусовидный;
Край колоний: а - ровный, б -
волнистый, в - лопастной, г - бахромчатый;
Структура колоний: а - однородная, б
- мелкозернистая, в - крупнозернистая,
г - струйчатая, д - волокнистая.
|
В числе характеристик колоний
учитывают их размер (диаметр в мм), форму, возвышение над поверхностью
(плоская, выпуклая), особенности края (ровный - S-форма, волнистый - R-форма) и
поверхности (блестящая, матовая), цвет, плотность (прозрачная, мутная) и
консистенцию (вязкая, пленчатая и др.).
Для определения качественного состава бактерий, колонии на
чашке группируют по культуральным признакам (характер колонии), которые
являются наиболее существенной особенностью роста микроорганизмов на плотной
питательной среде.
Различают: 1) поверхностные; 2) глубинные; 3) донные
колонии, в зависимости от того, где они развивались - на поверхности плотной
питательной среды, в толще ее или на дне сосуда. Обычно изучают и описывают
только колонии, выросшие на поверхности среды, так как именно эти колонии
отличаются большим разнообразием. Глубинные колонии, напротив, довольно
однообразны. Чаще всего они имеют вид более или менее сплющенных чечевичек,
принимающих в проекции форму овалов с заостренными концами. Лишь у немногих
микроорганизмов глубинные колонии напоминают пучки ваты с нитевидными выростами
в питательную среду. Образование глубинных колоний часто сопровождается
разрывом агаризованной среды вследствие выделения углекислоты или других газов
развивающимися микроорганизмами. Донные колонии самых разнообразных
микроорганизмов растут в виде тонких прозрачных пленок, стелющихся по дну.
При описании колонии необходимо указывать возраст культуры,
состав среды и температуру культивирования.
Решающее значение при оценке энтеробактерий на пластинчатых
средах имеет дифференциация по окраске изолированных колоний, зависящая от
отношений бактерий к дифференцирующим компонентам питательной среды, например,
лактозе (табл 4).
Таблица 4
Характеристика
колоний энтеробактерий различных родов
|
Род
|
Характер роста на различных питательных
средах
|
|
1
|
2
|
|
Salmonella
|
Размер колоний 2,0 - 4,0 мм в диаметре,
слегка выпуклые, с ровным краем и гладкой поверхностью, влажные.
На МПА - прозрачные с голубоватым оттенком колонии.
На среде Эндо - обычно прозрачные. бледно-розовые,
без металлического блеска.
На среде Плоскирева - бесцветные, мутноватые, уплотненные.
На среде Левина - прозрачные с фиолетовым оттенком.
На висмут-сульфит агаре - черные, с металлическим блеском. Под
колониями среда прокрашивается в черный цвет.
S. paratyphi
А - зеленоватые,
светло-нежные.
На солевом агаре - голубоватые, нежные, прозрачные.
|
|
Escherichia
|
Более крупные, чем колонии сальмонелл;
многообразны по окраске, плотности и форме; могут быть плоские, выпуклые или
со слегка волнистым слоем; влажные, сухие, иногда слизистые; прозрачные или
полупрозрачные; напоминают колонии клебсиелл.
На МПБ - растут диффузно, образуя интенсивную равномерную муть
и легко разбивающийся осадок; иногда образуют поверхностную пленку и кольцо
на стенке пробирки.
На МПА - гладкие, выпуклые, блестящие, с ровными краями
колонии, хорошо суспендируемые в растворе хлорида натрия (S-форма) и
более плоские, сухие, с неровными краями, плохо суспендируемые в растворе
хлорида натрия колонии (R-форма).
На среде Эндо - у лактозоположительных
штаммов - темно-красные, с металлическим блеском или без него, розовые или с
бесцветным ободком и интенсивно красным или розовым центром; у
лактозоотрицательных штаммов - под цвет среды или с розоватым оттенком.
На среде Плоскирева - рост значительно подавляется, колонии
с желтоватым оттенком.
На среде Левина - темно-синие, с металлическим блеском
или розовые.
На висмут-сульфит агаре -
бледно-зеленые, прозрачные, блестящие, иногда бурые, без металлического
блеска, легко снимаются со среды. Под колониями среда не прокрашивается.
|
|
Enterobacter
|
Хорошо растут на обычных питательных
средах. По размеру, форме и окраске сходны с колониями эшерихий и клебсиелл.
На среде Эндо - от малинового до розового цвета или
бежевого оттенка.
На среде Плоскирева - колонии с желтоватым оттенком. В косо
проходящем свете имеют зеленовато-желтоватый оттенок.
На висмут-сульфит агаре - бледно-зеленые, бурые, прозрачные,
блестящие, легко снимаются со среды. Под колониями среда не прокрашивается.
|
|
Erwinia
|
Хорошо растут при 25 - 27 °С, при 37 °С
могут не расти или давать скудный, замедленный рост. Образуют желтый пигмент.
На среде Эндо - розоватые, без металлического блеска.
На среде Плоскирева - выпуклые, желтоватого оттенка.
На висмут-сульфит агаре -
зеленоватые или коричневого цвета, без металлического блеска.
|
|
Edwardsiella
|
Растут на обычных питательных средах, но
более медленно, чем другие виды энтеробактерий, образуя мелкие (до 1 мм в диаметре),
полупрозрачные колонии.
На среде Эндо - бесцветные или розоватые,
полупрозрачные, сходные с колониями сальмонелл.
На висмут-сульфит агаре - темные, без металлического блеска и
почернения среды под ними.
На среде Плоскирева - бесцветные, полупрозрачные, с гладкой
блестящей поверхностью.
Не имеют специфического запаха.
|
|
Citrobacter
|
Гладкие, слегка выпуклые, влажные,
сероватые колонии с блестящей поверхностью. Могут встречаться слизистые и
шероховатые формы.
На среде Эндо - у лактозоположительных штаммов -
интенсивно-розовые или красные с темным центром, но не дающие характерного
для эшерихий металлического блеска; у лактозоотрицательных штаммов - слегка
опалесцируют, в тон среда или с розоватым оттенком.
На среде Плоскирева - лактозоположительные штаммы имеют
интенсивную розово-красную окраску с темным центром. Лактозоотрицательные
штаммы образуют слегка опалесцирующие, выпуклые колонии, окрашенные в тон
среды.
На висмут-сульфит агаре - через 48 ч инкубации колонии светло-зеленые,
коричневые или черные. Черные колонии, образуемые штаммами, продуцирующими
сероводород, в отличие от черных колоний, образуемых сальмонеллами, не
окрашивают в черный цвет среду под колонией.
Рост колоний сопровождается резким
неприятным запахом.
|
|
Klebsiella
|
Крупные (в диаметре 3 мм), выпуклые,
влажные, слизистые, нередко сливаются друг с другом.
На МПБ - равномерное помутнение, образование осадка и
поверхностная пленка.
На МПА - крупные, выпуклые, слизистые колонии.
На среде Эндо - лактозоположительные штаммы сходны с
колониями эшерихий, с металлическим блеском или без него. Могут быть красные,
розовые, белые, прозрачные, бесцветные с белым ободком, с темным или розовым
центром.
На среде Плоскирева - красные, розовые, бесцветные, бежевые
или желтые (в зависимости от степени ферментации лактозы).
|
|
Proteus
|
На МПБ - вызывают равномерное помутнение и
осадок.
На среде Эндо - Р. vulgaris и P. mirabilis проявляют способность к роению и дают
сливной рост. Другие виды образуют колонии, сходные с колониями сальмонелл.
На среде Плоскирева - 2 - 7 мм в диаметре, прозрачные и
полупрозрачные, выпуклые, с желтовато-розовым оттенком (перламутровые).
Вокруг колонии желтоватый ореол.
На висмут-сульфит агаре - через 48 часов культивирования
колонии влажные, грязно-коричневого цвета, без металлического блеска. После
их снятия на среде остается темно-коричневая редукционная зона.
Рост колоний сопровождается резким
гнилостным запахом.
|
|
Serratia
|
Бесцветные, по размеру и форме сходны с
колониями сальмонелл. Хорошо растут при 15 - 30 °С.
На кровяном агаре при 37 °С образуют серовато-белые
прозрачные колонии, гладкие или мелкозернистые, 1 - 2 мм в диаметре. При
комнатной температуре через 24 - 48 ч колонии становятся красными, т.к.
бактерии образуют розово-красный или малиновый водонерастворимый пигмент
продигиозин.
На скошенном МПА образуют гладкий белый налет.
На среде Эндо - прозрачные, бледно-розовые, без
металлического блеска.
На среде Плоскирева - бесцветные.
На висмут-сульфит агаре -
коричневые, черные. Пол колониями среда не прокрашивается.
Культура издает ароматный запах,
напоминающий залах карамели.
|
|
Morganella
|
Хорошо растут на обычных питательных
средах.
На кровяном агаре некоторые штаммы дают гемолиз.
На среде, содержащей 5 % триптофана,
штаммы морганелл продуцируют красно-коричневый пигмент.
Сходны по культуральным свойствам с Proteus.
На среде Эндо - сливной рост.
На среде Плоскирева - прозрачные и полупрозрачные, выпуклые, с желтовато-розовым оттенком.
На висмут-сульфит агаре - влажные, коричневого цвета, без
металлического блеска.
|
|
Hafhia
|
Полупрозрачные, бесцветные, розоватые,
сероватые или имеют оттенок среды.
На МПА - гладкие, влажные, полупрозрачные. мутноватые,
сероватые колонии диаметром 2 - 4 мм.
На среде Эндо - полупрозрачные, бесцветные или
бледно-розовые, без металлического блеска.
На среде Плоскирева - дают скудный пост, сероватые или
желтоватые или розоватые.
|
|
Yersinia
|
Хорошо растут на простых питательных
средах при температуре 28 - 29 °С и pH - 7,2 - 7,4. Культивируются в
температурном диапазоне 14 - 42 °С и pH 4 - 10. Колонии мелкие (до 1 мм в
диаметре). При 37 °С может отмечаться полиморфизм колоний, проявляющийся
появлением R-форм с выпуклым, коричневого цвета
центром и волнистыми истонченными краями.
На МПБ - могут
вызывать равномерное
помутнение (Y. enterocolitica), равномерное помутнение с последующим выпадением хлопьевидного
или вязкого осадка (Y. pseudotuberculusis) или в виде взвешенных хлопьев в прозрачном
бульоне с образованием рыхлого осадка (Y. pestis).
На МПА - образуют мелкие (диаметром 0,1 - 0,5 мм), выпуклые,
прозрачные, с голубоватым оттенком блестящие колонии. Y. pseudotuberculusis на скошенном агаре растут в виде
сплошного налета серовато-желтоватого цвета с блестящей волнистой
поверхностью.
На среде Эндо и Левина - в течение первых суток роста при 22 °С
колонии мелкие (росинки), обычно выпуклые, блестящие, бес- цветные или с
розовым оттенком, с ровным краем. В течение вторых суток роста становятся
крупными. При этом, колонии Y. enterocolitica (на среде Левина) фиолетовые с
металлическим блеском, могут приобретать розовый оттенок, а Y. pseudotuberculosus - остаются неокрашенными.
На среде Плоскирева - не растут. При обильном посеве
образуют очень мелкие колонии, часто не видимые невооруженным глазом.
На солевом агаре - в первые сутки (при 22 °С) колонии Y. enterocolitica небольшие, блестящие, прозрачные,
голубоватые, мягкие. Y. pseudotuberculosus - полупрозрачные.
На среде СТБС - иерсинии синего цвета, другие
энтеробактерии - желтоватого цвета.
|
|
Providencia
|
Хорошо растут на обычных питательных
средах. По размеру и форме сходны с колониями Proteus, но
отсутствует способность к «роению».
На среде Эндо - розовые. без металлического блеска.
На среде Плоскирева - выпуклые, желтовато-розовые
На висмут-сульфит агаре -
коричневого цвета, без металлического блеска.
|
|
Shigella
|
На плотных средах образуют небольшие
гладкие S-колонии правильной формы и крупные
шероховатые R-колонии с неровными краями, напоминающими виноградный лист.
Колонии могут быть слегка выпуклыми, бесцветные, блестящие, полупрозрачные,
мягкой консистенции, легко снимающиеся петлей с поверхности агара.
На MПБ - S-формы лают
равномерное помутнение, R-формы
образуют придонный осадок и среда остается прозрачной.
На среде Эндо и Плоскирева - S-формы колонии круглые, куполообразные, гладкие, полупрозрачные
или голубовато-розового цвета в проходящем свете. R-формы колоний неправильной формы, плоские, тусклые, с
шероховатой поверхностью и неровными краями, с розоватым или желтоватым
оттенком.
|
Необходимо учитывать, что после
культивирования бактерий при 37 °С и учета выросших колоний, чашки Петри
необходимо выдержать еще сутки при комнатной температуре (для подращивания и
выделения Erwinia, Serratia и Yersinia).
Дальнейшую работу проводят с колониями, имеющими ровный
край. С чашек, на которые проводили мерно посев (с определенного разведения), подсчитывают
выросшие колонии, определяя биологическую концентрацию микроорганизмов в 1 г
фекалий (табл 5).
При наличии на чашках Петри нескольких типов колоний для
дальнейшей работы отбирают не менее трех из них каждого типа.
С чашек со средой Плоскирева, прежде всего, отбирают
колонии, сходные по культуральным свойствам с сальмонеллами (бесцветные,
полупрозрачные, плоские); с клебсиеллами и энтеробактерами (розовые, с желтым
центром, выпуклые, бежевые или желтые); с протеями (прозрачные или
полупрозрачные, слегка выпуклые, с желтовато-розовым перламутровым оттенком); с
цитробактерами и гафниями (выпуклые, полупрозрачные, окрашенные в тон среды, а
также розовые или красные).
Р. vulgaris и Р. mirabilis проявляют способность к «роению»,
в результате высокой степени подвижности этих микроорганизмов. Для получения
изолированных колоний рекомендуют использовать среду Эндо с желчью (способ
приготовления см. в приложении 4).
Со среды Эндо отбирают, в первую очередь, лактозонегативные
(бледно-розовые или розовые) колонии, подозрительные на сальмонеллы,
лактозонегативные эшерихии, клебсиеллы, энтеробактеры, цитробактеры, и засевают
на среду Клиглера или Олькеницкого. Для выявления ЕРЕС (энтеропатогенные
эшерихии) колонии малинового цвета с металлическим блеском или без него или
малиновые с розовым ободком отсевают одновременно на среду Клиглера или
Олькеницкого и косой агар для дальнейшей серологической диагностики.
На 5 %-ном кровяном агаре по наличию зоны просветления
(гемолиза) вокруг колонии выявляют гемолитические формы энтеробактерий.
Результаты учитывают через 24 ч, окончательно - через 48 ч.
На висмут-сульфитном агаре отбирают колонии, подозрительные
на сальмонеллы (черные, с характерным металлическим блеском и почернением среды
вокруг колонии). Исключение составляют Salmonella choleraesuis,
V. Kunzendorf, S. typhisuis.
Для количественной характеристики условно-патогенных
энтеробактерий (табл. 5) подсчитывают колонии каждого типа на пластинчатых
дифференциально-селективных средах (Эндо, 5 %-ный кровяной агар, среда
Плоскирева 10-4).
Таблица 5
Пример
определения концентрации микроорганизмов
(метод БК)
|
Среда
|
Разведение
|
Число
колоний
|
Тип колоний
|
Количество
бактерий в расчёте на 1 г фекалий
|
|
Эндо
|
10-6
|
15
|
Малиновые с металлическим блеском, S - R-формы, диаметр - 3 - 4 мм, выпуклые, гладкие.
|
(15·20)·106
= 3·108
|
|
30
|
Розовые, с малиновым центром, блестящие S-формы, диаметр - 3 - 4 мм, выпуклые.
|
(30·20)·106
= 6·108
|
|
3
|
Бледно-розовые, выпуклые, блестящие, S-формы, диаметр - 3 - 4 мм.
|
(3·20)·106
= 6·107
|
На последующих этапах количество
выросших колоний умножают на соответствующее разведение (из которого проводили
высев на чашку) и на 20, если высевали 0,05 мл, или на 10, если высевали 0,1
мл.
Например, высев из разведения 10-6 привел к
развитию на чашке со средой Эндо трех колоний, однородных по характеристикам и
отнесенных к роду Citrobacter. Для определения содержания их в 1 г фекалий 3
умножают на 106 и на 20 (3·106·20 = 6·107).
Таким образом, устанавливают, что в 1 г материала содержалось 6 107
бактерий рода Citrobacter.
Для выявления некоторых морфологических особенностей,
количественного учета микроорганизмов, проверки чистоты культуры и ряда других
целей готовят фиксированные окрашенные препараты, которые могут храниться
длительное время.
Приготовление фиксированных окрашенных препаратов включает
следующие этапы: приготовление мазка, высушивание, фиксацию, окраску и
определение размера клеток бактерий.
Приготовление мазка. На обезжиренное предметное
стекло наносят маленькую каплю водопроводной воды и переносят в нее петлей
небольшое количество исследуемого материала. Получившуюся суспензию равномерно
размазывают петлей или краем покровного стекла на площади 1 - 2 см2
как можно более тонким слоем. Мазок должен быть настолько тонок, чтобы высыхал
почти тотчас же после приготовления.
Высушивание мазка. Лучше всего сушить препарат при
комнатной температуре на воздухе. Хорошо приготовленный тонкий мазок высыхает
очень быстро (не более 1 мин). Если высушивание мазка замедленно, то препарат
можно слегка нагреть в струе теплого воздуха высоко над пламенем горелки, держа
стекло мазком вверх.
Эту операцию следует проводить крайне осторожно, не
перегревая мазок, иначе клетки микроорганизмов деформируются.
Фиксация. Фиксация препарата преследует несколько
целей: убить микроорганизмы, т.е. сделать безопасным дальнейшее обращение с
ними, обеспечить лучшее прилипание клеток к стеклу и сделать мазок более
восприимчивым к окраске (мертвые клетки окрашиваются лучше, чем живые).
Самым распространенным способом фиксации является
термическая обработка. Для этого препарат трижды проводят через наиболее
горячую часть пламени горелки, держа предметное стекло мазком вверх. Не следует
перегревать мазок, так как при этом могут произойти грубые изменения клеточных
структур, а иногда и внешнего вида клеток, например их сморщивание.
Для исследования тонкого строения клетки прибегают к
фиксации различными химическими веществами. Чаще всего пользуются этиловым
спиртом (время фиксации 15 - 20 мин), метиловым спиртом (время фиксации 3 - 5
мин), смесью равных объемов этилового спирта и эфира (препарат погружают на 15
- 20 мин в смесь или заливают мазок и дают смеси испариться). По окончании
фиксации препарат отмывают от фиксатора водопроводной водой и окрашивают.
Окраска. Для окрашивания клеток микроорганизмов чаще
всего пользуются анилиновыми красителями, среди которых различают кислые и
основные.
К кислым красителям относятся те, у которых ион, придающий
окраску (хромофор), является анионом, у основных красителей хромофором является
катион. Примером кислых красителей служат эозин, эритрозин, нигрозин, кислый
фуксин - все эти красители интенсивно связываются с цитоплазматическими
(основными) компонентами клетками.
Основные красители - основной фуксин, генцианвиолет,
метиленовый синий, кристаллический фиолетовый, сафранин - более интенсивно
связываются с ядерными (кислыми) компонентами клетки.
При исследовании микроорганизмов чаще применяют основные
красители.
Различают простые и дифференциальные способы окрашивания клеток.
При простой окраске прокрашивается вся клетка так, что хорошо видны ее форма и
размеры. При дифференциальной окраске окрашивается не вся клетка, а
определенные её структуры, и поэтому такой тип окраски используется для
выявления и изучения конкретных клеточных структур. В этом случае окраску
препарата проводят не одним, а несколькими красителями.
Для простого окрашивания клеток микроорганизмов чаще всего
пользуются фуксином и генцианвиолетом. Для этого фиксированный препарат
помещают на приспособления-перекладины или так называемые препаратодержатели
(параллельно расположенные стеклянные палочки длиной 20 - 30 см, соединенные
резиновыми трубками). Палочки устанавливают над фарфоровыми или стеклянными
чашками или ваннами. Препарат обливают из пипетки раствором выбранного
красителя. Следует обращать внимание на то, чтобы конец пипетки не касался
мазка. Обычно бывает достаточно покрыть мазок несколькими каплями красителя.
Время окрашивания указанными красителями колеблется от 1 до 3 мин. Нужно
следить, чтобы во время окрашивания раствор красителя на мазке не подсыхал, в
случае необходимости доливают новые порции.
По окончании окраски препарат промывают струёй воды до тех
пор, пока стекающая вода станет бесцветной. Затем препарат высушивают на
воздухе или осторожно промокают его фильтровальной бумагой и рассматривают с
иммерсией. В правильно окрашенном и хорошо промытом препарате поле зрения
остается совершенно светлым и чистым, а окрашенными оказываются только клетки
микроорганизма.
Для получения более чистых препаратов краску можно наливать
на мазок, покрытый фильтровальной бумагой, или воспользоваться модифицированным
методом Синева, при котором применяют фильтровальную бумагу, заранее
пропитанную красителем. В этом случае, на фиксированный мазок наносят несколько
капель дистиллированной воды, накладывают полоску сухой фильтровальной бумаги,
пропитанную красителем, и прижимают ее пинцетом к поверхности стекла. По
истечении времени окрашивания фильтровальную бумагу снимают, препарат промывают
водой, сушат и рассматривают с иммерсией.
Описанный метод относится к так называемым позитивным
способам окраски, когда окрашиваются клетки микроорганизмов. Помимо этого
существует так называемое негативное контрастирование, когда краситель
заполняет пространство, окружающее клетки, и не проникает в сами клетки, в
результате чего микроорганизмы выглядят как светлые частицы на равномерно
окрашенном фоне. Для негативного окрашивания чаще всего пользуются жидкой
тушью, водными растворами конго-рота (3 %), нигрозина (10 %) и некоторыми
другими красителями.
Окрашивание негативными красителями можно вести двумя
путями: либо раствор красителя наносят на сухой фиксированный мазок, дают ему
высохнуть и затем рассматривают с иммерсией, либо каплю исследуемой суспензии
бактерий смешивают с красителем непосредственно на предметном стекле, покрывают
ее покровным стеклом и изучают с сухой системой. В последнем случае негативное
окрашивание можно комбинировать с прижизненной окраской клеток. Для этого каплю
исследуемой суспензии микроорганизмов помещают вначале в каплю разбавленного
раствора фуксина, а затем смешивают с каплей туши и закрывают покровным
стеклом.
Определение размеров клеток проводят под микроскопом
с помощью окулярной линейки (микрометра) или окулярного винтового микрометра,
используя 24-часовые культуры микроорганизмов. Размеры клеток особенно удобно
определять, пользуясь фазово-контрастным устройством. Если клетки подвижны,
препарат слегка подогревают или к капле используемой суспензии добавляют каплю
0,1 %-ного водного раствора агар-агара. Фиксировать и окрашивать клетки
нежелательно, так как это ведет к некоторому изменению их истинных размеров.
Размеры клеток выражают в микронах.
Определение размеров клеток микроорганизмов под микроскопом
включает три этапа: определение размеров клеток в делениях окулярной линейки,
определение цены деления окулярной линейки в мкм и расчет размеров клеток в
мкм.
1. Определение размеров клеток в делениях окулярной
линейки существляют с помощью окулярной линейки (окуляр-микрометра), которую
помещают на диафрагму окуляра, для чего вывинчивают глазную линзу окуляра,
устанавливают окуляр-микрометр и вновь завинчивают линзу (рис. 3).
Рис. 3. Окулярный микромер
На столик микроскопа помещают препарат «раздавленная капля»,
препарат парафинируют для предохранения от высыхания нанесением расплавленного
парафина на края покровного стекла. Фиксированные препараты для определения
размеров клеток нежелательны, так как фиксация и окраска может изменить размеры
клеток. Если клетки подвижны, препарат слегка подогревают или к капле
исследуемой суспензии добавляют 0,1 % водный раствор агар-агара.
После установки препарата на столике микроскопа, проводят
фокусировку объекта. Путем передвижения предметного столика в двух плоскостях
располагают клетки на шкале окуляр-микрометра и определяют, скольким делениям
линейки соответствует длина и ширина клетки при данном увеличении микроскопа.
Чтобы результаты были достоверными, измеряют обычно не менее 10 - 20 клеток. У
кокков измеряют диаметр, у других форм - длину и ширину.
2. Определение цены деления окулярной линейки в мкм
проводят с помощью объективной линейки (объект-микрометра) для данного
увеличения микроскопа.
Объективный микрометр представляет собой металлическую
пластинку с отверстием в центре, в которое вставлено стекло. На стекло нанесена
линейка длиной 1 мм, которая разделена на 100 частей, так что одно деление ее
соответствует 0,01 мм или 10 мкм (рис. 4).
Для определения цены деления
окулярной линейки на столик микроскопа вместо препарата помещают объективный
микрометр и при малом увеличении фокусируют изображение линейки. Затем
перемещают линейку объект-микрометра в центр поля зрения и меняют объектив на
тот, при котором измеряли размер клеток. Перемещая столик микроскопа и
поворачивая окуляр, устанавливают микрометры так, чтобы их шкалы были
параллельны и одна перекрывала другую (рис. 5).
|
|
|
|
Рис.
4. Объективный микрометр
|
Рис.
5. Определение цены деления
|
Совмещают одно из делений шкалы окулярного и объективного микрометров
и находят следующее их совмещение. Устанавливают, какую часть деления
объективного микрометра составляет одно деление окулярной линейки и умножают
полученное число на 10. Таким образом получают цену деления окулярного
микрометра в микрометрах для данного увеличения микроскопа:
а - цена деления
окуляр-микрометра, мкм; п - число делений объект-микрометра; с -
число делений окуляр-микрометра; 10 мкм - цена одного деления
объект-микрометра.
Определение цены деления окуляр-микрометра проводят в
трехкратной повторности, каждый раз сбивая совмещения и устанавливая новые.
Результаты определений записывают в таблицу (табл. 6).
Таблица 6
Результаты
определений цены деления окуляр-микрометра
|
Объектив;
окуляр
|
Цена
деления (каждого из трех определений), мкм
|
Цена
деления (среднее значение), мкм
|
|
10х;
|
7х
|
a1
|
а2
|
а3
|
аср
|
|
40х;
|
10х
|
a1
|
а2
|
а3
|
аср
|
|
90х;
|
15х
|
a1
|
а2
|
а3
|
аср
|
3. Расчет размеров клеток в мкм.
Зная, скольким делениям окулярной линейки соответствует длина и ширина
изучаемого объекта, умножают цену деления окуляр-микрометра на эти числа:
N
= с·а, где
N - длина или ширина клетки, мкм; с - число
делений окуляр-микрометра; а - цена деления окуляр-микрометра.
Размеры клеток микроорганизмов в конечном счете записывают
по форме:
(Nmin - Nmax) - (nmin -
nmax) мкм,
где
Nmin и Nmax -
минимальное и максимальное значения длины клетки, nmin и nmax - минимальное и
максимальное значение ширины клетки, мкм - единица измерения размеров клеток,
например: (2 - 3) - (0,1 - 1,0).
Результаты определения размеров клеток микроорганизмов
вносят в таблицу (табл. 7).
Таблица 7
Результаты
определения размеров клеток
|
Культура
микроорганизма
|
Число
измеряемых клеток
|
Длина
|
Ширина
|
Размер
клеток, записанный по форме (Nmin - Nmax) - (nmin - nmax), мкм
|
|
в
делениях окулярной линейки
|
в
мкм
|
в
делениях окулярной линейки
|
в
мкм
|
|
|
|
|
|
|
|
|
При извлечении части клеток для приготовления
препарата микроорганизмов, выращенных на поверхности плотной среды, необходимо
строго соблюдать условия, которые позволили бы предохранить культуру от
загрязнения другими микроорганизмами. Клетки для препаратов берут
бактериологической петлей или иглой и работают в стерильной зоне пламени.
Петля представляет собой тонкую проволоку из платины или
нихрома, прикрепленную к металлическому держателю. Конец проволоки загибают в
виде кольца (диаметром около 2 мм), которым и захватывают небольшое количество
микробной массы. Однако предварительно такую петлю необходимо простерилизовать,
т.е. уничтожить имеющиеся на ней микроорганизмы.
Стерилизацию бактериологической петли проводят в пламени
горелки, прокаливая докрасна проволоку и обжигая примыкающую к ней часть
держателя, вводимую внутрь пробирки (колбы, чашки Петри). Петлю рекомендуется
держать в пламени горелки почти вертикально, чтобы вся проволока была
равномерно раскалена. Однако прикосновение к культуре клеток слишком горячей
петлей приводит к их повреждению. Поэтому петлю следует предварительно
остудить, прикоснувшись ею к внутренней поверхности пробирки (крышке чашки
Петри) или к питательной среде, свободной от клеток микроорганизмов. При этом
горячая петля вызывает плавление среды.
Чистоту выделенных культур проверяют одновременно
несколькими способами - визуально, микроскопированием и высевом на ряд
питательных сред.
Визуальный контроль проводят, просматривая рост
выделенной культуры, на поверхности скошенной агаризованной среды. Если
культура чистая, то характер её роста однороден по всему штриху и её оставляют
для дальнейшей работы. Если рост культуры по штриху неоднороден, культуру
считают загрязненной и отбрасывают.
Микроскопический контроль обязательный этап проверки
чистоты выделенной культуры. Для этого готовят препарат фиксированных
окрашенных клеток и исследуют его с иммерсионной системой. Чистые культуры
многих бактерий, как правило, морфологически однородны. Однако клетки некоторых
микроорганизмов очень полиморфны, поэтому определение чистоты таких культур при
микроскопировании затруднительно.
Во многих случаях загрязнение культур посторонней
микрофлорой выявляется уже с помощью микроскопического контроля и такие
культуры «отбрасывают». Наиболее надежным способом проверки чистоты культуры
является высев ее на ряд питательных сред.
Рассев на плотные среды проводят для того, чтобы
получить изолированные колонии. Обязателен посев на мясо-пептонный агар -
среду, благоприятную для развития многих гетеротрофных организмов. Выросшие
колонии просматривают и сверяют их признаки с отмеченными при выделении.
Однородность колоний и совпадение их признаков с описанными ранее являются
свидетельством чистоты выделенной культуры.
Принадлежность микрорганизма к классу, порядку, семейству, а
иногда даже к роду можно установить на основании морфологических признаков и
тех сведений, которые исследователь получает в процессе выделения чистой
культуры. Одним из таких признаков является способность клеток к окрашиванию
методом Грама.
Окраска клеток микроорганизмов по методу Грама.
Сущность окраски микроорганизмов по Граму заключается в том, что при обработке
генцианвиолетом и йодом в клетках одних микроорганизмов образуется относительно
устойчивый и нерастворимый в спирте комплекс. Клетки других микроорганизмов
после обработки генцианвиолетом и йодом легко обесцвечиваются спиртом и
приобретают красный цвет при последующей покраске фуксином. Первые
микроорганизмы называются грамположительными, вторые - грамотрицательными.
Красить по Граму всегда следует клетки молодых культур (чаще
всего суточные). Целесообразно одновременно окрашивать клетки контрольных
микроорганизмов, отношение которых к окраске по Граму известно заранее. Мазок
для окраски по Граму должен быть тонким, чтобы клетки равномерно распределялись
по поверхности предметного стекла и не образовывали скоплений, так как от
толщины мазка зависят результаты окрашивания.
Окраску проводят следующим образом:
1. На обезжиренное стекло нанести каплю физраствора, в которой
суспендировать культуру.
2. Препарат высушить и зафиксировать над пламенем горелки,
проведя над огнем 2 - 3 раза.
3. Наложить на мазок кусочек фильтровальной бумаги,
пропитанный генцианвиолетом - 1 - 2 мин.
4. Удалить фильтровальную бумагу с красителем. Водой не
смывать.
5. Налить раствор Люголя на 1 - 2 мин до почернения мазка.
6. Удалить раствор Люголя. Водой не смывать.
7. Налить на препарат 96° спирт на 20 секунд. Чтобы
исключить излишнее обесцвечивание бактерий, к спирту следует добавить йод (2 мл
10 %-ного спиртового раствора йода на 100 мл этанола).
8. Промыть препарат водой.
9. Наложить на мазок кусочек фильтровальной бумаги,
пропитанный водным раствором фуксина - 1 - 2 мин.
10. Удалить фильтровальную бумагу с красителем. Промыть
мазок водой.
11. Высушить, микроскопировать с иммерсионным маслом.
При правильном окрашивании грамположительные бактерии имеют
сине-фиолетовый цвет, грамотрицательные - красный или розовый цвет.
Энтеробактерии являются грамотрицательными микроорганизмами,
кокки - грамположительными.
КОН-тест. Наиболее простой метод определения
отношения бактерий к окраске по Грамму. В основе метода с применением
гидроокиси калия (КОН) лежит способность клеточной стенки грамположительных
бактерий сохранять целостность при воздействии КОН, тогда как клеточная стенка
грамотрицательных бактерий разрушается.
Постановка пробы с КОН предусматривает суспендирование
суточной агаровой культуры бактерий в капле 3 %-ного раствора КОН на предметном
стекле.
При положительной реакции, свойственной грамотрицательным
микроорганизмам, через 2 - 5 минут жидкость в капле становится вязкой, нити
слизи тянутся за петлей на 0,5 - 2,0 см. Образование слизистой консистенции
после обработки грамотрицательных бактерий КОН обусловлено выходом из
разрушенных клеток ДНК, являющейся вязким компонентом. Учет этой пробы более
нагляден на черном фоне.
Выявление у бактерий капсулы. Для окраски капсул
бактерий применяют методы Хисса, Лейфсона, Антони, негативное контрастирование
(например метод Гинса-Бурри) и др. Для негативного окрашивания чаще всего
пользуются жидкой тушью, водными растворами конго-рота (3 %), нигрозина (10 %)
и некоторыми другими красителями.
Наиболее часто применяют методы Антони и Гинса-Бурри.
Окраска бактериальных капсул по методу Гинса-Бурри:
- на обезжиренное стекло наносят каплю водного раствора
фуксина, в которую стерильной бактериальной петлей вносят исследуемые бактерии;
- рядом с каплей фуксина помещают каплю туши. Обе капли
тщательно смешивают стерильной бактериальной петлей;
- с помощью второго предметного стекла делают мазок (так же
как делают мазок крови);
- мазок высушивают на воздухе и микроскопируют с
иммерсионной системой.
В результате окрашивания на темно-дымчатом фоне препарата
видны розовые клетки микроорганизмов, окруженные бесцветной капсулой.
Окраска бактериальных капсул по методу Антони:
- высушенный на воздухе мазок бактериальной культуры
окрашивают в течение 2 мин 1 %-ным раствором кристаллического фиолетового;
- краситель отмывают 20 %-ным водным раствором сульфата
меди, удаляют его избыток фильтровальной бумагой и подсушивают.
В результате капсулы выглядят светло-голубыми, а
микроорганизмы - темно-фиолетовыми.
Первичная идентификация энтеробактерий. Отобранные
для дальнейшего изучения колонии пересевают на одну из сред для первичной
идентификации - комбинированные среды Олькеницкого или Клиглера (среды красного
цвета), на которых выявляют одновременно несколько признаков: способность
образовывать сероводород и отношение к глюкозе и лактозе (а также
дополнительно, сахарозе и мочевине - на среде Олькеницкого).
Высевают колонии на комбинированную среду бактериологической
иглой вначале по скошенной части штрихом, а затем уколом, в толщу агарового
столбика. Посевы инкубируют при 37 ± 1 °С в течение 18 - 20 ч.
По совокупности биохимических свойств, выявленных на
комбинированной среде, делают предположительное заключение о возможной родовой
принадлежности культуры (рис. 6).
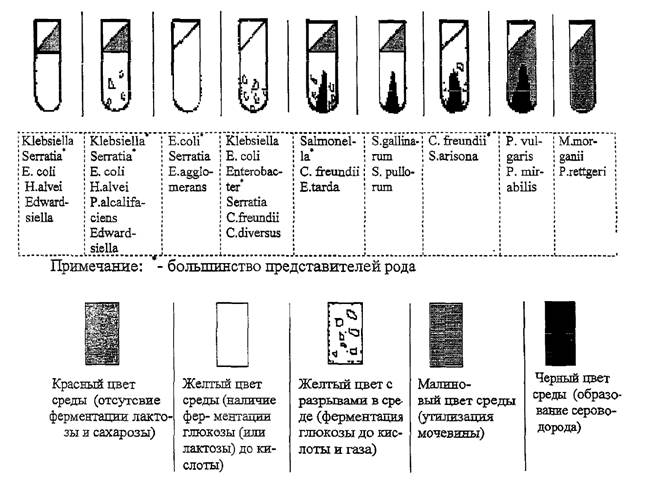
Рис. 6. Первичная идентификация энтеробактерий на среде
Олькеницкого
О ферментации лактозы (сахарозы) судят по изменению цвета
среды в скошенной части, а о ферментации глюкозы - в столбике, в котором при
газообразовании появляются пузырьки воздуха (разрывы среды или ее отслоение от
стенок пробирки). Образование сероводорода устанавливают по почернению среды.
При росте культуры, гидролизующей мочевину, происходит щелочение, вследствие
чего вся среда приобретает малиновый цвет. В случае указанного расщепления
мочевины в среде Олькеницкого учет ферментации углеводов невозможен.
В случае если при культивировании микроорганизмов среда
Олькеницкого или Клиглера не изменила цвет, данные микроорганизмы не относятся
к энтеробактериям. Для уточнения вида микроорганизма, необходимо сделать мазок,
окрасить его по Граму или провести КОН-тест и микроскопировать.
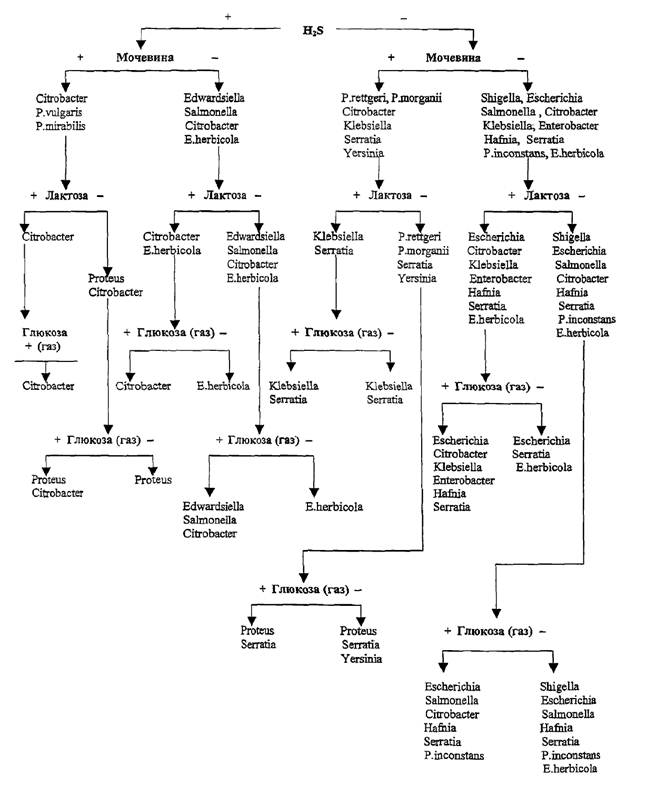
Схема 1. Ключевой биохимический тест для первичной
идентификации
энтеробактерий
Приведенная схема 1 (ключ) дифференциации энтеробактерий с
использованием комбинированных сред (Олькеницкого или Клиглера) поможет
бактериологу в выборе наиболее значимых биохимических тестов с учетом
результатов, полученных на комбинированной среде. Применение указанного ключа в
сочетании с рядом дополнительных признаков, очевидных уже на начальных этапах
изучения некоторых культур (особенности колоний, образование пигмента,
способность к роению и др.), позволяет сузить перечень предполагаемых родов и
более рационально выбрать тесты для дальнейшей дифференциации. Так, когда в
число рассматриваемых родов входит Proteus, особое место отводится тесту на
фенилаланиндезаминазу. В дифференциации Escherichia и Shigella первоочередными
тестами являются ацетатный, нитратный тест Кристенса, а также определение
подвижности. При определении представителей родов Hafnia
и Yersinia учитывают изменение ряда признаков при различных температурах
культивирования (22 - 25 °С и 37 ºС).
По сочетанию биохимических признаков на комбинированной
среде можно заподозрить одновременно несколько родов энтеробактерий. Поэтому
для установления родовой и видовой принадлежности бактерий следует использовать
минимальный дифференцирующий ряд (табл. 8); для полной видовой идентификации -
дополнительные биохимические тесты (табл. 9).
Salmonella
Сальмонеллы - короткие палочки с закругленными концами,
размером 2,0 - 5,_ мк в длину и 0,7 - 1,5 мк в ширину, грамотрицательные, имеют
жгутики, обычно подвижны (исключение - S. gallinarum и
S. pullorum), спор и капсул не образуют. Хорошо растут на обычных питательных
средах при 37 °С.
Род Salmonella объединяет более 2200 серовариантов, которые
разделены по антигенному родству на 52 серогруппы. В пределах каждого серовара
сальмонеллы подразделяются на биовары, фаговары, кроме того, они различаются по
характеру продуцируемого бактериоцина и по устойчивости к действию определенных
антибиотиков.
Сальмонеллы имеют соматический термостабильный О-антиген и
жгутиковый термолабильный Н-антиген. У выделенных из организма больных животные
штаммов сальмонелл обнаруживают Vi-антиген, который связывают с вирулентностью
возбудителя сальмонеллезов.
По ферментативной активности сальмонеллы условно
подразделяются на подроды (I, II, III,
IV, V). Подавляющее большинство выделяемых от животных сальмонелл входят в
подрод I (S. choleraesuis, S. typhimurium, S. gallinarum, S. pullorum, S.
enteritidis, S. dublin, S. abortusovis, S. abortusbovis, S. typhisuis и др).
Сальмонеллы не сбраживают лактозу и сахарозу, индола не
образуют, ферментируют глюкозу, маннит и мальтозу с образованием кислоты и
газа, образуют сероводород, желатину не разжижают, молоко не створаживают (табл
10).
Для различия сальмонелл от других микроорганизмов используют
их ферментирующую способность в отношении индола, цитрата Симонса, лизина (для
дифференциации от шигелл), малоната натрия, фенилаланина.
Для различия отдельных видов сальмонелл используют
ферментирующую способность бактерий в отношении рамнозы, глицерина, дульцита,
арабинозы и некоторые другие признаки.
Для более тщательной дифференциации отдельных представителей
группы сальмонелл пользуются расширенным пестрым рядом, в который входит более
полный набор углеводов и многоатомных спиртов (табл 9), а также проводят серологическую типизацию по О- и
Н-антигенам в реакции агглютинации с поливалентными групповыми О-сыворотками и
с монорецепторными О- и Н-сыворотками.
В процессе идентификации сальмонеллы следует
дифференцировать, главным образом, от Citrobacter freundii, Proteus mirabilis и
Hafnia alvei.
Таблица 10
Дифференцирующие
признаки подродов и отдельных сероваров рода Salmonella
|
№
|
Тест
или субстрат
|
Salmonella I
|
Salmonella II
|
Salmonella III
|
Salmonella IV
|
S. choleraesuis
|
S. gallinarum
|
S. pullorum
|
|
1.
|
Цитрат Симонса
|
+
|
+
|
+
|
+
|
(-)
|
-
|
-
|
|
2.
|
Сероводород
|
+
|
+
|
+
|
+
|
+/-
|
+
|
+
|
|
3.
|
Аргинин
|
+/-
|
+
|
(+)
|
+/-
|
+/-
|
-
|
+/-
|
|
4.
|
Орнитин
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
|
5.
|
Подвижность
|
+
|
+
|
+
|
+
|
+
|
-
|
-
|
|
6.
|
Малонат натрия
|
-
|
+
|
+
|
-
|
-
|
-
|
-
|
|
7.
|
Газ на D-глюкозе
|
+
|
+
|
+
|
+
|
+
|
-
|
(+)
|
|
8.
|
Лактоза
|
-
|
-
|
+/-
|
-
|
-
|
-
|
-
|
|
9.
|
Дульцит
|
+
|
+
|
-
|
-
|
-
|
+
|
-
|
|
10.
|
Салицин
|
-
|
-
|
-
|
+/-
|
-
|
-
|
-
|
|
11.
|
Сорбит
|
+
|
+
|
+
|
+
|
(+)
|
-
|
(-)
|
|
12.
|
Арабиноза
|
+
|
+
|
+
|
+
|
-
|
(+)
|
+
|
|
13.
|
Рамноза
|
+
|
+
|
+
|
+
|
+
|
-
|
+
|
|
14.
|
Мальтоза
|
+
|
+
|
+
|
+
|
+
|
+
|
-
|
|
15.
|
Трегалоза
|
+
|
+
|
+
|
+
|
-
|
+/-
|
(+)
|
|
16.
|
β-галактозидаза
|
-
|
+/-
|
+
|
-
|
-
|
-
|
-
|
Примечание: +/- - чаще
положительная реакция, но бывает и отрицательная.
В лабораторной практике, при идентификации сальмонелл,
необходимо учитывать возможные изменения биохимических свойств, возникающих, главным
образом, под влиянием антибиотиков и других лечебных препаратов. Так, наряду с
лактозонегативными штаммами могут встречаться варианты, которые ферментируют
лактозу с образованием кислоты, а также варианты, не сбраживающие маннит и не
образующие газа при ферментации глюкозы и маннита, сохраняя при этом другие
признаки, свойственные для бактерий группы сальмонелл.
Такие штаммы, с целью проверки однородности колоний,
подлежат рассеву на дифференциально-диагностические среды. Для восстановления
исходных биохимических свойств атипичной культуры сальмонелл достаточно
провести ряд пассажей на 10 %-ном желчном бульоне, бульоне Хоттингера и МПА.
Escherichia
Род Escherichia включает 3 вида: Е. coli, Е. blattae, Е. adecarboxylata.
Основной представитель рода Escherichia coli (кишечная
палочка) - короткие толстые палочки с закругленными концами, грамотрицательные,
длиной 1,0 - 3,0 мк и шириной 0,4 - 0,8 мк. Обладают полиморфизмом (встречаются
коккоподобные и нитевидные формы). Обладают перитрихиально расположенными
жгутиками и поверхностными структурами - фимбриями (пили) или ресничками.
Подвижность вялая, встречаются и неподвижные штаммы. Спор не образуют,
некоторые виды имеют капсулу. Хорошо развиваются в аэробных условиях при 37
ºС на простых питательных средах.
У кишечной палочки различают соматический О-антиген,
жгутиковый Н-антиген, капсульный К-антиген и пили-антигены (адгезивные
антигены). В результате наличия К-антигена, расположенного поверх О-антигена,
значительная часть штаммов кишечной палочки неспособна агглютинироваться
О-сыворотками.
По соматическому О-антигену описано около 180 серологических
групп Е. соli. У различных О-серогрупп обнаружено 104
разновидности поверхностных К-антигенов и 56 жгутиковых Н-антигенов.
У некоторых штаммов кишечной палочки пили являются факторами
колонизации, обуславливающие адгезивные свойства этих бактерий, т.е.
способность прилипать к другим клеткам. Так, пили эшерихий, ответственные за
колонизацию тонкого отдела кишечника, связывают с поверхностными антигенами
белковой природы К99, К88, 987Р, F41, Att25. Пили дифференцируют по характеру
адгезии к эпителиальным клеткам или гемагглютинации с эритроцитами разных видов
животных.
Антигены К88 и К99 ведут себя серологически подобно
К-антигенам полисахаридной природы, обуславливая феномен О-инагглютинабельности
эшерихий.
Определение адгезивной активности эшерихий имеет важное
значение для оценки их потенциальной роли в возникновении ОКЗ.
Наиболее часто от животных при диареях выделяют
микроорганизмы с антигенами адгезии К88, К99, F41, 987Р, Att25.
Эти антигены выявляют в реакции агглютинации на стекле с
соответствующими антиадгезивными сыворотками. Для накопления антигенов адгезии
изучаемую культуру следует выращивать на среде Минка (см. приложение 2).
В разных странах мира антиген К88 чаще всего обнаруживают у
энтеропатогенных эшерихий (ЕРЕС), вызывающих желудочно-кишечные болезни свиней
антиген 987Р - у новорожденных поросят, а антиген К99 является ведущим фактором
колонизации кишечника (фактором патогенности) у телят и ягнят.
Escherichia coli ферментирует с образованием кислоты и газа
лактозу, глюкозу, мальтозу, маннит, образует индол, створаживает молоко,
желатину не разжижает (табл 11). Встречаются также штаммы, не ферментирующие
или слабо ферментирующие лактозу.
Таблица
11
Основные
биохимические свойства E. coli
|
№
|
Тест
или субстрат
|
Результат
реакции
|
|
1.
|
Цитрат Симонса
|
-
|
|
2.
|
Мочевина
|
-
|
|
3.
|
Малонат натрия
|
-
|
|
4.
|
Сероводород
|
-
|
|
5.
|
Фенилаланин
|
-
|
|
6.
|
Ацетат натрия
|
+
(+)
|
|
7.
|
Подвижность
|
+/-
|
|
8.
|
Индол
|
+/-
|
|
9.
|
Лизиндекарбоксилаза
|
+/-
|
|
10.
|
Реакция Фогес-Проскауэра
|
-
|
|
11.
|
Желатин
|
-
|
|
12.
|
Орнитин
|
+/-
|
|
13.
|
Аргинин
|
+/-
|
|
14.
|
Адонит
|
-
|
|
15.
|
Арабиноза
|
+/-
|
|
16.
|
Глюкоза (газ)
|
+/-
|
|
17.
|
Дульцит
|
+/-
|
|
18.
|
Инозит
|
-
|
|
19.
|
Ксилоза
|
+/-
|
|
20.
|
Лактоза
|
+/-
|
|
21.
|
Маннит
|
+
|
|
22.
|
Мальтоза
|
+/-
|
|
23.
|
Рамноза
|
+/-
|
|
24.
|
Рафиноза
|
+/-
|
|
25.
|
Салицин
|
+/-
|
|
26.
|
Сахароза
|
+/-
|
|
27.
|
Сорбит
|
+/-
|
|
28.
|
Реакция с метиловым красным
|
+
|
Примечание: -/+ - чаще
отрицательная реакция, но бывает и положительная; жирным шрифтом выделены
тесты, выявляющие устойчивые биохимические свойства E. coli.
Для дифференциации кишечной палочки от других энтеробактерий
бывает достаточно использовать их ферментирующую способность в отношении
цитрата Симонса, малоната натрия, мочевины, фенилаланина и образование
сероводорода.
Klebsiella
Клебсиеллы - неподвижные, грамотрицательные палочки размером
в длину 2,0 - 3,0 мк и в ширину 0,5 - 1,0 мк, неровно-овальной формы. Жгутиков
и спор не образуют. Образуют капсулу, обеспечивающую устойчивость клебсиелл к
неблагоприятным факторам внешней среды. Располагаются единично, парами или
цепочками.
Бурно растут на обычных питательных средах при 37 °С.
Наличие капсул обусловливает образование крупных, выпуклых, влажных, часто
слизистых колоний слизистой консистенции. На средах, обогащенных углеводами или
азотом отмечается лучшее образование капсулы, которая может быть выявлена в
мазках окрашенных тушью.
Хорошо окрашиваются аналиновыми красителями, капсулы не
окрашиваются, остаются в виде светлых ореолов вокруг бактерий.
Род Klebsiella представлен 4 видами: K.
pneumoniae, K. oxytoca, K.
terrigen, K. planticola. Вид K.
pneumoniae подразделяется на 3 подвида: pneumoniae, ozaenае,
rhinoscleromatis.
K. pneumoniae подвид pneumoniae, как
и эшерихии, относятся к постоянной микрофлоре кишечника животных, но может
играть роль этиологического фактора при желудочно-кишечных болезнях молодняка,
септических процессах, пневмониях, метритах, маститах.
Клебсиеллы имеют соматический О-антиген и капсульный
К-антиген, а также образуют фимбрии (пили) или реснички 2 типов -
маннозочувствительные толстые (6,5 - 7 пт) и маннозорезистентные тонкие (4,5
пт), способствующие адгезина поверхности эпителиальных клеток.
Основными дифференциальными признаками являются: наличие
капсулы неподвижность, отсутствие оксидазы, способность утилизировать цитрат
Симонса и глюкозу, положительная реакция Фогес-Проскауэра, ферментация инозит
гидролиз мочевины, отсутствие орнитиндекарбоксилазы, неспособность к
образованию сероводорода. В отличие от эшерихий клебсиеллы (кроме K. oxytoca не выделяют индол.
Дифференциацию клебсиелл от эшерихий следует проводить на 48-часовой агаровой
культуре. Образуются характерные крупные, выпуклые, слизистые колонии.
Ферментативные свойства клебсиелл широко варьируют. Эти
бактерии желатину не разжижают, разлагают сахара с образованием кислоты и газа
или только кислоты. Наиболее постоянно сбраживают глюкозу. Молоко свертывают
непостоянно, иногда образуют индол (табл 12).
Таблица
12
Биохимические
свойства K. pneumoniae
|
№
|
Тест
или субстрат
|
Реакция
|
№
|
Тест
или субстрат
|
Реакция
|
|
1.
|
Сероводород
|
-
|
17.
|
Лактоза
|
+
|
|
2.
|
Мочевина
|
(+)
|
18.
|
Маннит
|
+
|
|
3.
|
Цитрат Симонса
|
+
|
19.
|
Сахароза
|
+
|
|
4.
|
Малонат натрия
|
+
|
20.
|
Инозит
|
+
|
|
5.
|
Фенилаланин
|
-
|
21.
|
Дульцит
|
-/+
|
|
6.
|
Подвижность
|
-
|
22.
|
Салицин
|
+
|
|
7.
|
Лизин
|
+
|
23.
|
Адонит
|
+
|
|
8.
|
Орнитин
|
-
|
24.
|
Рамноза
|
+
|
|
9.
|
Аргинин
|
-
|
25.
|
Ксилоза
|
+
|
|
10.
|
Метил-рот
|
-/+
|
26.
|
Сорбит
|
+
|
|
11.
|
Фогес-Проскауэр
|
+/-
|
27.
|
Арабиноза
|
+
|
|
12.
|
Индол
|
-/+
|
28.
|
Целлобиоза
|
+
|
|
13.
|
Желатин
|
+
|
29.
|
Глицерин
|
+
|
|
14.
|
Ацетатная среда
|
+
|
30.
|
Крахмал (нераств.)
|
+
|
|
15.
|
Цитрат Кристенса
|
+
|
31.
|
Сорбоза
|
-/+
|
|
16.
|
Глюкоза (газ)
|
+
|
32.
|
Д-тартрат
|
-/+
|
Примечание: (+) - замедленная положительная
реакция.
Учитывая, что культурально-морфологические свойства
клебсиелл и эшерихий сходны, необходимо проводить биохимическую дифференциацию
этих родов энтеробактерий (табл 13).
Таблица
13
Основные
тесты для дифференциации E. coli и K. pneumonia
|
№
|
Тест
или субстрат
|
Результат
реакции
|
|
E. coli
|
K. pneumonia
|
|
1.
|
Цитрат Симонса
|
-
|
+
|
|
2.
|
Малонат натрия
|
-
|
+
|
|
3.
|
Мочевина
|
-
|
(+)
|
|
4.
|
Адонит
|
-/+
|
+/-
|
|
5.
|
Инозит
|
-/+
|
+
|
|
6.
|
Метил-рот
|
+
|
-/+
|
|
7.
|
Фогес-Проскауэр
|
-
|
+/-
|
|
8.
|
Индол
|
+/-
|
-/+
|
|
9.
|
Подвижность
|
+/-
|
-
|
Proteus
Протей представляет собой прямые грамотрицательные подвижные
палочки, длиной 1 - 3 мк, шириной 0,4 - 0,8 мк. Встречаются нитевидные формы. Хорошо
растут на простых питательных средах с образованием гнилостного запаха.
От больных животных наиболее часто выделяют Р. vulgaris и Р.
mirabillis.
Антигенная структура протеев включает около 49 соматических
О-антигенов и 19 жгутиковых Н-антигенов.
Таблица
14
Биохимические
свойства Р. vulgaris и P. mirabillis
|
№
|
Тест
или субстрат
|
P. vulgaris
|
P. mirabillis
|
|
1.
|
Глюкоза
|
+
|
+
|
|
2.
|
Лактоза
|
-
|
-
|
|
3.
|
Маннит
|
-
|
-
|
|
4.
|
Сахароза
|
+
|
+/-
|
|
5:
|
Адонит
|
-
|
-
|
|
6.
|
Арабиноза
|
-
|
-
|
|
7.
|
Дульцит
|
-
|
-
|
|
8.
|
Инозит
|
-
|
-
|
|
9.
|
Ксилоза
|
+
(+)
|
+
|
|
10.
|
Мальтоза
|
+
|
-
|
|
11.
|
Рамноза
|
-
|
-
|
|
12.
|
Рафиноза
|
-
|
-
|
|
13.
|
Сорбит
|
-
|
-
|
|
14.
|
Метил-рот
|
+
|
+
|
|
15.
|
Реакция Фогес-Проскауэра
|
-
|
-/+
|
|
16.
|
Индол
|
+
|
-
|
|
17.
|
Сероводород
|
+
|
+
|
|
18.
|
Мочевина
|
+
|
+
(+)
|
|
19.
|
Желатин
|
+
|
+
|
|
20.
|
Фенилаланин
|
+
|
+
|
|
21.
|
Лизин
|
-
|
-
|
|
22.
|
Аргинин
|
-
|
-
|
|
23.
|
Орнитин
|
-
|
+
|
|
24.
|
Цитрат Симонса
|
+/-
|
+
(+)
|
|
25.
|
Цитрат Кристенса
|
-/+
|
+
|
|
26.
|
Ацетатная среда
|
+/-
|
+/-
|
|
27.
|
Малонат натрия
|
-
|
-
|
|
28.
|
Подвижность
|
+
|
+
|
Способность к дезаминированию
фенилаланина является одним из основных признаков протеев и фенотипически близких
к ним морганелл и провиденсий, позволяющих дифференцировать их от остальных
энтеробактерий (табл. 15).
Таблица 15
Дифференцирующие
признаки родов Proteus, Morganella, Providencia
|
№
|
Тест
|
Proteus
|
Morganella morganii
|
Providencia
|
|
P. vulgaris
|
P. mirabillis
|
|
P. rettgeri
|
P. alcaligene
|
|
1.
|
Индол
|
+
|
-
|
+
|
+
|
+
|
|
2.
|
Сероводород
|
+
|
+
|
-
|
-
|
-
|
|
3.
|
Мочевина
|
+
|
+
(+)
|
+
|
+
|
-
|
|
4.
|
Желатин
|
+
|
+
|
-
|
-
|
-
|
|
5.
|
Орнитин
|
-
|
+
|
+
|
-
|
-
|
|
6.
|
Мальтоза
|
+
|
-
|
-
|
-
|
-
|
|
7.
|
Фенилаланин
|
+
|
+
|
+
|
+
|
+
|
|
8.
|
Ползучий рост
|
+
|
+
|
-
|
-
|
-
|
|
9.
|
Цитрат Симонса
|
+/-
|
+
(+)
|
-
|
+
|
+
|
|
10.
|
Манноза
|
-
|
-
|
+
|
+
|
+
|
|
11.
|
Мальтоза
|
+
|
-
|
-
|
-
|
-
|
|
12.
|
Инозит
|
-
|
-
|
-
|
+
|
-
|
|
13.
|
Адонит
|
-
|
-
|
-
|
+
|
+
|
При росте на плотных (особенно на
влажных) питательных средах большинство штаммов обладает свойством «роения»
(ползучего роста), проявляющимся образованием радиально расходящегося от места посева
тонкого сплошного налета. Для подавления феномена «роения», вызывающего
затруднения при выделении чистых культур других видов микроорганизмов,
используют среды, содержащие соли желчных кислот, желчь, 0,1 %-ный раствор
хлоралгидрата, 4 - 7 °С с агара, а также хорошо просушенные среды.
Citrobacter
Цитробактер - прямые подвижные, грамотрицательные палочки,
длиной 2_ мк и шириной 0,8 - 1,0 мк. Располагаются по одиночке или парами.
Хорошо растут на обычных питательных средах при 37 °С.
У цитробактеров обнаруживают соматический О-антиген и
жгутиковый Н-антиген. Имеют общие антигены с сальмонеллами и эшерихиями.
Основными дифференцирующими признаками являются: способность
утилизировать цитрат, отсутствие лизиндекарбоксилазы и отрицательная реакция
Фогес-Проскауэра (табл 16).
Таблица
16
Биохимические
свойства бактерий рода Citrobacter
|
№
|
Тест
или субстрат
|
Реакция
|
№
|
Тест
|
Реакция
|
|
1.
|
Адонит
|
+/-
|
17.
|
Индол
|
+/-
|
|
2.
|
Арабиноза
|
+
|
18.
|
Сероводород
|
+/-
|
|
3.
|
Глюкоза (газ)
|
+
|
19.
|
Мочевина
|
-
(+)
|
|
4.
|
Дульцит
|
+/-
|
20.
|
Желатин (22 °С)
|
-
|
|
5.
|
Инозит
|
-
(+)
|
21.
|
Фенилаланин
|
-
|
|
6.
|
Ксилоза
|
+
|
22.
|
Лизин
|
-
|
|
7.
|
Лактоза
|
+
(-)
|
23.
|
Аргинин
|
+/-
|
|
8.
|
Мальтоза
|
+
|
24.
|
Глутаминовая к-та
|
+/-
|
|
9.
|
Маннит
|
+
|
25.
|
Орнитин
|
-
|
|
10.
|
Рамноза
|
+
|
26.
|
Цитрат Симонса
|
+
|
|
11.
|
Салицин
|
+/-
|
27.
|
Восстан. нитратов
|
+
|
|
12.
|
Сахароза
|
+/-
|
28.
|
Малонат натрия
|
+/-
|
|
13.
|
Сорбит
|
+
|
29.
|
Мукат
|
+
|
|
14.
|
Трегалоза
|
+
|
30.
|
Д-тартрат
|
+
|
|
15.
|
Метил-рот
|
+
|
31.
|
β-галактозидаза
|
+
|
|
16.
|
Фогес-Проскауэр
|
-
|
32.
|
Подвижность
|
+
|
Род Citrobacter включает 3 вида: C. freundii, C. diversus, C. amalonaticus,
различающиеся по ферментативным свойствам (табл 17).
Таблица
17
Дифференцирующие
признаки видов рода Citrobacter
|
№
|
Тест
или субстрат
|
C. freundii
|
C. diversus
|
C. amalonaticus
|
|
1.
|
Индол
|
-
|
+
|
+
|
|
2.
|
Сероводород
|
+
|
-
|
-
|
|
3.
|
Салицин
|
-
|
+
|
+
|
|
4.
|
Аргинин
|
+/-
|
+
|
+
|
|
5.
|
Орнитин
|
+/-
|
+
|
+
|
|
6.
|
Малонат натрия
|
-
|
+
|
-
|
|
7.
|
Адонит
|
-
|
+
|
-
|
Для полной идентификации
цитробактеров необходимо определение их серовариантной принадлежности по О- и Н-антигенам.
Serratia
Серратии представляют собой прямые, подвижные,
грамотрицательные палочки с закругленными концами, длиной 0,9 - 2,0 мк и
шириной 0,5 - 0,8 мк. Некоторые штаммы образуют капсулу.
Антигенная структура бактерий включает 21 соматический и 25
жгутиковых антигенов.
Серратии - каталазоположительные бактерии.
Таблица
18
Биохимические
свойства Serratia
|
№
|
Тест
или субстрат
|
Реакция
|
№
|
Тест
или субстрат
|
Реакция
|
|
1.
|
Лактоза
|
(-/+)
|
17.
|
Фогес-Проскауэр
|
+/-
|
|
2.
|
Сахароза
|
+
|
18.
|
Индол
|
-
|
|
3.
|
Глюкоза
|
+/-
|
19.
|
Сероводород
|
-
|
|
4.
|
Адонит
|
+/-
|
20.
|
Мочевина
|
+/-
|
|
5.
|
Арабиноза
|
-
|
21.
|
Желатин (22 °С)
|
+
(+)
|
|
6.
|
Дульцит
|
-
|
22.
|
Фенилаланин
|
-
|
|
7.
|
Инозит
|
+/-
|
23.
|
Лизин
|
+
|
|
8.
|
Ксилоза
|
+/-
|
24.
|
Аргинин
|
-
|
|
9.
|
Мальтоза
|
+
|
25.
|
Орнитин
|
+
|
|
10.
|
Маннит
|
+
|
26.
|
Цитрат Симонса
|
+
|
|
11.
|
Рамноза
|
-
|
27.
|
Цитрат Кристенса
|
+
|
|
12.
|
Рафиноза
|
-
|
28.
|
Ацетатная среда
|
+
|
|
13.
|
Салицин
|
+
|
29.
|
Малонат натрия
|
-
|
|
14.
|
Сорбит
|
+
|
30.
|
D-тартрат
|
+
|
|
15.
|
β-галактозидаза
|
-/+
|
31.
|
Подвижность
|
+
|
|
16.
|
Метил-рот
|
-/+
|
32.
|
Пигментообразование
|
+/-
|
Примечание: (-/+) - замедленная
реакция; + (+) - положительная или замедленная положительная реакция.
Род включает 6 видов различающихся по биохимическим
свойствам: S. marcescens, S. liguefaciens, S. plymuthica, S. rubidae, S.
odorifera, S. ficaria. Патогенными для животных являются S. marcescens и S.
liguefaciens.
Таблица
19
Внутриродовая
дифференциация Serratia
|
№
|
Тест
|
S. marcescens
|
S. liguefaciens
|
S. plymuthica
|
S. rubidae
|
S. odorifera
|
S. ficaria
|
|
1.
|
Индол
|
-
|
-
|
-
|
-
|
+
|
-
|
|
2.
|
Глюкоза (газ)
|
-
|
+
|
+/-
|
-
|
-
|
-
|
|
3.
|
Лактоза
|
-
|
+
|
+/-
|
+
|
+
|
+/-
|
|
4.
|
Лизин
|
+
|
+
|
-
|
-
|
+
|
-
|
|
5.
|
Орнитин
|
+
|
+
|
-
|
-
|
-
|
-
|
|
6.
|
Рост при 4 °С
|
-
|
+
|
+
|
-
|
+
|
+
|
|
7.
|
Пигментообразование
|
+/-
|
+/-
|
-
|
+/-
|
-
|
-
|
Серратии могут продуцировать два
вида пигментов: продигиозин и пирумин.
Продигиозин - не диффундирующий в питательную среду
водорастворимый пигмент, придающий колониям красную окраску. Более интенсивное
образование продигиозина отмечается на пептон-глицериновом агаре при 20 - 35
°С.
Пирумин - диффундирующий в питательную среду водорастворимый
пигмент, придающий колониям розовую окраску.
Enterobacter
Энтеробактеры - прямые, подвижные, грамотрицательные
палочки, длиной 1,2 - 3,0 мк и шириной 0,6 - 1,0 мк.
Хорошо растут на питательных средах для энтеробактерий.
Из кишечного содержимого, респираторных органов и гениталий
животных выделяют Е. cloacae и Е. aerogenes.
Внутривидовая дифференциация, а также дифференциация на
биогруппы основывается на различиях в ферментации углеводов и наличии
аминокислотных декарбоксилаз. В отдельных случаях проводят серотипизацию по О-
и Н-антигенам.
Дифференцирующим признаком энтеробактеров от рода Klebsiella
является их подвижность, от медленно гидролизующих желатин штаммов Е. aerogenes
- штаммы K. pneumoniae подвида pneumoniae всегда
уреазоположительны.
От рода Serratia энтеробактеры отличаются тем, что не
способны продуцировать диоксирибонуклеазу, эстеразу, липазу и расщеплять
твин-80.
Таблица
20
Дифференцирующие
признаки Enterobacter
|
№
|
Тест
или субстрат
|
Е.
cloacae
|
Е.
аеrоgenes
|
K. рnеumоniae
|
Hafnia
|
Serratia
|
|
1.
|
Гидролиз желатина
|
(+)
|
-
|
-
|
-
|
(+)
|
|
2.
|
Лизин
|
-
|
+
|
+
|
+
|
+/-
|
|
3.
|
Аргинин
|
+
|
-
|
-
|
-
|
-
|
|
4.
|
Мукат
|
+/-
|
+
|
(+)
|
-
|
-
|
|
5.
|
Подвижность
|
+
|
+
|
-
|
+
|
+
|
|
6.
|
Орнитин
|
+
|
+
|
-
|
+
|
+
|
|
7.
|
Диоксирибонуклеаза
|
-
|
-
|
-
|
-
|
+
|
|
8.
|
Цитрат Симонса
|
+
|
+
|
+
|
-
|
+
|
|
9.
|
Сорбит
|
+
|
+
|
+
|
-
|
+
|
По культурально-морфологическим свойствам
Enterobacter во многом сходны с Е. соli, поэтому
учитывают ферментативные отличия этих микроорганизмов в сравнительном аспекте
(табл 21).
Таблица
21
Ферментативные
отличия видов Enterobacter от E. coli
|
№
|
Тест
или субстрат
|
E. cloacae
|
E. aerogenes
|
Е. соli
|
|
1.
|
Цитрат Симонса
|
+
|
+
|
-
|
|
2.
|
Малонат натрия
|
+/-
|
+
|
-
|
|
3.
|
Мочевина
|
(+)
|
-
|
-
|
|
4.
|
Индол
|
-
|
-
|
+/-
|
|
5.
|
Инозит
|
-
|
+
|
-/+
|
|
6.
|
Адонит
|
+/-
|
+
|
-/+
|
|
7.
|
Желатин
|
(+)
|
-
|
-
|
|
8.
|
Метил-рот
|
-
|
-
|
-
|
|
9.
|
Фогес-Проскауэр
|
+
|
+
|
+
|
|
10.
|
Ацетатная среда
|
+
|
+
|
-
|
Энтеробактеры, в отличие от эшерихий, ферментируют цитрат
Симонса и малонат натрия.
Hafnia
Гафнии представляют собой прямые, грамотрицательные палочки,
длиной 2 - 5 мк и шириной 1 мк. Подвижность наиболее выражена при 30 °С, при 37
°С этот признак непостоянен. Встречаются неподвижные штаммы.
Хорошо растут как на простых питательных средах, так и на
селективных для энтеробактерий.
Оксидазоотрицательны. По культуральным свойствам напоминают
лактозоотрицательные бактерии.
Таблица
22
Биохимические
свойства рода Hafnia
|
№
|
Тест
или субстрат
|
Реакция
|
№
|
Тест
или субстрат
|
Реакция
|
|
1.
|
Лактоза
|
-
(+)
|
17.
|
Метил-рот (35 °С)
|
+
|
|
2.
|
Глюкоза (газ)
|
+/-
|
18.
|
Фогес-Проскауэр
|
+
|
|
3.
|
Маннит
|
+
|
19.
|
Индол
|
-
|
|
4.
|
Сахароза
|
+/-
|
20.
|
Сероводород
|
-
|
|
5.
|
Адонит
|
-
|
21.
|
Мочевина
|
-
|
|
6.
|
Арабиноза
|
+
|
22.
|
Желатин (22 °С)
|
-
|
|
7.
|
Глицерин
|
-
|
23.
|
Фенилаланин
|
-
|
|
8.
|
Дульцит
|
-
|
24.
|
Лизин
|
+
|
|
9.
|
Инозит
|
-
|
25.
|
Аргинин
|
-
|
|
10.
|
Ксилоза
|
+
|
26.
|
Орнитин
|
+
|
|
11.
|
Мальтоза
|
+
|
27.
|
Цитрат Симонса
|
+/-
|
|
12.
|
Рамноза
|
+
|
28.
|
Ацетатная среда
|
-/+
|
|
13.
|
Рафиноза
|
-
|
29.
|
Малонат натрия
|
+/-
|
|
14.
|
Салицин
|
+/-
|
30.
|
Подвижность
|
+/-
|
|
15.
|
Сорбит
|
-
|
31.
|
β-галактозидаза
|
+
|
|
16.
|
Трегалоза
|
+
|
32.
|
Оксидаза
|
-
|
Род Hafnia представлен одним видом -
Hafnia alvei, которую выделяют от молодняка животных при кишечных инфекциях и
пневмониях.
Для дифференциации гафний от других энтеробактерий в
качестве дополнительного теста ставят реакцию с 1 %-ным раствором перекиси
водорода на наличие каталазы. Для этого, суточную агаровую культуру H. alvei растирают в капле 1 %-ного раствора перекиси
водорода на предметном стекле. При этом, гафнии дают бурное газообразование,
более интенсивное, чем другие энтеробактерии.
Morganella
Морганеллы - это грамотрицатедьные, прямые, подвижные
палочки, длиной 1 - 1,7 мк и шириной 0,6 - 0,7 мк.
Хорошо растут на обычных питательных средах.
Род представлен одним видом - Morganella morganii. Может
вызывать диареи у молодняка животных.
Известно около 50 серовариантов, отличающихся структурой
соматического антигена, и большое число серовариантов, имеющих разные типы
жгутиковых Н-антигенов.
К основным дифференцирующим признакам относятся: способность
к дезаминированию фенилаланина, выделению индола и гидролизу мочевины, а также
способность дезаминировать орнитин и ферментировать с образованием кислоты
маннозу (табл 9, 15).
Спектр ферментативной активности по отношению к углеводам
незначителен. Морганеллы ферментируют глюкозу и маннозу, встречаются штаммы,
ферментирующие трегалозу и лактозу.
На среде, содержащей 5 % триптофана, штаммы морганелл
продуцируют красно-коричневый пигмент.
Yersinia
Иерсинии представляют собой палочковидные или овоидные,
грамотрицательные клетки, длиной 1 - 3 мк и шириной 0,5 - 0,8 мк. Располагаются
поодиночке, парами, иногда короткими цепочками из 4 - 5 клеток.
Хорошо растут на простых питательных средах. В
мазках-отпечатках и из бульонных культур могут окрашиваться биполярно.
В культурах, выращенных при 30 °С иерсинии (за исключением
Y. pestis) подвижны, при 37 °С это свойство утрачивается.
Род включает 7 видов: Y. pestis, Y. pseudotuberculosis, Y. enterocolitica, Y.
intermedia, Y. frederiksenii, Y. kristensenii, Y. ruckeri.
Острое расстройство пищеварения у молодняка животных может
вызвать Y. enterocolitica.
Y. enterocolitica в жидких питательных средах цепочек не
образует, при 18 - 20 °С подвижна.
Антигенная схема Y. enterocolitica включает 34 сероварианта
по О-антигену и 20 - по Н-антигену. Серовариант O9
имеет общие антигены с бруцеллами, а O12 - с
сальмонеллами.
По ферментативной активности у Y. enterocolitica различают 5
биоваров (табл. 23).
Таблица
23
Дифференцирующие
признаки биоваров Y. enterocolitica
|
№
|
Тест
|
Биовар
|
|
1
|
2
|
3
|
4
|
5
|
|
1.
|
Липаза (твин-80)
|
+
|
-
|
-
|
-
|
-
|
|
2.
|
Диоксирибонуклеаза
|
-
|
-
|
-
|
+
|
+
|
|
3.
|
Индол
|
+
|
+
|
-
|
-
|
-
|
|
4.
|
Редукция нитратов
|
+
|
+
|
+
|
+
|
-
|
|
5.
|
Ксилоза
|
+
|
+
|
+
|
-
|
-
|
|
6.
|
Сахароза
|
+
|
+
|
+
|
+
|
+/-
|
|
7.
|
Трегалоза
|
+
|
+
|
+
|
+
|
-
|
Иерсинии оксидазоотрицательны и
каталазоположительны. Патогенны для многих видов животных и человека. При
последовательных пассажах через питательные среды иерсинии (кроме Y. pestis)
утрачивают свою вирулентность.
Edwardsiella
Эдвардсиеллы представляют собой прямые, подвижные,
грамотрицательные палочки, длиной 2 - 3 мк и шириной 1 мк.
Оксидазоотрицательны и каталазоположительны.
Растут на обычных питательных средах, но более медленно, чем
другие виды энтеробактерий.
Род включает 3 вида: Е. tarda, Е. ictaluri, Е. hoshinae.
Диареи у молодняка разных видов животных вызывает Е. tarda.
Таблица
25
Дифференцирующие
признаки видов рода Edwardsiella
|
№
|
Признак
|
Е.
tarda
|
Е.
hoshinае
|
Е.
ictaluri
|
|
Дикий
тип
|
Биогруппа
I
|
|
1.
|
Маннит
|
-
|
+
|
+
|
-
|
|
2.
|
Сахароза
|
-
|
+
|
+
|
-
|
|
3.
|
Трегалоза
|
-
|
-
|
+
|
-
|
|
4.
|
Арабиноза
|
-
|
+
|
(-)
|
-
|
|
5.
|
Малонат натрия
|
-
|
-
|
+
|
-
|
|
6.
|
Индол
|
+
|
+
|
(-)
|
-
|
|
7.
|
Сероводород
|
+
|
-
|
-
|
-
|
|
8.
|
Подвижность
|
+
|
+
|
+
|
-
|
|
9.
|
Цитрат Симонса
|
-
|
-
|
-
|
-
|
Примечание: (-) - замедленная отрицательная
реакция.
Эдвардсиеллы редуцируют нитраты, имеют орнитин- и
лизиндекарбоксилазу, ферментируют маннозу, мальтозу. Дают отрицательную реакцию
Фогес-Проскауэра, не утилизируют цитрат в среде Симонса, не гидролизуют
мочевину. Не имеют фенилаланиндезаминазы и аргининдегидролазы, не гидролизуют
желатин, не ферментируют лактозу, дульцит, ксилозу, не имеют
β-галактозидазы.
Providencia
Провиденсии представляют собой грамотрицательные, подвижные,
прямые палочки, длиной 1,5 - 2,5 мк и шириной 0,6 - 0,8 мк.
Хорошо растет на обычных питательных средах, по многим
признакам сходен с Proteus.
Род включает 3 вида: Р. alcaligenes, Р. stuartii, Р.
rettgeri.
Согласно ранее существующей классификации Р. alcaligenes и
P. stuartii составляли один вид - Proteus inconstans, a P. rettgeri - Proteus
rettgeri.
Таблица
27
Дифференцирующие
признаки видов рода Providencia
|
№
|
Тест
|
P. alcaligenes
|
P. stuartii
|
P. rettgeri
|
|
1.
|
Мочевина
|
-
|
+/-
|
+
|
|
2.
|
Инозит
|
-
|
+
|
+
|
|
3.
|
Маннит
|
-
|
+/-
|
+
|
|
4.
|
Арабитол
|
-
|
-
|
+
|
|
5.
|
Эритрол
|
-
|
-
|
+/-
|
|
6.
|
Трегалоза
|
-
|
+
|
-
|
|
7.
|
Адонит
|
+
|
-
|
+
|
Характерными дифференцирующими
признаками для рода являются: неспособность к «роению», ферментирование
инозита, маннита, маннозы и утилизирование цитрата Симонса. Наличие
фенилаланин-дезаминазы является одним из наиболее важных диагностических
признаков.
Erwinia
Эрвинии представляют собой прямые, подвижные,
грамотрицательные палочки, длиной 1 - 3 мк, шириной 0,5 - 1,0 мк. Располагаются
поодиночке, парами, иногда короткими цепочками.
Род включает 15 видов. От животных выделяют Е. herbicola,
которая может вызвать расстройство пищеварения.
Эрвинии оксидазоотрицательны и каталазоположительны.
Большинство штаммов эрвиний продуцируют желтый пигмент.
Ферментируют с образованием кислоты глюкозу, маннит,
мальтозу, арабинозу, ксилозу, рамнозу, фруктозу, галактозу, сахарозу. Не
гидролизуют мочевину и не образуют индол и сероводород. Гидролизуют желатин. В
отличие от некоторых родов энтеробактерий не имеют аргининдегидролазы, лизин- и
орнитиндекарбоксилазы.
Эрвинии не растут или дают замедленный, скудный рост при 37
°С. Оптимальная температура культивирования 25 - 27 °С. Колонии эрвиний могут
быть самые разнообразные, более всего сходны с колониями E. coli.
На этапе дифференциации родов могут быть использованы
специфические поли- и моновалентные бактериофаги (сальмонеллезный,
колипротейный, клебсиеллезный, синегнойный и др.).
Высокая специфичность некоторых штаммов бактериофагов
позволяет использовать их для диагностики инфекционных заболеваний и индикации
патогенных микроорганизмов. Фагоиндикацей можно дифференцировать не только
отдельные виды бактерии, но и серологически неотличимые штаммы одного и того же
вида; установить природу возбудителя инфекции даже в том случае, когда другие
метод оказываются неэффективными.
Бактериофаги можно применять для обнаружения в исследуемом
материале возбудителя без выделения чистых культур. Этот метод, предложенный
В.Т. Тимаковым и Д.М. Гольдфарбом в 1956 г, названный реакцией нарастания
титра фага, основан на увеличении количества фаговых частиц при добавлении
их в исследуемый патологический материал.
Фаги широко распространены в природе. Они известны почти у
всех патогенных и многих непатогенных микроорганизмов: у бактерий кишечной
группы, микобактерий, стрептококков, стафилококков, сарцин, споровых и
актиномицетов. У дрожжей, плесневых грибков и водорослей фаги не выявлены.
Почти везде, где есть благоприятные условия для развития микроорганизмов,
удается обнаружить бактериофаги. Их выделяют из воды, почвы, сточных вод,
растений, открытых полостей животных и человека, из молока, испражнений,
бактериальных культур и так далее. Фаги, лизирующие патогенные бактерии,
находят в выделениях больных людей и животных, особенно в период выздоровления.
Существует несколько методов определения чувствительности
микроорганизмов к бактериофагам и идентификации бактерий. Наиболее известные
методы - метод стекающей капли и метод Аппельмана.
Метод стекающей капли. Для проведения пробы с фагом
используют 4- или 18-часовую бульонную культуру бактерий; отдельные колонии,
непосредственно взятые с чашек с дифференциально-диагностическими средами;
культуру, взятую с комбинированной среды типа Олькеницкого или Клиглера.
На хорошо подсушенный в чашке Петри мясо-пептонный агар (рН
= 7,2 - 7,4), разделенный на сектора (6 - 8), бактериологической петлей
штрихами засевают изучаемые культуры. Затем пастеровской пипеткой или иглой
диаметром 4 - 5 мм в середине сектора с посевом наносят каплю специфического
бактериофага. Чашки с посевами выдерживают на столе, переворачивая 15 - 20 мин,
а затем инкубируют при 37 °С в течение 18 - 20 ч.
Рис. 7. Лизирующее действие фага на плотной среде
При положительной реакции на месте нанесения фага появляется
четко очерченный лизис (+ + + +), полусливной лизис (+ + +), большее или
меньшее число отдельных негативных колоний ( + +, +).
При отсутствии лизиса (отрицательная реакция) в месте
нанесения фага наблюдают рост культуры (рис. 7).
Метод Аппельмана - метод определения литической
активности бактериофага на жидких питательных средах. Состоит в испытании
различных разведений фага с одним и тем же количеством бактериальной культуры.
В ряд стерильных из нейтрального стекла пробирок с
одинаковым диаметром наливают по 4,5 мл питательной среды. В 1-ю пробирку
прибавляют 0,5 мл испытуемого фага, тщательно перемешивают и последовательно
разводят, затем переносят из пробирки в пробирку по 0,5 мл (каждый раз
отдельной пипеткой).
Обычно готовят 10 разведений фага. Из 10-й пробирки лишние
0,5 мл выливают; получают разведения фага от 10-1 до 10-10.
Затем в пробирки прибавляют по 0,1 мл 18-часовой бульонной культуры. 11-я и
12-я пробирки - контрольные: 11-я - бульон и культура без фага (контроль за
ростом культуры), 12-я - только бульон (контроль стерильности).
Все пробирки инкубируют в термостате при температуре 37 °С в
течение 18 - 24 час.
Литическую активность фага, выраженную в титре, определяют
по последней пробирке, в которой отсутствует мутность или осадок (рост и
размножение бактерий).
Титр бактериофага - это максимальное
разведение фага, при котором рост микробов отсутствует. Например, если в 9
пробирках наступил полный лизис, титр фага будет равен 10-9.
Для серологической идентификации сальмонелл, клебсиелл,
протеев, цитробактеров используют коммерческие диагностические агглютинирующие
адсорбированные поливалентные и моновалентные О- и Н-сыворотки в реакции
агглютинации на стекле в соответствии с антигенно-диагностической схемой,
приведенной в наставлениях по применению препаратов и Методических указаниях по
бактериологической диагностике (Лабораторные
исследования в ветеринарии. Бактериальные инфекции. - М., 1986)
Патогенные эшерихии не отличаются от непатогенных по морфологическим
и культуральным свойствам, поэтому их диагностика основана на серологическом
методе.
Серогрупповую и видовую принадлежность определяют у культур,
отнесенных по культурально-биохимическим свойствам к роду эшерихии с помощью
агглютинирующих О-колисывороток в реакции агглютинации на стекле и в пробирках.
Порядок применения О-колисывороток дан в наставлении по применению препарата.
При отрицательных результатах реакции агглютинации на стекле с ветеринарным
набором сывороток может быть применен медицинский набор агглютинирующих
поливалентных и моновалентных ОК-сывороток или ОК-иммуноглобулинов и
адсорбированных О-сывороток (см. соответствующие наставления по применению).
Серотипирование эшерихий для выявления энтеропатогенных
эшерихий (ЭПЭ) имеет важное значение для эпизоотологического анализа
заболеваемости. Вместе с тем необходимо иметь в виду, что многочисленные
наблюдения свидетельствуют об отсутствии прямой корреляции между сероварами и
патогенностью отдельных эшерихий внутри О-серогрупп. Поэтому выявление одного
из существенных признаков патогенности адгезивной активности - является
необходимым звеном в диагностике ЭПЭ (см. раздел 3).
Бифидобактерии в жидкой среде Блаурокка образуют слизистый
мутный осадок. Колонии лактобактерий в толще полужидкой среды МРС-2 напоминают
маленькие гвоздики беловато-желтоватого цвета.
Для идентификации бифидо- и лактобактерий из посевов на
средах Блаурокка и МРС-2 готовят мазки и окрашивают их по Граму.
Обнаружение характерных тонких, с несколько утолщенными
концами грамположительных палочек, расположенных в виде римской цифры V (или
летящей птички) им в виде скоплений, напоминающих паучки, подтверждает их принадлежность
к бифидобактериям.
Лактобациллы представляют собой крупные грамположительные
палочки различной длины - от 0,7 - 1,1 до 3,0 - 8,0 мк, расположенные единично,
парами или цепочками, прямые с закругленными концами, иногда слегка извитые.
В результате исследования необходимо указать наличие или
отсутствие в посеве фекалий патогенных энтеробактерий, а также описать состав
кишечной микрофлоры. Количество живых микробных клеток в 1 г фекалий
подсчитывают для каждого вида микроорганизмов по формуле:
М = 20·N·10n
где: М - число живых микробных клеток в 1 г фекалий;
N - количество колониеобразующих единиц;
20 - коэффициент пересчета при высеве 0,05 мл бактериальной
взвеси;
10n -разведение, из которого выделен данный вид бактерий.
Например, у теленка в 1 г фекалий обнаружено:
E. coli 3,8·108
K. рnеumоniае 6,0 107
Р. mirabilis 1,7·108
С. freundi 2,1·107
S. epidermidis 5,4·105
Lactobacillus 2,0·105
В. bifidum 1,2·106.
Заключение. Патогенные бактерии семейства
Enterobacteriaceae не обнаружены. Выявлен дизбактериоз кишечника, обусловленный
ассоциацией условно-патогенных бактерий (K. pneumoniae, P. mirabilis, С.
freundi) и дефицитом лактобактерий.
При проведении эпизоотологического анализа используют данные
об отношении выделенных культур к сероварам, чувствительности к
антибактериальным препаратам и специфическим фагам.
Оценка результатов исследований зависит от:
- выяснения этиологической структуры ОКЗ;
- направленного применения специфических биопрепаратов,
уточнения их состава;
- разработки тактики эпизоотологических и
лечебно-профилактических мероприятий;
- объективной оценки эффективности проводимых мероприятий.
Значение выделенных бактерий в этиологии ОКЗ целесообразно
оценивать по следующим критериям:
1. Патогенные виды бактерий признают безусловно
этиологическим фактором.
2. Роль условно-патогенных видов микроорганизмов в качестве
потенциального возбудителя ОКЗ определяют количественной характеристикой (в
случае выделения не менее чем 106 колониеобразующих единиц бактерий
в 1 г исследуемого материала) и повторным выделением в динамике заболевания.
Особое внимание следует обратить на выделение ассоциации нескольких видов
условно-патогенных микроорганизмов и сочетание с клиническими проявлениями
болезни.
3. Для более полной оценки этиологической роли выделенной
культуры микроорганизма желательно изучать комплекс его вирулентных свойств, в
том числе адгезивную и гемолитическую активность, а также выявлять
специфические сывороточные антитела к аутоштамму - представителю
условно-патогенных энтеробактерий и сальмонелл в парных сыворотках.
4. Для оценки степени защищенности организма нормальной
микрофлорой кишечника рекомендуется за минимальный уровень наличия лакто- и
бифидобактерий принимать количество их не менее 108 бактерий в 1 г
исследуемого материала.
3.
Определение чувствительности к антибактериальным препаратам
Примерно 50 лет назад началась эра применения антибиотиков в
медицине и ветеринарии. Поиск новых антибиотиков продолжается с прежней
интенсивностью, однако частота их обнаружения резко снизилась. Кроме того, с
угрожающей скоростью стали появляться штаммы патогенных бактерий, устойчивых к
антибиотикам. В то время, когда пенициллин G только напал применяться в
медицине, большинство штаммов стафилококков были к нему чувствительны, а в
настоящее время практически все известные стафилококковые инфекции устойчивы к
этому антибиотику.
Ещё более важная проблема - появление штаммов бактерий,
устойчивых одновременно к нескольким антибиотикам, так называемых штаммов со
множественной устойчивостью. Например, частота встречаемости штаммов
Shigella с таким свойством с 1954 г увеличилась с 0,2 до 52 %.
Устойчивость бактерий к антибиотикам обусловлена многими
факторами. Иногда она обусловлена мутацией в хромосомном гене микроорганизма,
которая изменяет структуру мишени в клетке. Например, стрептомицин нарушает
синтез белка в микроорганизме, прикрепляясь к одному из белков 30S-субъединицы
рибосомы. Некоторые мутации в гене, кодирующем этот рибосомный белок, нарушают
его способность связывать стрептомицин, но не влияют существенным образом на
работу рибосомы. Поэтому клетка с подобной мутацией становится устойчивой к
стрепомицину.
Устойчивость может быть обусловлена и проникновением в
бактериальную клетку плазмиды, принадлежащей к классу факторов резистентности
(R-факторы). Эти плазмиды часто обеспечивают устойчивость одновременно к
нескольким антибиотикам. Они несут гены, кодирующие ферменты, которые
катализируют химические модификации антибиотиков, лишая их, таким образом,
антибиотической активности.
Множественная устойчивость штаммов бактерий почти всегда
обусловлена R-факторами. Поскольку эти плазмиды имеют широкий спектр хозяев и
достаточно часто передаются от одного вида бактерий к другому, их
распространение в естественных бактериальных популяциях, безусловно, самый
серьезный аспект проблемы устойчивости микроорганизмов к антибиотикам.
Кроме этого, большие дозы ряда антибиотических препаратов
оказывают побочное действие на макроорганизм. Установлено, что большие дозы
пенициллина и стрептомицина оказывают нейротоксическое действие, тетрациклины
вызывают поражение печени, хлормицетин обуславливает токсическое действие на
кроветворные органы, хлортетрациклин и окситетрациклин при внутривенном
введении могут привести к коллапсу со смертельным исходом. При введении
пенициллина и стрептомицина могут появиться крапивница, контактные дерматиты,
ангионевротический отёк, аллергическая язва и т.д. Доказано также, что
большинство антибиотиков обладают иммуннодепрессивным действием.
Таким образом, для успешного проведения лечения
антибиотиками, особенно в случаях хронической инфекции, необходимо
предварительно определить степень чувствительности возбудителя заболевания к
тем или иным антибиотическим препаратам.
При определении чувствительности необходимо иметь чистые
культуры бактерий и лишь при необходимости срочного получения ответа,
используют смешанные культуры, содержащие всю микрофлору, имевшуюся в
материале.
Если от животных выделены патогенные и условно-патогенные
микроорганизмы в этиологически значимых количествах, следует определить
чувствительность культур к тем антибактериальным препаратам, которые используют
в данном животноводческом хозяйстве.
Чувствительность бактерий к антибиотикам определяется, в
соответствии с наставлением по применению набора дисков антибиотиков и
методическими указаниями по определению чувствительности к антибиотикам
возбудителей инфекционных болезней сельскохозяйственных животных (1986) -
методом серийных разведений антибиотика в плотной или жидкой питательной среде
или методом диффузии в агар с использованием бумажных дисков.
Наиболее прост и доступен метод определения чувствительности
с помощью дисков, пропитанных различными антибиотиками.
В стерильные чашки Петри, разливают по 15 мл плотной
питательной среды АГВ или МПА. На поверхность застывшего и слегка подсушенного
агара стерильно вносят 0,5 - 1,0 мл суспензии суточной культуры исследуемых
бактерий.
Бактериальную взвесь равномерно распределяют по поверхности
агара стерильным шпателем. После этого на поверхности засеянной среды
стерильным пинцетом раскладывают диски с антибиотиками - по 5 - 6 дисков на
каждую чашку на расстоянии 25 мм от центра чашки. Чашки выдерживают при 37 °С
16 - 18 час, после чего учитывают результаты опыта путем измерения зон задержки
роста микробов вокруг дисков.
После роста культуры на чашках с диск-антибиотиками проводят
измерение зон задержки роста микроорганизмов вокруг диска, включая диаметр
самого диска, и результат выражают в мм. Естественно, что размер зон зависит от
степени чувствительности возбудителя к данному антибиотику. Чем больше площадь
зоны задержки роста, тем чувствительнее культура к данному антибиотику.
Принято считать, что при зоне диаметром до 10 мм штамм
расценивается как антибиотикорезистентный, 11 - 15 мм - как слабо
чувствительный и 15 - 25 мм - как чувствительный к антибиотикам. Зоны, превышающие
25 мм, свидетельствуют о высокой чувствительности микроорганизма к данному
антибиотику. Однако этот метод нельзя считать количественным.
Метод серийных разведений антибиотика в плотной питательной
среде (на чашки Петри) имеет преимущества, так как дает возможность определить
чувствительность большого числа штаммов одновременно (50 и более с помощью
штамма-репликатора) и минимальную, подавляющую рост концентрацию антибиотика
(МПК) для штамма-возбудителя.
ПРИЛОЖЕНИЯ
Приложение 1
Консерванты
Глицериновый
Cостав:
|
натрия хлорид (NaCl) 0,85 %-ный
раствор
|
- 1000 мл;
|
|
глицерин нейтральный
|
- 500 мл;
|
|
натрия гидрофосфат, безводный (Na2HPO4) 20 %-ный раствор
|
- 150 мл.
|
Приготовление.
Смешивают первые два ингредиента и добавляют раствор
гидрофосфат натрия в таком количестве, чтобы довести pH до 7,8 - 8,0, затем
разливают в пробирки или флаконы по 10 мл, стерилизуют в автоклаве при 112 °С в
течение 15 мин или текучим паром 3 дня подряд. После стерилизации доводят pH до
7,6 - 7,8.
Фосфатно-буферный
Состав:
|
калия дигидрофосфат (KН2РO4)
|
- 0,45 г;
|
|
натрия гидрофосфат, безводный
(NaHPO4)
|
- 5,34 г;
|
|
вода дистиллированная
|
- 1000 мл.
|
Приготовление.
Ингредиенты смешивают, разливают по 10 мл в пробирки или
флаконы, стерилизуют в автоклаве 30 мин при 121 °С.
Буферный
глицерино-солевой
Состав:
|
натрия хлорид (NaCl)
|
- 4,2 г;
|
|
калия гидрофосфат (K2НРO4)
|
- 3,1 г;
|
|
калия дигидрофосфат (KН2РO4)
|
- 1,0 г;
|
|
глицерин нейтральный
|
- 300 мл;
|
|
вода дистиллированная
|
- 700 мл.
|
Приготовление.
Ингредиенты растворяют, перемешивают, смесь разливают в
стерильные пробирки по 5 мл и автоклавируют 30 мин при 112 °С. Целесообразно
для контроля качества хранения раствор слабо подкрашивать феноловым красным.
Изотонический
раствор хлорида натрия
Состав:
|
натрия хлорид (NaCl)
|
- 8,5 г;
|
|
вода дистиллированная
|
- 1000 мл.
|
Приготовление.
Соль растворяют при подогревании, фильтруют, разливают в
пробирки по 5 - 7 мл, стерилизуют 30 мин при 121 °С.
Полужидкий голодный агар (ПГА)
(среда для хранения и пересылки культур)
Невысокое содержание питательных веществ понижает
жизнедеятельность бактерий, особенно в условиях хранения при 4 - 6 °С.
Состав:
|
Бульон питательный, содержащий 0,6
- 0,9 % общего азота (pH 7,2 - 7,4)
|
- 1000 мл
|
|
Агар
|
- 2 - 4 г.
|
Приготовление: агар
расплавляют в горячем бульоне, фильтруют, разливают по 8 - 10 мл в пробирки или
в мелкие ампулы, стерилизуют при 121 °С.
Применение: культуру засевают 1 - 2 уколами в толщу
среды, помещают в термостат и после 18 - 20 часов выращивания выросшие культуры
оставляют для хранения.
Ватные пробирки в пробках заливают парафином или заменяют на
стерильные корковые, ампулы запаивают. Штаммы хранят при 4 - 6 °С, пересевают
через 2 - 3 месяца.
Приложение 2
Среды обогащения и
накопления
Селенитовая
среда
Используют для накопления сальмонелл.
Состав:
|
натрия гидроселенит (NaHSeО3)
без примеси теллура
|
- 14 г;
|
|
пептой венгерский «Рихтер» или
чехословацкий «Опофа»
|
- 15 г;
|
|
натрия гидрофосфат, безводный
(NaHPО4)
|
- 7 г;
|
|
натрия дигидрофосфат, безводный
(NaH2PО4)
|
- 3 г;
|
|
лактоза
|
- 4 г;
|
|
вода дистиллированная
|
- 1000 мл.
|
Приготовление.
Среды готовят из двух основных растворов:
Раствор № 1. Определяют пропорцию Na2HPО4
и NaH2PО4 с используемым образцом пептона и гидроселенита
натрия для установления pH в пределах 6,9 - 7,1, для чего регулируют
соотношение фосфатов. Подтитровка всегда нужна при изменении серии любого из
входящих в среду основных ингредиентов.
После установления соотношения фосфатов, к раствору № 1
добавляют пептон и лактозу. Разливают во флаконы по 50 мл и стерилизуют текучим
паром два дня по 30 мин.
Количество фосфатов в рецепте среды дано в расчете на
безводные препараты. При отсутствии таковых, заранее заготовленные навески
«выветривают» в термостате в течение 15 - 16 суток.
Раствор № 2. Раствор гидроселенита натрия 10 %-ный
готовят на стерильной дистиллированной воде перед употреблением. Перед началом
работы в каждый флакон с 50 мл основного раствора (раствор № 1) добавляют 2 мл
раствора гидроселенита натрия (раствор № 2), асептически разливают по 5 - 7 мл
в стерильные пробирки и закрывают плотно пробками. Дальнейшая стерилизация не
нужна.
Основной раствор для приготовления селенитовой среды можно
хранить холодильнике 1 - 2 месяца.
Для приготовления среды следует использовать
высококачественный пептон («Рихтер», «Опофа» или жидкий аминопептид -
отечественный заменитель импортного пептона).
Среда
Мюллера
Используют для накопления сальмонелл.
К 4,5 г простерилизованного сухим жаром химически чистого
мела (СаСО3 добавляют 90 мл МПБ или бульона Хоттингера и стерилизуют
30 мин при 121 °С).
Перед посевом к бульону с мелом асептически добавляют 2 мл
раствора Люголя (йодид калия - 25 г, йод кристаллический - 20 г, вода
дистиллированная - до 100 мл) и 10 мл раствора тиосульфата натрия (тиосульфат
натрия - 50 г, вода дистиллированная - до 100 мл).
Смесь перемешивают и разливают по пробиркам.
Среда
Кауфмана
Используют для накопления сальмонелл.
К 100 мл стерильной среды Мюллера асептически добавляют 5 мл
стерильной желчи (желчь стерилизуют дробно, текучим паром 3 дня подряд по 20
мин) и 5 мл 0,1 %-ного водного раствора бриллиантового зеленого. Разливают по
пробиркам. Не стерилизуют.
Среда
Киллиана
Используют для накопления сальмонелл.
К 100 мл стерильного МПБ или бульона Хоттингера (pH 6,7 -
6,9) непосредственно перед применением добавляют 1 мл 0,1 %-го водного раствора
бриллиантового зеленого.
Магниевая
среда
Используют для накопления сальмонелл. Готовят два раствора.
Раствор 1. К 890 мл дистиллированной воды добавляют
4,2 г пептона, 7,15 г хлорида натрия, 1,43 г дигидрофосфата калия (KН2РО4) и 9 мл дрожжевого диализата.
Раствор 2. В 90 мл дистиллированной воды растворяют
35,7 г хлорида магния (MgCl2·6Н2O).
Оба раствора смешивают и добавляют 0,9 мл 0,5 %-го водного
раствора бриллиантового зеленого. Разливают по пробиркам и стерилизуют 30 мин
при 112 °С.
Среда
ЭТ-1
Используют для накопления сальмонелл и эдвардсиелл.
К 1000 мл МПБ или бульона Хоттингера (pH 7,4 - 7,6)
добавляют 2 г глюкозы и 2 мл 5 %-го спиртового раствора розоловой кислоты.
Смесь кипятят на водяной бане 15 - 20 мин, добавляют 25000ЕД полимиксина и
асептически разливают по пробиркам.
Для приготовления 5 %-го спиртового раствора розоловой
кислоты 0,5 г розоловой кислоты растворяют в 10 мл спирта-ректификата, после
чего добавляют 90 мл дистиллированной воды.
Среда
Минка
Используют для накопления эшерихий, обладающих адгезивными
антигенами.
Раствор 1 (фосфатный буферный раствор pH 7,5). Берут
1,36 г калия фосфорнокислого однозамещенного (KН2РO4), 10,1 г натрия фосфорнокислого двузамещенного
(NaHPO4 7Н2O)
и растворяют в дистиллированной воде до конечного объема 1000 мл. Стерилизуют
30 мин при 115 °С.
Раствор 2. 10 г сульфата магния (MgSO4
7Н2O), 1 г хлорида марганца (МnСl2 4Н2O), 0,135 г хлорного железа (FеСl3·6Н2O) и 0,4
г хлорида кальция (СаСl2·Н2O) растворяют в дистиллированной воде до конечного объема
1000 мл. Стерилизуют 30 мин при 115 °С.
Раствор 3. 5 мл гидролизата лактальбумина (или
ферментативного казеиново-дрожжевого гидролизата) растворяют в 100 мл
дистилированной воды Стерилизуют текучим паром 3 дня по 30 мин.
Раствор 4. 5 г глюкозы растворяют в 100 мл
дистиллированной воды. Стерилизуют текучим паром 3 дня по 30 мин.
Раствор 5. 26 г агара «Дифко» растворяют в 1000 мл
дистиллированной воды. Стерилизуют 30 мин при 115 °С.
Полученные растворы асептически соединяют в следующем
соотношении:
раствор 1 - 500 мл;
раствор 2 - 1 мл;
раствор 3 - 20 мл при 50 °С;
раствор 4 - 20 мл;
раствор 5 - 460 мл при 50 °С.
Все растворы стерилизуют отдельно.
Готовую среду Минка не стерилизуют.
Казаминовую кислоту в составе среды Минка можно заменить
ферментативным казаминовым дрожжевым гидролизатом (ФКДГ) или гидролизатом
лактальбумина (ГЛА) в тех же соотношениях.
Среда
П-1
Используют для накопления протеев.
В 1000 мл стерильного бульона Хотингера растворяют 1 г
маннита, 5 г желчных солей по Олькеницкому, 0,8 г дигидрофосфата калия (KН2РО4), 20 мл 0,01 %-го водного
раствора кристаллвиолета. Кипятят на водяной бане 15 - 20 мин. Добавляют 10 мл
50 %-го водного раствора мочевины и 1000000 ЕД полимиксина. Асептически
разливают по пробиркам.
Приготовление желчных солей по Олькеницкому.
К 1000 мл бычьей или свиной желчи добавляют 40 г гидроокиси
натрия и автоклавируют 3 ч при 1,5 атм. Добавляют 100 мл 20 %-го раствора
хлорида бария (ВаС12·2Н2O),
автоклавируют 1 ч при 100 °С и оставляют на 12 - 18 ч при комнатной
температуре. После этого сливают, промывают водой и добавляют 40 %-й водный
раствор гидроокиси натрия (до щелочной реакции). Полученный раствор солей высушивают
при 115 °С.
Среда
К-1
Используют как селективную среду и для накопления клебсиелл.
В 1000 мл стерильной дистиллированной воды растворяют 5 г
хлорида натрия, 0,2 г сульфата магния (MgSO4·7H2O), 2 г дигидрофосфата калия (KН2РO4), 2 г гидрофосфата калия (K2НРO4), 2 г рафинозы, 2 мл 1,6 %-го щелочного
раствора бромтимолового синего, 20 мл 0,01 %-го водного раствора
кристаллвиолета. Кипятят 15 - 20 мин на водяной бане, добавляют 4 мл 50 %-го
раствора мочевины и асептически разливают по пробиркам.
Для приготовления 1,6 %-го щелочного раствора бромтимолового
синего в 80 мл дистиллированной воды растворяют 1,6 г бромтимолового синего и
20 мл 0,25 н. раствора гидроокиси натрия.
Среда
Ворфеля-Фергюсона
Используют для лучшего образования капсулы у клебсиелл.
В 100 мл дистиллированной воды растворяют 2 г хлорида
натрия, 1 г сульфата калия (K2SO4), 0,25 г сульфата
магния (MgSO4×7Н2O), 20 г сахарозы, 88 мл дрожжевого экстракта (или 2 г сухого
дрожжевого экстракта), фильтруют через бумажный фильтр, разливают по пробиркам
и стерилизуют 15 мин при 121 °С.
Бульон
с 0,2% глюкозы
Используется для лучшего образования капсулы у клебсиелл.
Берут 1000 мл МПБ или бульона Хоттингера (pH 7,2 - 7,4). В
небольшом его объеме, нагретом до 40 - 50 °С, растворяют 2 г глюкозы и
смешивают с оставшимся бульоном. Разливают по пробиркам и стерилизуют 30 мин
при 112 °С.
Среда
Ющенко, Дунаева
Используют для накопления иерсиний.
В 990 мл дистиллированной воды растворяют 8,5 г хлорида
натрия, добавляют 3 мл 1/15 М раствора гидрофосфата натрия (Na2HPO4×12Н2O)
и 7 мл 1/15 M раствора дигидрофосфата калия (K2НРO4).
Устанавливают pH 7,2, фильтруют, разливают по пробиркам и стерилизуют 10 мин
при 116 °С или 30 мин текучим паром.
Среды для первичной
идентификации
Трехсахарный агар с
мочевиной по Олькеницкому
Состав:
|
Агар питательный сухой
|
- 25 г;
|
|
Лактоза
|
- 10 г;
|
|
Сахароза
|
- 10 г;
|
|
Глюкоза
|
- 1 г;
|
|
Аммоний-железо (II)
сульфат ((FeSO4)·(NH4)2SO4·6H2O))
|
- 0,2 г;
|
|
Натрий тиосульфат (Na2S2O3·5H2O)
|
- 0,3 г,
|
|
Мочевина
|
- 10 г;
|
|
Феноловый красный (0,4 %-ный
водный раствор)
|
- 4 мл;
|
|
Вода дистиллированная
|
- 1000 мл.
|
Приготовление.
Соли предварительно растворяют в небольшом объеме
дистиллированной воды. Углеводы и мочевину также растворяют в небольших объемах
воды при подогревании в водяной бане. Сухой питательный агар расплавляют в
оставшемся объеме воды при нагревании и помешивании. Затем все ингредиенты
соединяют, перемешивают с расплавленным агаром, фильтруют через марлевый
фильтр, устанавливают pH = 7,2 - 7,4.
Добавляют индикатор, хорошо перемешивают, разливают в
пробирки по 6 - 7 мл. Стерилизуют текучим паром 3 дня подряд по 20 мин.
Скашивают, оставляя столбик 2 - 2,5 см. Готовая среда бледно-розового цвета.
Агар Клиглера
Состав:
|
Панкреатический гидролизат казеина
|
- 20 г;
|
|
Экстракт дрожжей
|
- 6,0 г;
|
|
Натрия хлорид
|
- 5,0 г;
|
|
Натрия тиосульфат
|
- 0,3 г;
|
|
Натрия метабисульфит
|
- 0,5 г;
|
|
Натрия карбонат
|
- 0,8 г;
|
|
Железа окисного цитрат
|
- 0,3 г;
|
|
Феноловый красный
|
- 0,05 г;
|
|
Агар
|
- 11,0 г.
|
Приготовление:
55 г коммерческой сухой среды размешивают в 1 л
дистиллированной воды доводят до кипения.
Кипятить нужно до полного расплавления агара (3 - 4 мин), затем
разлить пробирки по 6 мл, автоклавировать 30 мин при 112 °С. Среду скосить так,
чтобы в нижней части пробирки был столбик высотой 2,5 - 3,0 см. Готовая среда
имеет темно-красный (бурый) цвет.
Среда для теста на
окисление-ферментацию
Среда предназначена для установки путей расщепления
углеводов бактериями. У энтеробактерий расщепление углеводов происходит
ферментацией, у псевдомонад - окислением. Существуют бактерии, у которых
метаболизм углеводов полностью отсутствует.
Состав:
|
Пептон
|
- 2 г
|
|
NaCl
|
- 5 г
|
|
K2НРО4
|
- 0,3 г
|
|
Агар
|
- 3 г
|
|
1 %-й водный раствор бромтимоловый
синий
|
- 3 мл
|
|
Глюкоза
|
- 10 г
|
|
Вода дистиллированная
|
- 1000 мл
|
Приготовление: все вещества,
входящие в состав среды, растворяют при подогревании в водяной бане, фильтруют,
разливают в пробирки по 5 - 6 мл и стерилизуют при 118 °С 10 мин (pH 7,1 -
7,2).
Среда с KNО3
для определения редукции нитратов
Эта среда предназначена для подтверждения принадлежности
испытуемого штамма к энтеробактериям и для дифференциации грамотрицательных
бактерий от грамположительных.
Под восстановлением нитратов подразумевается способность
микробов редуцировать соли азотной кислоты (нитраты (NO-3)
и нитриты (NO-2)) с выделением аммиака (NO3)
или свободного азота (N2).
Процесс редукции нитратов энтеробактерии осуществляют с
помощью фитонитратредкутазы.
Состав:
|
Калий нитрат (KNO3),
свободный от KNО2 и от нитратов
|
- 0,2
|
|
Пептон
|
- 5 г
|
|
Вода дистиллированная
|
- 1000 мл
|
Приготовление: ингридиенты
смешивают, устанавливают pH 7,4, разливают в пробирки по 5 мл и стерилизуют при
120 °С 15 мин.
Приложение 4
Селективные среды
Среда Эндо
Селективная среда для энтеробактерий. Выпускается в сухом
виде. Состоит из агара, основного фуксина, сульфата натрия, фосфата натрия,
лактозы.
Для посевов используют свежеприготовленную среду.
В 100 мл дистиллированной воды растворяют 5 г сухой среды,
кипятят при постоянном помешивании 2 - 3 мин и разливают по чашкам Петри.
Для предотвращения образования большого количества
конденсата среду после кипячения охлаждают до 50 °С. Готовая среда имеет
розовый цвет.
Колонии лактозоположительных штаммов красные, лактозоотрицательных
-бесцветные или слегка розоватые.
Готовая среда чувствительна к свету, поэтому после
приготовления она не подлежит продолжительному хранению. Подсушивать и хранить
среду следует в темном месте.
Для подавления роения (подвижности) бактерий рода Proteus, к
100 мл готовой среды Эндо добавляют 3 мл медицинской желчи.
Агар Плоскирева
Селективная среда для сальмонелл.
Выпускается в сухом виде. Состоит из агара с желчными
солями, цитрата натрия, тиосульфата натрия, фосфата натрия, лактозы, нейтрального
красного, бриллиантового зеленого, соды кальцинированной, йода, хлорида натрия.
Готовая среда прозрачная или розовато-желтого цвета.
Лактозоположительные сальмонеллы образуют колонии красного
цвета, лактозоотрицательные - бесцветные.
Висмут-сульфит агар
Селективная среда для сальмонелл.
Выпускается в сухом виде. Состоит из агара, гидролизата
рыбы, глюкозы цитрата висмута, сульфита натрия, соли Мора, фосфата натрия,
бриллиантового зеленого.
Готовая среда имеет зеленоватую окраску.
Сальмонеллы, продуцирующие сероводород, образуют черные
колонии с прокрашиванием агара под колонией в черный цвет. Сальмонеллы, не
продуцирующие сероводород, образуют бесцветные или зеленовато-коричневые
колонии.
Среда Левина
Селективная среда для энтеробактерий.
К 100 мл расплавленного и охлажденного до 60 - 70 °С 2 %-го
агара Хоттингера (pH 7,2 - 7,4) добавляют 2 мл 0,5 %-го водного раствора
метиленового синего (подогретого на водяной бане до 60 - 70 °С), 1,5 мл 2 %-го
раствора эозина, 2 г лактозы и 0,2 г двуосновного фосфорнокислого калия (KН2РО4).
Перемешивают, разливают по чашкам, подсушивают. Перед
добавлением в среду раствора красителей стерилизуют текучим паром 3 дня по 30
мин.
Готовая среда имеет фиолетовый цвет.
Колонии эшерихий синего или черного цвета, сальмонелл -
бесцветные или розовые, протея - оранжевые, с измененным цветом среды вокруг
колонии.
Кровяной агар (5
%-ный)
Расправляют определенное количество 2 %-ного мясопептонного
стерильного агара, охлаждают его до температуры 45 °С и прибавляют
дефибринированную или цельную стерильно взятую кровь (к 95 мл агара добавляют 5
мл крови).
Добавляют кровь при соблюдении правил стерильности. Готовую
среду разливают в стерильные чашки Петри, дают ей застыть и подсушивают в
термостате. Слой агара должен быть равномерно окрашен в красный цвет.
Дифференциально-диагностические
среды
Среда Штерна
Используют для дифференциации сальмонелл.
К 1000 мл МПБ или бульона Хоттингера добавляют 2,5 мл 10 %-го
насыщенного спиртового раствора основного фуксина, 16,6 мл 10 %-го водного
раствора сульфита натрия (Na2SO4)
и 10 мл глицерина.
Разливают по пробиркам и стерилизуют 15 мин при 112 °С.
Готовая среда имеет желтую окраску.
Если испытуемая культура относится к Salmonella typhimurium,
которая способна ферментировать глицерин, то среда приобретает фиолетовый
оттенок.
Среда Биттера
Используют для дифференциации сальмонелл.
В 1000 мл дистиллированной воды растворяют 0,05 г пептона,
0,5 г трехосновного лимоннокислого натрия (цитрат натрия), 5 г хлорида натрия,
5 г рамнозы (или арабинозы). Кипятят на водяной бане 3 - 5 мин, фильтруют через
бумажный фильтр. Разливают по пробиркам и стерилизуют 30 мин при 112 °С или
текучим паром 3 дня по 30 мин.
Если испытуемая культура относится к сальмонеллам, способным
ферментировать рамнозу или арабинозу (S. typhimurium), то при добавлении к
суточной культуре (выращенной на данной среде) 2 капель 0,5 %-го спиртового
раствора метилового красного среда приобретает красную окраску.
Среда для посева по
Свену-Гарду
Используют для выявления у сальмонелл специфической фазы
жгутикового антигена.
К 1000 мл МПБ или бульона Хоттингера добавляют 8 г агара и
растворяют путем кипячения на водяной бане. Устанавливают pH 7,2 - 7,4,
фильтруют через бумажный фильтр и стерилизуют 30 мин при 121 °С.
Среды, содержащие
органические кислоты
Предназначены для дифференциации сальмонелл по их
способности расщеплять органические кислоты (тартраты, мукат, цитрат натрия).
В 1000 мл дистиллированной воды растворяют 10 г пептона,
добавляют 8 мл 0,1 н. раствора гидроокиси натрия, 12 мл 0,2 %-го водного
раствора бромтимолового синего, 10 г D-тартрата (или одну из следующих кислот:
5 г L-тартрата, 5 г мезо-тартрата, 10 г муката, 10 г цитрата натрия).
Устанавливают pH 7,4, разливают в пробирки и стерилизуют 20 мин при 112 °С.
Готовая среда сине-зеленого цвета.
При положительной реакции в процессе инкубации среда с
культурой приобретает зелено-желтую или мутно-белую окраску.
Для получения более отчетливых результатов в конце срока
инкубации в пробирки с сомнительной или отрицательной реакцией добавляют
несколько капель насыщенного раствора ацетата свинца, в результате при
отрицательной реакции выпадает обильный осадок до 2/3 объема среды, при
положительной - выпавший осадок незначителен.
Среда с триптофаном
Используют для определения у бактерий наличия
триптофандезаминазы.
В 1000 мл дистиллированной воды растворяют 2 г
DL-триптофана. Устанавливают pH 6,7 - 6,9.
Для определения способности бактерий к дезаминированию триптофана
испытуемую агаровую культуру бактериологической петлей вносят в пробирку 0,5 мл
раствора триптофана и инкубируют 30 мин при 37 °С, после чего вносят каплю 10
%-го водного раствора хлорида железа трехвалентного (FeCl3).
При положительной реакции среда приобретает темно-красную
окраску, при отрицательной - желтую.
Пептон-глицериновый
агар
Используют для выявления у серратий пигмента продигиозина.
В 900 мл дистиллированной воды растворяют кипячением 5 г пептона
и 20 г агара, после добавляют 10 мл глицерина. Доводят объем до 1000 мл
дистиллированной водой и стерилизуют 30 мин при 110 °С.
Среда Блаурокка
(модифицированная, печеночная)
Предназначена для выделения и культивирования бифидобактерий.
Состав:
|
печеночный экстракт
|
- 1 л;
|
|
агар-агар
|
- 0,75 г;
|
|
пептон сухой (ТУ-13805-76)
|
- 10 г;
|
|
лактоза (ТУ-6-09-2293-72)
|
- 10 г;
|
|
цистин
|
- 100 мл;
|
|
NaCl
|
- 5 г.
|
Приготовление.
Берут 0,5 кг свежей говяжьей печени, очищают от пленок,
измельчают и заливают 1 л дистиллированной воды, кипятят в течение часа. Затем
содержимое отстаивают и фильтруют через ватно-марлевый фильтр, доводят
дистилированной водой до первоначального объема.
В полученный печеночный экстракт добавляют предварительно
растопленный агар-агар, пептон и цистин, устанавливают рН = 8,1 - 8,2 (для
подщелачивания используют 18 - 20 %-ный раствор NaOH) и кипятят 15 мин. Затем
отстаивают 30 мин и фильтруют. Фильтрат доводят дистиллированной водой до 1 л и
добавляют лактозу.
Среду разливают по флаконам 50 - 100 мл и стерилизуют 50 мин
текучим паром и 30 мин при 0,5 атм. Перед употреблением среду разливают в
пробирки по 10 - 15 мл и прогревают в водяной бане 40 мин при 100 °С.
Показатели среды: аммонийный азот - 70 - 80 мг %, pH = 7,2 -
7,4.
Среда МРС-2 (полужидкая)
Предназначена для выделения и культивирования лактобактерий.
Состав:
агар-порошок по ГОСТ 16280-70;
марганец сернокислый 5Н2О по ГОСТ
435-77;
цистеин солянокислый ТУ 6-097400-77;
магний сернокислый 7Н2О по ГОСТ
4523-77;
калий фосфорнокислый двузамешенный 12Н2О по ГОСТ
2493-75;
глюкоза по ГОСТ 18321-77;
пептон сухой ферментативный по ГОСТ
13805-76;
твин-80;
автолизат дрожжевой (дрожжи хлебопекарные по ГОСТ
171-81);
вода дистиллированная по ГОСТ 6709-72;
молоко по Богданову 2:1 (молоко коровье по ГОСТ
13277-79);
натрия гидроокись по ГОСТ
4328-77;
кислота уксусная ледяная по ГОСТ 61-75.
Приготовление.
50,0 мг марганца сернокислого, 200 мл цистеина
солянокислого, 200 мг магния сернокислого, 2,0 г калия фосфорнокислого
двухзамещенного, 20,0 г глюкозы растворяют в 200 мл дистиллированной воды в
порядке записи. Отдельно растворяют 10 г пептона в 100 мл кипящей
дистиллированной воды, добавляют 1 мл твина-80. Смешивают обе части среды.
Добавляют 50 мл дрожжевого автолизата, 0,5 л молока по Богданову и 0,2 - 0,3
%-ного агар-агара
Устанавливают pH = 6,2 - 6,6 20 %-ным раствором NaOH и
ледяной уксусной кислотой. Нагревают до кипения. Фильтруют через ватно-марлевый
фильтр. Разливают в пробирки и стерилизуют 30 мин при 100 °С и 20 мин при 110
°С.
Инструкция
по применению пластины биохимической дифференцирующей
энтеробактерии (ПБДЭ)
(BIOCHEMICAL DIFFERENTIATION PLATE OF ENTEROBAKTERIA)
ПБДЭ - система одноразового использования для дифференциации
микроорганизмов семейства энтеробактерий.
ПБДЭ - позволяет определить следующие биохимические
свойства: утилизацию цитрата натрия как в присутствии сахара (модификация
цитратной среды Симмонса), малоната натрия, глюкозы, лактозы, маннита,
сахарозы, инозита, сорбита, арабинозы, мальтозы, образование индола,
сероводорода, ацетилметил карбинола (отношение к реакции Фогеса - Проскауэра),
наличие уреазы, β-галактозидазы, декарбоксилаз орнитина и лизина,
дигидролазы аргинина, дезаминазы фенилаланина.
ПБДЭ представляет собой помещённую в планшет панель с 20
конусообразными лунками, на дно которых нанесены соответствующие субстраты с
индикаторами, стабилизированные поливиниловым спиртом. Панель и планшет
изготовлены из нейтральной полимерной плёнки путём вакуум-формования.
Субстраты с индикатором вносят в лунки в жидком виде, затем
высушивают и стерилизуют.
Биологические
свойства
Специфическое действие препарата заключается в возможности
дифференцировать микроорганизмы на основе определения ферментативных систем по
их действию на соответствующие субстраты (углеводы, аминокислоты и т.п.).
Назначение
ПБДЭ предназначена для определения биохимической активности
микроорганизмов семейства Enterobacteriaceae, выделяемых в ходе
бактериологического исследования и дифференциации представителей данного
семейства до вида.
Способ
применения
Идентификацию культур, выделяемых непосредственно из нативного
материала, производят со скошенного мясо-пептонного агара или со среды
Олькеницкого (Клиглера). Используют культуры, выращенные в течение (21 ± 3) ч
при температуре (37 ± 1) °С.
Если выделенная культура микроорганизма находилась
какое-либо время на хранении при комнатной температуре или в холодильнике,
производят предварительный посев её на мясо-пептонный бульон. Посевы инкубируют
в течение (3 ± 1) ч при температуре (37 ± 1) °С, затем осуществляют пересев
культуры на скошенный мясо-пептонный агар.
Готовят суспензию культуры микроорганизма в стерильном 0,85
% растворе хлористого натрия, pH (6,00 + 0,050) и доводят мутность суспензии до
10 единиц по отраслевому стандартному образцу для визуального определения
мутности бактерийных взвесей, стеклянному.
При отсутствии отраслевого стандартного образца в 4 мл
стерильного 0,85 % раствора хлористого натрия вносят исследуемую (2 - 3 петли)
культуру до появления видимой мутности.
Проведение
исследования
1. Вскрывают упаковку.
2. Регистрируют на выступающем конце донышка планшета номер
засеваемого штамма.
3. Открывают крышку планшета и располагают его на столе.
4. Добавляют пипеткой вместимостью 1 мл по 0,5 мл микробной
суспензии во все лунки панели, кроме лунки для обнаружения сероводорода, куда
вносят только одну каплю (0,05 мл) суспензии.
5. Заливают лунку для обнаружения сероводорода 0,1 мл
растопленного и охлаждённого до температуры (39 ± 1) °С мясо-пептонного
бульона, содержащего 0,6 % агара.*
____________
*
Для получения чётких результатов необходимо добиться осуществления более
быстрой диффузии субстрата в инокулят. Особенно это относится к тексту на
выявление сероводорода. Поэтому необходимо перемешать концом раскапывающей
пипетки субстрат, инокулят и мясо-пептонный бульон, содержащий 0,_ % агара, а
затем производить требуемые инструкцией манипуляции.
6. Для создания анаэробных условий в лунки для определения
наличия лизиндекарбоксилазы, орнитиндекарбоксилазы, аргининдигидролазы и
образования сероводорода добавляют 1 - 2 капли стерильного вазелинового масла.
7. Закрывают крышку планшета.
8. Выдерживают ПБДЭ в течение (20 ± 2) ч при температуре (37
± 1) °С.
9. После окончания инкубации открывают крышки планшетов и в
лунки добавляют следующие компоненты:
- для выявления фенилаланиндезаминазы добавляют 1 каплю 10
%-ого раствора хлорного железа (железо трёххлористое 6-водное по ГОСТ
4147-74);
для определения ацетилметилкарбинола - 1 каплю 6 %-ого
раствора α нафтола (α-нафтол по ГОСТ 5833-70) и затем 1
каплю 40 %-ого раствора гидроокиси калия (калия гидроокись по ГОСТ
24363-80);
- для выявления индола - 1 каплю реактива Эрлиха.
Учёт
результатов
1. Учёт результатов проводят визуально в соответствии с
цветовым указателем, приложенным к ПБДЭ, через (4 ± 1) и (20 ± 2) ч инкубации
при температуре (37 ± 1) °С.**
2. Выявление образования ацетилметилкарбинола осуществляют
через (15 ± 5) мин после закапывания реактивов.***
____________
** Иногда учёт теста на
обнаружение β-галактозидазы возможен только через (4 ± 1) ч, поэтому учёт
результатов производят дважды: через (4 ± 1) и через (20 ± 2) ч.
*** Для избежания явления высыхания лунок за время
инкубации в термостате рекомендуется заливать воду в донышко планшета.
Форма
выпуска
ПБДЭ, запаянные в полиэтиленовую плёнку, уложены в картонные
коробки размером 200×120×40 мм по 5 штук или в коробки размером
200×120×80 мм по 10 штук.
Обезвреживание
ПБДЭ обезвреживают автоклавированием в течение 15 мин при
температуре (121 ± 1) °С или в 3 %-ном растворе перекиси водорода в течение (18
± 3) ч.
Условия
хранения и транспортирования
Хранят препарат с относительной влажностью воздуха не более
60 % при температуре (20 ± 5) °С. Срок годности 1 год. Транспортирование всеми
видами крытого транспорта.
Рекламации на качество препарата направляют в
Государственный научно-исследовательский институт стандартизации и контроля
медицинских и биологических препаратов им. Л. А. Тарасевича (121002, Москва,
Сивцев Вражек, 41, телефон 241-39-22) и в адрес предприятия, изготовившего
препарат (603600, Нижний Новгород, Грузинская, 44, телефон 33-40-07).
Цветовой
указатель учета реакции на ПБДЭ
|
№
|
Тесты
|
Сокращения
|
Положительная
реакция
|
Отрицательная
реакция
|
|
1.
|
Утилизация цитрата натрия
|
ЦН
|
Зелёный,
синий
|
Жёлтый,
слабо-зелёный
|
|
2.
|
Утилизация малоната натрия
|
МН
|
-»-
|
Жёлтый
|
|
3.
|
Утилизация цитрата натрия с глюкозой
|
ЦНГ
|
Зелёный,
фиолетовый,
бурый
|
Жёлтый,
жёлто-коричневый
|
|
4.
|
Наличие лизиндекарбоксилазы
|
ЛИЗ
|
Зелёный,
синий
|
Жёлтый,
слабо-зелёный
|
|
5.
|
Наличие аргининдигидролазы
|
АРГ
|
-»-
|
-»-
|
|
6.
|
Наличие орнитиндекарбоксилазы
|
ОРН
|
-»-
|
-»-
|
|
7.
|
Наличие фенилаланиндезаминазы
|
ФА
|
-»-
|
-»-
|
|
8.
|
Образование индола
|
ИНД
|
Розовый
|
Бесцветный
|
|
9.
|
Образование ацетилметилкарбинола
|
АМК
|
Розовый,
малиновый
|
-»-
|
|
10.
|
Наличие уреазы
|
УР
|
-»-
|
Жёлтый
|
|
11.
|
Образование сероводорода
|
H2S
|
Чёрный
|
Жёлтый
|
|
12.
|
Утилизация глюкозы
|
ГЛ
|
Жёлтый
|
Красный
|
|
13.
|
Наличие β-галактозидазы
|
β-ГАЛ
|
-»-
|
Бесцветный
|
|
14.
|
Утилизация лактозы
|
ЛАК
|
-»-
|
Красный
|
|
15.
|
Утилизация маннита
|
МТ
|
-»-
|
-»-
|
|
16.
|
Утилизация сахарозы
|
САХ
|
-»-
|
-»-
|
|
17.
|
Утилизация инозита
|
ИН
|
-»-
|
-»-
|
|
18.
|
Утилизация сорбита
|
СОР
|
-»-
|
-»-
|
|
19.
|
Утилизация арабинозы
|
АР
|
-»-
|
-»-
|
|
20.
|
Утилизация мальтозы
|
МАЛ
|
-»-
|
-»-
|
Инструкция
по применению систем индикаторных бумажных для идентификации
микроорганизмов семейства Enterobacteriaceae (СИБ)
(Indicatory paper systems for identification of microorganisms
of Enterobacteriaceae family)
Системы индикаторные бумажные (СИБ) для идентификации
микроорганизмов семейства Enterobacteriaceae представляют собой диски или
полоски хроматографической бумаги, содержащие определённые количества субстрата
в сочетании с соответствующим индикатором, стабилизированные плёнкообразующие
покрытием - поливиниловым спиртом.
СИБ используют взамен дифференциально-диагностических сред
при изучении биохимических свойств микроорганизмов.
Выпускают в наборе из 13 тестов для межродовой и видовой
дифференциации энтеробактерий: СИБ с сорбитом, инозитом, лизином, орнитином,
цитратом натрия, малонатом натрия, для выявления β-галактозидазы, индола,
уреазы, фенилаланиндезаминазы, сероводорода, оксидазы, для реакции
Фогес-Проскауэра.
Набор обеспечивает проведение 50 анализов.
Назначение
Определение ферментативной активности микроорганизмов
семейства Еnterobacteriaceae и их идентификация.
Биологические
свойства
Специфическое действие препарата заключается в возможности
дифференцировать энтеробактерии на основе определения ферментативных систем по
их действию на соответствующие субстраты.
Способ
применения
Основные требования, предъявляемые при работе с СИБ:
- исследования проводят с чистой культурой, а также с
отдельными колониями непосредственно с чашек с дифференциально-диагностическими
средами (среда Эндо, Плоскирёва, висмут-сульфит агар);
- в опытные пробирки с 0,9 % раствором хлорида натрия (pH
7,3 ± 0,1) или фосфатно-буферным раствором (pH 5,5 ± 0,2), в зависимости от
изучаемого теста вносят полную петлю культуры, выросшей на поверхности
мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1) °С. При
определении утилизации углеводов и многоатомных спиртов может быть использована
микробная взвесь в количестве 2 - 3 капель (3 - 4 мл 0,9 % раствора хлорида
натрия смывают культуру с поверхности скошенного агара);
- погружение дисков в пробирки производят обожжённым
пинцетом;
- учёт результатов реакций предварительный и окончательный,
приведён в таблице;
- критерием правильности учёта реакции должны быть чёткие
различия в окраске по сравнению с контролем (за исключением аминокислот, где в
опытной пробирке слабое зелёное окрашивание свидетельствует об отрицательном
результате, в то время как в контроле диски с аминокислотами окрашены в жёлтый
цвет);
- основные ошибки при применении СИБ возникают при
несоблюдении режима pH применяемых питательных сред, при использовании посуды,
обработанной различными моющими порошками и недостаточно отмытой;
- для ускоренного получения чётких результатов необходимо
соблюдение температурного режима термостата (37 ± 1) °С.
1.
Определение оксидазной активности
Культуру, выросшую на поверхности мясо-пептонного агара в
течение 18 - 24 ч при температуре (37 ± 1) °С, растирают петлёй на индикаторной
бумажке, помещённой в чашку Петри. На одной бумажке можно исследовать 10 - 14
культур (не более).
2.
Определение утилизации углеводов и многоатомных спиртов
В пробирке с 0,3 мл стерильного 0,9 %-ного раствора хлорида
натрия (pH 7,3 ± 0,1) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, или вносят 2 - 3 капли микробной взвеси. Затем погружают диск с
соответствующим углеводом или многоатомным спиртом. Среда в пробирках в
результате быстрой диффузии в неё индикатора становится красной. В случае
необходимости учёта газообразования рекомендуется использовать небольшой
комочек стерильной гигроскопической ваты, который помещают в пробирку для
определения утилизации глюкозы. В качестве контроля служат диски, погружённые в
пробирки со стерильным 0,9 %-ным раствором хлорида натрия. Инкубируют пробирки
при температуре (37 ± 1) °С.
3.
Определение активности β-галактозидазы
В пробирке с 0,3 мл стерильного 0,9 %-ного раствора хлорида
натрия (рН 7,3 ± 0,1) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, затем в эту взвесь помещают индикаторный диск и инкубируют при температуре
(37 ± 1) °С.
В качестве контроля используют диск, помещённый в пробирку
со стерильным 0,9 %-ным раствором хлорида натрия.
4.
Определение индолообразования с помощью индикаторных бумажных полосок
В пробирке с 0,3 мл стерильного 0,9 %-ного раствора хлорида
натрия (рН 7,3 ± 0,1) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С. Полоску для oбнаружения индола складывают по намеченной на ней линии вдвое
и пинцетом опускают на дно пробирки так, чтобы длинный бесцветный конец
погрузился в суспензию, а короткий конец, имеющий зеленовато-серую окраску,
находился над поверхностью суспензии. Посевы инкубируют при температуре (37 ±
1) °С. В качестве контроля используют полоску, помещённую в пробирку со
стерильным 0,9 %-ным раствором хлорида натрия.
5.
Определение уреазной активности
В пробирке с 0,3 мл стерильного 0,9 %-ного раствора хлорида
натрия (рН 7,3 ± 0,1) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, затем в эту взвесь погружают индикаторный диск с мочевиной и инкубируют при
температуре (37 ± 1) °С. В качестве контроля используют диск, помещённый в
пробирку со стерильным 0,9 %-ным раствором хлорида натрия.
6.
Определение активности декарбоксилаз лизина, орнитина
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного
раствора (рН 5,5 ± 0,2) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч, при температуре (37 ± 1)
°С, затем в эту взвесь погружают индикаторный диск с одной из аминокислот
(лизином, орнитином), вносят 0,2 мл стерильного вазелинового масла и инкубируют
при температуре (37 ± 1) °С.
В качестве контроля используют диски с соответствующими
аминокислотами, погружённые в пробирки со стерильным фосфатно-солевым буферным
раствором (pH 5,5 ± 0,2) с добавлением 0,2 мл стерильного вазелинового масла.
7.
Определение активности фенилаланиндезаминазы
В пробирке с 0,3 мл стерильного 0,9 %-ного раствора хлорида
натрия (рН 7,3 ± 0,1) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, затем в эту взвесь погружают диск с фенилаланином и инкубируют при
температуре (37 ± 1) °С. В качестве контроля используют диск, помещённый в
пробирку со стерильным 0,_ %-ным раствором хлорида натрия. После инкубации в
течение 1 - 2 ч в пробирку помещают индикаторные диски с хлоридом железа (III).
8.
Определение образования сероводорода
Индикаторный диск помещают в бактериологическую пробирку на
поверхность мясо-пептонного агара, содержащего 0,5 - 0,7 % агара
микробиологического (pH 7,3 ± 0,1), засеянного уколом культурой, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, что позволяет одновременно определять подвижность. Пробирки инкубируют при
температуре (37 ± 1) °С. В качестве контроля используют пробирку со стерильным
мясо-пептонным агаром, на поверхность которого помещают индикаторный диск.
9.
Определение утилизации цитрата и малоната натрия
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного
раствора (рН 5,5 ± 0,2) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, затем в эту взвесь погружают индикаторный диск с цитратом или малонатом
натрия и инкубируют при температуре (37 ± 1) °С. В качестве контроля используют
диски, помещённые в пробирки со стерильным фосфатно-солевым буферным раствором
(pH 5,5 ± 0,2).
10.
Определение ацетилметилкарбинола (реакция Фогес-Проскауэра)
В пробирке с 0,3 мл стерильного фосфатно-солевого буферного
раствора (pН 5,5 ± 0,2) суспендируют полную петлю культуры, выросшей на
поверхности мясо-пептонного агара в течение 18 - 24 ч при температуре (37 ± 1)
°С, затем в эту взвесь помещают субстратный диск, погружённый в пробирку со
стерильным 0,9 %-ным раствором хлорида натрия. Через 18 - 24 ч инкубации при
температуре (37 ± 1) °С в пробирки закапывают по 1 - 2 капли 6 %-ного
спиртового раствора α-нафтола и 40 %-ного раствора гидроокиси калия и
выдерживают 15 - 20 мин при температуре (37 ± 1 ) °С.
Примечание: 6 %-ный раствор α-нафтола готовят на одну неделю
работы, хранят в посуде из тёмного стекла.
Учёт
результатов
Учёт результатов исследований проводят визуально в
соответствии с таблицей.
Учёт
результатов исследований
|
Тесты
|
Цвет
субстрата в растворённом виде
|
Срок
учёта результатов
|
Результат
|
|
положительный
|
отрицательный
|
|
Наличие оксидазы
|
серовато-сиреневый
|
30
- 60 с
|
синее окрашивание
|
серое окрашивание
|
|
Утилизация углеводов и многоатомных
спиртов
|
красный
|
5
- 18 ч
|
окрашивание в жёлтый или оранжевый цвет
|
красный цвет
|
|
Наличие β-галактозидазы
|
бесцветный
|
1
- 5 ч
|
жёлтый цвет
|
окрашивание отсутствует
|
|
Образование индола
|
бесцветный
|
от
40 мин до 2 ч
|
окрашивание короткого конца в
розово-малиновый цвет
|
окрашивание отсутствует
|
|
Наличие уреазы
|
бесцветный
|
от
40 мин до 2 ч
|
окрашивание в розово-красный цвет
|
окрашивание отсутствует
|
|
Наличие декарбоксилаз лизина, орнитина
|
жёлтый
|
5
- 18 ч
|
окрашивание в синий или
интенсивно-зелёный цвет
|
жёлтый или светло- зелёный цвет
|
|
Наличие фенилаланиндезаминазы
|
бесцветный
|
1
- 2 ч
|
Через 10 - 15 с после помещения
индикаторного диска с хлоридом железа
|
|
зелёное окрашивание
|
окрашивание отсутствует
|
|
Образование сероводорода
|
кремовый
|
5
- 18 ч
|
чёрный цвет
|
окрашивание отсутствует
|
|
Утилизация цитрата и малоната натрия
|
оранжевый
|
5
- 18 ч
|
малиново-красный
|
жёлтый или оранжевый
|
|
Реакция Фогеса- Проскауэра
|
бесцветный
|
18
- 24 ч
|
Через 15 - 20 мин после закапывания по 1
- 2 капли 6 %-ного раствора α-нафтола и 40 %-ного раствора гидроокиси
калия
|
|
малиново-красный
|
окрашивание отсутствует
|
Обезвреживание
Использованные СИБ обезвреживают автоклавированием в течение
15 минут при температуре (120 ± 1) °С или выдерживают в 6 %-ном растворе
перекиси водорода в течение (18 ± 1) ч.
Форма
выпуска
СИБ-диски выпускаются во флаконах, СИБ-полоски в стеклянных
пробирках на 50 анализов.
Набор комплектуют в картонные пачки (12 флаконов и 2
пробирки). К набору СИБ прилагается стерильный фосфатно-солевой буферный
раствор (pH 5,5 ± 0,2).
Условия
хранения и транспортирования
Хранить в тёмном помещении с относительной влажностью
воздуха не более 60 %, при температуре 4 - 25 °С. Транспортировать всеми видами
крытого транспорта при температуре от минус 20 до 25 °С.
Срок
годности
Срок годности СИБ 2 года.
Рекламации на качество СИБ направлять в Государственный
научно-исследовательский институт стандартизации и контроля медицинских
биологических препаратов им. Л.А. Тарасевича (121002, г. Москва, Сивцев Вражек,
41, тел. 241-39-22) и в адрес предприятия, изготовившего препарат (603600, г.
Нижней Новгород, Грузинская, 44, тел. 34-19-45).
Методические указания «Выделение и идентификация бактерий
желудочно-кишечного тракта животных» разработаны в Федеральном государственном
образовательном учреждении высшего профессионального образования «Московская
государственная академия ветеринарной медицины и биотехнологии имени К.И.
Скрябина» (МГАВМиБ).
1. Блохина И.Н., Воронин Е.С., Брусникина Н.Ф. и др.
Методические рекомендации по выделению и идентификации условно-патогенных
энтеробактерий и сальмонелл при острых кишечных заболеваниях молодняка
сельскохозяйственных животных. - М.: MBA, 1990.
2. Воронин Е.С., Грязнева Т.Н., Тихонов И.В., Девришов Д.А.,
Джамбулатов З.М., Ахмедов М.М. Выделение и идентификация условно-патогенных
микроорганизмов и сальмонелл при острых кишечных заболеваниях молодняка
животных (переработанное и дополненное) /Учебно-методическое пособие. - М.:
МГАВМиБ им. К.И. Скрябина, 2003.
3. Голубева В.А., Килессо В.А., Киселева Б.С. и др.
Энтеробактерии /Руководство для врачей // Под редакцией В.И. Покровского. - М.:
Медицина. - 1985. - 321 с.
5. Грязнева Т.Н., Соболь М.А., Троицкая И.В. Применение
систем индикаторных бумажных (СИБ № 6) в лабораторной практике птицеводства
/Межвуз. сборник научных трудов «Ветеринарная и биологическая наука -
ветеринарному производству». - Н. Новгород, 1997 г.
6. Интизаров М.М. Микрофлора тела животных /Лекция для
слушателей ФПК, преподавателей и научных сотрудников. - М.: MBA, 1989.
7. Петровская В.Г., Марко О.П. Микрофлора человека в норме и
патологии. - М.: Медицина, 1976.
8. Сидоров М.А., Скородумов Д.И., Федотов В.Б. Определитель
зоопатогенных микроорганизмов /Справочник. - М.: Колос. - 1995.
9. Ставцева Л.Я., Грязнева Т.Н. Антагонистическая активность
бифидо- и лактобактерий в отношении патогенных и условно-патогенных
энтеробактерий //Ветеринария. - № 6. - 1991.
10. Ставцева Л.Я., Грязнева Т.Н. Роль условно-патогенных
энтеробактерий в возникновении диареи у новорожденных телят - гипотрофиков
/Межвуз. сб. науч. трудов «Новое в диагностике, лечении и профилактике болезней
молодняка с/х животных». - Москва, 1991 г.
11. Трещанина Н.А. Техника микробиологических исследований
/Лабораторный практикум по микробиологии. - Часть I. - Самара, 1997.
12. Трещанина Н.А. Выделение чистой культуры бактерий /Лабораторный
практикум по микробиологии. - Часть II. - Самара, 1997.
13. Трещанина Н.А. Изучение свойств выделенного штамма
/Лабораторный практикум по микробиологии. - Часть III.
- Самара, 1997.
Коллектив
авторов:
Воронин Евгений Сергеевич
- ректор Московской государственной академии ветеринарной медицины и
биотехнологии имени К.И. Скрябина (МГАВ-МиБ), академик РАСХН, профессор, доктор
биологических наук.
Грязнева Татьяна Николаевна
- доцент кафедры биотехнологии МГАВМиБ, кандидат ветеринарных наук.
Тихонов Игорь Владимирович -
заведующий кафедрой биотехнологии МГАВМиБ, доктор биологических наук,
профессор.
Гаврилов Владимир Андреевич
- профессор кафедры биотехнологии МГАВМиБ, доктор ветеринарных наук.
Девришов Давудай
Абдулсемедович - заведующий лабораторией инфекционной патологии и
биотехнологии МГАВМиБ, доктор биологических наук, профессор.
Джамбулатов Зайдин
Магомедович - начальник комитета ветеринарии Республики Дагестан, кандидат
ветеринарных наук.
Белоусов Василий Иванович
- начальник отдела ветсанэкспертизы и лабораторной диагностики Департамента
ветеринарии Минсельхоза России, доктор ветеринарных наук, профессор.
Калмыков Михаил Викторович
- директор ФГУ «Центральная научно-методическая ветеринарная лаборатория» (ФГУ
ЦНМВЛ), кандидат биологических наук.
Таранова Людмила Алексеевна
- заведующая отделом диагностики бактериальных инфекций ФГУ ЦНМВЛ, кандидат
ветеринарных наук.








