Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы ускоренного определения
бактерий рода Campylobacter
в пищевой продукции и оценка
их антибиотикорезистентности
Методические указания
МУ 4.2.3545-18
Москва 2019
1. Разработаны Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека; ФГБУН «ФИЦ питания и биотехнологии» (С.А. Шевелева, Н.Р. Ефимочкина, Л.П. Минаева, В.В. Стеценко, И.Б. Быкова, Т.В. Пичугина, Ю.М. Маркова, Ю.В. Короткевич, А.С. Полянина, А.И. Алешкина).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 25 декабря 2018 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы ______________________ А.Ю. Попова 25 декабря 2018 г. |
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Методы ускоренного определения бактерий
рода Campylobacter в пищевой продукции и
оценка их антибиотикорезистентности
Методические указания
МУ 4.2.3545-18
I. Общие положения и область применения
1.1. Настоящие методические указания по методам контроля (далее - МУК) устанавливают ускоренные методы определения термофильных бактерий рода Campylobacter в пищевых продуктах и смывах с объектов окружающей среды, а также порядок проведения микробиологического контроля на наличие бактерий рода Campylobacter на предприятиях птицеперерабатывающей промышленности.
МУК носят рекомендательный характер.
1.2. В группу термофильных бактерий рода Campylobacter с оптимальной температурой роста +42 °С входят возбудители кампилобактериоза С. jejuni ssp. jejuni, С. jejuni ssp. doylei, C. coli, C. lari, C. upsaliensis и C. helveticus, обладающие способностью инфицировать человека и теплокровных животных. Наибольшую эпидемиологическую значимость представляют С. jejuni, которые обусловливают основную часть случаев кампилобактериоза.
1.3. МУК устанавливают методы оценки чувствительности к антимикробным препаратам термофильных бактерий рода Campylobacter, выделенных из пищевой продукции и смывов с объектов окружающей среды предприятий птицеперерабатывающей промышленности, для целей мониторинга антибиотикорезистентных возбудителей кампилобактериоза и разработки мер ограничения их циркуляции.
1.4. МУК предназначены для органов и организаций Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, осуществляющих контроль безопасности пищевой продукции, в том числе импортируемой в Российскую Федерацию, для проведения производственного контроля на предприятиях птицеперерабатывающей промышленности, для лабораторной диагностики зараженности кампилобактериями пищевой продукции при расследовании вспышек заболеваний с пищевым путем передачи, а также могут использоваться другими лабораторными центрами (лабораториями), осуществляющими производственный контроль основного и вспомогательного сырья, производственных процессов, контроль безопасности пищевой продукции в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения1.
1.5. МУК распространяются на пищевую продукцию и смывы с объектов окружающей среды на предприятиях птицеперерабатывающей промышленности, подлежащие исследованиям на наличие термофильных бактерий рода Campylobacter, для оценки санитарно-технического состояния производства и эффективности проводимых санитарно-противоэпидемических (профилактических) мероприятий, а также в рамках федерального государственного санитарно-эпидемиологического надзора (контроля) - для целей мониторинга заболеваемости населения кампилобактериозом с пищевым путем передачи.
________
1 Статья 40 Федерального закона от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения»; постановление Правительства Российской Федерации от 16.04.2012 № 317 «О лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах».
1.6. МУК применяются для исследования продуктов убоя птицы, продукции ее переработки, полуфабрикатов из птицы; смывов с оборудования и инвентаря, контактных поверхностей в производственных, складских, моечных помещениях, с рук и санитарной одежды персонала, с тары и упаковки для пищевой продукции.
II. Основные методы
2.1. МУК устанавливают ускоренные методы определения термофильных бактерий рода Campylobacter в пищевой продукции и смывах на основе:
- бактериологического анализа (качественного и количественного, с идентификацией до рода);
- фермент-связанного флуоресцентного иммуноанализа (качественного недифференцированного суммарного определения бактерий видов С. jejuni, С. coli, С. lari);
- ПЦР-анализа с гибридизационно-флуоресцентной детекцией.
Применение указанных МУК позволяет сократить время анализа в сравнении со стандартными методами на 3 - 4 суток.
2.2. Бактериологический (культуральный) метод определения бактерий рода Campylobacter в пищевой продукции предусматривает посев определенных количеств продукта в жидкие селективные среды, содержащие антибиотики и аэротолерантные добавки, с последующим пересевом на поверхность агаризованных селективных сред, инкубирование посевов, выявление в этих посевах бактерий, способных расти и образовывать типичные колонии на поверхности селективного агара, с последующим выделением чистой культуры. Все этапы инкубации посевов осуществляются в микроаэрофильных условиях. Идентификация чистых культур проводится по совокупности культуральных, морфологических и биохимических признаков, определяющих принадлежность к бактериям рода Campylobacter.
2.3. Бактериологический (культуральный) метод определения бактерий рода Campylobacter в смывах с объектов окружающей среды предусматривает комплексный анализ трех проб в исследуемой зоне (3×100 см2) с применением трех видов сред для накопления и транспортирования, с последующими пересевами на поверхность агаровых дифференциально-диагностических сред.
2.4. Метод фермент-связанного флуоресцентного иммуноанализа бактерий рода Campylobacter основан на связывании бактериальных антигенов, находящихся в бульоне обогащения, с антителами, адсорбированными на внутренней поверхности пипетирующего устройства (твердая фаза), последующем удалении (отмывке) несвязанных компонентов, добавлении антител, меченых щелочной фосфатазой, к адсорбированному комплексу антиген-антитело и флуоресцентно-меченого субстрата, и измерении флуоресценции продукта гидролиза флуоресцентномеченого субстрата (4-метил-умбелиферилфосфата), который катализируется щелочной фосфатазой. Интенсивность флуоресценции измеряется при длине волны 450 нм.
2.5. Метод детекции термофильных бактерий рода Campylobacter на основе ПЦР предусматривает высев определенных количеств исследуемых проб пищевых продуктов или смывов в селективные питательные среды, инкубирование посевов, экстракцию ДНК из культуральной жидкости, амплификацию участка ДНК со специфичными праймерами и постановку ПЦР с гибридизационно-флуоресцентной детекцией ампликонов в режиме реального времени.
2.6. Оценку антибиотикочувствительности штаммов термофильных кампилобактерий, выделенных из пищевой продукции или объектов окружающей среды, проводят диско-диффузионным методом, с использованием дисков с антибиотиками и измерением зон ингибирования роста исследуемой культуры. При необходимости определяют минимальную концентрацию антибиотика, подавляющую рост штамма (МИК, минимальная ингибирующая концентрация) методом серийных разведений в планшете или с применением Е-тестов, представляющих собой модифицированный вариант диффузионного метода тестирования с применением полосок, пропитанных убывающими концентрациями антибиотиков.
III. Средства измерения, оборудование и реактивы
3.1. Оборудование и средства измерений
|
Анализатор потенциометрический с диапазоном измерения pH от 3,0 до 8,0 с точностью ±0,01 ед. pH при температуре +25 °С |
|
|
Баня водяная с терморегулятором, позволяющая поддерживать температуру от 0 до 100 °С |
|
|
Бокс абактериальной воздушной среды (ПЦР-бокс) или ламинарный шкаф класса биологической безопасности II тип А |
|
|
Весы лабораторные общего назначения, 2 класса точности, с наибольшим пределом взвешивания 1000 г |
|
|
Встряхиватель вибрационный типа «Вортекс» со скоростью вращения до 3000 об./мин |
|
|
Денситометр для бактериальных суспензий, калиброванный по стандартам мутности |
|
|
МакФарланда |
|
|
Дистиллятор, обеспечивающий качество дистиллированной воды, соответствующей |
|
|
Дозаторы пипеточные автоматические с переменным объемом дозирования от 0,1 мм3 до 1000 мм3 с точностью ±0,8 % |
|
|
Гомогенизатор бактериологический перистальтического типа |
|
|
Инкубаторы-анаэростаты, СО2-иикубаторы или другие устройства, создающие анаэробные/микроаэрофильные условия культивирования |
|
|
Микроскоп биологический бинокулярный с увеличением 900× - 1000× с иммерсионной системой |
|
|
Микроцентрифуга настольная типа эппендорф (частота вращения не менее 13000 мин-1) |
|
|
Камера морозильная, обеспечивающая температуру не выше минус 20 °С |
|
|
Камера морозильная, обеспечивающая температуру не выше минус 70 °С, для хранения выделенных культур кампилобактерий |
|
|
Насос вакуумный (водоструйный) |
|
|
Облучатель бактерицидный настенный с мощностью бактерицидных ламп 30 Вт и производительностью (95 % обеззараживания) не менее 300 м3/ч. |
|
|
Автоматический ИФА-анализатор для фермент-связанного флуоресцентного иммуноанализа |
|
|
Амплификатор программируемый для проведения качественного и количественного анализа ДНК методом полимеразной реакции в режиме «реального времени» и «по конечной точке», с использованием различных комбинаций реагентов - флуорофоров и с возможностью регистрации флуоресцентного сигнала не менее чем по четырем каналам |
|
|
Системы экстракции ДНК/РНК роботизированные |
|
|
Стерилизатор паровой медицинский (автоклав) |
|
|
Термостат твердотельный для пробирок типа эппендорф вместимостью 1,5 см3, диапазон температур от 25 до 100 °С |
|
|
Термостат электрический суховоздушный с диапазоном рабочих температур от 20 до 60 °С и отклонением от заданной температуры не более ±1 °С |
|
|
Холодильник с температурой от 2 до 8 °С с морозильной камерой не выше минус 16 °С для хранения выделенных проб ДНК |
|
|
Часы механические сигнальные |
ГОСТ 14919 |
|
Шкаф сушильно-стерилизационный, позволяющий поддерживать температуру в диапазоне от 50 до 200 °С с погрешностью ±2 °С |
|
3.2. Лабораторная посуда и материалы
|
Бумага фильтровальная лабораторная |
|
|
Вата медицинская гигроскопическая |
|
|
Зонд-тампоны для отбора, транспортировки и хранения биологических проб в комплекте с пробиркой стерильные |
|
|
Колбы стеклянные плоскодонные конические или круглые различной вместимости |
|
|
Контейнеры стерильные из полимерных материалов с крышками для отбора проб |
|
|
Марля медицинская |
|
|
Микропробирки для ПЦР стерильные тонкостенные 0,2 см3 (плоская крышка, коническое дно) - для амплификаторов с детекцией через дно пробирки; 0,2 см3 (куполообразная крышка) - для амплификаторов с детекцией через крышку |
|
|
Наконечники одноразовые с фильтром для дозаторов с переменным объемом дозирования от 0,1 мм3 до 1000 мм3 |
|
|
Ножницы медицинские |
|
|
Оптические стандарты МакФарланда № 1, 2, 3 |
|
|
Пакеты полимерные для стерилизации лабораторных принадлежностей и обеззараживания отходов |
|
|
Пакеты бумажные для стерилизации лабораторных принадлежностей |
|
|
Пакеты газогенераторные для кампилобактерий |
|
|
Пакеты полимерные |
|
|
Ножницы медицинские |
|
|
Петли бактериологические калиброванные на 1 мм3 |
|
|
Пергамент |
|
|
Пипетки градуированные вместимостью 1, 2, 5 и 10 см3 |
|
|
Пробирки типа эппендорф вместимостью 0,5 см3 и 1,5 см3 |
|
|
Пробки силиконовые, целлюлозные, ватно-марлевые для стеклянных колб, флаконов, пробирок |
|
|
Планшеты иммунологические 96-луночные стерильные |
|
|
Пробирки центрифужные конические стерильные вместимостью 15 см3 и 50 см3 |
|
|
Пробирки стеклянные типов П1, П2 |
|
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С (цена деления шкалы 1 °С) |
|
|
Термоконтейнер (сумка-холодильник) |
|
|
Флаконы и колбы стеклянные вместимостью 250 см3, 500 см3, 1000 см3, 2000 см3 |
|
|
Халаты, шапочки, маски, бахилы одноразовые, перчатки резиновые или латексные неопудрнные |
|
|
Чашки биологические (Петри) стеклянные или одноразовые из полимерных материалов диаметром 90 мм или 100 мм |
3.3. Реактивы, питательные среды, дезинфицирующие средства
3.3.1. Реагенты для ПЦР и иммуноанализа
Иммунохроматографические тесты для выявления Campylobacter spp.
Комплекты реагентов (наборы) для выделения ДНК/РНК из пищевой продукции.
Комплекты реагентов для роботизированных систем экстракции ДНК/РНК (силика магнитная, буфер лизирующий, буферы для экстракции) Комплекты реагентов (наборы) для проведения ПЦР с гибридизационно-флуоресцентной детекцией, обеспечивающие аналитическую чувствительность на уровне 1×103 ГЭ/см3 в отношении выявляемых фрагментов ДНК бактерий Campylobacter spp., содержащие: смеси олигонуклеотидных праймеров на участки ДНК бактерий и флуоресцентномеченых олигонуклеотидных зондов, комплементарных участкам амплифицируемых ДНК-мишеней; полимеразу (TaqF), смесь буфера и нуклеозидтрифосфатов, ДНК-буфер, положительные контрольные образцы этапа ПЦР со специфическими фрагментами ДНК искомых микроорганизмов и внутренним контрольным образцом, отрицательный контрольный образец и внутренний неконкурентный контрольный образец этапа выделения, минеральное масло для ПЦР
Наборы реагентов для определения бактерий рода Campylobacter методом фермент-связанного флуоресцентного иммуноанализа по методическим указаниям2.
________
2 МУК 4.2.2321-08 «Методы определения бактерий рода Campylobacter в пищевых продуктах», утвержденные Роспотребнадзором 24.01.2008, с изменениями МУК 4.2.2878-11 «Дополнения и изменения № 1 к МУК 4.2.2321-08 «Методы определения бактерий рода Campylobacter в пищевых продуктах», утвержденным Роспотребнадзором 24.06.2011 (далее - МУК 4.2.2321-08).
3.3.2.
Реактивы, питательные среды
для селективного обогащения
микроорганизмов и их компоненты
|
Агар микробиологический |
|
|
Агар |
|
|
Мюллера-Хинтона |
|
|
Амфотерицин |
|
|
Ацетон |
|
|
Добавка ростовая аэротолерантная на основе натрия пировинограднокислого, железа (II) сернокислого, натрия метабисульфита для кампилобактерий в соответствии с методическими указаниями |
|
|
Бульон Престона для накопления кампилобактерий |
|
|
Бульон для бруцелл |
|
|
Вода дистиллированная |
|
|
Гидролизат казеина ферментативный |
|
|
Диски с антибиотиками: эритромицином, гентамицином, ципрофлоксацином, налидиксовой кислотой, амикацином, тетрациклином, доксициклином, клиндамицином, хлорамфениколом (при необходимости могут быть использованы диски с другими антибиотиками) |
|
|
Добавки селективные антибиотиков для кампилобактерий, модифицированные |
|
|
Железо (II) сернокислое |
|
|
Калий фосфорнокислый однозамещенный |
|
|
Кампилобакагар |
ТУ 9398-057-7895326-2007 |
|
Кислота соляная |
|
|
Колумбийский кровяной агар (основа) |
|
|
Кристалвиолет |
|
|
Кровь дефибринированная для питательных сред, стерильная |
|
|
Мультимикротесты для биохимической идентификации Campylobacter spp. |
|
|
Набор реагентов для окраски по Граму |
|
|
Натрий хлористый |
|
|
Натрий фосфорнокислый однозамещенный безводный |
|
|
Натрий фосфорнокислый двузамещенный безводный |
|
|
Натрия гидросульфит |
|
|
Натрия гидроокись |
|
|
Натрия гидроокись |
|
|
Натрий метабисульфит |
|
|
Пептон мясной ферментативный |
|
|
Пептон соевый |
|
|
Полимиксин В сульфат |
|
|
Рифампицин |
|
|
Сафранин |
|
|
Стандарт мутности |
|
|
МакФарланда 0,5 ед. |
|
|
Тест-системы для определения минимальных ингибирующих концентраций антибиотика3 (например, Е-тесты, MIC Tests, Sensititre Сатруи) |
|
|
Транспортная среда Кэрри-Блера |
|
|
Трафарет для отбора смывов площадью 100 см2 |
|
|
Трехсахарный железосодержащий агар (на основе сред № 13, Клиглера, Олькеницкого) |
|
|
Экстракт дрожжевой сухой L-цистеина гидрохлорид |
|
________
3 Примечание: Допускается использование тест-систем с аналогичными или лучшими характеристиками.
Приготовление и контроль качества питательных сред осуществляют в соответствии с ГОСТ ISO 11133-2016.
Контрольные тест-штаммы бактерий Campylobacter jejuni, С. coli, С. lari, типичные по культуральным, морфологическим и биохимическим свойствам
Тест-штаммы должны быть снабжены «Паспортом штамма», выданным национальной или международной коллекцией микроорганизмов, видовая принадлежность контрольных штаммов должна быть подтверждена с использованием биохимических и генотипических методов.
Тест-штаммы необходимо сохранять в лиофильно высушенном виде. При регулярном использовании допускается сохранять в полужидком агаре для бруцелл или в полужидкой среде по п. 4.3.12, в пробирках с плотно притертыми пробками, в защищенном от света месте, при температуре (5 ± 1) °С с еженедельным пересевом, или замораживать при температуре (-70 ± 2) °С, хранение в течение 2 - 3 мес.
3.3.4. Дезинфицирующие средства Спирт этиловый ректификованный ГОСТ 5962-2013
Средства дезинфицирующие на основе трихлоризоциануровой кислоты, натриевой соли дихлоризоциануровой кислоты.
Допускается использование других средств измерений с метрологическими характеристиками, вспомогательного оборудования с техническими характеристиками не хуже указанных в настоящем стандарте. Допускается использование других реактивов по качеству и чистоте не ниже вышеуказанных.
IV. Подготовка к проведению испытаний
4.1. Приготовление растворов и реактивов
4.1.1. Изотонический 0,85 % водный раствор натрия хлорида готовят в соответствии с ГОСТ 10444.1-84.
4.1.2. Растворы и реактивы для окраски микроскопических препаратов по Граму, растворы гидроокиси натрия и соляной кислоты готовят в соответствии с инструкциями изготовителя или по ГОСТ 10444.1-84.
4.1.3. Фосфатно-буферный раствор (далее - ФБР).
Приготовление концентрированного раствора: (34 ± 0,4) г однозамещенного фосфорнокислого калия (KН2РO4) растворяют в 500,0 - 700,0 см3 дистиллированной воды в мерной колбе вместимостью 1000 см3 по ГОСТ 1770-74. Активную кислотность раствора (7,2 ± 0,1) ед. pH устанавливают добавлением 1 Н раствора гидроокиси натрия и доводят дистиллированной водой до 1000,0 см3. Полученный раствор хранят в емкости, укупоренной резиновой пробкой, в условиях холодильника не более 30 сут.
Приготовление разбавленного раствора: 1,25 см3 концентрированного раствора вносят пипеткой в мерную колбу вместимостью 1000 см3 по ГОСТ 1770-74 и доводят объем дистиллированной водой до метки, проверяют активную кислотность, которая должна составлять (7,1 ± 0,1) ед. pH.
ФБР разливают по 9,0 см3 в пробирки, по 90,0 см3 в колбы вместимостью 250 см3 по ГОСТ 1770, и по 900,0 см3 в колбы вместимостью 2000 см3 по ГОСТ 1770, закрывают ватными пробками. Стерилизуют в автоклаве при (121 ± 1) °С в течение (20 ± 1) мин.
4.1.4. При добавлении к 1 дм3 ФБР натрия хлорида в количестве 9 г до стерилизации получают фосфатный буферный 0,9 % раствор NaCl.
4.1.5. Аэротолерантная (ростовая) добавка.
Аэротолерантную добавку готовят по следующему порядку:
- натрий пировинограднокислый - 6,25 г;
- железо (II) сернокислое - 6,25 г;
- натрий метабисульфит - 6,25 г;
- стерильная дистиллированная вода - 100 см3.
Натрий пировинограднокислый растворяют в 10 - 20 см3 стерильной дистиллированной воды, добавляют железо (II) сернокислое и натрия метабисульфит, доводят объем раствора до 100 см3. Разливают в пробирки по 4 см. Хранят в защищенном от света месте при температуре минус 20 °С не более 1 мес. Раствор чрезвычайно чувствителен к воздействию света, после его добавления к питательным средам их необходимо сохранять в защищенном от света месте.
4.2. Подготовка посуды и материалов
Вымытую посуду стерилизуют в сушильном шкафу при (160 ± 5) °С в течение 2 ч или в паровом стерилизаторе (автоклаве) при (121 ± 1) °С в течение (30 ± 1)мин с последующим подсушиванием в стерилизационном сушильном шкафу.
Чашки Петри и пипетки стерилизуют завернутыми в плотную оберточную бумагу или в пеналах. В верхнюю часть пипетки предварительно вкладывают кусочек ваты.
Пробирки, флаконы, бутылки, колбы закрывают ватно-марлевыми пробками. Поверх пробки (кроме пробирок) надевают бумажный колпачок, который обвязывают вокруг горлышка ниткой или закрепляют резиновым колечком.
Каучуковые, корковые и стеклянные пробки стерилизуют в автоклаве упакованными в бумагу.
Стерильную посуду хранят в плотно закрывающихся шкафах или ящиках с крышками. Срок хранения стерильной посуды - не более 30 суток при ненарушенной упаковке или в невскрытых пеналах.
Перед применением одноразовых наконечников с фильтром для дозаторов и чашек Петри одноразовых необходимо проверить герметичность их упаковки.
4.3. Приготовление питательных сред
4.3.1. Приготовление и контроль качества питательных сред осуществляют в соответствии с ГОСТ ISO 11133-2016 согласно инструкции изготовителя. Допускается применение сред лабораторного приготовления из отдельных компонентов.
4.3.2. Селективный бульон Престона готовят в соответствии с порядком, изложенным в МУК 4.2.2321-08.
4.3.3. Жидкая селективная среда для накопления кампилобактерий.
Жидкую селективную среду для накопления кампилобактерий готовят в соответствии со следующим порядком:
Основа среды (г/дм3):
Пептон мясной ферментативный 12,0
Гидролизат казеина 10,0
Дрожжевой экстракт 2,0
Натрия хлорид 5,0
Натрий пировинограднокислый 0,25
Натрия метабисульфит 0,25
Железо сернокислое (II) 0,25
L-цистеина гидрохлорид 0,1
Натрий фосфорнокислый двузамещенный 12-водный 8,75
Калий фосфорнокислый однозамещенный 1,4
Компоненты среды растворяют в 1000 см3 дистиллированной воды, при наличии осадка фильтруют через ватно-марлевый фильтр, устанавливают pH (7,0 ± 0,1); разливают в пробирки, флаконы или другие емкости, стерилизуют автоклавированием 15 мин при 121 °С. Стерильную основу среды охлаждают до температуры 45 - 50 °С и асептически вносят в нее кровь стерильную дефибринированную в количестве 50 см3, антибиотики - полимиксин В сульфат (5000Е), рифампицин (10 мг) и амфотерицин (10 мг).
Готовая среда должна быть прозрачной, светло-соломенного цвета, после добавления крови - темно-красного цвета. Готовую к применению питательную среду хранят при 2 - 8 °С не более 5 дней.
4.3.4. Селективный агар Престона готовят в соответствии с порядком, изложенным в МУК 4.2.2321-08.
4.3.5. Дифференциально-диагностический агар для выделения и количественного учета Campylobacter spp. (далее - ДДА Campy).
Среду ДДА Campy готовят в соответствии со следующим порядком:
Основа среды (г/дм3):
Пептон мясной ферментативный 15,0
Пептон соевый ферментативный 8,0
D-глюкоза 5,0
Агар микробиологический 15,0
Натрия хлорид 5,0
Натрий пировинограднокислый 0,25
Натрия метабисульфит 0,25
Железо сернокислое (II) 0,25
Натрий углекислый 0,5
Аскорбиновая кислота 0,75
Компоненты среды растворяют в 1000 см3 дистиллированной воды, нагревают до полного расплавления агара, при наличии осадка фильтруют через ватно-марлевый фильтр, устанавливают pH (7,0 ± 0,1); разливают в пробирки, флаконы или другие емкости, стерилизуют автоклавированием 15 мин при 121 °С. В стерильную основу среды, охлажденную до температуры 45 - 50 °С, вносят асептически кровь стерильную дефибринированную в количестве 50 см3, антибиотики - полимиксина В сульфат (5000Е), рифампицин (10 мг) и амфотерицин (10 мг).
Кампилобакагар готовят из сухой среды в соответствии с инструкцией изготовителя.
4.3.7. Колумбийский кровяной агар.
Колумбийский кровяной агар готовят из сухой среды в соответствии с инструкцией изготовителя. К охлажденной до 45 - 50 °С стерилизованной среде асептически добавляют 70 см3 стерильной дефибринированной крови, тщательно перемешивают и разливают в стерильные чашки Петри слоем толщиной 5 см.
4.3.8. Бульон для бруцелл.
Бульон для бруцелл готовят из сухой среды в соответствии с инструкцией изготовителя.
4.3.9. Транспортная среда Кэрри-Блера. Используют готовую жидкую среду в пробирках промышленного производства, или готовят из сухой среды в соответствии с инструкцией изготовителя.
Агар Мюллера-Хинтона готовят из сухой среды в соответствии с инструкцией изготовителя. К охлажденной до 45 - 50 °С стерилизованной среде асептически добавляют 70 см3 стерильной дефибринированной крови, тщательно перемешивают и разливают в стерильные чашки Петри слоем толщиной 5 см.
4.3.11. Трехсахарный железосодержащий агар (на основе сред № 13, Клиглера, Олькеницкого).
Готовят из соответствующих сред промышленного изготовления согласно инструкций изготовителя.
4.3.12. Полужидкий питательный агар для криохранения культур Campylobacter spp.
Полужидкий питательный агар для криохранения культур Campylobacter spp. готовят в соответствии со следующим порядком:
Основа среды (г/дм3):
Пептон мясной ферментативный 11,0
Гидролизат казеина 10,0
Дрожжевой экстракт 2,0
Агар микробиологический 1,25
Натрия хлорид 5,0
Натрий пировинограднокислый 0,25
Натрия метабисульфит 0,25
Железо сернокислое(II) 0,25
Компоненты среды растворяют в 1000 см3 дистиллированной воды, нагревают до полного расплавления агара, при наличии осадка фильтруют через ватно-марлевый фильтр, устанавливают pH (7,0 ± 0,1); разливают в пробирки, флаконы или другие емкости, стерилизуют автоклавированием 15 мин при 121 °С. Стерильную среду инокулируют культурой Campylobacter spp, инкубируют посевы в течение (48 ± 2) ч в микроаэрофильных условиях (N2 - 85 %, СO2 - 10 %, O2 - 5 %) при температуре (41,5 ± 0,5) °С, после чего к инокулированной среде добавляют стерильный глицерин в соотношении 15:85, перемешивают и хранят в холодильнике или замораживают при температуре (-70 ± 2) °С.
V. Создание микроаэрофильных условий культивирования
5.1. Оптимальная газовая среда для культивирования бактерий рода Campylobacter имеет состав: двуокись углерода (СO2) - 10 %, кислород (O2) - 5 %, азот (N) - 85 %.
Посевы помещают в контейнеры для анаэробного культивирования определенного объема, в анаэростат или в стерильные газонепроницаемые пакеты, куда вкладывают газогенераторные пакеты для кампилобактерий. Газогенераторные пакеты рассчитаны на определенный объем анаэростата (газонепроницаемых систем настольных), что необходимо учитывать при их применении. Инкубирование посевов проводят при температуре (42,0 ± 0,5) °С.
Культивирование посевов допускается осуществлять непосредственно в анаэробном инкубаторе или СO2-инкубаторе, позволяющем поддерживать температуру (42 ± 1) °С и оптимальный состав газовой среды.
VI. Отбор и подготовка проб для анализа
6.1. Отбор и подготовка проб пищевой продукции для анализа
Отбор и подготовку проб продукции производят в соответствии с МУК 4.2.2321-08, ГОСТ 31904-2012, ГОСТ 26669-85, ГОСТ ISO 7218-2015, ГОСТ Р 50396.0-2013, ГОСТ Р 51447-99.
Масса или объем отбираемых проб должны быть достаточными для проведения исследования и минимально вдвое превышать размер аналитического(их) образца(ов).
Учитывая, что кампилобактерии очень чувствительны к воздействию факторов окружающей среды, - таких как воздействие кислорода, высушивание, снижение pH, нагревание, УФ-излучение и длительное хранение в аэробных условиях, при отборе проб пищевых продуктов на наличие бактерий рода Campylobacter необходимо соблюдать следующие правила:
- отбор проб и их доставку в лабораторию для исследования проводят в максимально короткие сроки, по возможности не более 1 часа;
- отбор проб твердых пищевых продуктов осуществляют в стерильные газонепроницаемые пакеты, удаляют избыток воздуха, герметизируют путем перекручивания свободных краев пакета и фиксации при помощи обхвата, пробы жидких продуктов отбирают в герметично закрывающуюся стерильную стеклянную посуду;
- отбор проб расфасованной пищевой продукции осуществляют в оригинальной упаковке, не допуская нарушений ее целостности;
- доставку проб в лабораторию осуществляют в термоконтейнере с охлаждающими вкладышами (в сумке-холодильнике);
- до проведения анализа пробы сохраняют в защищенном от света месте, при температуре (5 ± 1) °С, пробы замороженных продуктов размораживают в защищенном от света месте при температуре (5 ± 1) °С в течение не более 18 часов или в течение 1 часа при температуре (19 ± 1) °С;
- после вскрытия упаковки пробы подвергают исследованию немедленно, приготовление объединенной пробы, навесок продукта и посев осуществляют в максимально короткие сроки. Для приготовления объединенной пробы продукт измельчают, не допуская активного перемешивания пробы во избежание воздействия кислорода.
6.2. Взятие смывов
6.2.1. При проведении контроля на загрязненность возбудителями кампилобактериоза проводят отбор и анализ смывов с поверхностей оборудования, инвентаря, рук и одежды персонала.
6.2.2. Производственный контроль эффективности мер, направленных на предотвращение перекрестной контаминации кампилобактериями на предприятиях птицеперерабатывающей промышленности, осуществляется в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения4, с учетом порядка и периодичности контроля санитарного состояния предприятий на патогенные микроорганизмы, в том числе сальмонеллы.
Требования к организации работ по производственному контролю в целях профилактики кампилобактериоза установлены в санитарно-эпидемиологическими правилами5.
Ориентировочная частота проведения анализа смывов на наличие кампилобактерий для оценки санитарного состояния конкретного предприятия представлена в табл. 1.
Отбор смывов производится после санитарной обработки, перед началом работы оборудования. При обнаружении бактерий рода Campylobacter в смывах периодичность контроля на соответствующем участке увеличивают в 2 раза.
________
4 Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения»; санитарные правила СП 1.1.1058-01 «Организация и проведение производственного контроля за соблюдением Санитарных правил и выполнением санитарно-противоэпидемических (профилактических) мероприятий», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 13.07.2001 № 18 (зарегистрировано Минюстом России 30.10.2001, регистрационный номер 3000), с изменениями, внесенными постановлением Главного государственного санитарного врача Российской Федерации от 27.03.2007 № 13 (зарегистрировано Минюстом России 26.04.2007, регистрационный номер 9357); санитарно-эпидемиологические правила СП 3.1.7.2816-10 «Профилактика кампилобактериоза среди людей», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 29.12.2010 № 188 (зарегистрировано Минюстом России 14.03.2011, регистрационный номер 20085) (далее - СП 3.1.7.2816-10 от 29.12.2010 № 188).
5 Санитарно-эпидемиологические правила СП 3.1.7.2816-10 «Профилактика кампилобактериоза среди людей», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 29.12.2010 № 188 (зарегистрировано Минюстом России 14.03.2011, регистрационный номер 20085) (далее - СП 3.1.7.2816-10 от 29.12.2010 № 188).
Рекомендуемый порядок взятия смывов на предприятиях
птицеперерабатывающей промышленности
|
Объекты контроля |
Периодичность контроля |
|
|
Цеха убоя, первичной переработки мяса и птицы |
Крупное оборудование, включая конвейеры, поверхности столов, ванны охлаждения |
Не реже 1 раза в две недели, не менее 5 проб |
|
Мелкое оборудование и инвентарь (выборочно, с чередованием единиц оборудования |
Не реже 1 раза в две недели, не менее 5 проб |
|
|
Цеха производства сырых полуфабрикатов из мяса и птицы |
Крупное оборудование |
Не реже 1 раза в месяц, не менее 3 проб |
|
Мелкое оборудование и инвентарь (выборочно, с чередованием единиц оборудования |
Не реже 2 раз в месяц, не менее 3 проб |
|
|
Цеха упаковки |
Тара, упаковочное оборудование, поверхности, контактирующие с продукцией |
Не реже 2 раз в квартал, не менее 3 проб |
|
Руки персонала, одежда |
у работников, соприкасающихся с продукцией, в середине и в конце смены |
Не реже 2 раз в квартал, не менее 5 проб |
6.2.3. При обнаружении термофильных кампилобактерий в смывах с технологического оборудования, инвентаря убойных, яйцеобрабатывающих цехов проводят внеочередную тщательную механическую и санитарную обработку, дезинфекцию оборудования, включая холодильные камеры. При последующем контроле за проведенными мероприятиями термофильные кампилобактерии в смывах не должны обнаруживаться.
6.2.4. Для взятия смывов используют зонд-тампоны стерильные в комплекте с пробирками. Предварительно в промаркированные пробирки асептически вносят по 5 см3 стерильных жидких сред по п. 4.3 - бульон Престона с кровью, бульон для бруцелл, среду Кэрри-Блера.
Пробы смывов в исследуемой зоне отбирают трижды, с участка площадью 100 см3 для каждого тампона, используя стерильный трафарет из металла 10×10 см. Трафарет фламбируют перед каждым употреблением. Смывы с мелкого оборудования берут со всей поверхности. После взятия смыва каждый зонд-тампон быстро погружают в пробирку с соответствующей средой, избегая встряхивания. Полученные пробы помещают в стерильный газонепроницаемый пакет, вкладывают газогенераторный пакет для кампилобактерий и герметично запаковывают. Доставку проб в лабораторию для исследования проводят в максимально короткие сроки.
VII. Проведение анализа
7.1. Проведение анализа бактериологическим
(культуральным)
методом
7.1.1. Посев и культивирование проб пищевой продукции
Для определения наличия или отсутствия термофильных бактерий рода Campylobacter подготовленные пробы продуктов в количестве 10 г (см3) или 25 г (см3) вносят в 9-кратный объем одной из жидких сред по п. 4.3.2 или 4.3.3. Инокулированную среду инкубируют в течение 4 часов при 37 °С. В случае посевов замороженных продуктов или продуктов, которые хранились более 10 дней, - в течение 3 часов при температуре 32 °С, потом 2 часов - при температуре 37 °С. Затем все посевы продолжают инкубировать в течение 18 часов при температуре 42 °С. После этого делают пересев петлей на поверхность одной из дифференциально-диагностических сред по п. 4.3.4, 4.3.5, 4.3.6 и вновь инкубируют при температуре 42 °С в течение 18 - 24 часов. Инкубация на всех этапах осуществляется в микроаэрофильных условиях.
Количественный анализ проб проводят методом наиболее вероятного числа (НВЧ) в соответствии со схемой, приведенной в МУК 4.2.2321-08. Для этого от каждой исследуемой пробы засевают в жидкую среду не менее трех масс (объемов) продукта в трехкратной повторности: 10 г (см3)×3; 1 г (см3)×3; 0,1 г (см3)×3; а при необходимости - четвертую в количестве 0,01 г (см3)×3 раза.
7.1.2. Идентификация выделенных культур
Кампилобактерии при росте в микроаэрофильных условиях на поверхности селективного агара образуют мелкие округлые колонии или колонии средних размеров, неправильной формы, как бы растекающиеся по ходу штриха, серые или полупрозрачные с сероватым оттенком, гладкие, влажные, блестящие.
Отбирают не менее 3 типичных или подозрительных на принадлежность к Campylobacter spp. изолированных колоний, пересевают на поверхность кровяного колумбийского агара по п. 4.3.7 и инкубируют в течение 18 - 20 ч в микроаэрофильных условиях.
Выросшие культуры окрашивают по Граму и микроскопируют, определяют наличие оксидазы и каталазы.
Бактерии рода Campylobacter - грамотрицательные мелкие, тонкие палочки с одним или более завитками. В мазке имеют вид запятой, буквы S, либо галочки при соединении двух клеток.
Тест на оксидазу. Полоску фильтровальной бумаги смачивают 2 - 3 каплями оксидазного реагента. На обработанную реактивом полоску платиновой петлей наносят исследуемую культуру. При появлении сиреневой, фиолетовой или глубокой синей окраски в течение 10 секунд реакцию считают положительной. Допускается применение бумажных дисков/полосок промышленного производства. Бактерии рода Campylobacter оксидазоположительны.
Тест на каталазу. В каплю 3 % раствора перекиси водорода на чистом предметном стекле вносят петлю исследуемой культуры. Появление пузырьков воздуха свидетельствует о положительной реакции. Термофильные бактерии рода Campylobacter каталазаположительны, за исключением редко встречающегося вида С. upsaliensis.
При обнаружении роста на агаровой селективной среде колоний с типичными культуральными свойствами, в которых обнаруживаются клетки с типичной для кампилобактерий морфологией, обладающие ферментами каталазой и оксидазой, делают вывод об обнаружении термотолерантных бактерий рода Campylobacter.
В качестве дополнительного подтверждающего теста принадлежности выделенной культуры к термофильным кампилобактериям допускается использовать иммунохроматографические тесты для детекции Campylobacter spp. промышленного изготовления, в соответствии с инструкцией изготовителя.
При необходимости определения видовой принадлежности выделенных культур исследования проводят в соответствии с процедурой, изложенной в МУК 4.2.2321-08. Допускается применение мультимикротестов/микрообъемных тест-систем для биохимической идентификации кампилобактерий промышленного изготовления, анализ проводят в соответствии с инструкцией изготовителя.
При необходимости резервирования культур, в том числе для последующей оценки их антибиотикочувствительности, штаммы кампилобактерий пересевают с поверхности кровяного агара в полужидкую среду для криохранения по п. 4.3.12. Культуры хранят в холодильнике не более 5 суток или замораживают при температуре (-70 ± 2) °С и хранят не более 3 месяцев.
7.1.3. Посев и культивирование смывов
Пробы инокулированных смывами сред, подготовленных по п. 6.2, не открывая герметично закрытый пакет, помещают в термостат и инкубируют в течение 18 часов при температуре 42 °С. После этого из каждой жидкой среды делают пересев петлей на поверхность одной из дифференциально-диагностических сред по п. 4.3.4, 4.3.5, 4.3.6, посевы инкубируют при температуре 42 °С в течение 18 - 24 часов. Инкубация на всех этапах осуществляется в микроаэрофильных условиях. Далее определение присутствия термофильных бактерий рода Campylobacter проводят по п. 7.1.1 и 7.1.2. Результаты высева из трех жидких сред оценивают как одну пробу, то есть при обнаружении роста термофильных кампилобактерий в любой из трех сред результат считается положительным.
7.2. Проведение анализа методом
фермент-связанного
флуоресцентного иммуноанализа
Инокулированные в селективном бульоне по п. 7.1.1 пробы пищевой продукции или инокулированные по п. 7.1.3 пробы смывов отбирают в стерильные пробирки по 1 - 2 см3, закрывают и нагревают на водяной бане (15 ± 1) мин при 95 - 100 °С. Охлаждают в течение 10 мин, перемешивают и вносят 0,5 см3 в стрип из тест-набора реагентов для определения бактерий рода Campylobacter методом фермент-связанного флуоресцентного иммуноанализа. Оставшуюся часть инокулированного бульона хранят в холодильнике при 2 - 4 °С для подтверждения положительных образцов. Далее определение проводят в соответствии с процедурой, изложенной в МУК 4.2.2321-08.
При проведении внутреннего производственного контроля и для оценки санитарно-гигиенического состояния производства допускается не проводить подтверждение положительного результата культуральным методом.
В иных случаях подтверждение положительного результата проводят путём высева 0,1 см3 бульона обогащения, хранившегося при 2 - 4 °С (без прогревания), на поверхность одной из селективных сред по п. 4.3.4, 4.3.5, 4.3.6. Инкубацию образцов проводят при температуре (42 ± 0,5) °С в течение 18 - 24 ч, при отсутствии роста инкубируют ещё 24 ч.
При обнаружении подозрительных колоний проводят их идентификацию (не менее 3 колоний) на принадлежность к термофильным бактериям рода Campylobacter по п. 7.1.2.
При получении противоречивых результатов (положительные результаты фермент-связанного флуоресцентного иммуноанализа не подтверждены культуральным методом) для проверки следует использовать дополнительные методы.
7.3. Проведение анализа методом ПЦР
с гибридизационно-флуоресцентной детекцией
Для подращивания находящихся в пробах пищевой продукции и смывов термофильных кампилобактерий, образцы подготовленные по п. 6, засевают в бульон Престона по п. 4.3.2 в соотношении 1:9 и инкубируют в соответствии с п. 7.1.1. Инкубация осуществляется в микроаэрофильных условиях.
Материалом для ПЦР-анализа являются пробы культуральной жидкости.
Экстракцию ДНК из культуральной жидкости проводят без дополнительной обработки, применительно к используемым наборам реагентов и в соответствии с инструкцией изготовителя. Для экстракции ДНК применяются комплекты реагентов на основе методов сорбции ДНК на силикагеле или преципитации ДНК при возможности их сочетания с наборами реагентов для проведения ПЦР.
Использование автоматических экстракторов нуклеиновых кислот допускается при наличии указаний в инструкции к прилагаемым наборам реагентов о возможности их применения при анализе данного вида образцов.
Не допускается применение упрощенных методик экстракции ДНК на основе термокоагуляции.
ПЦР-анализ проводят в соответствии с методическими указаниями6. Для выявления ДНК термофильных Campylobacter spp. используют наборы реагентов, обеспечивающие постановку ПЦР с гибридизационно-флуоресцентной детекцией продуктов амплификации в режиме реального времени. Постановка ПЦР осуществляется с обязательным применением внутренних контрольных образцов, начиная с этапа экстракции ДНК.
________
6 МУК 4.2.2872-11 «Методы выявления и идентификации патогенных бактерий - возбудителей инфекционных заболеваний с пищевым путем передачи в продуктах питания на основе ПЦР с гибридизационно-флуоресцентной детекцией», утвержденные Роспотребнадзором 15.06.2011 (далее - МУК 4.2.2872-11).
Оставшуюся часть инокулированного бульона хранят в холодильнике при 2 - 4 °С для подтверждения положительных образцов культуральным методом или с помощью ПЦР-анализа парных проб по п. 9.2 МУК 4.2.2872-11.
При проведении внутреннего производственного контроля и для оценки санитарно-гигиенического состояния производства допускается не проводить подтверждение положительного результата культуральным методом.
В иных случаях подтверждение положительного результата проводят культуральным методом или с помощью ПЦР-анализа по п. 9.2 МУК 4.2.2872-11.
При использовании культурального метода 0,1 см3 бульона обогащения, хранившегося при 2 - 4 °С (без прогревания), переносят на поверхность одной из селективных сред по п. 4.3.4, 4.3.5, 4.3.6. Инкубацию образцов проводят при температуре (42 ± 0,5) °С в течение 18 - 24 ч, при отсутствии роста инкубируют еще 24 ч.
При обнаружении подозрительных колоний проводят их идентификацию (не менее 3 колоний) на принадлежность к бактериям рода Campylobacter по п. 8.1.2.
При получении противоречивых результатов (положительные результаты ПЦР-анализа не подтверждены культуральным методом или ПЦР-методом), для проверки следует использовать дополнительные методы.
VIII. Учет результатов
Результат оценивают по каждой исследованной пробе продукта отдельно.
Если в результате проведенного исследования термофильные бактерии рода Campylobacter обнаружены, то результат выражают следующим образом: «Бактерии рода Campylobacter обнаружены в соответствующей массе (объеме) продукта». Если не обнаружены: «Бактерии рода Campylobacter не обнаружены в соответствующей массе (объеме) продукта».
При необходимости после проведения видовой идентификации по п. 7.1.2 в ответе указывается вид бактерий рода Campylobacter.
Для количественной оценки содержания термофильных кампилобактерий регистрируют число положительных результатов в колбах и пробирках с посевами трех последовательно убывающих масс (объемов) продукта, в которых подтверждено наличие бактерий рода Campylobacter, при пересеве на твердые питательные среды и последующей идентификации. В зависимости от получаемой комбинации положительных и отрицательных результатов для каждого значения массы (объема) продукта составляют трехзначное число (индекс), по которому находят наиболее вероятное число (НВЧ) кампилобактерий, соответствующее их содержанию в 1 г (см3) продукта (приложение 1 к МУК 4.2.2321-08), результат указывают как содержание термофильных кампилобактерий в КОЕ/г (см3) пищевого продукта. Результат исследования смывов выражают аналогично.
IX. Оценка чувствительности выделенных штаммов
кампилобактерий к антимикробным препаратам
Основой для выбора антимикробных препаратов (далее АМП), подлежащих включению в исследование, являются данные о природной чувствительности представителей рода Campylobacter, о распространении среди них приобретенной резистентности, о клинической эффективности антибиотиков и практике применения ветеринарных лекарственных средств с антимикробным действием.
9.1. Оценка чувствительности микроорганизмов к
антимикробным
препаратам диско-диффузионным методом
Перечень препаратов для тестирования штаммов кампилобактерий и сведения о пограничных значениях зон подавления роста для определения чувствительности кампилобактерий к АМП представлены в табл. 2.
Критерии оценки чувствительности Campylobacter spp. к АМП
|
АМП |
Диаметр зоны, мм |
Порог чувствительности, мг/л |
Диапазон тестируемых концентраций, мг/л |
|
|
S ≥ |
R < |
|||
|
Ципрофлоксацин |
26 |
25 |
0,5 |
0,12 - 16 |
|
Эритромицин |
20 |
19 |
4 - 8 |
1 - 128 |
|
Налидиксовая кислота |
20 |
19 |
16 |
1 - 64 |
|
Тетрациклин |
30 |
30 |
1 - 2 |
0,5 - 64 |
|
Гентамицин |
17 |
16 |
2 |
0,12 - 16 |
|
Доксициклин |
30 |
30 |
- |
- |
|
Хлорамфеникол |
17 |
17 |
- |
- |
|
Амикацин |
18 |
16 |
- |
- |
Для оценки чувствительности выделенных штаммов термофильных кампилобактерий диско-диффузионным методом используют агар Мюллера-Хинтона (далее - МХА) с добавлением 5 % дефибриниро-ванной крови по п. 4.3.10.
После добавления крови МХА разливают в чашки Петри таким образом, чтобы толщина агара составляла (4 ± 0,5) мм, что приблизительно соответствует 25 см3 среды на чашку Петри диаметром 90 мм; 31 см3 на круглую чашку Петри диаметром 100 мм, 71 см3 на круглую чашку Петри диаметром 150 мм. Не следует перемещать и двигать чашки Петри до полного затвердевания среды. Чашки с МХА должны быть подсушены перед инокуляцией для уменьшения роения (при 20 - 25 °С в течение 10 - 12 часов или при 35 °С со снятой крышкой в течение 15 мин). При высокой влажности поверхности среды возможно формирование нечеткого края зоны подавления роста. Нельзя пересушивать агар. Хранить готовые чашки с МХА необходимо при 8 - 10 °С в вентилируемых пластиковых боксах не более 7 суток.
Для приготовления инокулята используют чистую культуру кампилобактерий, выросшую на поверхности кровяного агара в течение 18 - 24 ч. Для этого петлей или ватным тампоном собирают несколько морфологически схожих колоний и суспендируют в стерильном изотоническом растворе. Плотность бактериальной суспензии доводят до величины 0,5 по стандарту мутности МакФарланда, что приблизительно соответствует 1,5×108 бактериальных клеток/см3. Использование большей или меньшей концентрации бактерий может приводить к формированию зоны подавления роста меньшего или большего диаметра.
Для измерения концентрации суспензии рекомендуется использовать фотометрическое устройство (денситометр), калиброванное по стандартам мутности МакФарланда, в соответствии с инструкцией производителя. Плотность суспензии также может быть определена путем визуального сравнения приготовленной суспензии со стандартом мутности 0,5 по МакФарланду на белом фоне с черными линиями. Перед использованием стандарт мутности следует энергично встряхнуть на вор-тексе. Суспензию следует использовать в течение 15 минут после приготовления.
Суспензию инокулируют на поверхность МХА. Для этого погружают стерильный ватный тампон в суспензию, удаляют избыток жидкости, отжав тампон о стенки пробирки и растирают суспензию равномерно штриховыми движениями по поверхности среды в трех направлениях, поворачивая чашку Петри на 60°, для получения сплошного газона роста культуры. Допускается использовать автоматический инокулятор.
На поверхность инокулированного МХА помещают диски с антибиотиками, не позднее, чем через 15 мин после нанесения суспензии. Длительное нахождение инокулированных чашек при комнатной температуре может привести к началу роста бактериальной культуры и ложному уменьшению зоны подавления роста. Контакт диска с агаром должен быть плотным. После нанесения на поверхность агара диски нельзя передвигать. На одну чашку диаметром 90 мм помещают не более 6 дисков, а на чашку диаметром 150 мм - не более12 дисков.
После нанесения дисков с антибиотиками чашки Петри с МХА в течение 15 мин должны быть помещены в термостат вверх дном. Посевы инкубируют при температуре (37 ± 0,5) °С в течение 48 ч или при температуре (41,5 ± 0,5) °С в течение 24 ч. На чашках должен сформироваться равномерный сплошной слой бактериального роста (газон). При слабом росте после 24 ч следует продлить инкубацию до 40 - 48 часов, после чего провести учет результатов.
Зоны подавления роста вокруг дисков с антибиотиками должны иметь форму окружности. Края зон подавления роста должны быть ровными. Формирование отдельных колоний вместо сплошного роста свидетельствует о недостаточной плотности инокулята. В этом случае исследование необходимо повторить.
Для контроля качества оценки антибиотикочувствительности используют тест-культуру Campylobacter spp. по п. 3.3.3, чувствительную к антибиотикам.
Оценку чувствительности тестируемого штамма к конкретному АМП проводят, измеряя диаметры зон подавления роста вокруг дисков при помощи линейки, штангенциркуля или автоматическими приборами для учета результатов определения чувствительности диско-диффузионным методом. Для измерения зон чашки с МХА помещают дном книзу, крышку снимают и смотрят под углом 45° в отраженном свете.
9.2. Определение минимальных ингибирующих
концентраций
к АМП у бактерий рода Campylobacter
При необходимости, при обнаружении резистентности исследуемого штамма кампилобактерий к одному или нескольким АМП дискодиффузионным методом, определяют минимальные ингибирующие концентрации (далее - МИК) к соответствующим препаратам методом серийных разведений в соответствии с методическими указаниями7 и ГОСТ Р ИСО 20776-1-2010.
Для анализа МИК антибиотиков в отношении тест-штаммов бактерий рода Campylobacter допускается использовать наборы реагентов промышленного производства8 - планшетные тест-системы или Е-тесты (MIC Test), представляющие собой модифицированный вариант диффузионного метода тестирования. Анализ проводят в соответствии с инструкциями изготовителя. Для интерпретации результатов используют табл. 2.
Полученные данные используют для целей мониторинга и наблюдения за циркуляцией антибиотикорезистентных штаммов бактерий рода Campylobacter, выделенных из пищевых продуктов и смывов, в том числе при проведении профилактических мероприятий в соответствии с санитарно-эпидемиологическими правилами9.
________
7 МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам», утвержденные Роспотребнадзором 04.03.2004.
8 Примечание: Допускается использование реагентов с аналогичными или лучшими характеристиками.
9 СП 3.1.7.2816-10 от 29.12.2010 № 188.
X. Требования безопасности и квалификации операторов
10.1. Исследования пищевых продуктов и объектов окружающей среды проводят в соответствии с законодательством в области обеспечения санитарно-эпидемиологического благополучия населения10, а также с соблюдением требований техники безопасности, установленных для работ с токсичными, едкими веществами (ГОСТ 12.1.005-88, ГОСТ 12.1.007-76).
Помещение лаборатории должно соответствовать требованиям санитарно-эпидемиологических правил11 и иметь боксы биологической безопасности 2 класса типа А.
________
10 Санитарно-эпидемиологические правила СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 28.0.1.2008 № 4 (зарегистрировано Минюстом России 21.02.2008, регистрационный номер 11197), с изменениями, внесенными постановлениями Главного государственного санитарного врача Российской Федерации от 02.06.2009 № 42 (зарегистрировано Минюстом России 08.07.2009, регистрационный номер 14280), от 29.06.2011 № 86 (зарегистрировано Минюстом России 12.07.2011, регистрационный номер 21317).
11 Санитарно-эпидемиологических правил СП 1.2.1318-03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами», утвержденные постановлением Главного государственного санитарного врача Российской Федерации от 30.04.2003 № 85 (зарегистрировано Минюстом России 19.05.2003, регистрационный номер 4558).
10.2. При выполнении методики и работе с электроустановками необходимо соблюдать правила электробезопасности в соответствии ГОСТ Р 12.1.019-2009.
10.3. Помещение лаборатории должно быть оборудовано приточно-вытяжной вентиляцией, соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83.
10.4. К выполнению методики допускают лиц с высшим или средним специальным образованием, прошедших соответствующую подготовку и имеющих навыки работы в области микробиологического и молекулярно-генетического анализа, способных после освоения техники анализа и приемов по эксплуатации аппаратуры получать результаты в пределах нормативов оперативного контроля погрешности.
XI. Условия выполнения измерений
Измерения проводятся в лабораторных условиях, соответствующих требованиям СанПиН 2.2.4.548-96 и ГОСТ 12.1.005-88:
- Температура окружающего воздуха (23 ± 1) °С;
- Атмосферное давление (97 ± 10) кПа;
- Относительная влажность (65 ± 5) %.
Приложение
МУК 4.2.3545-18
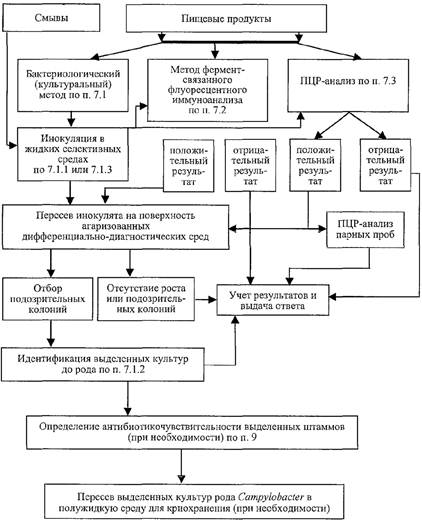
Схема проведения анализа на наличие бактерий рода Campylobacter
в пищевых продуктах и смывах
Нормативные и методические документы
1. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2. Постановление Правительства Российской Федерации от 16.04.2012 № 317 «О лицензировании деятельности в области использования возбудителей инфекционных заболеваний человека и животных (за исключением случая, если указанная деятельность осуществляется в медицинских целях) и генно-инженерно-модифицированных организмов III и IV степеней потенциальной опасности, осуществляемой в замкнутых системах».
3. СП 1.1.1058-01 «Организация и проведение производственного контроля за соблюдением Санитарных правил и выполнением санитарно-противоэпидемических (профилактических) мероприятий».
4. СП 1.3.2322-08 «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней».
5. СП 1.2.1318-03 «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами».
6. СП 3.1.7.2816-10 «Профилактика кампилобактериоза среди людей».
7. МУ 1.3.2569-09 «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности».
8. МУК 4.2.2321-08 «Методы определения бактерий рода Campylobacters пищевых продуктах» с изменениями МУК 4.2.2878-11 «Дополнения и изменения № 1 к МУК 4.2.2321-08 «Методы определения бактерий рода Campylobacter в пищевых продуктах».
9. МУК 4.2.1890-04 «Определение чувствительности микроорганизмов к антибактериальным препаратам».
10. МУК 4.2.2872-11 «Методы выявления и идентификации патогенных бактерий - возбудителей инфекционных заболеваний с пищевым путем передачи в продуктах питания на основе ПЦР с гибридизационно-флуоресцентной детекцией».
11. ГОСТ 31904-2012 «Продукты пищевые. Методы отбора проб для микробиологических испытаний».
12. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов».
13. ГОСТ 12.1.005-88 «Общие санитарно-гигиенические требования к воздуху рабочей зоны».
14. ГОСТ ISO 7218-2015 «Микробиология пищевых продуктов и кормов для животных. Общие требования и рекомендации по микробиологическим исследованиям».
15. ГОСТ ISO 10272-1-2013 «Микробиология пищевых продуктов и кормов для животных. Методы обнаружения и подсчета бактерий Campylobacter spp. Часть 1. Метод обнаружения».
16. ГОСТ ISO 20838-2014 «Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция для обнаружения патогенных пищевых микроорганизмов. Требования к амплификации и обнаружению для качественного анализа».
17. ГОСТ ISO 20837-2013 «Микробиология пищевых продуктов и кормов для животных. Полимеразная цепная реакция (ПЦР) для обнаружения патогенных микроорганизмов в пищевых продуктах. Требования к подготовке образцов для качественного обнаружения».
18. ГОСТ ISO 11133-2016 «Микробиология пищевых продуктов, кормов для животных и воды. Приготовление, производство, хранение и определение рабочих характеристик питательных сред».
19. ГОСТ Р ИСО 20776-1-2010 «Клинические лабораторные исследования и диагностические тест-системы in vitro. Исследование чувствительности инфекционных агентов и оценка функциональных характеристик изделий для исследования чувствительности к антимикробным средствам. Часть 1. Референтный метод лабораторного исследования активности антимикробных агентов против быстрорастущих аэробных бактерий, вызывающих инфекционные болезни».
20. ГОСТ Р 50396.0-2013 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям».
21. ГОСТ Р 51447-99 «Мясо и мясные продукты. Методы отбора проб».
22. Клинические рекомендации «Определение чувствительности микроорганизмов к антимикробным препаратам», 2018-03.