НАСТАВЛЕНИЕ ПО ДИАГНОСТИКЕ БРУЦЕЛЛЕЗА ЖИВОТНЫХ
УТВЕРЖДАЮ
Руководитель Департамента ветеринарии
_____________________ Е.А. Непоклонов
29 сентября 2003 г. № 13-5-02/0850
1. ОБЩИЕ ПОЛОЖЕНИЯ
1.1. Бруцеллез - инфекционная, хронически протекающая болезнь животных.
Возбудитель - бактерии из рода бруцелла, в который входят шесть самостоятельных видов: мелитензис (овец и коз), абортус (крупного рогатого скота), суис (свиней), канис (собак), овис (баранов и овец) и неотома (кустарниковых крыс).
Микроорганизмы первых четырех видов вызывают бруцеллез животных, а пятого вида - инфекционный эпидидимит баранов (ИЭ).
От животных, больных бруцеллезом, могут заражаться люди, для которых наиболее опасен возбудитель бруцеллеза овец и коз.
1.2. Диагноз на бруцеллез у животных ставят на основании результатов бактериологического, серологического, молекулярно-генетического и аллергического исследований с учетом эпизоотологических данных и клинических признаков болезни, руководствуясь при этом санитарными и ветеринарными правилами по профилактике и борьбе с заразными болезнями, общими для человека и животных.
1.2.1. При установлении диагноза на бруцеллез необходимо учитывать следующее:
- различные виды возбудителя являются патогенными, в основном, для животных соответствующего вида. Бруцеллы видов мелитензис, абортус и суис могут мигрировать на животных других видов;
- клинические признаки бруцеллеза у животных не характерны. Наиболее часто клиническое проявление болезни у маточного поголовья - аборт, у свиноматок наблюдается мумификация плодов.
При абортах отмечается утолщение плодовых оболочек, образование на них фибринозных или гнойных хлопьев. Бруцеллез сопровождается нередко поражением суставов (артриты), синовиальной системы (тендовагиниты, бурситы), половой системы (у самок - эндометрит, вагинит, у самцов - орхит, эпидидимит);
- патологоанатомическая картина при бруцеллезе не имеет характерных особенностей, позволяющих использовать их для диагностики этой болезни. Только у свиней на слизистой оболочке матки иногда находят желтовато-гнойные или казеозные узелки величиной с просяное зерно, так называемый "милиарный бруцеллез матки";
- у баранов, больных бруцеллезом, в семенниках и придатках обнаруживают некротические или гнойные очаги различной величины; отмечают заполнение полости мошонки серозно-гнойным транссудатом, разрастание фиброзной ткани, сращение придатка с семенником и общей влагалищной оболочкой, иногда атрофию семенников.
1.3. Диагностика бруцеллеза включает лабораторные (бактериологическое, серологическое и молекулярно-генетическое) исследования материала и аллергическое исследование свиней в хозяйствах.
Плановые серологические исследования являются основным методом выявления больных и подозрительных по заболеванию животных.
Бактериологическую диагностику проводят в случае аборта или при появлении у животных других признаков (бурситы, гигромы, орхиты, эпидидимиты и прочие), вызывающих подозрение на данное заболевание. Одновременно проводят серологическое исследование сывороток крови этих животных.
Молекулярно-генетическое исследование (ПЦР) проводят в случае аборта и при появлении у животных других клинических признаков, вызывающих подозрение на бруцеллез, а также при получении положительных и сомнительных результатов серологического исследования на бруцеллез животных, не иммунизированных противобруцеллезными вакцинами, из хозяйств, благополучных по данному заболеванию.
1.4. При взятии проб крови, молока и патологического материала, а также проведении лабораторных исследований необходимо соблюдать меры, предупреждающие заражение людей и обсеменение объектов внешней среды, руководствуясь при этом действующими правилами и инструкциями.
2. ВЗЯТИЕ МАТЕРИАЛА ОТ ЖИВОТНЫХ И ПЕРЕСЫЛКА ЕГО ДЛЯ ЛАБОРАТОРНЫХ ИССЛЕДОВАНИИ
2.1. Материал для лабораторных исследований отбирают от каждого животного в отдельности.
2.2. Для бактериологического исследования на бруцеллез направляют абортированный плод с плодовыми оболочками (от свиноматок берут не менее трех плодов) или селезенку, печень, желудок плода с содержимым, перевязанный со стороны пищевода и двенадцатиперстной кишки, и околоплодную жидкость.
Для прижизненной диагностики бруцеллеза от животных берут кровь, молоко, содержимое гигром (бурситов) и абсцессов. При диагностическом убое - дополнительно селезенку, печень, подчелюстные, заглоточные, предлопаточные, надколенные, подколенные, надвыменные, парааортальные, тазовые лимфатические узлы и половые органы. Жидкий материал берут в стерильную посуду (пробирки, банки).
При взятии содержимого гигром, бурс в области поражения выстригают шерсть, кожный покров дезинфицируют 70 %-ным спиртом и смазывают настойкой йода. Затем стерильным шприцем с иглой большого диаметра делают пункцию, отсасывают содержимое гигромы (бурсы) и переносят его в стерильную пробирку с резиновой пробкой.
Перед взятием проб молока у коров вымя обмывают теплой водой, соски обрабатывают 70 %-ным спиртом. Для исследования из каждой доли вымени берут последние порции молока в количестве 10 - 15 мл в отдельные стерильные пробирки с резиновыми пробками.
У овец и коз пробы молока берут путем пункции цистерны вымени. Для этого животное фиксируют в боковом положении, вымя у основания соска протирают 70 %-ным спиртом и смазывают настойкой йода. Стерильным шприцем с иглой делают пункцию у основания соска и после попадания иглы в цистерну (о чем судят по свободному движению конца иглы) набирают в шприц молоко и переносят его в стерильную пробирку с резиновой пробкой.
Молоко должно быть доставлено в лабораторию и исследовано в день взятия пробы. Если это невозможно, молоко консервируют сухой борной кислотой (0,1 г на 10 мл) или генцианвиолетом (0,4 мл 1 %-го спиртоводного раствора краски на 10 мл молока). Консервированное молоко пригодно для исследования в течение 10 дней.
2.2.1. Отобранные для бактериологического исследования пробы упаковывают в целлофан или пергаментную бумагу, помещают в непроницаемую тару (ящик, банка, полиэтиленовый пакет) и в этот же день направляют в лабораторию. От абортировавшего животного одновременно с патологическим материалом направляют кровь (сыворотку крови) для серологического исследования на бруцеллез. Если в течение 24 - 30 ч взятый материал доставить в лабораторию не представляется возможным, его консервируют стерильным 30 %-ным водным раствором химически чистого глицерина. Материал заливают консервирующей жидкостью в количестве, превышающем его объем в 4 - 5 раз. Крупные плоды направляют в неконсервированном виде.
2.3. Для серологического исследования в лабораторию направляют кровь (сыворотку крови) и молоко.
2.3.1. Кровь у животных берут из яремной вены (у свиней - из яремной, ушной или хвостовой; у собак - головной предплечья или латеральной подколенной голени; у лисиц и песцов - из бедренной вены; у норок путем отсечения подушечки среднего пальца задней лапы или кончика хвоста в стерильные пробирки по 5 - 7 мл (от пушных зверей по 1 - 2 мл). Пробирки нумеруют и составляют опись проб.
Сыворотку крови получают методом отстоя. Для свертывания крови и отстаивания сыворотки пробирки с кровью выдерживают в термостате при 30 - 38 °С в течение 1 ч или при комнатной температуре 8 - 10 ч, сгусток крови от стенок отделяют стальной спицей, а затем пробирки выдерживают при 4 - 10 °С. Через 20 - 24 ч после взятия крови отстоявшуюся сыворотку сливают в сухие стерильные пробирки и направляют для исследования в лабораторию в свежем или консервированном виде (сыворотку крови собак сливают через 3 - 4 ч и повторно через 10 - 12 ч).
Консервирование сывороток проводят:
- добавлением 0,05 мл (1 капля) 5 %-го раствора фенола на каждый миллилитр сыворотки при тщательном перемешивании;
- сухой борной кислотой (2 - 4 % к объему сыворотки) до получения насыщенного раствора и образования на дне пробирки небольшого осадка;
- путем однократного замораживания.
Неконсервированные сыворотки пригодны для исследования в течение 6 сут. со дня взятия крови при условии хранения их при 4 - 8 °С.
Сыворотки, консервированные фенолом или борной кислотой, пригодны для исследования в течение 30 сут.; замороженные сыворотки - в течение 3 сут. после однократного оттаивания.
Мутные, проросшие, гемолизированные сыворотки исследованию на бруцеллез не подлежат.
2.3.2. Для исследования на бруцеллез в кольцевой реакции пробу цельного свежего молока от коровы (буйволицы) берут сборную из каждой доли вымени одного удоя в одну стерильную пробирку в количестве 10 - 15 мл. При этом, если молоко берут перед дойкой, то первые порции молока сдаивают. Пробы молока на рынках берут из каждой отдельной посуды (бидон, фляга и проч.) после тщательного его перемешивания. Пробирки нумеруют и составляют опись проб.
Молоко исследуют свежее (охлажденное до 4 - 10 °С или неохлажденное) или консервированное добавлением в каждую пробу одной капли 10 %-го раствора формалина на 5 мл молока. Консервированное молоко пригодно для исследования в течение 2 - 3 сут. Перед исследованием молоко необходимо тщательно перемешать для равномерного распределения сливок.
При массовом исследовании молока работу по отбору проб и постановке кольцевой реакции можно проводить непосредственно на ферме в специально отведенном помещении.
Не разрешается исследовать в кольцевой реакции молоко от коров (буйволиц), больных маститом или болезнями, сопровождающимися повышением температуры тела, а также молоко животных в первые две недели после родов. Молоко, имеющее повышенную кислотность (30° по Тернеру и выше), исследованию не подлежит, т.к антиген обесцвечивается.
2.4. На направляемый в лабораторию материал заполняют сопроводительный документ установленной формы.
3. БАКТЕРИОЛОГИЧЕСКАЯ ДИАГНОСТИКА БРУЦЕЛЛЕЗА
3.1 Бактериологическую диагностику бруцеллеза проводят в случае аборта или при появлении у животных других признаков (бурситы, гигромы, орхиты, эпидидимиты и прочие), вызывающих подозрение на данное заболевание.
3.2 Бруцеллы обнаруживают бактериоскопией мазков из патологического материала, выделением культуры бруцелл на питательных средах и, при необходимости, путем постановки биологической пробы на морских свинках.
3.3 Бактериоскопическое исследование
Из доставленного на исследование патологического материала делают по два мазка из каждого объекта. При исследовании абортированных плодов мазки готовят из содержимого желудка, жидкости брюшной и грудной полостей, печени, селезенки, а также котиледонов плодовых оболочек Из паренхиматозных органов, котиледонов и другого плотного материала делают мазки-отпечатки, жидкий материал наносят на предметные стекла пипеткой.
Мазки, фиксированные над пламенем горелки, окрашивают по Граму и одному из следующих специальных методов: по Стампу (модифицированный метод Циль-Нильсена), Козловскому или Шуляку-Шину (см. Прил. № 1, п. 1). При микроскопии мазков учитывают, что бруцеллы - мелкие, грамотрицательные, расположенные отдельно, попарно или кучно коккобактерии, окрашивающиеся по Стампу, Козловскому или Шуляку-Шину в красный цвет.
3.4. Бактериологическое исследование
3.4.1 Для культивирования бруцелл используют мясо-пептонный печеночный бульон (МППБ), печеночный глюкозо-глицериновый бульон (ПГГБ), мясо-пептонный печеночно-глюкозо-глицериновый агар (МППГГА), печеночный глюкозо-глицериновый агар (ПГГА), картофельный агар, эритрит-агар, сывороточно-декстрозный агар, печеночно-сывороточный агар и печеночно-аминопептидный агар, (см. Прил. № 1, п. 2) и другие питательные среды, предназначенные для этой цели.
3.4.2 Перед посевом материала кожу абортированного плода с поверхности по белой линии протирают тампонами, смоченными 5 %-ным раствором фенола. Стерильными ножницами вскрывают брюшную стенку и грудную клетку плода, содержимое грудной и брюшной полостей набирают пастеровскими пипетками и высевают в 1 пробирку с бульоном и 2 пробирки с агаром, а содержимое желудка - в 2 пробирки с бульоном и не менее 5 пробирок с агаром.
Из печени и селезенки вырезают кусочки размером не менее 2,0×1,5×2,5 см, увлажняют их спиртом, обжигают с поверхности и растирают в стерильной ступке с песком. Затем в ступку добавляют равное количество стерильного физиологического раствора и вновь растирают. Полученную взвесь пастеровской пипеткой по 0,1 - 0,2 мл высевают на поверхность предварительно подсушенных плотных сред (в пробирках или чашках). Допускается высев материала пастеровской пипеткой из органов (место прокола органа предварительно прижигают раскаленным шпателем). Из каждого органа делают посев на 1 пробирку с бульоном и 2 пробирки с агаром.
Если в лабораторию доставлен только желудок плода, высев проводят не менее чем на 10 пробирок агара.
При поступлении нескольких плодов от одного животного посевы делают из органов и тканей каждого плода отдельно.
Из плодовых оболочек и плаценты вырезают кусочки тканей с утолщенными ворсинками и стенками, наличием на поверхности фибрина или гнойного экссудата (выбирают менее загрязненные участки без некротических изменений).
Для уничтожения посторонней микрофлоры кусочки плаценты помешают в чашку Петри и заливают 3 %-ным раствором гидроокиси калия на 30 мин. Затем их обмывают стерильным физиологическим раствором, готовят из этого материала суспензию в ступке со стерильным песком и делают посев пастеровской пипеткой на чашки со средой, содержащей бактериостатические препараты: генцианвиолет 1:200000 (0,1 мл 0,5 %-го спиртоводного раствора на 100 мл среды) или кристаллвиолет 1:100000, генцианвиолет и малахитовую зелень в концентрации каждой краски 1:200000, уксуснокислый натрий из расчета 12,5 мг на 100 мл среды и др.
Содержимое бурс, гигром высевают на 3 - 4 чашки с плотной питательной средой, содержащей бактериостатические препараты.
Пробы молока центрифугируют 30 мин при 3000 об./мин. Верхний слой (сливки) и осадок набирают в пастеровскую пипетку и по 0,1 - 0,2 мл вносят на 3 - 4 чашки с агаром, содержащим бактериостатические препараты. Молоко, консервированное генцианвиолетом или другими консервантами, высевают на среды без бактериостатических веществ.
3.4.3. Для выращивания культуp посевы помещают в термостат при 37 - 38 °С.
При исследовании материала от крупного рогатого скота половину засеянных пробирок и чашек культивируют в обычных условиях, другую - в атмосфере с повышенным содержанием углекислого газа (10 - 15 %) в CO2 - инкубаторе или эксикаторе (микроанаэростате). Аналогичные условия можно создать в пробирках, закрытых резиновыми пробками или залитых парафином.
Перед парафинированием пробирки закрывают ватными пробками, пронося последние над пламенем горелки. Затем верхнюю часть пробки обрезают, а оставшуюся часть углубляют на 0,5 - 1,0 см внутрь пробирки и заливают расплавленным парафином.
Необходимое содержание углекислого газа в эксикаторе можно получить путем:
- заполнения части объема углекислым газом из баллона или аппарата Киппа;
- внесения бикарбоната натрия и серной или соляной кислоты (0,48 г бикарбоната натрия и 5 мл 25 %-го раствора кислоты или 0,4 г бикарбоната натрия и 0,35 мл концентрированной соляной кислоты на 1 л объема);
- сжигания ваты, смоченной спиртом. При этом пробирки и чашки с посевами должны занимать не более половины объема эксикатора. Для определения концентрации углекислого газа в эксикаторе можно использовать химический метод (см. Прил. № 1, п. 3).
3.4.4. Посевы выдерживают в термостате при 37 - 38 °С в течение 30 сут. Первичный осмотр посевов проводят через 24 - 48 ч. Пробирки с агаром и бульоном, заросшие посторонней микрофлорой, обезвреживают путем автоклавирования при 1,5 атм. в течение 1 ч.
В дальнейшем для обнаружения роста бруцелл посевы просматривают каждые 3 - 4 сут. визуально, при необходимости через лупу или малом увеличении микроскопа. При отсутствии роста часть поверхности агара орошают посевным материалом.
При значительном росте посторонней микрофлоры (80 % и более засеянных пробирок) бактериологическое исследование прекращают.
При просмотре посевов обращают внимание на характер роста микробов. На поверхности агара бруцеллы образуют мелкие, блестящие, выпуклые, с ровными краями и гладкой поверхностью просвечивающиеся колонии, имеющие в отраженном свете голубоватый оттенок, в падающем свете - сероватый. С возрастом колонии мутнеют и приобретают более темную окрасу, что связано с появлением пигмента.
В бульоне бруцеллы образуют равномерное помутнение и пристеночное кольцо, возвышающееся над уровнем бульона, а в дальнейшем небольшой осадок на дне пробирки. В отраженном свете пристеночное кольцо имеет голубоватый оттенок.
При обнаружении роста на жидких средах и отсутствии характерного роста на агаре из каждой пробирки готовят мазки, которые окрашивают одним из специальных методов, и делают пересев на чашки с плотной средой для выделения чистой культуры. Пересевы на чашках культивируют так же, как и высевы из патологического материала.
Выделенные культуры идентифицируют по тинкториальным (окраска мазков по Граму и одним из специальных методов - по Стампу, Козловскому или Шуляку-Шину), морфологическим, культурным свойствам и в реакции агглютинации на стекле с использованием набора компонентов для серологической дифференциации бруцелл.
Для постановки пластинчатой реакции агглютинации на стекле необходимы следующие компоненты: испытуемая культура, набор для серологической дифференциации бруцелл (выпускается биопредприятием), 0,5 %-ный фенолизированный физиологический раствор pH 7,0 - 7,2.
Для исследования берут двухсуточные агаровые культуры R- и S-сыворотки бруцеллезные агглютинирующие разводят 0,5 %-ным фенолизированным физиологическим раствором до рабочего разведения, указанного на этикетке коробки. Разведенные сыворотки допускается использовать в течение месяца. R-антиген бруцеллезный цветной для РА и антиген бруцеллезный для роз бенгал пробы в пластинчатой РА применяют неразведенными. Предметные стекла для реакции подготавливают общепринятым способом. Физиологический раствор, пробирки и пипетки должны быть стерильными.
Техника постановки реакции. На предметное стекло раздельно наносят по одной капле R- и S-сывороток бруцеллезных агглютинирующих и физиологического раствора. Испытуемую культуру бактериологической петлей отдельно эмульгируют в каплях R- и S-сывороток и в капле физиологического раствора для определения самоагглютинации культуры. Параллельно в каждом опыте ставят контроли: R- и S-сыворотки в разведении, указанном на этикетке, с цветным R-бруцеллезным антигеном и с роз бенгал антигеном.
Учет и оценка реакции. Реакцию учитывают невооруженным глазом или с помощью увеличительного стекла в течение 2 минут по следующей схеме:
++++ (4 креста) - полное просветление жидкости с образованием четко выраженного агглютината - положительная реакция;
+++ (3 креста) - неполное просветление жидкости с выраженным агглютинатом - положительная реакция;
++ (2 креста) - неполное просветление жидкости со слабо выраженным агглютинатом - положительная реакция;
+ (1 крест) - жидкость без просветления с едва заметным агглютинатом - сомнительная реакция;
- (минус) - просветление жидкости не наступило, смесь гомогенная - отрицательная реакция.
Следует иметь ввиду, что реакция с R-бруцеллезной сывороткой проходит замедленно; агглютинат, как правило, мелкозернистый. Результаты реакции с испытуемой культурой считают достоверными, если в контролях R- и S-бруцеллезных сывороток с гомологичными антигенами агглютинация четко выражена не менее чем 3 креста, а с гетерологичными - отсутствует.
Реакцию с испытуемой культурой считают положительной при наличии агглютинации на 2 креста и более. При отрицательной реакции ее проводят повторно с этой же культурой, взятой из трех - четырех мест посева.
Культуры, обладающие типичными для бруцелл морфологическими, культуральными и тинкториальными свойствами, а также дающие положительную реакцию агглютинации с R- и S-бруцеллезными сыворотками в отдельности или с обеими сыворотками одновременно при отсутствии самоагглютинации в физиологическом растворе, признают бруцеллами.
Культура возбудителя инфекционного эпидидимита баранов и бруцеллеза собак, вызванного В. canis, постоянно агглютинируется только R-бруцеллезной сывороткой.
3.5. Биологическое исследование
3.5.1. Биологическое исследование проводят на морских свинках (не менее двух) массой 350 - 400 г, предварительно проверенных на бруцеллез исследованием в РА сыворотки крови в разведении 1:5 с отрицательным результатом.
3.5.2. Для постановки биологической пробы используют тот же материал, что и для бактериологического исследования.
Из органов и содержимого желудка абортированного плода готовят суспензию на стерильном физиологическом растворе в соотношении 1:10 и вводят морской свинке подкожно с внутренней стороны бедра в объеме 1 мл.
Из плаценты и плодовых оболочек, предварительно обработанных тампонами, смоченными дезинфицирующим раствором, и подсушенных сухими стерильными тампонами, вырезают кусочки размером 0,5×0,5 см, фламбируют на пламени горелки, растирают в ступке со стерильным песком и заливают физиологическим раствором в соотношении 1:10. Полученную суспензию вводят морской свинке в объеме 1 мл.
Содержимое гигром, бурс вводят морской свинке подкожно в объеме 0,2 - 0,3 мл. При этом необходимо учитывать возможность гибели животного от сопутствующей микрофлоры, особенно стрептококков.
Пробы молока центрифугируют 30 мин при 3000 об./мин. Морской свинке вводят подкожно 2 - 3 мл материала из верхнего слоя (сливки) и осадка молока после центрифугирования.
3.5.3. На 15, 25 и 40-е сут. после заражения у морских свинок берут кровь в количестве 1 - 2 мл из ушной вены путем надреза или из сердца - путем пункции. Сыворотку крови исследуют в пробирочной РА в разведениях от 1:10 до 1:80.
При положительной реакции агглютинации в разведении 1:10 и выше морских свинок убивают. В случае необходимости получения культуры возбудителя материал от них исследуют бактериологически. Высевы делают пастеровскими пипетками в одну пробирку бульона и две пробирки агара из паховых, парааортальных лимфатических узлов (правых и левых), селезенки (2 высева), печени и костного мозга. Посевы культивируют, как описано в подпунктах 3.4.3 и 3.4.4.
При отрицательной РА у морских свинок в указанные выше сроки биопробу считают отрицательной, подопытных животных убивают, бакисследование не проводят.
3.5.4. При выделении культуры бруцелл на питательных средах из исходного материала биологическое исследование по данной экспертизе прекращают, а ранее зараженных морских свинок убивают без бакисследования.
3.6. Результат исследования на бруцеллез считают положительным при выделении культуры возбудителя или при получении у морской свинки положительной РА в разведении сыворотки крови 1:10 и выше, если из исходного материала культура не выделена.
При положительных результатах бактериоскопии и отрицательных результатах бактериологического исследования и биопробы материал считают подозрительным на бруцеллез. При сохранении патматериала или возможности взятия нового (кровь, молоко, моча и др.) исследование проводят методом полимеразной цепной реакции. По ее результатам делают заключение о заболевании животных бруцеллезом.
3.7. Сроки исследования:
- бактериологического - до 1 мес;
- биологического - до 2 мес.
3.8. В ветеринарных лабораториях все выделенные культуры бруцелл после их идентификации подлежат уничтожению путем автоклавирования при 1,5 атм. в течение 1 ч.
3.9. При необходимости определения вида бруцелл выделенные от животных культуры направляют в республиканские, краевые, областные ветеринарные лаборатории или ветеринарные научно-исследовательские учреждения, в которых имеются лаборатории или отделы, занимающиеся изучением бруцеллеза животных и имеющие разрешение органов здравоохранения на работу с микроорганизмами второй группы.
4. СЕРОЛОГИЧЕСКАЯ ДИАГНОСТИКА БРУЦЕЛЛЕЗА
4.1 Серологическая диагностика бруцеллеза заключается в обнаружении специфических антител в сыворотке крови животных в реакции агглютинации (РА) в пробирках, реакции связывания комплемента (РСК), реакции длительного связывания комплемента на холоде (РДСК), реакции иммунодиффузии с 0-полисахаридным антигеном (РИД), пластинчатой реакции агглютинации с роз бенгал антигеном (роз бенгал проба - РБП) и в молоке коров - кольцевой реакции (КР) и других реакциях, утвержденных в установленном порядке.
4.2 Постановка и учет результатов реакции агглютинации (РА) в пробирках
4.2.1 Реакцию агглютинации в пробирках с бруцеллезным антигеном применяют при диагностике бруцеллеза у крупного рогатого скота (буйволов, яков, зебу), овец, коз, лошадей, верблюдов, оленей (маралов), собак, пушных зверей и морских свинок.
4.2.2 Компоненты реакции агглютинации:
- испытуемые сыворотки крови (см. п. 2.3.1);
- позитивная бруцеллезная сыворотка, изготовленная биопредприятием;
- негативная сыворотка (сыворотка крови здоровых животных из опыта или консервированная), изготовленная биопредприятием или полученная в лаборатории;
- антиген бруцеллезный единый для РА, РСК и РДСК (см. Прил. № 2, п. 6);
- 0,5 %-ный фенолизированный раствор хлорида натрия. При исследовании сывороток крови крупного рогатого скота, лошадей, верблюдов, собак, пушных зверей и морских свинок для разведения испытуемых сывороток и антигена используют фенолизированный физиологический раствор хлорида натрия (0,85 %-ный); при исследовании крови овец и коз - 5 %-ный и оленей (маралов) - фенолизированный 10 %-ный раствор хлорида натрия (см. Прил. № 2, п. 1).
4.2.3. Постановка реакции агглютинации
Реакцию агглютинации проводят в серологических пробирках в объеме 1 мл в четырех разведениях:
- при исследовании сывороток крови овец, коз, оленей (маралов) и собак - 1:25, 1:50, 1:100 и 1:200;
- крупного рогатого скота, лошадей и верблюдов - 1:50, 1:100, 1:200 и 1:400;
- пушных зверей и морских свинок - 1:10, 1:20, 1:40 и 1:80.
При массовых исследованиях допускается постановка реакции в первых двух разведениях.
Компоненты реакции вносят индивидуальными мерными пипетками (дозаторами) или групповыми дозаторами Флоринского.
Для исследования каждой испытуемой сыворотки крови требуется 5 пробирок В пробирках первого ряда делают исходное разведение. Для этого сыворотку крови крупного рогатого скота, лошадей и верблюдов берут в дозе 0,1 мл, вносят в пробирку, добавляют к ней 2,4 мл соответствующего раствора хлорида натрия, смешивают и получают разведение сыворотки 1:25. Сыворотку крови овец, коз, оленей (маралов) и собак берут в дозе 0,2 мл и добавляют 2,3 мл соответствующего раствора хлорида натрия (разведение 1:12,5), а сыворотку крови пушных зверей и морских свинок берут в дозе 0,3 мл и добавляют 1,2 мл соответствующего раствора хлорида натрия (разведение 1:5). Таким образом, делают исходное разведение испытуемых сывороток в пробирках первого ряда штатива (по 10 проб в ряду).
После приготовления исходного разведения сывороток в первом ряду в пробирки третьего, четвертого и пятого рядов вносят по 0,5 мл соответствующего раствора хлорида натрия. Затем из пробирок первого ряда при помощи группового дозатора Флоринского или индивидуальных пипеток-дозаторов переносят в пробирки второго и третьего рядов по 0,5 мл исходного разведения сывороток (1:25; 1:12,5 или 1:5). В пробирках третьего ряда сыворотки смешивают, по 0,5 мл этого разведения переносят в пробирки четвертого ряда и так же из пробирок четвертого ряда - в пятый. Из пробирок пятого ряда 0,5 мл жидкости удаляют. Таким образом, делают последовательные двукратные разведения сывороток.
После этого в каждую пробирку второго, третьего, четвертого и пятого рядов с разведенными сыворотками вносят при помощи группового дозатора Флоринского или другого дозирующего устройства по 0,5 мл антигена, предварительно разведенного 1:10 соответствующим раствором хлорида натрия. После добавления антигена разведение сыворотки в каждой пробирке удваивается и, в зависимости от вида исследуемых животных, будет составлять 1:50, 1:100, 1:200 и 1:400; 1:25, 1:50, 1:100 и 1200 или 1:10, 1:20, 1:40 и 1:80.
В пробирки первого ряда бруцеллезный антиген не вносят, они служат контролем качества сыворотки. При наличии хлопьев, фибрина, эритроцитов и посторонних примесей результаты реакции агглютинации не учитывают.
При массовых исследованиях сыворотки разливают индивидуальной микропипеткой (с грушей) или групповыми дозаторами Флоринского в две пробирки в дозах 0,02 и 0,01 мл (сыворотки крупного рогатого скота, лошадей и верблюдов) или 0,04 и 0,02 мл при исследовании сывороток овец, коз, оленей (маралов) и собак Затем в каждую пробирку добавляют по 1,0 мл антигена, разведенного соответствующим раствором хлорида натрия 1:20. При этом разведения сывороток будут соответственно 1:50 и 1:100 или 1:25 и 1:50.
При постановке реакции агглютинации одновременно с испытуемыми сыворотками ставят контроли с негативной и позитивной бруцеллезной сыворотками в таких же разведениях.
После добавления к испытуемым и контрольным сывороткам антигена штативы с пробирками встряхивают для смешивания компонентов и помещают в термостат при 37 - 38 °С на 16 - 20 ч, затем выдерживают при комнатной температуре в течение 1 ч и проводят учет реакции.
4.2.4. Учет реакции агглютинации. Результаты реакции учитывают визуально, определяя степень просветления жидкости, внешний вид агглютината (при его наличии) или антигена на дне пробирки до и затем, после легкого встряхивания, оценивают в крестах по следующей схеме:
++++ (4 креста) - полное просветление жидкости, микробные клетки антигена осели на дно пробирки в виде "зонтика", при легком встряхивании "зонтик" разбивается на хлопья и комочки, а жидкость остается прозрачной (100 % агглютинации);
+++ (3 креста) - неполное просветление жидкости и хорошо выраженный "зонтик" (75 % агглютинации);
++ (2 креста) - неполное просветление жидкости, "зонтик" умеренно выражен (50 % агглютинации);
+ (1 крест) - едва заметное просветление жидкости, "зонтик" выражен слабо, при встряхивании заметно небольшое количество хлопьев или комочков (25 % агглютинации);
- (минус) - просветления жидкости и образования "зонтика" не наступило, на дне пробирки по центру образуется небольшой осадок микробов антигена в виде точки или пятна. При встряхивании осадок легко разбивается, поднимается вверх в виде косички и равномерно распределяется в жидкости, которая при этом приобретает первоначальную мутность.
За титр антител принимают наибольшее разведение сыворотки, в котором произошла агглютинация на 2 креста (++), что соответствует количеству международных единиц (ME) антител в 1 мл сыворотки (например, сыворотка с титром 1:100 содержит 100 ME, 1:200 - 200 ME и т.д.).
Для более объективной оценки результатов РА в крестах готовят стандарты мутности, соответствующие 75, 50, 25 и 0 % просветления жидкости.
В четыре пробирки последовательно наливают 1, 2, 3 и 4 мл антигена, разведенного 1:10. Затем в том же порядке в три первые пробирки добавляют 3, 2 и 1 мл физиологического раствора. В четвертую пробирку раствор не добавляют. После встряхивания пробирок из каждой из них переносят по 0,5 мл в серологические пробирки и добавляют по 0,5 мл физиологического раствора. Полученные стандарты соответствуют 75, 50 и 25 % просветления жидкости. В четвертой пробирке просветление отсутствует. Стандарты мутности готовят каждый раз при постановке РА и выдерживают в термостате одновременно с основной реакцией.
При массовых исследованиях в двух разведениях все сыворотки, давшие агглютинацию с оценкой не менее чем на 2 креста (++) в каком-либо из указанных разведений, исследуют повторно в четырех разведениях.
4.2.5. Диагностическая оценка реакции агглютинации
Реакцию считают положительной при наличии агглютинации с сывороткой крови крупного рогатого скота (буйволов, яков, зебу), верблюдов и лошадей, не иммунизированных или иммунизированных неагглютиногенными противобруцеллезными вакцинами (см. Прил. № 2, п. 7), содержащей 200 ME антител и выше; овец и коз - 100 ME и выше; оленей (маралов) и собак - 50 ME и выше; пушных зверей и морских свинок - 10 ME и выше.
При выявлении среди не иммунизированных противобруцеллезными вакцинами, а также иммунизированных неагглютиногенными вакцинами крупного рогатого скота, верблюдов и лошадей, животных, реагирующих только в РА с содержанием антител 50 - 100 ME, а среди овец, коз, оленей (маралов), собак - 25 ME, считают сомнительно реагирующими и исследуют повторно через 15 - 30 сут. При повышении титров заболевание считают установленным. При сохранении титров на прежнем уровне проводят дополнительные исследования по дифференциации, согласно утвержденным методам.
При выявлении в стадах крупного рогатого скота, ранее иммунизированного против бруцеллеза агглютиногенными вакцинами (см. Прил. № 2, п. 7), животных, реагирующих только в РА с содержанием не выше 200 ME антител и РСК в разведении сыворотки крови не выше 1:10, их повторно исследуют через 15 - 30 сут. в РА, РСК и РИД. При повышении содержания антител в исследуемых сыворотках в РА и (или) РСК или положительной РИД заболевание считают установленным.
При выявлении в неблагополучных по бруцеллезу стадах крупного рогатого скота, ранее не иммунизированных или иммунизированных противобруцеллезными вакцинами, животных, положительно реагирующих в РА с содержанием 100 ME антител и выше, признают больными. Реакцию считают сомнительной при содержании 50 ME антител. Сыворотки крови от таких животных через 15 - 30 сут исследуют повторно. При получении вновь сомнительного результата животных признают больными бруцеллезом.
При исследовании в РА неиммунизированных баранов-производителей, козлов, пробников и ярок, содержащихся в благополучных по бруцеллезу отарах, где овцы (козы) иммунизированы против бруцеллеза, реакцию считают положительной, а заболевание установленным при содержании в сыворотке крови животных 100 ME антител и выше. Реакцию считают сомнительной при наличии 50 ME антител. Сыворотки крови от таких животных через 15 - 30 сут. исследуют повторно. При получении вновь сомнительных результатов животных признают здоровыми, а отару - благополучной по бруцеллезу.
В заключении лаборатории о результатах исследования должна быть сообщена диагностическая оценка каждой пробы (положительная, сомнительная, отрицательная) и конечное разведение (титр) сыворотки, в котором получен соответствующий результат, выраженный в международных единицах (например: титр сыворотки крови крупного рогатого скота 1:200 с оценкой 2 - 4 креста - "положительная" 200 ME; титр сыворотки 1:100 с оценкой 2 - 4 креста - "сомнительная" 100 ME).
Суммарные результаты исследования испытуемых сывороток, серию антигена, срок его годности, а также титр позитивной сыворотки записывают в журнал серологических исследований.
4.3. Постановка и учет реакции связывания комплемента (РСК) и реакции длительного связывания комплемента (РДСК)
4.3.1. Реакцию связывания комплемента применяют при диагностике бруцеллеза у крупного рогатого скота (буйволов, яков, зебу), овец, коз, свиней, верблюдов, лошадей, оленей (маралов), собаки пушных зверей.
Реакцию длительного связывания комплемента, как более чувствительную, применяют вместо РСК при исследовании на бруцеллез сывороток крови животных.
4.3.2. Компоненты реакции и их подготовка к работе:
- испытуемые сыворотки крови (см. п. 2.3.1);
- позитивная бруцеллезная сыворотка, изготовленная биопредприятием или полученная от больного бруцеллезом животного;
- негативная сыворотка (сыворотка крови здоровых животных из опыта или консервированная), изготовленная на биопредприятии или полученная в лаборатории.
Испытуемые и контрольные (позитивную и негативную) сыворотки инактивируют в водяной бане в день постановки реакции: для РСК - при 60 - 62 °С в течение 30 мин (сыворотки крови ослов и мулов - 64 - 65, буйволов - 62 - 64, свиней - 58 - 60 °С); для РДСК - сыворотки крови животных всех видов - при 63 - 64 °С в течение 30 мин;
- антиген бруцеллезный единый для РА, РСК и РДСК в рабочем титре, указанном биопредприятием-изготовителем (см. Прил. № 2, п. 6);
- комплемент - сыворотка крови морской свинки, лиофильно высушенная, биофабричного изготовления или нативная (свежая или консервированная добавлением 2 - 4 % борной кислоты).
Сухой биофабричный комплемент растворяют физиологическим раствором, как указано на этикетке коробки. Берут такое количество ампул (флаконов), в которых содержится необходимое для проведения всего опыта количество комплемента. В каждую ампулу (флакон) вносят физиологический раствор и, не встряхивая, помещают в холодильник на 20 - 30 мин. Растворившийся комплемент осторожно перемешивают путем легкого встряхивания ампул (флаконов), сливают в одну пробирку, смешивают и помещают в холодильник при 4 - 10 °С. Непосредственно перед внесением в пробирки для титрования растворенный или нативный комплемент разводят физиологическим раствором 1:20, а остальной - хранят в холодильнике для постановки главного опыта. Рабочее разведение комплемента также готовят непосредственно перед внесением в пробирки главного опыта;
- гемолитическая сыворотка (гемолизин) - сыворотка крови кролика, гипериммунизированного эритроцитами барана, - для РСК и РДСК в удвоенном титре. Титрование гемолизина проводят при использовании каждой новой серии и по истечении срока годности (см. Прил. № 2, п. 5);
- эритроциты барана - 2,5 %-ная от осадка взвесь эритроцитов барана в физиологическом растворе для РСК и РДСК (см. Прил. № 2, п. 3).
Для приготовления гемолитической системы взвесь эритроцитов и раствор гемолизина в рабочем разведении смешивают в равных объемах и при постановке РСК выдерживают в водяной бане при 37 - 38 °С в течение 15 - 20 мин при периодическом перемешивании, а при постановке РДСК - в холодильнике. При смешивании компонентов раствор гемолизина вливают во взвесь эритроцитов;
- физиологический раствор - 0,85 %-ный раствор химически чистого хлорида натрия в дистиллированной воде с pH 6,8 - 7,2 или физиологический раствор, содержащий ионы магния и кальция (см. Прил. № 2, п. 2). Последний в обязательном порядке готовят в случае использования нативного комплемента (свежей или консервированной сыворотки крови морской свинки).
Рабочие разведения всех компонентов для РСК или РДСК готовят перед постановкой реакции и при необходимости проверяют их на антикомплементарность и гемотоксичность по следующей схеме:
|
Компоненты реакции |
Проверка на: |
||||
|
антикомплементарность |
гемотоксичность |
||||
|
комплемента |
гемолизина |
антигена |
физиологического раствора |
||
|
Комплемент в разведении 1:20 |
0,2 |
0,2 |
- |
- |
- |
|
Гемолизин в рабочем разведении |
0,2 |
- |
0,2 |
- |
- |
|
Антиген в рабочем разведении |
0,4 |
- |
- |
0,4 |
- |
|
Эритроциты 2,5 %-ная взвесь |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Физиологический раствор |
- |
0,6 |
0,6 |
0,4 |
0,8 |
|
водяная баня при 37 - 38 °С |
|||||
|
Результат |
Гемолиз |
Полная задержка гемолиза |
|||
В реакциях используют компоненты, не обладающие антикомплементарными и гемотоксическими свойствами.
4.3.3. Постановка реакции связывания комплемента
Реакцию проводят в водяной бане при 37 - 38 °С в объеме 1 мл (по 0,2 мл сыворотки, антигена, комплемента и 0,4 мл гемолитической системы).
Перед каждой постановкой главного опыта проводят титрование комплемента в бактериолитической системе на сыворотке из опыта, т.е. того вида животных, которых исследуют (см. табл. 1), или в гемолитической системе (см. Прил. № 2, п. 4). Если в пробирках с сывороткой и антигеном отмечают задержу гемолиза по сравнению с той же сывороткой без антигена, это означает, что для титрования была взята положительная сыворотка. В таком случае определение титра комплемента проводят по ряду пробирок без антигена.
Сыворотку разводят 1:5 физиологическим раствором (1 мл сыворотки + 4 мл физиологического раствора), инактивируют, как указано в подпункте 4.3.2, и вносят по 0,2 мл в два ряда по 10 пробирок Затем в пробирки каждого ряда вносят комплемент.
Для более точной дозировки вначале готовят необходимые разведения комплемента в десятикратных объемах в отдельных пробирках дополнительного ряда. В пробирки вносят комплемент, разведенный 1:20 (1,0 + 19,0 физраствора), в дозах 0,2; 0,4; 0,6 мл и т.д. до 2 мл и добавляют в каждую пробирку недостающее до 2 мл количество физиологических) раствора, т.е. соответственно 1,8; 1,6; 1,4 мл и т.д. по следующей схеме:
|
Доза комплемента |
0,02 |
0,04 |
0,06 |
0,08 |
0,1 |
0,12 |
0,14 |
0,16 |
0,18 |
0,2 |
|
Комплемент 1:20 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
1,2 |
1,4 |
1,6 |
1,8 |
2,0 |
|
Физиологический раствор |
1,8 |
1,6 |
1,4 |
1,2 |
1,0 |
0,8 |
0,6 |
0,4 |
0,2 |
- |
Из первой пробирки этого ряда переносят по 0,2 мл жидкости в первые пробирки с сывороткой, взятой для титрования, из второй пробирки - соответственно во вторые пробирки с сывороткой и т.д. Работу можно выполнять аппаратом Флоринского.
Титрование можно проводить путем внесения микропипеткой в пробирки каждого ряда с сывороткой комплемента, разведенного 1:20 (0,1 + 1,9 физраствора), в возрастающих дозах от 0,02 до 0,2 мл с интервалом 0,02 мл и добавления недостающего до 0,2 мл (в каждой пробирке) количества физиологического раствора.
После внесения комплемента в первый ряд пробирок с сывороткой вносят по 0,2 мл антигена в рабочем разведении, а во второй ряд - по 0,2 мл физиологического раствора, смешивают путем встряхивания штатива и ставят в водяную баню при 37 - 38 °С на 20 мин. Затем во все пробирки добавляют по 0,4 мл гемолитической системы, смешивают путем встряхивания и вновь помещают в водяную баню на 20 мин, после чего учитывают результат.
Схема титрования комплемента в бактериолитической системе представлена в таблице 1.
СХЕМА ТИТРОВАНИЯ КОМПЛЕМЕНТА В БАКТЕРИОЛИТИЧЕСКОЙ СИСТЕМЕ
|
Компоненты реакции |
Ряд пробирок |
Номера пробирок |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
Сыворотка из опыта 1:5 |
первый |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
второй |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
|
водяная баня 30 мин при 58 - 65 °С |
|||||||||||
|
Антиген в рабочем разведении |
первый |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
второй |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Физиологический раствор |
первый |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
второй |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
|
Доза комплемента в разведении 1:20 |
первый |
0,02 |
0,04 |
0,06 |
0,08 |
0,1 |
0,12 |
0,14 |
0,16 |
0,18 |
0,2 |
|
второй |
0,02 |
0,04 |
0,06 |
0,08 |
0,1 |
0,12 |
0,14 |
0,16 |
0,18 |
0,2 |
|
|
Физиологический раствор |
первый |
0,18 |
0,16 |
0,14 |
0,12 |
0,1 |
0,08 |
0,06 |
0,04 |
0,02 |
- |
|
второй |
0,18 |
0,16 |
0,14 |
0,12 |
0,1 |
0,08 |
0,06 |
0,04 |
0,02 |
- |
|
|
водяная баня 20 мин при 37 - 38 °С |
|||||||||||
|
Гемолитическая система |
первый |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
второй |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
|
водяная баня 20 мин при 37 - 38 °С |
|||||||||||
|
Примерный результат |
первый |
ЗГ |
ЗГ |
ЗГ |
ЧГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
|
второй |
ЗГ |
ЗГ |
ЧГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
|
Титром комплемента в бактериолитической системе считают его минимальное количество, вызывающее полный гемолиз эритроцитов в пробирках с негативной сывороткой или позитивной сывороткой без антигена в течение 20 мин в водяной бане при 37 - 38 °С.
Учет результатов титрования проводят немедленно после выемки штатива из бани.
В примере, приведенном в таблице 1, титр комплемента в баксистеме равен 0,1. Рабочий титр комплемента для главного опыта на 0,02 больше, т.е. 0,12.
Схема титрования комплемента в гемолитической системе приведена в таблице 1 Приложения № 2.
Титром комплемента в гемолитической системе считают его минимальное количество, вызывающее полный гемолиз эритроцитов в течение 10 мин в водяной бане при 37 - 38 °С.
В приведенном примере титр комплемента в гемолитической системе равен 0,08. Рабочий титр комплемента для главного опыта на 0,04 больше, т.е. 0,12.
Количество комплемента, необходимого для проведения главного опыта, рассчитывают по формуле:
![]()
где: Х - количество комплемента;
А - рабочий титр комплемента;
В - количество пробирок в опыте;
20 - исходное разведение комплемента (1:20).
![]()
Так как количество комплемента в рабочем разведении, требующемся для всей реакции (на 100 пробирок), равно 20 мл (0,2×100), то к 0,6 мл нативного комплемента следует добавить 19,4 мл физиологического раствора.
4.3.4. Проведение главного опыта
Испытуемые сыворотки исследуют в разведениях 1:5 и 1:10 с антигеном и 1:5 без антигена (контроль на антикомплементарность сывороток), при массовом исследовании реакцию проводят в одной пробирке в разведении сыворотки 1:5 с антигеном (см. таблицу 2).
Необходимые разведения сывороток готовят следующим образом:
- при исследовании в одной пробирке к 0,05 мл испытуемой сыворотки добавляют 0,2 мл физиологического раствора (разведение 1:5);
- при постановке реакции в трех пробирках в первую вносят 0,1 мл испытуемой сыворотки, добавляют 0,4 мл физиологического раствора (разведение 1:5) и смешивают. Из первой пробирки берут 0,3 мл, переносят 0,2 мл во вторую пробирку и 0,1 мл - в третью, в которую затем добавляют 0,1 мл физиологического раствора (разведение 1:10).
Инактивирование разведенных сывороток проводят в порядке, указанном в подпункте 4.3.2.
Сыворотку, физиологический раствор и другие компоненты реакции вносят при помощи индивидуальных пипеток (дозаторов) или аппарата Флоренского и др.
Реакцию проводят по схеме главного опыта (см. таблицу 2).
СХЕМА ГЛАВНОГО ОПЫТА РСК
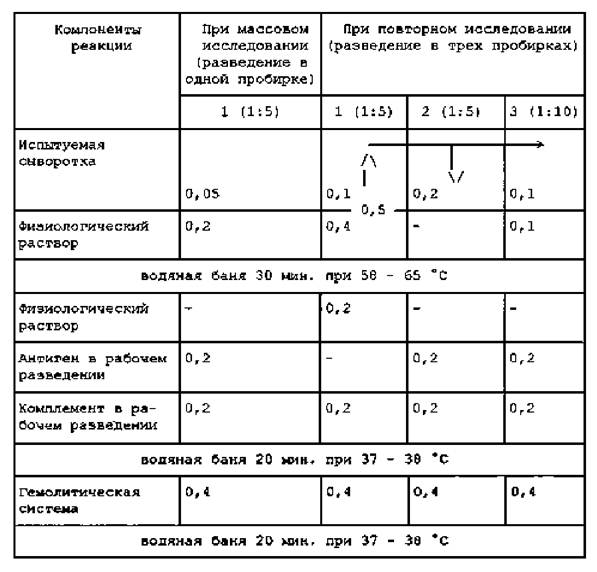
Примечание. Допускается смешивание равных объемов рабочих разведений антигена и комплемента непосредственно перед внесением в пробирки.
Главный опыт сопровождается следующими контролями:
- негативной и позитивной бруцеллезной сывороток в разведении 1:5 и 1:10 с антигеном и 1:5 без антигена (по схеме главного опыта);
- гемолитической системы (0,4 мл гемолитической системы и 0,6 мл физиологического раствора);
- комплемента (0,2 мл комплемента в рабочем разведении; 0,4 мл физиологического раствора и 0,4 мл гемолитической системы);
- антигена (0,2 мл антигена в рабочем разведении; 0,4 мл физраствора и 0,4 мл гемолитической системы).
4.3.5. Постановка реакции длительного связывания комплемента (РДСК)
Реакцию длительного связывания комплемента на холоде проводят в серологических пробирках. Сыворотку, антиген и комплемент вносят по 0,2 мл, гемолитическую систему - в оттитрованной рабочей дозе.
ПОСЛЕДОВАТЕЛЬНОСТЬ ПОСТАНОВКИ РДСК
|
Первый день |
Розлив испытуемых и контрольных сывороток для главного опыта и для титрования гемолитической системы. |
|
|
Инактивирование сывороток |
|
|
Контроль компонентов реакции на антикомплементарность и гемотоксичность (по схеме 4.3.2). |
|
|
Розлив антигена и комплемента. |
|
|
Приготовление гемолитической системы. |
|
|
Выдерживание пробирок главного опыта, титрации гемсистемы и гемсистемы в холодильнике |
|
Второй день |
Выдерживание пробирок главного опыта, титрации гемсистемы и гемолитической системы при комнатной температуре 20 минут. |
|
|
Титрование гемолитической системы. |
|
|
Главный опыт. Розлив гемолитической системы в пробирки с исследуемыми сыворотками. Водяная баня. |
|
|
Учет и оценка результатов реакции |
Испытуемые сыворотки исследуют в разведениях 1:5 и 1:10 с антигеном и 1:5 без антигена (контроль на антикомплементарность сыворотки), при массовом исследовании реакцию проводят в одной пробирке в разведении сыворотки 1:5 с антигеном (см. табл. 6). Одновременно разливают сыворотки для титрования гемолитической системы. Разведения сывороток готовят, как указано в подпункте 4.3.3. Инактивирование разведенных сывороток крови проводят, как указано в подпункте 4.3.2, гемсистему готовят по п. 4.3.2.
Комплемент применяют в рабочем разведении 1:25 или 1:20 при титре 0,06 - 0,1 или 1:20 - 1:15 при титре 0,1 - 0,14, указанном на этикетке коробки с препаратом, изготовленным биопредприятием. Если титр комплемента неизвестен или используется сыворотка крови морской свинки, то титр определяют в гемсистеме и разводят, как указано выше.
Перед внесением гемолитической системы в пробирки с исследуемыми сыворотками проводят титрование гемолитической системы на сыворотке из опыта (свежей или консервированной) по схеме, приведенной в таблице 3.
СХЕМА ТИТРОВАНИЯ ГЕМОЛИТИЧЕСКОЙ СИСТЕМЫ
|
Компоненты реакции |
Ряд пробирок в штативе |
Номера пробирок |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
||
|
Сыворотка из опыта в разведении 1:5 |
первый |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
второй |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
|
водяная баня 30 мин при 63 - 64 °С |
|||||||||||
|
Физиологический раствор |
первый |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
второй |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
|
Антиген в рабочем разведении |
первый |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
второй |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
|
Комплемент в рабочем разведении |
первый |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
второй |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
|
холодильник 16 - 18 ч при 2 - 6 °С |
|||||||||||
|
Гемолитическая система |
первый |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
1,0 |
|
второй |
0,1 |
0,2 |
0,3 |
0,4 |
0,5 |
0,6 |
0,7 |
0,8 |
0,9 |
1,0 |
|
|
водяная баня 20 мин при 37 - 38 °С |
|||||||||||
|
Примерный результат |
первый |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ЗГ |
НГ |
НГ |
|
второй |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ЗГ |
ЗГ |
НГ |
|
Учет результатов титрования проводят немедленно после выемки штатива из бани.
Титром гемолитической системы считают наибольшее ее количество, в котором произошел полный гемолиз в обоих рядах пробирок с негативной сывороткой или в безантигенном ряду, если исследуемая сыворотка оказалась позитивной. Рабочая доза на один интервал ниже (например: при титре гемолитической системы 0,7 мл рабочая доза - 0,6 мл).
Внесение компонентов и последовательность постановки реакции проводят по схеме, указанной в таблице 4.
СХЕМА ПОСТАНОВКИ РДСК
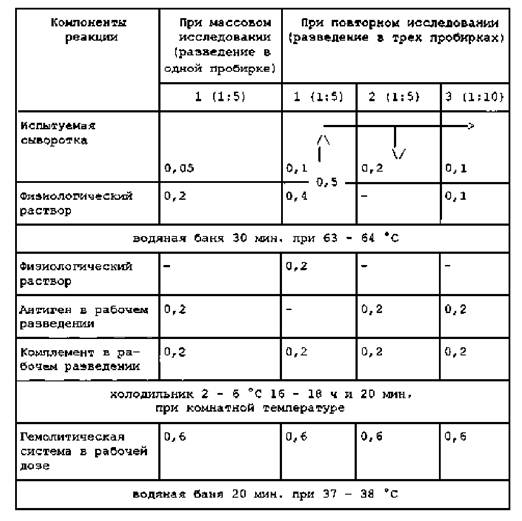
Контроли реакции:
- негативная и позитивная бруцеллезная сыворотки в разведении 1:5 и 1:10 с антигеном и 1:5 без антигена (по схеме главного опыта);
- гемолитическая система в рабочей дозе без сыворотки, антигена и комплемента (0,6 мл гемсистемы и 0,6 мл физраствора);
- антиген без сыворотки и комплемента (0,2 мл антигена в рабочем разведении; 0,4 мл физраствора и 0,6 мл гемсистемы).
4.3.6. Учет результатов в РСК и РДСК
Реакцию связывания комплемента и реакцию длительного связывания комплемента учитывают визуально. При постановке реакции в одной пробирке (при массовом исследовании) учет проводят один раз - сразу после извлечения штативов из водяной бани. При исследовании в трех пробирках - через 3 - 4 ч, когда в контрольных пробах с позитивной бруцеллезной сывороткой эритроциты осядут на дно пробирки, или на следующий день (в этом случае штативы с пробирками главного опыта оставляют в холодильнике).
Результаты реакции оценивают в крестах по следующей схеме:
++++ (4 креста) - отсутствие гемолиза, надосадочная жидкость прозрачная и бесцветная, осадок 100 % эритроцитов на дне пробирки;
+++ (3 креста) - гемолиз 25 % эритроцитов, осадок 75 % эритроцитов;
++ (2 креста) - гемолиз 50 % эритроцитов, осадок 50 % эритроцитов;
+ (1 крест) - гемолиз 75 % эритроцитов, осадок 25 % эритроцитов;
- (минус) - гемолиз 100 % эритроцитов, осадок эритроцитов отсутствует, жидкость интенсивно окрашена гемоглобином.
Степень гемолиза эритроцитов при необходимости определяют по шкале, которую готовят перед учетом реакции. Для этого из реакции выбирают 5 пробирок с полным гемолизом и жидкость из них сливают в одну.
Из этой жидкости готовят разведение с меньшим процентом гемолиза по следующей схеме:
|
Номера пробирок |
1 |
2 |
3 |
4 |
5 |
|
Гемолизированная жидкость |
1,0 |
0,75 |
0,5 |
0,25 |
- |
|
Физиологический раствор |
- |
0,25 |
0,5 |
0,75 |
1,0 |
|
Процент гемолиза |
100 |
75 |
50 |
25 |
0 |
|
Оценка в крестах |
- |
+ |
++ |
+++ |
++++ |
Процент гемолиза эритроцитов в пробирках с исследуемыми сыворотками определяют путем сравнения со шкалой и выражают в крестах.
4.3.7. Диагностическая оценка РСК и РДСК
Реакцию считают:
- положительной - при задержке гемолиза на 2 - 4 креста в одном или в двух разведениях сыворотки (1:5 или 1:10) и полном гемолизе эритроцитов в контрольной пробирке (без антигена);
- сомнительной - при задержке гемолиза с оценкой в один крест в одном или двух разведениях сыворотки и полном гемолизе эритроцитов в контрольной пробирке (без антигена);
- отрицательной - при полном гемолизе эритроцитов в двух (трех) пробирках.
В благополучных по бруцеллезу хозяйствах при получении сомнительного результата сыворотки крови этих животных исследуют повторно через 15 - 30 сут. Животных, сыворотки крови которых дали дважды сомнительную РСК (РДСК), считают реагирующими отрицательно.
В неблагополучных по бруцеллезу хозяйствах при получении дважды сомнительного результата в РСК (РДСК) животных считают реагирующими положительно.
В благополучных по бруцеллезу стадах крупного рогатого скота, ранее вакцинированного против бруцеллеза, животных, реагирующих положительно только в РСК (РДСК) в разведении сыворотки не выше 1:10, считают реагирующими сомнительно и проводят повторные исследования через 15 - 30 сут. При повышении титра заболевание считают установленным. В случае сохранения титра в РСК (РДСК) на прежнем уровне, животных считают здоровыми, а хозяйство - благополучным по данному заболеванию.
4.4. Постановка и учет реакции иммунодиффузии (РИД) с 0-полисахаридным антигеном
4.4.1. Реакция иммунодиффузии (РИД) с 0-полисахаридным антигеном (0-ПС антиген) основана на выявлении специфических антител, синтезирующихся в организме животных, инфицированных возбудителем бруцеллеза.
4.4.2. Применение РИД с 0-ПС антигеном при диагностике бруцеллеза крупного рогатого скота
4.4.2.1. В благополучных по бруцеллезу крупного рогатого скота хозяйствах, где противобруцеллезные вакцины не применяют:
- при плановых исследованиях одновременно с РА (РА и РИД);
- для исследования сыворотки крови животных, сомнительно реагирующих в РА или (и) РСК (РДСК);
- для дифференциации неспецифических реакций, обусловленных родственной с бруцеллами микрофлорой, в том числе и иерсиниями.
4.4.2.2. В благополучных по бруцеллезу крупного рогатого скота хозяйствах, где проводится иммунизация животных агглютиногенными противобруцеллезными вакцинами:
- при плановых исследованиях животных одновременно с РА (РА и РИД);
- при контроле эпизоотического состояния животных по бруцеллезу, но не ранее, чем через 1,5 мес. после вакцинации;
- для дифференциации реакций, полученных в РА (не выше 200 ME) или (и) РСК (РДСК) не выше, чем в разведении 1:10.
4.4.2.3. В неблагополучных по бруцеллезу крупного рогатого скота хозяйствах:
- через 1,5 мес. после иммунизации или очередной реиммунизации противобруцеллезными агглютиногенными вакцинами с целью раннего выявления больных бруцеллезом животных;
- для более полного выявления инфицированных животных, особенно среди телок и нетелей, целесообразно проведение 2 - 4-кратных исследований сыворотки крови животных в течение первых 6 месяцев после иммунизации (реиммунизации);
- через 6 месяцев после иммунизации (реиммунизации) животных для оздоровления стада от бруцеллеза в комплексе реакций, предусмотренных нормативными документами по профилактике и борьбе с бруцеллезом;
- при снятии с хозяйств ограничений по бруцеллезу одновременно с РА, РСК (РДСК) и другими реакциями, утвержденными в установленном порядке.
4.4.3. Применение РИД с 0-ПС антигеном при диагностике бруцеллеза северных оленей
4.4.3.1. В благополучных по бруцеллезу хозяйствах, где противобруцеллезные вакцины не применяют:
- при плановых исследованиях одновременно с РА (РА и РИД);
- для исследования сыворотки крови животных, сомнительно реагирующих в РА или (и) РСК (РДСК);
- для дифференциации неспецифических реакций, обусловленных родственной с бруцеллами микрофлорой, в том числе и иерсиниями.
4.4.3.2. В благополучных по бруцеллезу хозяйствах, где животных иммунизируют против бруцеллеза агглютиногенными вакцинами:
- при плановых исследованиях одновременно с РА (РА и РИД) для оценки эпизоотического состояния по бруцеллезу не ранее чем через 2 мес. после иммунизации;
- для исследования сыворотки крови животных, сомнительно реагирующих в РА или (и) РСК (РДСК);
- для дифференциации неспецифических реакций, обусловленных родственной с бруцеллами микрофлорой, в том числе и иерсиниями.
4.4.3.3. В неблагополучных по бруцеллезу хозяйствах:
- с целью более раннего выявления больных бруцеллезом животных, но не ранее чем через 2 мес. после иммунизации против бруцеллеза агглютиногенными вакцинами;
- при снятии ограничений с хозяйства одновременно с РА, РСК (РДСК) и другими реакциями, утвержденными в установленном порядке.
4.4.4. Применение РИД с 0-ПС антигеном при диагностике бруцеллеза овец и коз
4.4.4.1. В благополучных по бруцеллезу мелкого рогатого скота хозяйствах, где противобруцеллезные вакцины не применяют:
- при плановых исследованиях одновременно с РА (РА и РИД);
- при исследовании сыворотки крови животных, сомнительно реагирующих в РА или (и) РСК (РДСК);
- для дифференциации неспецифических реакций, обусловленных родственной с бруцеллами микрофлорой, в том числе и иерсиниями.
4.4.4.2. В благополучных по бруцеллезу мелкого рогатого скота хозяйствах, где проводится иммунизация животных противобруцеллезными агглютиногенными вакцинами:
- для дифференциальной диагностики бруцеллеза овец и коз не ранее чем через 5 мес., только после однократной их иммунизации противобруцеллезными агглютиногенными вакцинами;
- для дифференциации неспецифических реакций, обусловленных родственной с бруцеллами микрофлорой, в том числе и иерсиниями.
4.4.4.3. В неблагополучных по бруцеллезу мелкого рогатого скота хозяйствах:
- с целью более раннего выявления больных бруцеллезом животных не ранее чем через 5 мес., только после однократной иммунизации противобруцеллезными агглютиногенными вакцинами;
- при снятии ограничений с неблагополучных по бруцеллезу хозяйств одновременно с РА, РСК (РДСК) и другими реакциями, утвержденными в установленном порядке.
4.4.5. Компоненты реакции
4.4.5.1. Для постановки РИД применяется тест-система, основой которой является 0-ПС антиген.
4.4.5.2. В состав тест-системы входит:
- 0-ПС антиген;
- контрольная положительная сыворотка;
- хлорид натрия;
- микробиологический агар.
4.4.5.3. Подготовка тест-системы к постановке реакции. Приготовление 10 % раствора хлорида натрия. Содержимое ракета с NaCl растворяют в 700 мл дистиллированной воды.
Приготовление 0,8 %-го раствора агара. Навеску агара переносят из флакона в колбу с 700 мл 10 %-ного раствора хлорида натрия и помещают в кипящую водяную баню. После расплавления агара содержимое колбы фильтруют через ватный фильтр. Приготовленный агар можно хранить при температуре 2 - 8 °С в течение 14 сут.
Приготовление геля для реакции иммунодиффузии. Отфильтрованный раствор агара расплавляют и разливают в чашки Петри, на поверхность стеклянных предметных стекол, стеклянных пластинок, помещенных на горизонтальный столик (в чашки Петри толщиной слоя не менее 2 мм); на предметное стекло - 2,5 мл; на стеклянную пластину размером 6×9 см - 12,5 мл. После застывания геля в нем штампом пробивают лунки: центральную диаметром 3 мм и по окружности 6 лунок диаметром по 5 мм. Агаровый гель из лунок удаляют с помощью вакуумного насоса или препаровальной иглы.
Для исследования используют сыворотки крови животных неконсервированные или консервированные (см. п. 2.3.1). Мутные, проросшие, гемолизированные сыворотки крови исследованию в РИД не подлежат.
4.4.5.4 Постановка реакции
Реакцию иммунодиффузии выполняют в чашках Петри или на стеклянных пластинках различных размеров, в зависимости от количества проб. Для исследования 5 - 35 проб используют чашки Петри; до 11 - предметные стекла; до 35 - пластинки размером 6×9 см; при большом количестве исследуемых проб можно использовать стекла большего размера.
В центральную лунку вносят 20 мкл 0-ПС антигена, а в периферические - по 40 мкл исследуемых сывороток крови.
На каждой пластинке (стекле) или чашке Петри ставят контроль с положительной сывороткой.
Стекла (чашки Петри) после внесения компонентов помещают во влажную камеру (эксикатор) при 18 - 24 °С.
4.4.5.5. Учет результатов
Учет результатов проводят визуально в косом проходящем свете с помощью осветителя ОИ-19 или аналогичного через 24 и 48 ч после постановки реакции.
Линия преципитации между лунками с антигеном и исследуемой сывороткой, сформировавшаяся через 24 ч, свидетельствует о положительной реакции.
Сыворотки крови, давшие линию преципитации через 48 ч, подлежат перестановке.
Линия преципитации, сформировавшаяся через 24 или 48 ч при перестановке, свидетельствует о положительной реакции.
4.4.5.6. Оценка реакции
При получении положительной РИД животное признают больным бруцеллезом.
4.5. Постановка и учет результатов пластинчатой реакции агглютинации с бруцеллезным роз бенгал антигеном (роз бенгал проба или РБП)
4.5.1. Пластинчатую реакцию агглютинации с бруцеллезным роз бенгал антигеном (РБП) применяют как экспресс-метод диагностики бруцеллеза у не иммунизированного противобруцеллезными вакцинами крупного рогатого скота, овец, коз, верблюдов, лошадей и северных оленей (маралов).
4.5.2. Компоненты РБП:
- испытуемые сыворотки крови (см. подпункт 2.3.1);
- антиген, окрашенный бенгальским розовым (роз бенгал антиген) (см. Прил. № 2, п. 6);
- позитивная бруцеллезная и негативная сыворотки;
- 0,5 %-ный фенолизированный физиологический раствор (см. Прил. № 2, п. 1).
4.5.3. Постановка РБП
Для массовых диагностических исследований используют "Комплект инструментов и приспособлений для проведения серологических исследований на бруцеллез сыворотки крови животных" (КИ), выпускающийся отечественной промышленностью. В состав КИ входят:
- шприц-полуавтомат (капельница) для дозирования сыворотки;
- пипетка-капельница для дозирования антигена;
- ручной смеситель на 25 лунок диагностической пластины;
- аппарат для автоматического покачивания диагностических пластин.
Перед постановкой реакции антиген и исследуемые сыворотки выдерживают 30 - 40 мин при комнатной температуре. Антиген гомогенизируют путем встряхивания.
Реакцию проводят на чистых сухих эмалированных диагностических пластинах с лунками при температуре не ниже 18 °С. На бортиках пластинки против каждой лунки записывают номер исследуемой сыворотки.
Исследуемые сыворотки крови в дозе 0,03 мл вносят на дно лунки при помощи шприца-полуавтомата (одна капля), микропипетки или дозатора. После внесения каждой сыворотки шприц-полуавтомат (микропипетку) трижды промывают фенолизированным физиологическим раствором и кончик подсушивают фильтровальной бумагой. При исследовании сывороток крови крупного рогатого скота, лошадей, верблюдов в каждую лунку рядом с сывороткой при помощи пипетки-капельницы для антигена из КИ или микропипетки вносят 0,03 мл (две капли) антигена, а при исследовании сывороток крови овец, коз и северных оленей (маралов) - 0,015 мл (одну каплю) антигена. Затем антиген в каждой лунке тщательно смешивают с сывороткой активными движениями ручного смесителя до получения однородной жидкости, распределяя ее при этом по всей поверхности лунки. После смешивания сывороток во всех лунках пластинки смеситель ополаскивают фенолизированным физиологическим раствором и просушивают марлевой салфеткой или фильтровальной бумагой.
Пластинку с сыворотками и антигеном покачивают в течение 4 мин осторожными вращательными движениями вручную или при помощи аппарата, предназначенного для этой цели. При положительной реакции в течение 4 мин появляются мелкие или крупные хлопья агглютината розового цвета.
В начале работы ставят контроль антигена с негативной и позитивной бруцеллезной сыворотками в тех же дозах, а также антигена на спонтанную агглютинацию (к 0,03 мл физиологического раствора добавляют 0,03 мл антигена).
4.5.4. Учет результатов реакции проводят визуально в течение 4 мин после смешивания сывороток с антигеном при слегка наклонном положении пластинки.
Реакцию считают положительной при наличии выраженной агглютинации окрашенных бруцелл антигена в виде мелких или крупных хлопьев розового цвета, выделяющихся на белом фоне лунки.
Реакцию считают отрицательной при отсутствии агглютинации (смесь гомогенна, равномерно окрашена).
При нечетко выраженной агглютинации проводят повторное исследование данной сыворотки и по его результатам дают окончательную оценку реакции (положительная или отрицательная).
После учета реакции пластинки дезинфицируют погружением на 5 мин в 2,5 - 5 %-ный раствор хлорамина, затем обрабатывают моющим средством, промывают водопроводной водой, высушивают на воздухе и используют повторно.
4.5.5. Диагностическая оценка РБП
В благополучных по бруцеллезу хозяйствах все сыворотки крови от животных, с которыми получена положительная РБП, в тот же или на другой день исследуют в РА и РСК (РДСК) или РА и РИД.
Если при исследовании в РА и РСК (РДСК) или РА и РИД будут получены отрицательные результаты, то у всех животных, давших положительную РБП, через 15 - 30 сут. вновь берут кровь и исследуют на бруцеллез в РА и РСК (РДСК) или РА и РИД. При получении отрицательных результатов животных признают здоровыми и исследование на бруцеллез прекращают. В случае получения положительных или сомнительных результатов, их оценку проводят в соответствии с действующими санитарными и ветеринарными правилами.
В неблагополучных по бруцеллезу хозяйствах при получении положительных результатов исследования в РБП сывороток крови овец, коз и северных оленей (маралов) животных признают больными бруцеллезом; сыворотки крови крупного рогатого скота, верблюдов и лошадей в тот же или на следующей день исследуют в РА и РСК (РДСК) или РА и РИД. Животных, давших положительные результаты исследований, признают больными бруцеллезом. При получении сомнительных результатов таких животных повторно исследуют в РА, РСК (РДСК) или РА и РИД через 15 - 30 сут. При получении положительных или сомнительных результатов в одной или двух реакциях их считают больными бруцеллезом.
4.6. Постановка и учет кольцевой реакции с молоком (КР)
4.6.1. Кольцевую реакцию с молоком применяют с целью определения благополучия стад (ферм) по бруцеллезу крупного рогатого скота (буйволов) и для проверки молока при продаже его на рынках.
Исследование молока на бруцеллез в КР разрешается проводить в лабораториях или непосредственно в хозяйствах только ветеринарным врачам ветеринарных лабораторий, а также лабораторий ветеринарно-санитарной экспертизы, прошедшим специальную подготовку по постановке и учету данной реакции.
4.6.2. Компоненты реакции:
- исследуемое молоко (см. подпункт 2.3.2);
- антиген бруцеллезный для кольцевой реакции с молоком (см. Прил. № 2, п. 6);
- сыворотка бруцеллезная позитивная.
4.6.3. Постановка кольцевой реакции
Перед исследованием молоко тщательно перемешивают путем энергичного встряхивания для равномерного распределения сливок.
Реакцию ставят в серологических пробирках Флоринского, которые нумеруют в соответствии с описью проб молока. В пробирки вносят по 2 мл молока. После каждой пробы пипетку двукратно промывают теплой водой. Антиген вносят по 0,1 мл в каждую пробирку с пробой молока. После внесения антигена в каждые 10 проб штатив с пробирками энергично встряхивают для равномерного распределения препарата в молоке.
При постановке реакции в уленгутовских пробирках сначала в каждую вносят антиген по 0,05 мл, затем шприцем с иглой длиной 50 - 60 мм, нажимая на поршень слабыми толчками, вливают в них по 1 мл молока и тщательно смешивают его с антигеном. После каждой пробы молока шприц двукратно промывают теплой водой.
При постановке реакции одновременно с испытуемыми пробами молока ставят следующие контрольные пробы:
- молоко от заведомо здоровой коровы (буйволицы);
- смесь молока здоровой коровы (буйволицы) с позитивной бруцеллезной сывороткой (0,1 мл сыворотки на 2 мл молока).
Штативы с испытуемыми и контрольными пробами молока помещают в термостат или водяную баню при температуре 37 - 38 °С на 1 ч и затем выдерживают 30 мин при комнатной температуре.
4.6.4. Учет и оценка результатов кольцевой реакции
Результаты реакции учитывают визуально через 30 - 40 мин после извлечения штативов из водяной бани (термостата) в крестах по следующей схеме:
+++ (3 креста) - четко выраженное синее (красно-вишневое) кольцо в верхней части столбика молока в слое сливок, остальная часть молока остается белой;
++ (2 креста) - четко выраженное синее (красно-вишневое) кольцо в верхней части столбика молока в слое сливок, остальная часть молока имеет синеватый или бледно-розовый цвет;
+ (1 крест) - синее (красно-вишневое) кольцо в слое сливок выражено слабо и весь столбик молока имеет синий (розовый) цвет;
- (минус) - столбик молока остается равномерно окрашенным в первоначальный синий (красно-вишневый) цвет, который был получен сразу после смешивания с антигеном, а слой сливок - белого или слегка желтоватого цвета.
Все пробы молока, давшие кольцевую реакцию с оценкой 3 и 2 креста, считают положительными, 1 крест - сомнительными.
При получении отрицательных результатов КР по всему стаду его считают благополучным по бруцеллезу.
При получении положительного или сомнительного результата КР берут кровь от всех животных данного стада (группы, населенного пункта) для исследования на бруцеллез в РА и РСК (РДСК) или РА и РИД, проводят эпизоотологическое обследование хозяйства, клинический осмотр животных и исследование на заболевание маститами.
Отрицательный результат исследования сывороток крови в РА и РСК (РДСК) или РА и РИД у всех животных свидетельствует об их благополучии по бруцеллезу, независимо от результатов, полученных в КР.
При получении положительных результатов исследования сыворотки крови на бруцеллез с животными стада поступают в соответствии с действующими санитарными и ветеринарными правилами. При этом изолируют также и животных, выделенных при исследовании молока в КР, если эта реакция не была связана с другими заболеваниями животных.
5. МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ ДИАГНОСТИКА БРУЦЕЛЛЕЗА
5.1. Тест-система предназначена для выявления ДНК бактерий рода Brucella (В. melitensis, В. abortus, В. suis, В. ovis, В. earns) в биологическом материале от животных, не иммунизированных противобруцеллезными вакцинами, в случае аборта или проявления у них других признаков (бурситы, гигромы, орхиты, эпидидимиты), вызывающих подозрение на бруцеллез, и (или) при получении положительных и сомнительных результатов серологического исследования.
ПЦР-анализ состоит из 3-х этапов: выделение ДНК из исследуемого материала; собственно полимеразная цепная реакция (ПЦР) - амплификация специфического участка ДНК бруцелл; электрофоретический анализ продуктов ПЦР и учет результатов ПЦР-анализа. Амплификация специфического участка ДНК происходит за счет многократного повторения циклов денатурации ДНК в исследуемой пробе, отжига специфических олигонуклеотидных затравок (праймеров) и синтеза комплементарных цепей ДНК с помощью фермента Так-полимеразы.
В данной тест-системе используется внутренний контрольный образец (ВКО Brucella sp.), позволяющий контролировать эффективность ПЦР-анализа для каждой исследуемой пробы. ВКО представляет собой фрагмент ДНК фага лямбда.
В состав тест-системы, рассчитанной на проведение 100 анализов, входят:
- набор для выделения ДНК (набор "ДНК-сорб-В");
- набор для проведения ПНР (набор "Ампли-Сенс-100");
- набор для электрофоретического анализа продуктов ПЦР (набор "ЭФ-200");
- набор контрольных образцов (может быть вложен в набор "Ампли-Сенс-100").
5.1.1. Набор для выделения ДНК состоит из следующих компонентов:
|
Лизирующий раствор |
1 флакон, 30,0 мл |
|
Раствор для отмывки 1 |
1 флакон, 30,0 мл |
|
Раствор для отмывки 2 |
1 флакон, 100,0 мл |
|
Суспензия сорбента |
2 пробирки по 1,25 мл |
|
ТЕ-буфер для элюции ДНК |
2 пробирки по 5,0 мл. |
5.1.2. Набор для проведения ПЦР состоит из следующих компонентов:
|
ПЦР-смесь-1 "Brucella sp." |
1 пробирка, 0,55 мл |
|
ПЦР-смесь-2 |
1 пробирка, 1,2 мл |
|
Воск для ПЦР |
1 пробирка, 1,7 мл |
|
Масло минеральное |
1 пробирка, 4,0 мл. |
5.1.3. Набор для электрофоретического анализа продуктов ПЦР состоит из следующих компонентов:
|
Концентрат ТБЕ-буфера с бромидом этидия |
1 флакон, 50,0 мл |
|
Агароза для электрофореза |
2 пробирки по 1,8 г. |
5.1.4. Набор контрольных образцов состоит из следующих компонентов:
|
Положительный контрольный образец (ПКО) |
1 пробирка, 0,1 мл |
|
ДНК Brucella abortus |
|
|
ДНК-буфер для разведения и хранения ДНК |
1 пробирка, 1,0 мл |
|
Внутренний контрольный образец (ВКО) |
1 пробирка, 1,0 мл |
|
Brucella sp. |
|
|
Отрицательный контрольный образец (ОКО) |
1 пробирка, 1,6 мл. |
Допускается другая фасовка компонентов, согласованная в установленном порядке.
5.1.5. На пробирки (флаконы) с каждым компонентом наборов 5.1.1, 5.1.2, 5.1.3, 5.1.4 должны быть наклеены этикетки с указанием краткого наименования компонента, количества в пробирке, номера серии и даты изготовления. Компоненты каждого набора упаковывают в отдельные запаиваемые пакеты из полиэтилена. На каждый пакет наклеивают этикету с указанием наименования набора, перечня компонентов, входящих в набор, количества пробирок каждого компонента, количества препарата в каждой пробирке, номера серии набора, условий хранения, даты изготовления, срока годности.
Комплект наборов 5.1.1, 5.1.2, 5.1.3, 5.1.4 упаковывают в картонную коробу На каждую коробку наклеивают этикетку, на которой указывают: наименование предприятия-изготовителя, полное наименование тест-системы, перечень наборов, входящих в тест-систему, номер серии, номер контроля, дату изготовления, срок годности, условия хранения, обозначение ТУ и надпись "Для животных". В каждую коробку вкладывают наставление по применению тест-системы.
5.1.6. Транспортируют и хранят тест-систему при температуре 2 - 8 °С. В процессе работы комплекты для выделения ДНК и для электрофоретического анализа продуктов ПЦР можно хранить при температуре 2 - 25 °С в темном сухом месте, а комплект для проведения ПЦР и комплект контрольных образцов - при температуре 2 - 8 °С.
5.1.7. Срок годности тест-системы - 6 мес. с даты изготовления.
5.2. Отбор материала для исследования
5.2.1. При отборе образцов материала, а также при подготовке проб для исследования необходимо соблюдать меры, предупреждающие заражение людей и контаминирование объектов внешней среды, руководствуясь при этом действующими правилами и инструкциями.
5.2.2. Материал от каждого животного отбирают отдельными пипетками и инструментами.
5.2.3. Для исследования используют следующий патматериал:
- содержимое брюшной полости и желудка, селезень, печень абортированного плода или весь плод;
- плаценту и плодовые оболочки от абортировавших животных;
- содержимое бурс, гигром;
- кровь и молоко от абортировавших животных и (или) от животных, в сыворотке которых обнаружены агглютинины и (или) комплементсвязывающие антитела;
- сперму от самцов с признаками орхита и эпидидимита и (или) при получении сомнительных или положительных результатов аллергического или серологического исследования на бруцеллез или инфекционный эпидидимит баранов;
- в случае убоя животных для исследования отбирают парные лимфатические узлы подчелюстные, заглоточные, предлопаточные, надколенные, подколенные, надвыменные, парааортальные, тазовые и кусочки паренхиматозных органов (печень, селезенка); от самцов с признаками орхита или эпидидимита отбирают семенники с придатками.
5.2.4. Жидкости для исследования, кроме крови, отбирают в объеме 10 - 20 мл в посуду, обработанную по п. 5.3.1, из тканей и органов вырезают кусочки размером 5×5×5 см (при невозможности толщина кусочков может быть меньше), лимфатические узлы берут целиком.
5.2.5. Кровь в объеме 5 - 10 мл берут в пробирки с предварительно налитым 3 %-ным раствором трилона Б (ЭДТА) из расчета 10:1.
5.2.6. Патматериал доставляют в лабораторию в день взятия или на следующий день, сохраняя при 4 - 8 °С. Допускается хранение материала при минус 20 °С в течение 90 сут. Возможно лишь однократное замораживание-оттаивание материала. Лимфоузлы и паренхиматозные органы могут быть направлены в лабораторию законсервированными 30 %-ным раствором глицерина. Крупные плоды направляют в неконсервированном виде.
5.3. Подготовка исследуемого материала
5.3.1. При подготовке материала для исследования в ПЦР необходимо соблюдение условий, исключающих возможность механической контаминации его возбудителем бруцеллеза или его ДНК и получения по этой причине ложноположительных результатов реакции.
Инструментарий, лабораторная посуда, вода, растворы, соприкасающиеся с исследуемым материалом, должны быть свободными от живых или убитых клеток возбудителя бруцеллеза и их фрагментов. При этом следует учитывать, что обычно применяемые методы стерилизации (кипячение, автоклавирование и т.д.) недостаточны для разрушения ДНК.
Использование одноразовой посуды обеспечивает получение объективных результатов исследования. При невозможности соблюдения этого условия лабораторную посуду выдерживают в течение 2 ч в сухожаровом шкафу при температуре не ниже 180 °С или обрабатывают в течение 1 - 2 ч 1 %-ным раствором соляной кислоты, 10 %-ным раствором гипохлорита натрия или хлорамина Б, смесью концентрированной серной кислоты с двухромовокислым калием (хромпик, см. Приложение № 3) и затем промывают дистиллированной водой.
Инструментарий (ножницы, пинцеты и т.п.) фламбируют над пламенем горелки. Ступки и пестики после стерилизации фламбируют с помощью ватного тампона, смоченного спиртом.
5.3.2. Размороженные или отмытые от консервирующей жидкости лимфатические узлы и кусочки паренхиматозных органов освобождают от жировой ткани и просушивают фильтровальной бумагой. Затем с помощью пинцета погружают по одному в 96 %-ный спирт и сразу поджигают. После угасания пламени фламбирование повторяют.
Фламбирование каждого лимфоузла или кусочка паренхиматозного органа проводят не менее четырех раз.
При фламбировании биоматериала соблюдают меры противопожарной безопасности.
5.3.3. Все манипуляции, связанные с подготовкой проб, проводятся пипеточными дозаторами переменных объемов (типа "Ленпипет") с использованием одноразовых полипропиленовых пробирок на 1,5 мл и 10,0 мл (ПО "Ленполимер") и наконечников с аэрозольным барьером. Одноразовая пластиковая посуда (пробирки, наконечники) должна сбрасываться в специальный контейнер, содержащий дезинфицирующий 10 %-ный раствор хлорной извести или 5 %-ный раствор хлорамина Б. После 24-часовой выдержки раствор выливают в канализацию, а отработанный пластик выбрасывают в мусорный контейнер. Для отбора и обработки проб материала из лимфоузлов, паренхиматозных органов, плаценты, плодовых оболочек дополнительно требуются лабораторные стаканчики или ступки, гомогенизаторы, стеклянные палочки, пастеровские пипетки, которые после подготовки пробы должны обрабатываться хромпиком.
5.3.4. Пробы исследуемых жидкостей, кроме крови и спермы, в объеме 10 мл (при необходимости объем проб доводят до требуемого путем добавления физиологического раствора) центрифугируют при 10 тыс. об./мин в течение 10 мин. Если осадок практически не виден, то в эту же пробирку вносят еще 10 мл материала и повторяют центрифугирование. Супернатант осторожно отбирают, оставив над осадком примерно 0,2 мл жидкости. Осадок ресуспендируют в оставшейся надосадочной жидкости и 0,1 мл суспензии используют для выделения ДНК.
5.3.5. Пробы цельной крови, консервированной трилоном Б, используют для выделения ДНК без предварительной подготовки.
5.3.6. Сперму перемешивают на вортексе при низких оборотах. С крышки пробирки сбрасывают капли, переносят 50 мкл спермы в отдельную пробирку и добавляют в нее 50 мкл 0,05 % TWEEN. Содержимое пробирки тщательно перемешивают на вортексе на малых оборотах и центрифугируют при 3 тыс. об./мин в течение 30 с. В отдельную пробирку переносят 50 мкл надосадочной жидкости, добавляют к ней 50 мкл ОКО, перемешивают на вортексе и используют для выделения ДНК.
5.3.7. Пробы паренхиматозных органов, семенников, плодовых оболочек, плаценты и лимфатических узлов (каждую отдельно) размером 1×1×1 см помещают в профламбированные ступки и измельчают ножницами. Затем материал в ступках тщательно растирают с прокаленным битым стеклом, добавляют 5 - 15 мл дистиллированной воды и перемешивают.
Подготовку проб для выделения ДНК можно осуществлять другим способом с использованием стерильных пастеровских пипеток с предварительно надпиленными и отломленными оттянутыми концами на 1 см выше начала сужения.
Пипетку путем легкого надавливания и вращения погружают в образец материала. Каждую пробу отбирают отдельной пипеткой. Пробу материала, заполнившую пипетку, переносят в универсальную пластиковую пробирку или толстостенную стеклянную пробирку с предварительно налитой стерильной дистиллированной водой в объеме 2 - 3 мл и измельчают до получения гомогенной взвеси. С этой целью в пробирку с пробой материала вносят стерильную пастеровскую пипетку с отломленным на 1 - 2 мм кончиком и, легко надавливая, осуществляют вращательные движения попеременно в одну и другую сторону, постепенно разрушая оттянутую часть. Для измельчения каждой пробы материала используют 1 - 2 пипетки.
Полученную взвесь отстаивают при температуре 20 - 25 °С в течение 30 мин, затем верхнюю фазу по 0,4 - 0,5 мл переносят пипеткой с одноразовым стерильным наконечником с аэрозольным барьером или стерильной пастеровской пипеткой в пробирки вместимостью 1,5 мл. Для выделения ДНК используют 0,1 мл.
В исходный материал в виде суспензии ткани, крови, молока и спермы, оставшийся в лаборатории, добавляют 20 % глицерина и хранят его в замороженном виде до окончания исследования.
5.4. Проведение ПЦР-анализа
ПЦР-анализ проводят в три этапа в трех отдельных комнатах (зонах).
5.4.1. Для работы требуются следующие материалы и оборудование:
ЗОНА-1 - для выделения ДНК из исследуемого материала:
- настольный бокс с бактерицидной лампой (например, "Циклотемп" СП "РТС") или стерильный ламинарный шкаф (например, БОВ-001-АМС, г. Миас);
- твердотельный термостат для пробирок типа "эппендорф" на 25 - 100 °С (например, "Биоком");
- вакуумный отсасыватель с колбой-ловушкой (например, ОМ-1, г. Ульяновск);
- микроцентрифуга для микропробирок типа "эппендорф" до 16 тыс. об./мин (например, "Еlmi", "Hettish", "Eppendorf);
- центрифуга/вортекс "Micro-Spin", "Minigen" (например, "Биоком");
- набор автоматических пипеток переменного объема (например, "Ленпипет");
- одноразовые полипропиленовые плотно закрывающиеся пробирки на 1,5 мл ("QSP", "Sarstedt");
- одноразовые наконечники для пипеток переменного объема с аэрозольным барьером до 200 и до 1000 мкл ("QSP");
- одноразовые наконечники для пипеток переменного объема до 200 и до 1000 мкл (например, "Ленпипет", "QSP");
- штативы для микропробирок, наконечников ("Хеликон", "Ленпипет");
- отдельный халат и одноразовые резиновые перчатки;
- холодильник на 2 - 8 °С с морозильной камерой;
- емкость с дезинфицирующим раствором.
ЗОНА-2 - для проведения амплификации (ПЦР):
- амплификатор (например, "Терцик", "ДНК-технология");
- ПЦР-бокс или отдельный стол, освещаемый УФ-лампой (например, "Циклотемп" СП "РТС");
- отдельный халат и одноразовые перчатки;
- отдельный набор автоматических пипеток переменного объема (например, "Ленпипет");
- одноразовые наконечники для микропипеток до 200 мкл (например, "Ленпипет");
- одноразовые полипропиленовые микропробирки для ПЦР на 0,5 (0,2) мл ("QSP");
- одноразовые наконечники с аэрозольным барьером до 200 мкл ("QSP");
- штативы для наконечников ("Ленпипет") и микропробирок на 0,5 (0,2) мл ("Хеликон");
- холодильник на 2 - 8 °С, морозильник на минус 20 °С для выделенных ДНК;
- твердотельный термостат для микропробирок на 95 °С (например, "Биоком");
- емкость с дезраствором для сброса наконечников.
ЗОНА-3 - для электрофоретического анализа продуктов ПЦР:
- камера для горизонтального электрофореза на 120 реакций (например, "SE-2", "Хеликон");
- источник постоянного тока на 150 - 200 В (например, "ДНК-технология");
- ультрафиолетовый трансиллюминатор с кабинетом для просмотра гелей (например, "Биоком");
- видеосистема с цифровой камерой для регистрации и передачи изображения (например, "Биотест-1" ЦНИИ Эпидемиологии, "Biorad").
В случае отсутствия видеосистемы допускается фиксирование результатов с помощью фотографирования на поляроидной пленке или пленке "Микрат-300", однако, при этом качество получаемого изображения не гарантировано, а также возможна контаминация лаборатории продуктами ПЦР при переносе материалов документирования в "чистое" помещение;
- дистиллятор;
- отдельный халат и одноразовые резиновые перчатки;
- отдельный набор автоматических пипеток переменного объема (например, "Ленпипет");
- мерный цилиндр вместимостью 1 л;
- колба коническая из термостойкого стекла для плавления агарозы на 250 мл;
- микроволновая печь (или электроплитка) для плавления агарозы;
- пластиковая емкость для дезактивации буфера и гелей, содержащих бромид этидия.
5.4.2. Порядок работы
Этап 1 (зона № 1). Выделение ДНК из исследуемого материала.
ВНИМАНИЕ! Необходимо помнить, что, во избежание перекрестной контаминации, открывать пробирку с исследуемым образцом можно только "сбросив" капли с крышки путем центрифугирования при 5 - 10 тыс. об./мин в течение 5 с.
1. Лизирующий раствор и раствор для отмывки 1, если они хранились при 2 - 8 °С, прогреть при 65 °С до полного растворения кристаллов. Проверить состояние сорбента: при отстаивании он должен занимать приблизительно половину объема суспензии.
2. Выставить в штативы необходимое количество одноразовых пробирок, включая отрицательный и положительный контроли выделения. Внести в каждую пробирку по 10 мкл внутреннего контрольного образца (ВКО), используя наконечники с аэрозольным барьером, и по 300 мкл лизируюшего раствора. Промаркировать пробирки.
3. В пробирки с лизирующим раствором и ВКО внести по 100 мкл проб, используя наконечники с аэрозольным барьером. В пробирку отрицательного контроля выделения (ОК) внести 100 мкл отрицательного контрольного образца (ОКО). В пробирку положительного контроля выделения (ПК) внести 90 мкл отрицательного контрольного образца (ОКО) и 10 мкл положительного контрольного образца (ПКО).
4. Пробы тщательно перемешать на вортексе, прогреть 5 мин при 65 °С и центрифугировать 5 с при 5 тыс. об./мин на микроцентрифуге. Если проба растворилась не полностью, центрифугировать пробирку на микроцентрифуге 5 мин при 10 - 12 тыс. об./мин и использовать для выделения ДНК надосадочную жидкость, перенеся ее в новую пробирку.
5. Тщательно ресуспендировать сорбент на вортексе. В каждую пробирку с исследуемыми пробами отдельным наконечником добавить по 25 мкл ресуспендированного сорбента. Перемешать на вортексе, выдержать при комнатной температуре в течение 10 мин, перемешивая на вортексе через каждые 2 мин, и оставить в штативе на 5 мин.
6. Осадить сорбент в пробирках центрифугированием при 5 тыс. об./мин в течение 30 с. Удалить супернатант в колбу-ловушку, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
7. Добавить в пробы по 300 мкл раствора для отмывки 1, перемешать на вортексе до полного ресуспендирования сорбента. Осадить сорбент центрифугированием при 5 тыс. об./мин на микроцентрифуге в течение 30 с. Удалить супернатант, не задевая осадка, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
8. Добавить в пробы по 300 мкл раствора для отмывки 2, перемешать на вортексе до полного ресуспендирования сорбента, центрифугировать 30 с при 10 - 12 тыс. об./мин. Отобрать супернатант, не задевая осадка, используя вакуумный отсасыватель и отдельный наконечник для каждой пробы.
9. Повторить процедуру отмывки, следуя пункту 8, отобрать супернатант полностью.
10. Поместить пробирки в термостат 65 °С на 5 - 10 мин для подсушивания сорбента. При этом крышки пробирок должны быть открыты.
11. В пробирки добавить по 50 мкл ТЕ-буфера для элюции ДНК. Перемешать на вортексе и поместить в термостат 65 °С на 5 мин, периодически встряхивая на вортексе.
12. Центрифугировать пробирки при 10 - 12 тыс. об./мин в течение 2 мин. Супернатант содержит очищенную ДНК. Пробы готовы к постановке ПЦР.
Этап 2 (зона № 2). Постановка ПЦР - амплификация участка ДНК.
Подготовка пробирок для постановки ПЦР
1. Пробирку с воском для ПЦР прогреть в термостате при 95 °С до полного расплавления воска.
2. Внести на дно микропробирок для амплификации по 5 мкл ПЦР-смеси-1 (нижней). Сверху добавить по капле (примерно 10 - 15 мкл) расплавленного воска так, чтобы он полностью накрыл жидкость. Закрыть крышки, на верхней части которых сделать пометки "БРУ". Если воск покрыл жидкость неровно или образовались пузыри, прогреть пробирки в амплификаторе 20 с при 95 °С, охладить и хранить при 2 - 8 °С. Можно подготовить сразу до 100 пробирок и хранить их в морозильнике.
3. В штатив поставить ряд пробирок с ПЦР-смесью-1 и воском в соответствии с количеством испытуемых проб, включая контрольные 1-го этапа анализа, продолжая ряд, добавить 2 пробирки для контролей 2-го этапа анализа. Промаркировать пробирки.
4. На поверхность воска внести по 10 мкл ПЦР-смеси-2 ("верхней"), при этом ПЦР-смесь-2 не должна проваливаться под воск и смешиваться с ПЦР-смесью-1. В противном случае пробирку выбраковывают.
5. Сверху добавить по капле минерального масла для ПЦР (примерно 25 мкл).
Подготовка контролей этапа ПЦР
1. Развести ДНК-буфером ПКО ДНК Brucella abortus в 10 раз. В отдельную пробирку внести 90 мкл ДНК-буфера и 10 мкл ПКО ДНК Brucella abortus, используя автоклавированный наконечник с аэрозольным барьером. Тщательно перемешать на вортексе и осадить капли с крышки пробирки центрифугированием при 5 тыс. об./мин в течение 5 с.
2. Развести ДНК-буфером ВКО Brucella sp. в 10 раз. Разведение готовить аналогично.
Основная часть работы
1. Взять подготовленные для ПЦР пробирки. Под масло или непосредственно на масло, используя наконечники с аэрозольными барьерами, внести по 10 мкл ДНК, выделенной из исследуемых и контрольных проб этапа выделения ДНК.
2. Три дополнительные пробирки предназначаются для контролей этапа ПЦР:
а) отрицательный контроль (К-) - вместо ДНК-пробы внести в подготовленную пробирку 10 мкл ДНК-буфера;
б) положительный контроль (К+) - внести в пробирку 10 мкл положительного контрольного образца ДНК, разведенного в 10 раз;
в) внутренний контроль (ВК+) - внести в пробирку 10 мкл положительного контрольного образца ДНК, разведенного в 10 раз.
3. Установить нужную программу амплификации (см. табл. 1).
Таблица 1
ПРОГРАММА ДЛЯ АМПЛИФИКАЦИИ ДНК БРУЦЕЛЛ
|
Цикл |
Амплификаторы с регулированием температуры по матрице (скорость нагрева-охлаждения не менее 1 °С/сек): "Ампли-3" (Биоком), "MiniCycler", "РТС-100" (MJ Research) |
Амплификаторы с активным регулированием (по раствору в пробирке): "GeneFmp PCR System 2400" (Perkin Elmer), "Omn-E" (Hibaid), "Терцик" (ДНК-технология) |
||||
|
температура |
время |
циклов |
температура |
время |
циклов |
|
|
1 |
95 °С |
2 мин |
1 |
95 °C |
2 мин |
1 |
|
2 |
95 °С |
1 мин |
42 |
95 °C |
10 с |
42 |
|
65 °С |
1 мин |
65 °C |
10 с |
|||
|
72 °С |
1 мин |
72 °C |
10 с |
|||
|
3 |
72 °С |
1 мин |
1 |
72 °C |
1 мин |
1 |
|
4 |
10 °С |
Хранение |
10 °С |
Хранение |
||
4. Когда температура в ячейке амплификатора достигнет 95 °С, поставить программу на паузу, поместить пробирки в ячейки амплификатора, закрыть крышку прибора и снять программу с паузы.
Время амплификации на амплификаторе с регулированием температур по матрице примерно 2 ч 30 мин, на амплификаторе с активным регулированием - 1 ч 50 мин.
5. После окончания реакции (в тот же день или утром следующего дня) пробирки отправить в зону № 3 для анализа продуктов ПЦР, который проводится разделением фрагментов ДНК в агарозном геле.
Этап 3 (зона № 3). Электрофоретический анализ продуктов ПЦР.
Работа с амплифицированными ДНК должна проводиться в отдельной комнате лаборантом или сотрудником лаборатории, не производящим манипуляций в пре-ПЦР помещении ("Правила проведения работ в диагностических лабораториях, использующих метод полимеразной цепной реакции. Основные положения", утвержденные 27 января 1997 г., № 13-7-2/840).
Приготовление рабочих растворов и агарозного геля
1. Приготовить рабочий электрофорезный буфер. В мерный цилиндр влить 25 мл концентрата ТБЕ-буфера с бромидом этидия, довести дистиллированной водой до 500 мл, закрыть цилиндр парафильмом и перемешать.
ВНИМАНИЕ! Этидия бромид - канцерогенное соединение, поэтому при работе с ним следует соблюдать правила безопасности: работать только в перчатках, избегать попадания на кожу и слизистые. При попадании на кожу и слизистые тщательно промыть соответствующий участок водой.
Все реагенты, содержащие этидия бромид, перед утилизацией следует подвергать специальной обработке (см. пункт дезактивация).
2. Агарозу из одного флакона пересыпать в стеклянную колбу из термостойкого стекла на 250 мл. Налить 100 мл готового рабочего буфера и плавить на электроплитке или в микроволновой печи до полного растворения агарозы (если используется электроплитка, содержимое колбы необходимо перемешивать стеклянной палочкой, чтобы предотвратить пригорание агарозы). После этого довести раствор агарозы до кипения еще два раза и остудить, вращая колбу, до 65 - 70 °С.
3. Выровнять столик для заливки гелей, залить расплавленный гель в форму камеры, установив гребенки на расстоянии не менее 3 см друг от друга так, чтобы они не касались дна. Толщина геля должна быть около 6 мм.
4. После полного застывания геля (30 мин при комнатной температуре) осторожно вынуть из него гребенки, не повредив лунки. Поместить подложу с готовым гелем в камеру, лунки должны располагаться ближе к отрицательному электроду. ДНК, соответственно, движется к положительному. Залить в камеру готового буфера столько, чтобы он сверху покрывал гель на 5 мм.
Основная часть работы
1. Пробирки с продуктами амплификации выставить в штатив последовательно, отобрать из-под слоя масла по 10 - 15 мкл проб и внести в лунки геля (если для внесения разных проб используется один и тот же наконечник, то его необходимо промывать буфером из камеры после каждой пробы). В каждом ряду лунок геля должен быть обязательно представлен К+ и, желательно, маркер молекулярных масс.
2. Подключить камеру к источнику тока, соблюдая полярность (ДНК движется к положительному электроду), и включить источник. Если нет нарушения контактов, то при прохождении тока от электродов должны подниматься пузырьки. Оптимальное напряжение 10 В/см геля.
3. Когда краситель ПЦР-смеси-2 пройдет примерно половину длины геля (не менее 1,5 см) выключить источник тока, перенести гель на трансиллюминатор, расположив полосы горизонтально. Получить изображение геля на компьютере с помощью видеосистемы, отмечая порядок нанесения проб, занести в базу данных.
При отсутствии видеосистемы электрофореграмму можно сфотографировать с оранжевым светофильтром в проходящем ультрафиолете на поляроидную пленку или "Микрат-300", отметив порядок нанесения проб. При просматривании геля и фотографировании глаза и лицо должны быть защищены специальной маской или стеклянной пластиной.
Следует помнить, что достоверность результатов и исключение риска контаминации лаборатории продуктами ПЦР гарантируется только при учете результатов с помощью цифровых методов.
4. После использования буфер и гели, содержащие бромид этидия, необходимо дезактивировать. Для этого к одному объему буфера и гелей добавляют равные объемы 0,5 М KMnO4 и 2,5 М HCl, выдерживают 4 - 6 часов, добавляют один объем NaOH, аккуратно перемешивают и сбрасывают нейтрализованные реактивы в канализацию.
5.5. Учет и интерпретация результатов
5.5.1. Учет результатов ПЦР-анализа следует начинать с результатов амплификации "контролей ПЦР" (таблица 2).
Таблица 2
УЧЕТ РЕЗУЛЬТАТОВ АМПЛИФИКАЦИИ КОНТРОЛЬНЫХ ОБРАЗЦОВ
|
|
Маркировка пробирки |
Название реагента |
Наличие полосы 770 п.н. |
Наличие полосы 460 п.н. |
|
"Контроли" 1-го этапа |
ОК |
ОКО |
+ |
- |
|
ПК |
ОКО + ПКО ДНК Brucella abortus |
+ |
+ |
|
|
"Контроли" 2-го этапа |
К+ |
ПКО ДНК Brucella abortus 1:10 |
- |
+ |
|
ВК+ |
ВКО Brucella sp. 1:10 |
+ |
- |
|
|
К- |
ДНК-буфер |
- |
- |
В дорожке, соответствующей положительному контролю амплификации "К+" ПКО ДНК Brucella abortus, должна быть яркая специфическая светящаяся полоса на уровне 460 п.н. (пар нуклеотидов); в дорожке, соответствующей положительному контролю амплификации ВКО Brucella sp. "ВК+", должна присутствовать полоса на уровне 770 п.н. Все амплификаты (за исключением двух контролей ПЦР "К+" и "К-") должны содержать полосу 770 п.н.
При интерпретации результатов анализа (таблица 3) положительными считают образцы, которые содержат специфическую светящуюся полосу на том же уровне, что и полоса с положительным контрольным образцом ПКО ДНК Brucella abortus, т.е. 460 п.н. большей или меньшей интенсивности.
В ярко положительных пробах может отсутствовать полоса ВКО и результат учитывают как положительный при условии правильного учета результатов анализа "контролей" (см. табл. 2 и 3, а также приложение № 4 - не приводится).
Таблица 3
ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ АНАЛИЗА
|
Результат ПЦР-анализа |
Результат амплификации исследуемой пробы |
|
|
Полоса 770 п.н. ВКО |
Полоса 460 п.н. ДНК Brucella sp. |
|
|
Положительный |
+ |
+ |
|
Положительный |
- |
+ |
|
Отрицательный |
+ |
- |
|
Недействительный |
- |
- |
Отрицательными считаются пробы, которые содержат только полосу ВКО.
Если в дорожке пробы, исследованной с отрицательным результатом, полоса внутреннего стандарта отсутствует, то отрицательный результат анализа данной пробы на ДНК Brucella sp. учитывать нельзя.
Кроме полос 460 и 770 п.н. могут наблюдаться нечеткие размытые полосы праймер-димеров, располагающиеся ниже уровня 100 п.н. (в нижней части дорожки), которые не учитывают.
Если результаты анализа контрольных образцов не совпадают с приведенными в таблице 3, то анализ считают недействительным и исследование повторяют.
При работе с такими материалами, как кровь, паренхиматозная ткань или лимфоузлы, в ПЦР участвует большое количество неспецифической геномной ДНК. При этом в дорожках геля появляются характерные шмеры, равномерно располагающиеся от лунки до самого низа дорожки или концентрирующиеся около лунки. На фоне шмера в положительном образце видна специфическая полоса, а в отрицательном образце она отсутствует. Однако большое количество геномной ДНК может ингибировать ПЦР (в дорожке отсутствует полоса ВКО). В этом случае следует переставить амплификацию данной ДНК-пробы, разведя ее в 5 раз буфером для элюции.
5.5.2. Результаты анализа не учитываются, если:
- в дорожке какой-либо пробы отсутствуют обе полосы. Необходимо повторить исследование этой пробы с самого начала. Причиной этого могут быть ошибки, допущенные при обработке исследуемого материала или при выделении ДНК (недостаточная сорбция ДНК, недостаточная очистка от ингибиторов реакции);
- в дорожках появляются неспецифические полосы на разных уровнях, отличных от 460 и 770 п.н. Возможные причины: отсутствие "горячего старта" или неверный температурный режим в ячейках амплификатора. Рекомендуется провести повторную ПЦР с теми же ДНК-пробами;
- следует провести повторную ПЦР, если специфическая полоса очень низкой интенсивности (гораздо ниже интенсивности положительных контролей). Если такой результат повторяется, то его считают сомнительным. Для уточнения результата необходимо повторное исследование;
- в дорожке любого отрицательного контроля (выделения ДНК и (или) ПЦР) выявляется специфическая полоса. Возможно произошла контаминация реактивов и проб. Требуется повторить анализ проб и предпринять меры по выявлению источника контаминации.
5.6. Оценка результатов
При положительном результате ПЦР, зарегистрированном при исследовании хотя бы одной пробы материала, животное считают больным бруцеллезом.
6. АЛЛЕРГИЧЕСКИЙ МЕТОД ДИАГНОСТИКИ БРУЦЕЛЛЕЗА ЖИВОТНЫХ
6.1. Метод аллергического исследования основан на выявлении у больных бруцеллезом животных повышенной чувствительности замедленного типа к специфическому аллергену.
6.2. Аллергический метод применяют для исследования на бруцеллез свиней с четырехмесячного возраста, не вакцинированных против бруцеллеза.
6.3. Аллергическое исследование на бруцеллез свиней разрешается проводить только ветеринарным врачам или фельдшерам со средним специальным образованием под наблюдением врача.
6.4. Для аллергической диагностики бруцеллеза у свиней применяют бруцеллин ВИЭВ.
Бруцеллин - стерильный биологический препарат, представляющий собой прозрачную жидкость коричневато-желтого цвета без опалесценции, содержащую продукты жизнедеятельности и специфические вещества, извлеченные из бруцелл.
Флаконы с бруцеллином должны быть плотно закрыты резиновыми пробками и закатаны алюминиевыми колпачками. При встряхивании и переворачивании флакона препарат не должен просачиваться через пробку. На каждом флаконе должна быть этикетка (или надпись) с обозначением наименования биопредприятия-изготовителя, наименования препарата и его количества, номера серии, даты выпуска, срока годности, условий хранения, стандарта (ГОСТ).
6.5. Бруцеллин используют только в день вскрытия флакона. Он пригоден для применения в течение 24 мес. со дня изготовления при условии хранения в темном сухом помещении при температуре плюс 2 - 15 °С.
6.6. Каждый флакон с бруцеллином перед применением осматривают. При обнаружении в препарате каких-либо примесей, плесени, хлопьев, при нарушении целостности стекла или укупорки, отсутствии надписи на флаконе, а также бруцеллин, подвергшийся замораживанию и давший осадок или помутнение, к применению не допускается.
6.7. Для введения животным бруцеллина используют иглы для внутрикожных инъекций с двумя трубками (№ 0706 ТУ 46-22-607-80) и шприцы, снабженные бегунком, вместимостью 2 мл. Можно применять также безыгольные инъекторы.
Шприцы и иглы перед и после их использования стерилизуют кипячением в течение 30 мин в дистиллированной или кипяченой воде без добавления дезинфицирующих средств. Безыгольные инъекторы стерилизуют в соответствии с инструкцией по их использованию.
Во время исследования животных инъекционные иглы меняют перед каждым наполнением шприца бруцеллином; в промежутках между инъекциями препарата иглу держат в ватном тампоне, смоченном 70 %-ным спиртом.
6.8. Непосредственно перед применением бруцеллина алюминиевый колпачок флакона с препаратом приоткрывают, резиновую пробку обрабатывают спиртом, прокалывают инъекционной иглой и шприцем через нее набирают необходимое количество аллергена.
Свиньям бруцеллин вводят внутрикожно с наружной стороны ушной раковины, ближе к основанию уха в дозе 0,2 мл. Правильность внутрикожной инъекции препарата контролируют по образованию бугорка размером с горошину.
При инъекции препарата животным обязательно соблюдение правил асептики. Участок кожи перед уколом протирают ватой, смоченной в спирте или 3 %-ном растворе борной кислоты.
6.9. У животных, больных бруцеллезом, на месте введения бруцеллина наступает воспалительная реакция в виде плотной или тестоватой припухлости, обычно хорошо видимой при осмотре. Кроме того, может развиться гиперемия, иногда кровоизлияние в виде темно-красного пятна в центре отека. У здоровых животных местная реакция не возникает.
6.10. Реакцию на бруцеллин у свиней учитывают два раза - через 24 и 48 ч после введения препарата путем осмотра, а при неясно выраженной реакции - пальпацией места инъекции. При обнаружении на месте введения препарата припухлости реакцию оценивают как положительную.
В случае неясно выраженной реакции пальпируют место введения препарата и сравнивают с кожей основания другого уха. Если обнаруживают хотя бы небольшую разницу, реакцию считают положительной. При отсутствии указанных признаков реакции результат исследования считают отрицательным.
Реагирующих на бруцеллин животных метят и выделяют из стада.
6.11. Свиней, положительно реагирующих в аллергической пробе, исследуют на бруцеллез в РСК (РДСК). Животных признают больными бруцеллезом только в том случае, если аллергическая проба подтверждается положительной РСК (РДСК).
При получении положительной РСК (РДСК) хозяйство (ферму) объявляют неблагополучным по бруцеллезу и проводят мероприятия в соответствии с действующими санитарными и ветеринарными правилами.
6.12. После применения бруцеллина у животных можно в любые сроки брать кровь для исследования на бруцеллез серологическим методом.
6.13. Проведение аллергического исследования на бруцеллез оформляют актом с приложением к нему описи реагировавших животных (указывают инвентарный номер, пол и возраст животных, характер реакции на бруцеллин). Один экземпляр акта направляют главному врачу района, другой хранят в хозяйстве.
Наставление по диагностике бруцеллеза животных от 29.09.03 № 13-5-02/0850 вводится в действие на территории Российской Федерации с 1 января 2004 г.
С выходом настоящего наставления утрачивает силу Наставление по диагностике бруцеллеза животных, утвержденное Департаментом ветеринарии Минсельхоза России 27.03.2000 № 13-7-2/1945.
Разработчики: д.в.н., профессор Шумилов К.В., с.н.с. Климанов А.И., к.в.н., с.н.с. Скляров О.Д., к.б.н., с.н.с. Мельниченко Л.П. (Федеральное государственное учреждение "Всероссийский государственный научно-исследовательский институт контроля, стандартизации и сертификации ветеринарных препаратов - Центр качества ветеринарных препаратов и кормов"), д.в.н., с.н.с. Альбертян М.П. (Государственное научное учреждение "Всероссийский научно-исследовательский институт экспериментальной ветеринарии им. Я.Р. Коваленко"), д.в.н., профессор Ощепков В.Г., к.в.н., с.н.с. Дегтяренко Л.В. (Государственное научное учреждение "Всероссийский научно-исследовательский институт бруцеллеза и туберкулеза животных"), Сидоркина Т.И. (Центральная научно-методическая ветеринарная лаборатория Минсельхоза Российской Федерации), д.в.н., профессор Белоусов В.И. (Департамент ветеринарии Минсельхоза Российской Федерации).
Приложение № 1
Окраска мазков по Стампу. Фиксированный на пламени мазок окрашивают в течение 10 мин раствором карболового фуксина Циля в разведении 1:10, слегка промывают водой и дифференцируют 0,5 %-ным раствором уксусной кислоты в течение 30 с. Вновь тщательно промывают водой и докрашивают 1 %-ным раствором метиленового синего в течение 20 - 30 с. Краску сливают, мазок промывают водой и просушивают фильтровальной бумагой.
Микроскопическая картина: бруцеллы - красные, другая микрофлора и фон препарата - синие.
Окраска мазков по Козловскому. Фиксированный на пламени мазок окрашивают 2 %-ным раствором сафранина, подогревая до появления пузырьков. Затем мазок быстро промывают водой и дополнительно окрашивают 0,75 - 1 %-ным водным раствором малахитового зеленого в течение 0,5 - 1 мин. Краску сливают, мазок промывают водой и просушивают фильтровальной бумагой.
Микроскопическая картина: бруцеллы - ярко-красные, другая микрофлора и фон препарата окрашены в зеленый цвет.
Раствор малахитового зеленого может быть заменен 1 %-ным раствором метиленового синего или бриллиантовой зелени.
Окраска мазков по Шуляку-Шин. Фиксированный на пламени мазок окрашивают в течение 2 мин карболовым фуксином Циля, разведенным 1:5, промывают водой и докрашивают в течение 5 мин 2 %-ным водным раствором метиленового синего. Краску сливают, мазок промывают водой и просушивают фильтровальной бумагой.
Микроскопическая картина: бруцеллы - ярко-красные, другая микрофлора и фон препарата окрашены в сине-голубой цвет.
2. ПРИГОТОВЛЕНИЕ ПИТАТЕЛЬНЫХ СРЕД
Мясная вода. Свежее мясо крупного рогатого скота освобождают от костей, жира и сухожилий и пропускают через мясорубку. 500 г фарша заливают одним литром водопроводной воды и выдерживают в течение 15 - 18 ч в прохладном месте. Затем настой кипятят в течение 30 - 40 мин, доливают дистиллированную воду до первоначального объема и фильтруют через ватно-марлевый фильтр или полотно. Полученную мясную воду стерилизуют при 120 °С в течение 20 мин.
Печеночная вода. Свежую печень крупного рогатого скота освобождают от жира, канальцев, пленок и пропускают через мясорубку. 500 г фарша заливают 1 л водопроводной воды, настаивают в течение 1 ч и кипятят при помешивании в течение 30 мин. После отстаивания фарш удаляют, в полученную жидкость доливают дистиллированную воду до первоначального объема и фильтруют через ватно-марлевый фильтр. Разливают по колбам, стерилизуют при 115 °С (0,7 атм.) в течение 30 мин.
Мясо-пептонный печеночно-глюкозо-глицериновый агар (МППГГА).
К 610 мл мясной воды добавляют 305 мл печеночной воды, 10 г пептона, 5 г х.ч. хлорида натрия и 20 - 30 г агар-агара, предварительно промытого и хорошо отжатого. Смесь варят в течение 1 ч в автоклаве, фильтруют через нейлоновый или ватно-марлевый фильтр, устанавливают pH 7,2 - 7,4, добавляют 10 г глюкозы и 20 мл глицерина. Среду разливают в пробирки или флаконы и стерилизуют при 115 °С (0,7 атм.) в течение 30 мин pH среды до стерилизации 7,2 - 7,4 после стерилизации 6,8 - 7,0.
Мясо-пептонный печеночный бульон (МППБ) готовят аналогично МППГГА, но без добавления агар-агара, глюкозы и глицерина.
Печеночный глюкозо-глицериновый агар (ПГГА). К печеночной воде добавляют 1 % пептона, 0,5 % х.ч. хлорида натрия и 2 - 3 % агар-агара, предварительно промытого и хорошо отжатого. Смесь варят в течение 1 ч в автоклаве, фильтруют через нейлоновый или ватный фильтр, устанавливают pH 7,2 - 7,4, добавляют 1 % глюкозы и 2 - 3 % глицерина. Среду разливают в пробирки или колбы и стерилизуют при 115 °С (0,7 атм.) в течение 30 мин. После стерилизации pH среды 6,8 - 7,0.
Печеночный глюкозо-глицериновый бульон готовят аналогично ПГГА, но без добавления агар-агара.
Картофельный агар. 500 г очищенного картофеля (берут белые или желтые клубни средней величины), нарезанного ломтиками, варят в одном литре водопроводной воды до готовности (избегать сильного разваривания картофеля). Затем отвар фильтруют через ватный фильтр и дистиллированной водой доводят объем до первоначального (1 л). К фильтрату добавляют 1 % пептона, 0,5 % х.ч. хлорида натрия и 2 - 3 % агар-агара. Смесь варят до полного расплавления агара, устанавливают pH 7,2 - 7,4 и отстаивают в теплом месте. В застывшем агаре срезают нижний слой с осадком, а прозрачную часть агара расплавляют и фильтруют через ватный фильтр. Вновь устанавливают pH 7,2 - 7,4, добавляют 1 % глюкозы и 3 % глицерина, разливают по пробиркам или колбам и стерилизуют при 115 °С (0,7 атм.) в течение 30 мин. После стерилизации pH среды - 6,8 - 7,0.
Сывороточно-декстрозный агар. К 835 мл дистиллированной воды добавляют 20 г агар-агара, 10 г пептона, 5 г х.ч. хлорида натрия и 165 мл мясной воды. Смешивают, кипятят до расплавления агара, устанавливают pH 7,8. Затем стерилизуют текучим паром в течение 1 ч, после чего пар закрывают, давление доводят до 2 атм. и нагреватель выключают. После автоклавирования среду отстаивают в течение 1 ч, затем фильтруют через ватный или бумажный фильтр, доводят pH до 7,2 - 7,4, разливают в колбы (пробирки, флаконы) и стерилизуют при 115 °С (0,7 атм.) в течение 30 мин. После стерилизации pH среды 6,8 - 7,0.
Перед употреблением среду расплавляют, охлаждают до 50 - 60 °С и добавляют к ней нормальную сыворотку крови крупного рогатого скота или лошади и раствор декстрозы, профильтрованные через стерилизующие пластины фильтра Зейтца. Конечная концентрация сыворотки в среде должна быть 10 %, декстрозы 1 %.
Печеночно-сывороточный и печеночно-аминопептидный агар.
К 1000 мл печеночной воды добавляют 10 г пептона, 5 г х.ч. хлорида натрия, 20 г агар-агара. К полученной смеси добавляют 17 мл 10 %-го раствора двууглекислой соды, автоклавируют при 115 °С (0,7 атм.) в течение 20 - 25 мин и фильтруют через ватный фильтр. Устанавливают pH 7,2 - 7,4 и добавляют 10 г глюкозы и 20 мл глицерина. Разливают в колбы и стерилизуют при 115 °С (0,7 атм.) в течение 20 мин. После стерилизации pH среды 6,8 - 7,0. Перед применением среду расплавляют, охлаждают до 50 - 60 °С и добавляют 10 - 20 % стерильной сыворотки крови крупного рогатого скота (овец) или 10 - 15 % аминопептида, затем разливают в пробирки или бактериологические чашки.
Эритрит агар. Представляет собой готовую питательную среду для выделения бруцелл. Готовится по прописи предприятия-изготовителя.
3. ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦИИ УГЛЕКИСЛОГО ГАЗА
В пробирку наливают 2 - 3 мл 0,1 %-го раствора бикарбоната натрия и добавляют 1 - 2 капли 0,5 %-ного раствора бромтимолового синего. В обычной атмосфере смесь имеет отчетливый синий цвет.
Пробирку ставят в эксикатор, в котором необходимо определить содержание углекислого газа. Учет проводят через 1 ч по изменению окраски смеси, пользуясь следующей таблицей:
|
Окраска смеси |
Процентное содержание СО2 в атмосфере эксикатора |
|
Синяя |
до 5 |
|
Сине-зеленая |
5 |
|
Зеленая |
10 |
|
Зелено-желтая |
15 |
|
Желтая |
20 |
Приложение № 2
1. ПРИГОТОВЛЕНИЕ ФЕНОЛИЗИРОВАННЫХ РАСТВОРОВ ХЛОРИДА НАТРИЯ ДЛЯ РА
Для приготовления фенолизированного 0,85; 5 и 10 %-го раствора хлорида натрия в 1000 мл дистиллированной воды растворяют соответственно 8,5; 50 или 100 г хлорида натрия и 5 г фенола. Доводят pH раствора до 6,8 - 7,2 и фильтруют через бумажный фильтр.
2. ПРИГОТОВЛЕНИЕ ФИЗИОЛОГИЧЕСКОГО РАСТВОРА ХЛОРИДА НАТРИЯ С ДОБАВЛЕНИЕМ ИОНОВ МАГНИЯ И КАЛЬЦИЯ (ДЛЯ РСК И РДСК)
Основные растворы солей магния и кальция готовят следующим образом: 1 г хлорида магния х.ч. растворяют в 11,8 мл и 1 г хлорида кальция х.ч. - в 54,4 мл дистиллированной воды. Основные растворы этих солей хранят в холодильнике.
Перед постановкой реакции берут на 1 л физиологического раствора хлорида натрия по 1,2 мл основных растворов хлорида магния и хлорида кальция. Смесь кипятят, охлаждают, фильтруют через бумажный фильтр и доводят pH до 6,8 - 7,2 прибавлением едкого натрия или соляной кислоты.
3. ПОЛУЧЕНИЕ И ПОДГОТОВКА К РАБОТЕ ЭРИТРОЦИТОВ БАРАНА ДЛЯ ПОСТАНОВКИ РСК И РДСК
Кровь у барана (овцы) берут из яремной вены с соблюдением правил асептики в сосуд со стеклянными или фарфоровыми бусами для дефибринирования или в сосуд с налитым в него раствором Алсивера в количестве, равном объему крови.
Для консервирования дефибринированной крови применяют раствор стрептомицина (1 г стрептомицина, растворенного в 20 мл физиологического раствора, на 100 мл крови).
Дефибринированная кровь пригодна для использования в течение 3 сут., консервированная стрептомицином или раствором Алсивера - до 12 сут.
Приготовление раствора Алсивера: в 1000 мл дистиллированной воды растворяют 18,7 г глюкозы, 4,2 г хлорида натрия, 8,0 г лимоннокислого натрия, 0,5 г лимонной кислоты. Раствор доводят до кипения, охлаждают, фильтруют через бумажный фильтр, разливают в колбы или флаконы и стерилизуют путем трехкратного автоклавирования текучим паром в течение 30 мин или путем фильтрации через стерилизующую пластину фильтра Зейтца.
Для приготовления суспензии эритроцитов свежую дефибринированную или консервированную кровь барана вносят в центрифужный стакан, добавляют физиологический раствор в соотношении не менее чем 8:1, перемешивают и центрифугируют при 2000 - 3000 об./мин в течение соответственно 15 - 10 мин, надосадочную жидкость сливают или отсасывают пипеткой, а осадок эритроцитов еще 2 - 3 раза отмывают в физиологическом растворе в указанном порядке до полного обесцвечивания надосадочной жидкости. После каждого центрифугирования осадок ресуспендируют путем перемешивания в новой порции физиологического раствора. После последнего центрифугирования надосадочную жидкость полностью отсасывают пипеткой при возможно более горизонтальном положении стакана, отмытую кровь вручную перемешивают активными круговыми движениями или с помощью пипетки и используют для приготовления гемсистемы.
4. ТИТРОВАНИЕ КОМПЛЕМЕНТА В ГЕМОЛИТИЧЕСКОЙ СИСТЕМЕ В РСК
Комплемент титруют в разведении 1:20 в дозах от 0,02 до 0,2 мл, которые готовят по п. 4.3.3.
После внесения комплемента в каждую пробирку добавляют остальные компоненты по схеме, приведенной в таблице 1.
СХЕМА ТИТРОВАНИЯ КОМПЛЕМЕНТА В ГЕМОЛИТИЧЕСКОЙ СИСТЕМЕ
|
Компоненты |
Номера пробирок |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
Доза комплемента в разведении 1:20 |
0,02 |
0,04 |
0,06 |
0,08 |
0,1 |
0,12 |
0,14 |
0,16 |
0,18 |
0,2 |
|
Физиологический раствор |
0,18 |
0,16 |
0,14 |
0,12 |
0,1 |
0,08 |
0,06 |
0,04 |
0,02 |
- |
|
Гемолитическая система |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
Физиологический раствор |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
водяная баня 10 минут при 37 - 38 °С |
||||||||||
|
Примерный результат |
ЧГ |
ЧГ |
ЧГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
Титром комплемента в гемолитической системе считают его наименьшее количество, вызывающее полный гемолиз эритроцитов в течение 10 мин в водяной бане при 37 - 38 °С.
Учет результатов титрования проводят немедленно после выемки штатива из водяной бани.
В примере, приведенном в таблице 1, титр комплемента в гемолитической системе равен 0,08.
5. ТИТРОВАНИЕ ГЕМОЛИЗИНА
Гемолизин титруют в разведении 1:500, 1:750, 1:1000, 1:1250, 1:1500, 1:1750, 1:2000 по схеме, приведенной в таблице 2.
Таблица 2
СХЕМА ТИТРОВАНИЯ ГЕМОЛИЗИНА
|
Компоненты |
Разведения гемолизина |
||||||
|
1:500 |
1:750 |
1:1000 |
1:1250 |
1:1500 |
1:1750 |
1:2000 |
|
|
Гемолизин |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Комплемент в разведении 1:20 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Эритроциты (2,5 %-ная взвесь) |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
0,2 |
|
Физиологический раствор |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
0,4 |
|
водяная баня 10 мин при 37 - 38 °С |
|||||||
|
Примерный результат |
ПГ |
ПГ |
ПГ |
ПГ |
ПГ |
ЧГ |
ЧГ |
Разведения гемолизина готовят из исходного 1:100 (0,1 мл гемолизина смешивают с 9,9 мл физиологического раствора) по следующей схеме:
|
Основное разведение гемолизина 1:100 (мл) |
Физиологический раствор (мл) |
Получаемые разведения |
|
0,2 |
0,8 |
1:500 |
|
0,2 |
1,3 |
1:750 |
|
0,2 |
1,8 |
1:1000 |
|
0,2 |
2,3 |
1:1250 |
|
0,2 |
2,8 |
1:1500 |
|
0,2 |
3,3 |
1:1750 |
|
0,2 |
3,8 |
1:2000 |
Титром гемолизина считают наименьшее его количество, необходимое для полного гемолиза в течение 10 мин 0,2 мл взвеси эритроцитов в присутствии 0,2 мл комплемента, разведенного 1:20. В приведенной таблице 2 титр гемолизина равен 1:1500.
Рабочий титр гемолизина для РСК и РДСК составляет удвоенную дозу от титра. Так, если титр гемолизина равен 1:1500, то рабочий титр в РСК и РДСК будет 1:750.
6. БРУЦЕЛЛЕЗНЫЕ АНТИГЕНЫ, ИСПОЛЬЗУЕМЫЕ В СЕРОЛОГИЧЕСКИХ РЕАКЦИЯХ
Антиген бруцеллезный, единый для РА, РСК и РДСК представляет собой гомогенную взвесь инактивированных нагреванием и фенолом бруцелл в физиологическом растворе. Специфическая активность антигена стандартизована по стандартному образцу сыворотки антибруцелла абортус, что позволяет выражать результаты реакции агглютинации в международных единицах (ME) антител.
Перед употреблением антиген тщательно встряхивают.
Антиген бруцеллезный для роз бенгал пробы (РБП) представляет собой стандартизованную суспензию в буферном растворе инактивированных нагреванием и фенолом бруцелл, окрашенных бенгальским розовым в розовый цвет.
Перед употреблением антиген выдерживают 30 - 40 мин при комнатной температуре, затем тщательно встряхивают.
Антиген бруцеллезный для кольцевой реакции (КР) с молоком представляет собой стандартизованную взвесь инактивированных нагреванием бруцелл, окрашенных гематоксилином в синий или тетразолием в красно-вишневый цвет. Перед употреблением антиген тщательно встряхивают.
Антигены во флаконах без этикеток (без надписи) или с трещинами, содержащие постороннюю примесь, не разбивающиеся хлопья, плесень, с истекшим сроком годности или подвергавшиеся замораживанию для применения не пригодны.
7. ВАКЦИНЫ, ПРИМЕНЯЮЩИЕСЯ ДНЯ СПЕЦИФИЧЕСКОЙ ПРОФИЛАКТИКИ БРУЦЕЛЛЕЗА У ЖИВОТНЫХ, УСЛОВНО ПРИНЯТО ДЕЛИТЬ НА ДВЕ ГРУППЫ: АГГЛЮТИНОГЕННЫЕ И НЕАГГЛЮТИНОГЕННЫЕ
7.1. Агглютиногенные вакцины (из шт. Б. абортус 19, Б. абортус 82, Б. абортус 75/79 - АВ, Б. мелитензис Рев-1 и др.) изготавливают из культур бруцелл, находящихся в S- или в SR (RS)-форме. В организме животных, привитых такими вакцинами, синтезируются специфические антитела, гомологичные S-антигену, выявляемые стандартными бруцеллезными диагностическими препаратами в РА, РСК, РДСК, РБП КР с молоком, РИД с 0-ПС антигеном и др.
7.2. Неагглютиногенные вакцины представляют собой убитые культуры бруцелл в R-форме, эмульгированные в масляном или другом адъюванте (французская вакцина "Абортокс", отечественная - из штамма Б. абортус 17/100 и др.). Такие вакцины в организме иммунизированных здоровых животных не вызывают образования антител, выявляемых антигенами, изготовленными из бруцелл в S-форме (антигенбруцеллезный единый для РА, РСК и РДСК, антиген бруцеллезный для кольцевой реакции с молоком, антиген бруцеллезный для роз бенгал пробы, 0-ПС антиген для РИД, антиген бруцеллезный эритроцитарный для реакции непрямой гемагглютинации - РНГА и др.).
Приложение № 3
В фарфоровую чашку емкостью 300 - 500 мл помешают 5 г тонко измельченного в ступке K2Сr2O7 (или 6 г Na2Cr2O7×2Н2O), приливают 100 мл концентрированной H2SO4 (технической) и осторожно нагревают на водяной бане до полного растворения двухромовокислого калия (натрия).
Ступки, пестики и т.п. после обработки проб выдерживают в растворе дезинфицирующего средства, моют обычным способом, а затем обрабатывают хромовой смесью, которую наливают в очищаемую посуду на 1/4 или 1/3 объема, осторожно смачивают все стенки. Для более энергичного воздействия на загрязняющие вещества хромовую смесь можно слегка подогреть (обязательно в фарфоровой посуде или в посуде из термостойкого стекла!). Затем смесь выливают в сосуд, в котором она хранится, при этом смачивают края обрабатываемой посуды. Ни в коем случае не выливают смесь в раковину, ею пользуются не один, а много раз. Когда смесь сольют, добавляют немного водопроводной воды. При этом происходит разогревание, что способствует полному разрушению загрязняющих веществ. Очищаемую посуду наполняют водопроводной водой, еще раз ополаскивают для удаления остатков хромовой смеси и тщательно моют волосяным ершом. Промывают водопроводной водой 5 - 6 раз, затем ополаскивают дистиллированной водой и сушат.
Лицо, руки, одежду защищают от попадания брызг.
СОДЕРЖАНИЕ