|
МЕЖГОСУДАРСТВЕННЫЙ
СОВЕТ ПО СТАНДАРТИЗАЦИИ, МЕТРОЛОГИИ И СЕРТИФИКАЦИИ INTERSTATE COUNCIL FOR STANDARDIZATION,
METROLOGY AND CERTIFICATION |
|
|
МЕЖГОСУДАРСТВЕННЫЙ |
ГОСТ |
МЕТОДЫ ИСПЫТАНИЙ
ХИМИЧЕСКОЙ ПРОДУКЦИИ,
ПРЕДСТАВЛЯЮЩЕЙ ОПАСНОСТЬ
ДЛЯ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение угнетения активности
анаэробных бактерий
|
|
Москва |
Предисловие
Цели, основные принципы и общие правила проведения работ по межгосударственной стандартизации установлены ГОСТ 1.0 «Межгосударственная система стандартизации. Основные положения» и ГОСТ 1.2 «Межгосударственная система стандартизации. Стандарты межгосударственные, правила и рекомендации по межгосударственной стандартизации. Правила разработки, принятия, обновления и отмены»
Сведения о стандарте
1 ПОДГОТОВЛЕН Межгосударственным техническим комитетом по стандартизации ТК 339 «Безопасность сырья, материалов и веществ» на основе собственного перевода на русский язык англоязычной версии международного документа, указанного в пункте 5
2 ВНЕСЕН Федеральным агентством по техническому регулированию и метрологии
3 ПРИНЯТ Межгосударственным советом по стандартизации, метрологии и сертификации (протокол от 27 августа 2015 г. № 79-П)
За принятие проголосовали:
|
Краткое наименование страны |
Код страны |
Сокращенное наименование национального органа по стандартизации |
|
Армения |
AM |
Минэкономики Республики Армения |
|
Беларусь |
BY |
Госстандарт Республики Беларусь |
|
Казахстан |
KZ |
Госстандарт Республики Казахстан |
|
Киргизия |
KG |
Кыргызстандарт |
|
Россия |
RU |
Росстандарт |
|
Таджикистан |
TJ |
Таджикстандарт |
4 Приказом Федерального агентства по техническому регулированию и метрологии от 21 октября 2015 г. № 1610-ст межгосударственный стандарт ГОСТ 33442-2015 введен в действие в качестве национального стандарта Российской Федерации с 1 сентября 2016 г.
5 Настоящий стандарт модифицирован по отношению к международному документу ОЭСР, Тест № 224:2007 «Угнетение активности анаэробных бактерий - снижение образования газа в результате анаэробного расщепления (сточных вод, ила)» (OECD, Test № 224:2007 «Determination of the inhibition of the activity of anaerobic bacteria - reduction of gas production from anaerobically digesting (sewage) sludge», MOD) путем изменения структуры для приведения в соответствие с правилами.
Сравнение структуры международного документа со структурой настоящего стандарта приведено в дополнительном приложении ДА.
Наименование настоящего стандарта изменено относительно наименования международного документа для приведения в соответствие с ГОСТ 1.5 (подраздел 3.6)
6 ВВЕДЕН ВПЕРВЫЕ
7 ПЕРЕИЗДАНИЕ. Сентябрь 2019 г.
Информация о введении в действие (прекращении действия) настоящего стандарта и изменений к нему на территории указанных выше государств публикуется в указателях национальных стандартов, издаваемых в этих государствах, а также в сети Интернет на сайтах соответствующих национальных органов по стандартизации.
В случае пересмотра, изменения или отмены настоящего стандарта соответствующая информация будет опубликована на официальном интернет-сайте Межгосударственного совета по стандартизации, метрологии и сертификации в каталоге «Межгосударственные стандарты»
Содержание
ГОСТ 33442-2015
|
МЕЖГОСУДАРСТВЕННЫЙ СТАНДАРТ |
|
МЕТОДЫ ИСПЫТАНИЙ ХИМИЧЕСКОЙ ПРОДУКЦИИ, Определение угнетения активности анаэробных бактерий Testing of chemicals of environmental hazard.
|
Дата введения - 2016-09-01
1 Область применения
Настоящий стандарт устанавливает метод определения угнетения активности анаэробных бактерий по ингибированию образования биологического газа в анаэробных условиях.
2 Общие сведения
2.1 При попадании в водную среду химические вещества проходят через аэробные и анаэробные зоны, где они могут разлагаться и/или ингибировать активность бактерий. В некоторых случаях химические вещества могут оставаться в анаэробных условиях без изменений в течение десятилетий или дольше. Очистка сточных вод на первой стадии, в частности первичное отстаивание, является аэробным процессом в надосадочной жидкости и анаэробным в субнатантном иле. Следующей стадией очистки является обработка сточных вод в аэробной зоне в аэрационном отстойнике активного ила и анаэробной зоне в субнатантном иле во втором отстойнике. Обычно ил с обеих стадий подвергается анаэробной обработке с образованием метана и диоксида углерода, которые, как правило, используются для получения электроэнергии. В более обширной окружающей среде химические вещества, осаждающиеся в запрудах, лиманах и море, вероятно, остаются в таких анаэробных зонах на неопределенный срок, если они не поддаются биологическому разложению. Некоторые химические вещества в больших количествах будут попадать в такие зоны преимущественно за счет своих физических свойств, таких как низкая растворимость в воде, высокая адсорбция на взвешенных частицах, а также отсутствие биологического разложения в аэробных условиях.
2.2 Несмотря на то что желательно, чтобы химические вещества, сбрасываемые в окружающую среду, подвергались биологическому разложению в аэробных и анаэробных условиях, важно, чтобы такие химические вещества не подавляли активность микроорганизмов в каждой зоне. В Великобритании имело место несколько случаев полного ингибирования образования метана, вызванного, например, присутствием в промышленных выбросах пентахлорфенола, что привело к очень дорогостоящему транспортированию ингибированного ила из метантенков в «безопасные» места и необходимости ввоза нормально функционирующего активного ила от соседних установок. Также имело место много случаев менее тяжелых нарушений разложения под действием некоторых других химических веществ, включая алифатические галогенуглеводороды (сухая очистка) и детергенты, приводящие к значительному ухудшению эффективности метантенков.
2.3 Только в одном документе ОЭСР [1] рассмотрено ингибирование бактериальной активности («Дыхание активированного ила»), с помощью которого оценивается влияние тестируемых веществ на скорость поглощения кислорода в присутствии субстрата. Метод широко применяют для получения своевременной информации о возможных отрицательных последствиях влияния химических веществ на аэробную очистку сточных вод, а также установление неингибирующих концентраций тестируемых веществ, используемых в различных методах оценки биологического разложения. В документе ОЭСР [2] предлагается ограниченный метод определения токсического влияния тестируемого вещества на образование газа анаэробным илом, разведенным до одной десятой от обычной концентрации взвешенных твердых частиц, позволяющий оценить с необходимой точностью процентное биологическое разложение. Поскольку разбавленный ил может быть более чувствительным к воздействию ингибирующих веществ, то группа ИСО решила подготовить метод с использованием неразведенного ила. Было рассмотрено не менее трех методов (из Дании, Германии и Великобритании) и подготовлено два стандарта ИСО: один - с использованием неразбавленного ила [3] и второй - с использованием ила, разведенного до одной сотой [4], для получения сведений об осадке и отложениях, имеющих низкие бактериальные популяции. Оба метода были оценены в межлабораторном испытании [5]; часть 1 была подтверждена в качестве приемлемого стандарта, при этом часть 2 вызвала разногласия. В Великобритании полагали, что поскольку большинство участников исследования сообщили о том, что образование газа было очень небольшим или отсутствовало вовсе, частично за счет того, что газовое пространство в процентном соотношении было слишком большим (на уровне 75 %) для достижения оптимальной чувствительности, то метод требует дальнейшего изучения.
2.4 В более ранней работе в Великобритании [6], [7] описывают манометрический метод с использованием в качестве субстрата неразведенного активного ила и сырого осадка из сточных вод в колбах емкостью 500 мл; но оборудование было громоздким, и запах сырого осадка был крайне неприятным. Позднее был разработан более компактный и удобный прибор [8], [9], который был успешно применен [10]. Группой специалистов было приготовлено несколько стандартных образцов ила в лаборатории для применения в методах оценки анаэробного биологического разложения и ингибирования микроорганизмов рядом химических веществ [11]. Также для проведения испытания сырой ил в качестве субстрата был заменен на разведенный 1:100 анаэробный ил или осадки, отложения и т.д. с низкой бактериальной активностью.
2.5 Метод, представленный в настоящем стандарте, может предоставить информацию, которая является полезной для прогнозирования возможного воздействия тестируемого вещества на образование газа в анаэробных метантенках. Однако только более длительные испытания, точнее имитирующие рабочие метантенки, способны определенно указать, может ли возникнуть адаптация микроорганизмов к тестируемому веществу или возможна ли адсорбция вещества на иле, в том числе с образованием токсических концентраций, в течение более длительного периода времени, чем позволяет данное испытание.
3 Принцип метода
Аликвотные количества смеси анаэробного активного ила (с общим содержанием твердых веществ от 20 до 40 г/л) и раствора разлагаемого субстрата инкубируют отдельно и совместно с тестируемым веществом в различных концентрациях в герметично закрытых сосудах в течение 3 сут. Измеряют количество образовавшегося газа (метан и диоксид углерода) по увеличению давления в сосудах. Рассчитывают процент ингибирования образования газа, вызванного различными концентрациями тестируемого вещества, по количеству газа, образовавшемуся в соответствующих тестовых и контрольных сосудах. Рассчитывают значения EC50 и другие эффективные концентрации с использованием графиков зависимости ингибирования, %, от концентрации тестируемых химических веществ или, более предпочтительно, их логарифмических значений.
4 Информация о тестируемом веществе
Для проведения испытания, как правило, используют наиболее чистую из доступных форм тестируемого вещества, поскольку примеси, входящие в состав некоторых веществ, например хлорфенолы, могут быть существенно более токсичными, чем сами тестируемые вещества. Как правило, применение рецептированных продуктов не рекомендуется, но для малорастворимых тестируемых веществ использование рецептированных форм может быть целесообразным. Для тестируемого вещества должны быть известны растворимость в воде и некоторых органических растворителях, давление пара, коэффициент абсорбции, стабильность к гидролизу и биологическому разложению в анаэробных условиях.
5 Применимость метода
Метод применим для растворимых и нерастворимых в воде веществ, в том числе летучих веществ. Следует соблюдать особую осторожность при работе с веществами, обладающими низкой растворимостью в воде [12] и высокой летучестью. Также для проведения испытания можно использовать инокулят из других природных анаэробных источников, например илов, насыщенных почв, донных отложений. Анаэробные бактериальные системы, ранее подвергшиеся воздействию токсичных веществ, могут адаптироваться к поддержанию их активности в присутствии ксенобиотиков. Инокулят из адаптированных бактериальных систем может показать более высокую толерантность к тестируемым веществам по сравнению с инокулятом из неадаптированных систем.
6 Стандартные вещества
Для проверки метода проводят испытание стандартных веществ в параллельных контрольных сосудах. Было установлено, что 3,5-дихлорфенол является стойким ингибитором анаэробного образования газа, а также потребления кислорода активным илом и других биохимических реакций. Большей ингибирующей активностью в отношении образования метана по сравнению с 3,5-дихлорфенолом обладают метилен-бис-тиоцианат и пентахлорфенол, но данные, полученные с ними, не валидированы. Не рекомендуется использовать в качестве стандартного вещества пентахлорфенол, поскольку он отсутствует в чистой форме.
7 Воспроизводимость метода
7.1 В международном кольцевом испытании [5] установлена приемлемая воспроизводимость определения значений EC50 в 10 лабораториях, участвовавших в испытании, для 3,5-дихлорфенола и 2-бромэтансульфоновой кислоты (диапазоны для первого вещества составляют от 32 до 502 мг/л и для второго - 220 - 2190 мг/л).
Таблица 1 - Значения EC50 по результатам постановки кольцевого метода - неразведенный ил
|
Количество |
Среднее |
Стандартное |
Коэффициент |
Среднее |
Стандартное отклонение, мг/г ила |
Коэффициент |
|
3,5-дихлорфенол |
||||||
|
10 |
153 |
158 |
103 |
5 |
4,6 |
92 |
|
2-бромэтансульфоновая кислота |
||||||
|
10 |
1058 |
896 |
85 |
34 |
26 |
76 |
7.2 Высокие значения коэффициентов вариации между лабораториями в значительной степени отражают различия в чувствительности микроорганизмов ила вследствие наличия либо отсутствия предварительного воздействия тестируемого вещества или других химически родственных веществ. Точность, с которой определялось значение EC50, основанное на концентрации ила, устанавливалась лучше, чем «объемное» значение (мг/л). Три лаборатории, представившие данные по точности определения значений EC50 для 3,5-дихлорфенола, продемонстрировали более низкие коэффициенты вариации (соответственно 22,9 % и 18 % для EC50, мг/г), чем средние значения для всех 10 лабораторий. Индивидуальные средние значения для трех лабораторий составили соответственно 3,1, 3,2 и 2,8 мг/г. Более низкие приемлемые коэффициенты вариации внутри лабораторий по сравнению со значительно более высокими коэффициентами вариации между лабораторными значениями, а именно 9 - 22 % до 92 % указывают, что имеются существенные различия в свойствах отдельных илов.
8 Описание испытания
8.1 Оборудование
Для проведения испытания используют стандартное лабораторное оборудование:
a) искробезопасный термостат с возможностью контроля температуры на уровне (35 ± 2) °С;
b) тестовые сосуды, изготовленные из устойчивого к давлению стекла, снабженные газонепроницаемыми крышками с покрытием, способные выдержать давление примерно 2 бар или 2 ∙ 105 Па (для покрытия используют, например, политетрафторэтилен). Рекомендуется использовать стеклянные бутыли вместимостью 125 мл, с фактическим объемом примерно 160 мл, герметично закрытые крышкой и обжатые алюминиевыми скобами. Также можно использовать сосуды общей вместимостью от 0,1 до 1 л.
Примечание - Для сосудов рекомендуется использовать газонепроницаемые силиконовые крышки. Газонепроницаемость крышек, особенно изготовленных из бутилкаучука, рекомендуется проверять, поскольку некоторые промышленно доступные крышки не являются газонепроницаемыми для метана и не остаются плотными после их прокалывания иглой в условиях испытания. Для летучих веществ рекомендуется использовать газонепроницаемые крышки с покрытием (некоторые промышленно доступные крышки являются относительно тонкими, менее чем 0,5 см, и не остаются газонепроницаемыми при прокалывании иглой шприца). Если тестируемые вещества не являются летучими, то рекомендуется использовать бутилкаучуковые крышки (толщиной примерно 1 см). Такие крышки обычно сохраняют газонепроницаемость после прокалывания иглой. Перед испытанием следует тщательно исследовать крышку на способность сохранять газонепроницаемость после прокалывания иглой;
c) точный манометр и устройство для крепления игл.
Общее образование газа (метан и диоксид углерода) измеряют с помощью манометра, приспособленного для измерения и удаления образовавшегося газа. Примером подходящего прибора является ручной точный манометр, соединенный с иглой шприца и трехсторонним газонепроницаемым клапаном, дающим возможность сброса избыточного давления (см. приложение A). Следует поддерживать минимальный внутренний объем шлангов датчика давления и клапана, чтобы ошибки, возникающие при пренебрежении объемом оборудования, были незначительными.
Примечание - Следует использовать измеритель давления с периодической калибровкой в соответствии с инструкциями изготовителя. Если используют манометр необходимого качества, например герметизированный со стальной мембраной, то его калибровка в лаборатории не требуется. Калибровку должна проводить лицензированная организация с рекомендованной периодичностью. Следует проверить точность калибровки в лаборатории с измерением в одной точке при 1 ∙ 105 Па по сравнению с манометром с механической индикацией. Если эту точку измеряют правильно, то линейность также будет неизменной. Если используют другие измерительные устройства (без калибровки, сертифицированной изготовителем), то следует проводить преобразование показаний манометра по всему диапазону с регулярной периодичностью (см. приложение B);
d) изолированные контейнеры для транспортирования активного ила;
e) трехсторонние клапаны давления;
f) сито, имеющее размер пор 1 мм2;
g) резервуар для активного ила, бутыль из стекла или полиэтилена высокого давления вместимостью примерно 5 л, снабженная мешалкой и устройством для пропускания потока газообразного азота (см. 8.2) через свободное пространство;
h) мембранные фильтры, 0,2 мкм, для стерилизации субстрата;
i) микрошприцы для газонепроницаемого соединения преобразователя давления (см. 8.1, c) со свободным пространством в тестовых сосудах (см. 8.1, b), а также для добавления нерастворимых жидких тестируемых веществ в тестовые сосуды;
j) перчаточный бокс - не обязательно, но рекомендуется при наличии небольшого положительного давления азота.
8.2 Реактивы
В ходе испытания следует использовать реактивы аналитической чистоты. Необходимо использовать газообразный азот высокой чистоты с содержанием кислорода менее 5 мкл/л.
8.3 Вода
Если на какой-либо стадии необходимо проводить разведение, то необходимо использовать деионизированную воду, предварительно деаэрированную. Аналитический контроль такой воды не требуется, но должна быть гарантия, что прибор для приготовления деионизированной воды регулярно проходит проверку. Деионизированную воду также следует использовать для приготовления основных растворов. Перед добавлением анаэробного инокулята в любой раствор или разведением тестируемого вещества необходимо удостовериться в отсутствии кислорода. Это выполняется продувкой газообразного азота через воду для разведения (или через разведенный раствор) в течение 1 ч перед добавлением инокулята или в альтернативном случае нагреванием воды для разведения до точки кипения и охлаждением до комнатной температуры в атмосфере, не содержащей кислород.
8.4 Активный ил
8.4.1 Пробу активного ила отбирают из метантенка на станции очистки сточных вод или в альтернативном случае из лабораторного метантенка ил предварительно очищают от бытовых сточных вод. Практическая информация об иле, отобранном из лабораторного метантенка, представлена в [11]. Если предполагается использовать адаптированный инокулят, то для проведения испытания используют активный ил, отобранный на промышленной станции очистки сточных вод. Для сбора ила используют широкогорлые бутыли из полиэтилена высокого давления или аналогичного материала, который может растягиваться при сборе ила. Ил вносят в бутыли для проб до высоты примерно 1 см от верхней части бутылей, их плотно закрывают, предпочтительно с предохранительным клапаном (см. 8.1, e), и помещают в изотермические контейнеры (см. 8.1, d) для сведения к минимуму температурного шока при переносе в термостат с поддержанием температуры на уровне (35 ± 2) °С. При открытии бутылей следует соблюдать осторожность, поскольку происходит сброс избыточного давления газа. Бутыли открывают осторожным ослаблением уплотнителя или с помощью трехстороннего клапана для сброса давления (см. 8.1, e). Предпочтительно использовать ил в течение нескольких часов после сбора или хранить его при (35 ± 2) °С в свободном пространстве азота не более 3 сут. В этом случае происходит небольшая потеря активности.
8.4.2 Активный ил выделяет горючие газы, представляющие пожаро- и взрывоопасность; он также продуцирует потенциально патогенные микроорганизмы, поэтому при обращении с илом следует предпринять соответствующие меры предосторожности. В целях безопасности не следует использовать стеклянные бутыли для сбора ила.
8.5 Инокулят
Непосредственно перед использованием ил осторожно перемешивают и просеивают через сито с размером пор 1 мм2 (см. 8.1, f) в подходящую бутыль (см. 8.1, g), через свободное пространство которой пропускают азот. Отбирают пробу инокулята для определения содержания общего сухого вещества [13]. Как правило, ил используют без разведения. Концентрация сухого вещества обычно составляет от 2 % до 4 %, мас./об. Проверяют значение pH ила и, если требуется, доводят до (7 ± 0,5).
8.6 Тестовый субстрат
Растворяют 10 г питательного бульона (например, Oxoid), 10 г дрожжевого экстракта и 10 г D-глюкозы в деионизированной воде и доводят объем раствора деионизированной водой до 100 мл. Раствор стерилизуют фильтрованием через мембранный фильтр 0,2 мкм (см. 8.1, h) и сразу же используют или хранят при 4 °С не более 1 сут.
8.7 Тестируемое вещество
8.7.1 Готовят отдельный основной раствор каждого водорастворимого тестируемого вещества с содержанием, например, 10 г/л вещества, в бескислородной воде для разведения (см. 8.3). Используют соответствующие объемы данных основных растворов для приготовления тестовых смесей, содержащих градуированные концентрации. Альтернативно готовят серии разведений каждого основного раствора таким образом, чтобы объем, добавленный в тестовые сосуды, был одинаковым для каждой требуемой конечной концентрации. Если необходимо, то pH основных растворов доводят до (7 ± 0,5).
8.7.2 Практические указания для веществ, которые недостаточно растворимы в воде, представлены в [12]. При необходимости использования органического растворителя следует избегать таких растворителей, как хлороформ и четыреххлористый углерод, которые сильно ингибируют образование метана. Готовят раствор соответствующей концентрации нерастворимого в воде вещества в подходящем летучем растворителе, например ацетоне, диэтиловом эфире. Вносят необходимые объемы растворителя в пустые тестовые сосуды (см. 8.1, b) и выпаривают растворитель перед добавлением ила. Для других методов обработки используют [12], но следует учитывать, что любые поверхностно-активные вещества, используемые для получения эмульсии, могут ингибировать образование газа в анаэробных условиях. Если предполагается, что присутствие органических растворителей и эмульгаторов вызывает появление побочных веществ или явлений, то тестируемое вещество может быть добавлено непосредственно в тестовую смесь в виде порошка или жидкости. Летучие вещества и нерастворимые в воде жидкие тестируемые вещества можно вносить с помощью микрошприца в тестовые сосуды, содержащие инокулят (см. 8.1, i).
8.7.3 В сосуды добавляют тестируемые вещества с получением серий концентраций, образующих геометрическую прогрессию, например 500, 250, 125, 62,5, 31,2 и 15,6 мг/л. Если диапазон токсичности для родственных веществ неизвестен, то вначале проводят предварительное испытание для установления соответствующих пределов токсичности с концентрациями 1000, 100 и 10 мг/л.
8.8 Стандартное вещество
Готовят водный раствор 3,5-дихлорфенола (10 г/л) при постепенном добавлении минимального количества 5 моль/л раствора гидроксида натрия к твердому веществу, со встряхиванием до растворения. Затем добавляют бескислородную воду для разведения (см. 8.3) до требуемого объема; обработка ультразвуком может способствовать растворению. Возможно использование других стандартных веществ, если обеспечивается средний диапазон значений EC50, не менее чем в трех испытаниях с различным инокулятом (различные источники или разное время сбора).
8.9 Ошибки
Некоторые составляющие компоненты ила предположительно могут взаимодействовать с потенциальными ингибиторами, делая их недоступными для микроорганизмов, что приводит к более низкому ингибированию или его отсутствию. Также если ил уже содержит вещество, которое является ингибитором, то можно получить ошибочные результаты при испытании тестируемого вещества. Помимо этого, существует ряд установленных факторов, которые могут привести к получению ошибочных результатов. Информация о таких факторах, а также методах их устранения или, по меньшей мере, снижения вероятности получения ошибочных результатов представлена в приложении C.
8.10 Проведение испытания
8.10.1 Количество параллельных сосудов зависит от степени точности, необходимой для определения показателей ингибирования. Если сосуды закрыты с обеспечением необходимой газонепроницаемости во время испытания, то следует использовать одну партию (не менее трех параллельных сосудов) тестовых сосудов для каждой тестируемой концентрации. Аналогично готовят одну партию сосудов со стандартным веществом и одну контрольную партию. Однако если герметичное закрытие сосудов является надежным только для одного или нескольких прокалываний иглой, то готовят партию (например, три параллельных сосуда) тестовых сосудов для каждого интервала времени t, в котором требуется получить результаты для всех тестируемых концентраций. Аналогично готовят t партий сосудов со стандартным веществом и контрольных сосудов.
8.10.2 Для проведения испытания следует использовать перчаточный бокс (см. 8.1, j). Не менее чем за 30 мин до начала испытания начинают продувку азотом перчаточного бокса, содержащего все необходимое оборудование. Следует гарантировать поддержание температуры ила на уровне (35 ± 2) °С во время обработки и герметизации сосудов.
8.11 Предварительное испытание
Если активность ила неизвестна, то проводят предварительное испытание. Готовят контрольные сосуды, например с содержанием сухого вещества 10, 20 и 40 г/л и субстратом, но без добавления тестируемого вещества. Также следует использовать различные объемы тестовой смеси, чтобы иметь три или четыре различных соотношения объема свободного пространства к объему жидкости. По результатам определения объема образовавшегося газа в различные интервалы времени устанавливают наиболее подходящие условия, позволяющие проводить два измерения в сутки, обеспечивающие значительные объемы газа и сброс давления в сутки при оптимальной чувствительности без угрозы взрыва.
Примечание - Под оптимальной чувствительностью понимают такую процедуру испытания и условия испытания, при которых объемы образующегося газа (из контрольных сосудов и тестовых сосудов, демонстрирующих ингибирование на уровне от 70 % до 80 %) могут оценивать с приемлемой точностью.
8.12 Добавление тестируемых веществ
8.12.1 Водорастворимые вещества добавляют в пустые тестовые сосуды (см. 8.1, b) в виде водных растворов (см. 8.7.1). Проводят не менее трех испытаний для каждой тестируемой концентрации (см. 8.7.3). В случае нерастворимых в воде и малорастворимых тестируемых веществ в пустые сосуды вносят растворы таких веществ в органических растворителях с помощью микрошприца. Готовят параллельные сосуды для каждой из пяти концентраций тестируемого вещества. Растворитель выпаривают пропусканием газообразного азота над поверхностью растворов в тестовых сосудах. Альтернативно нерастворимые твердые вещества добавляют в виде навесок непосредственно в тестовые сосуды.
8.12.2 Если нерастворимые или малорастворимые в воде вещества вносят без использования растворителя, то их добавляют непосредственно в тестовые сосуды с помощью микрошприца после добавления инокулята и субстрата (см. 8.13.3). Летучие тестируемые вещества следует добавлять таким же способом.
8.13 Добавление инокулята и субстрата
8.13.1 Перемешивают соответствующий объем просеянного активного ила в 5-литровой бутыли, одновременно пропуская газообразный азот через свободное пространство. Продувают газообразным азотом тестовые сосуды, содержащие водные растворы или растворы тестируемых веществ с выпаренным растворителем, в течение примерно 2 мин для удаления воздуха. Аликвотные пробы хорошо перемешанного ила, например 100 мл, вносят в тестовые сосуды, используя пипетку с широким наконечником или мерный цилиндр. Важно заполнить пипетку в один прием до точного требуемого объема ила, поскольку взвешенные твердые частицы ила быстро оседают. Если забирается большее количество ила, то следует освободить пипетку и начать наполнение снова.
8.13.2 Затем в тестовые сосуды добавляют достаточное количество раствора субстрата (см. 8.6) с получением концентрации 2 г/л из питательного бульона, дрожжевого экстракта и D-глюкозы в смеси, продолжая продувать сосуды азотом. Ниже приведен пример тестируемых партий.
Таблица 2 - Тестируемые партии
|
Конечная массовая |
Объем тестируемого вещества, мл |
Реактивы и среды, мл |
|||
|
Основной |
Основной |
Вода для |
Инокулят (9.5) |
Субстрат (9.6) |
|
|
0 |
- |
0 |
1,0 |
100 |
2 |
|
1 |
- |
0,1 |
0,9 |
100 |
2 |
|
3,3 |
- |
0,33 |
0,67 |
100 |
2 |
|
10 |
0,1 |
- |
0,9 |
100 |
2 |
|
33 |
0,33 |
- |
0,67 |
100 |
2 |
|
100 |
1,0 |
- |
0 |
100 |
2 |
Общий объем сосуда - 160 мл. Объем жидкости - 103 мл.
Объем газа - 57 мл или 35,6 % от общего объема.
8.13.3 Аналогичным образом следует тщательно продуть азотом пустые тестовые сосуды для летучих веществ и нерастворимых жидких тестируемых веществ (см. 8.12.2).
8.14 Контрольные сосуды и стандартное вещество
8.14.1 Готовят не менее трех параллельных сосудов, содержащих только ил и субстрат, для использования в целях контроля проведения испытания. Готовят дополнительные параллельные сосуды, содержащие ил, субстрат, а также достаточное количество основного раствора стандартного вещества, 3,5-дихлорфенола (см. 8.8), с получением конечной концентрации 150 мг/л. Данная концентрация должна ингибировать образование газа примерно на 50 %. В альтернативном случае готовят ряд концентраций стандартного вещества. Кроме того, для измерения pH готовят четыре дополнительных сосуда, содержащие ил, бескислородную воду и субстрат. В два сосуда добавляют тестируемое вещество в самой высокой тестовой концентрации, в оставшиеся два сосуда добавляют бескислородную воду.
8.14.2 Необходимо убедиться, что все сосуды - с тестируемым и стандартным веществами - содержат одинаковый объем жидкости VR; при необходимости для получения необходимого объема в сосуды добавляют бескислородную деионизированную воду (см. 8.3). Свободное пространство должно составлять от 10 % до 40 % объема сосуда, фактическое значение выбирают по данным, полученным в предварительном испытании. После добавления в сосуды всех составляющих компонентов удаляют иглу для подачи газа и каждый сосуд закрывают резиновой крышкой и алюминиевой скобой (см. 8.1, b), смочив пробку каплей деионизированной воды для облегчения ее установки. Содержимое каждого сосуда перемешивают путем встряхивания.
8.15 Инкубация сосудов
Сосуды переносят в термостат, регулируемый с помощью термореле и предпочтительно снабженный встряхивающим устройством, и инкубируют при температуре (35 ± 2) °С. Инкубацию проводят в темноте. Примерно через 1 ч выравнивают давление в сосудах до атмосферного давления введением иглы шприца, соединенной с манометром (см. 8.1, c), через крышку в каждой бутыли, открывают клапан до нулевого показания манометра и затем закрывают. Иглу следует вставлять под углом примерно 45 °С для предотвращения утечки газа из сосудов. Если сосуды инкубируют без встряхивающего устройства, то встряхивание проводят вручную два раза в день в течение всего периода инкубации для уравновешивания системы. Сосуды инкубируют и переворачивают для предотвращения утечки газа через крышку. Однако переворачивание не подходит для тех случаев, когда нерастворимые тестируемые вещества могут прилипать к нижней части сосуда.
8.16 Измерение давления
8.16.1 Когда температура сосудов достигает (35 ± 2) °С, измеряют и регистрируют pH содержимого в двух из четырех сосудов, приготовленных для этой цели. Их содержимое отбрасывают и продолжают инкубацию оставшихся сосудов в темноте. Измеряют и регистрируют давление в сосудах дважды в сутки в течение 48 - 72 ч, вставляя иглу манометра через крышку в каждый сосуд и высушивая иглу между измерениями. Во время измерения для всех частей сосуда необходимо поддерживать температуру инкубации. Измерение следует проводить как можно быстрее. Показанию манометра дают возможность стабилизироваться и регистрируют давление. Затем открывают клапан для сброса давления и закрывают его, когда показание устанавливается на нулевом значении. Измерение продолжают обычно в течение 48 ч со времени первого уравнивания давления, обозначенного как время «0». Для летучих веществ число показаний и сброса давления следует ограничить до одного (в конце инкубации) или двух для сведения к минимуму потерь тестируемого вещества [10].
8.16.2 Если показания давления являются отрицательными, то клапан не следует открывать. Иногда в игле шприца и шлангах накапливается влага, на что указывает небольшое отрицательное давление. В этом случае иглу удаляют, шланги встряхивают, высушивают тканью и устанавливают новую иглу.
8.17 Измерение pH
Измеряют и регистрируют pH содержимого каждого сосуда после конечного измерения давления.
9 Данные и отчет о проведении испытания
9.1 Обработка результатов
9.1.1 Рассчитывают суммарное и среднее давление, измеренное в каждый определенный момент времени, для каждого ряда параллельных сосудов и рассчитывают среднее суммарное общее давление газа в каждый определенный момент времени для каждого ряда параллельных сосудов. Строят кривую зависимости среднего суммарного образования газа Рa в зависимости от времени для контрольных, тестовых сосудов и сосудов со стандартным веществом. Выбирают время в линейной части кривой, обычно 48 ч, и рассчитывают процент ингибирования I для каждой концентрации по соотношению
|
|
(1) |
где I - процент ингибирования;
Pt - давление газа, образованного тестируемым веществом, за выбранное время, Па;
Рс - давление газа, образованного в контрольном сосуде, за выбранное время, Па.
9.1.2 Строят два графика: график зависимости I от концентрации и логарифма концентрации - для определения более линейного графика. Определяют значение EC50, мг/л, визуально или регрессионным анализом по более линейному графику. В сравнительных целях может быть полезным определить концентрацию вещества, выраженную в миллиграммах вещества на грамм общего сухого вещества. Для получения этой концентрации объемную концентрацию, мг/л, делят на объемную концентрацию сухого вещества ила, г/л (см. 8.5).
9.1.3 Рассчитывают процент ингибирования для одной используемой концентрации стандартного вещества или EC50, если испытано достаточное число концентраций.
9.1.4 Преобразовывают среднее давление газа в контрольном сосуде РсРа к объему по калибровочной кривой манометра (см. приложение B). По этому показателю рассчитывают образование газа в виде объема, полученного в течение 48 ч из 100 мл неразведенного ила при концентрации сухого вещества от 2 % (20 г/л) до 4 % (40 г/л).
9.2 Критерии достоверности
9.2.1 Результаты межлабораторного испытания [5] показали, что стандартное вещество (3,5-дихлорфенол) вызывает 50 %-ное ингибирование образования газа в диапазоне концентраций от 32 до 510 мг/л со средним значением 153 мг/л (см. 8.1). Такой диапазон является настолько широким, что жесткие пределы ингибирования не могут быть точно установлены в качестве критериев достоверности. Установление критериев достоверности станет возможным, когда будет разработан способ получения более устойчивых инокулятов. Объемы газа, образованного в контрольных сосудах в течение 48 ч, варьируют от 21 мл/г сухого вещества ила до 149 мл/г (среднее значение 72 мл/г). Отсутствует очевидная зависимость между объемом образовавшегося газа и соответствующим значением EC50. Конечное значение pH изменяется от 6,1 до 7,5.
9.2.2 Испытание считается достоверным, когда получают ингибирование на уровне более чем 20 % для контрольного сосуда со стандартным веществом, содержащего 150 мг/л 3,5-дихлорфенола, и более 50 мл газа на 1 г сухого вещества в контрольном сосуде без стандартного вещества при значении pH в диапазоне от 6,2 до 7,5 в конце испытания.
9.3 Отчет о проведении испытания
Отчет о проведении испытания должен включать следующую информацию:
Тестируемое вещество:
- тривиальное название, химическое название, номер CAS, структурная формула и соответствующие физико-химические свойства;
- чистота (примеси) тестируемого вещества.
Условия испытания:
- объемы жидкого содержимого и свободного пространства в тестовых сосудах;
- описание тестовых сосудов и способа измерения давления газа (например, тип манометра);
- внесение тестируемого вещества и стандартного вещества в тестовую систему, используемые концентрации тестируемого вещества и применение растворителей;
- подробная информация об используемом инокуляте: название станции очистки сточных вод, описание источника обработанных сточных вод (например, рабочая температура, время удерживания ила, преимущественно бытовые сточные воды или промышленные отходы и т.д.), концентрация сухого вещества, активность образования газа в анаэробном метантенке, предварительная обработка, или возможная предварительная адаптация к токсическим веществам, или место сбора ила, донных отложений и т.д.;
- диапазон температуры инкубации;
- количество параллельных сосудов.
Результаты:
- значения pH в конце испытания;
- все измеренные данные, полученные для соответствующих тестовых сосудов, контрольных сосудов и сосудов со стандартным веществом (например, давление, Па или мбар) в табличной форме;
- процент ингибирования в тестовых сосудах и сосудах со стандартным веществом и кривые зависимости ингибирования от концентрации;
- расчет значений EC50, мг/л или мг/г;
- образование газа на 1 г ила в течение 48 ч;
- причины любой отбраковки результатов испытания;
- обсуждение результатов, включая любые отклонения от установленной процедуры испытания, и обсуждение любых отклонений результатов испытания от ожидаемых за счет помех и ошибок;
- информация о том, проводилась ли оценка токсичности для предварительно подвергавшихся или неподвергавшихся воздействию микроорганизмов.
Приложение A
(рекомендуемое)
Пример прибора для определения образования
биологического газа по давлению газа
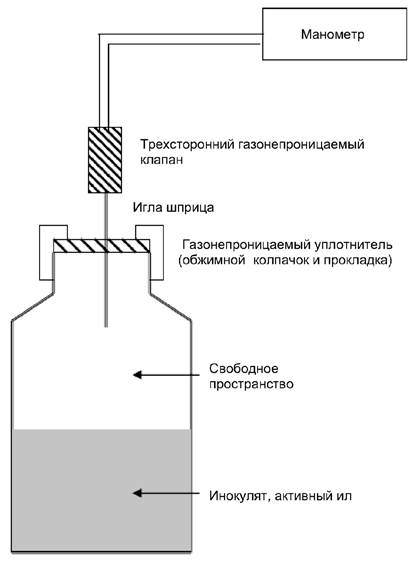
Рисунок 1 - Прибор для определения образования биологического газа по давлению газа
Температура тестовых сосудов должна поддерживаться на уровне (35 ± 2) °С.
Приложение B
(рекомендуемое)
Преобразование показаний манометра
Показания манометра соотносят с объемами газа с помощью калибровочной кривой. Исходя из полученных значений, рассчитывают объем образовавшегося газа на 1 г сухого вещества ила за 48 ч. Данный показатель активности используют в качестве одного из критериев, оценивающих достоверность результатов испытания. Калибровочную кривую строят введением известных объемов газа при температуре (35 ± 2) °С в бутыли, содержащие объем воды, равный объему тестовой смеси VR:
- в пять бутылей вносят аликвотные количества воды VR, мл, выдержанной при температуре (35 ± 2) °С. Бутыли закупоривают и помещают в водяную баню при температуре (35 ± 2) °С на 1 ч для уравновешивания;
- включают манометр, дают стабилизироваться и устанавливают показания на нуль;
- иглу шприца вставляют в крышку одной из бутылей, открывают клапан до нулевого показания манометра и клапан закрывают;
- процедуру повторяют с остальными бутылями;
- в каждую бутыль вводят по 1 мл воздуха при температуре (35 ± 2) °С. Вставляют иглу манометра в крышку одной из бутылей и получают стабилизированное показание давления;
- процедуру повторяют с остальными бутылями;
- повторяют всю процедуру с использованием 2, 3, 4, 5, 6, 8, 10, 12, 16, 20 и 50 мл воздуха;
- строят калибровочную кривую зависимости давления, Па, от введенного объема газа, мл. Отклик прибора является линейным в диапазоне от 0 до 70 000 Па, и от 0 до 50 мл образования газа.
Приложение C
(рекомендуемое)
Установленные факторы, которые могут привести
к получению ошибочных результатов
C.1 Качество крышек для сосудов
Имеются различные типы промышленно доступных крышек для сосудов. Многие из них, включая бутилкаучуковые, теряют герметичность при прокалывании иглой в условиях данного испытания. В некоторых случаях после прокалывания крышки иглой шприца давление падает очень медленно. Рекомендуется использовать газонепроницаемые крышки для предупреждения утечки газа (см. 8.1, b).
C.2 Влага в игле шприца
Иногда в игле шприца и шлангах скапливается влага, на что указывает небольшое отрицательное давление. Для устранения этого иглу удаляют, шланги встряхивают, высушивают тканью и устанавливают новую иглу (см. 8.1, c; 8.16.2).
C.3 Загрязнение кислородом
Анаэробные методы могут давать ошибочные результаты при загрязнении кислородом, которое может привести к снижению образования газа. В данном методе возможность загрязнения кислородом следует свести до минимума применением строго анаэробных методов, включая использование перчаточного бокса.
C.4 Крупные субстраты в иле
На анаэробное образование газа и чувствительность ила оказывают влияние субстраты, которые переносятся с инокулятом в тестовые сосуды. Активный ил из бытовых анаэробных метантенков также может содержать легко распознаваемый материал, такой как волосы и растительные остатки целлюлозы, что затрудняет получение репрезентативных проб. Крупный нерастворимый субстрат может быть удален с помощью просеивания, что делает получение репрезентативных проб более вероятным (см. 8.5).
C.5 Летучие тестируемые вещества
Летучие тестируемые вещества будут заполнять свободное пространство в тестовых сосудах. Это может привести к потере некоторого количества тестируемого вещества во время сброса давления после его измерения и получению ошибочно высоких значений EC50. Ошибку можно снизить выбором подходящего соотношения объема свободного пространства к объему жидкости и отказом от сброса газа после измерения давления [10].
C.6 Нелинейное образование газа
Если кривая зависимости среднего суммарного образования газа от времени инкубации не является линейной в течение 48 ч, то точность метода может быть понижена. Для предотвращения подобной ситуации следует использовать активный ил из другого источника и/или добавить повышенную концентрацию тестового субстрата - питательного бульона, дрожжевого экстракта и глюкозы (см. 8.7.3).
Приложение D
(рекомендуемое)
Применение активного ила из окружающей
среды с низкой концентрацией биомассы - анаэробный осадок, донные отложения
D.1 В общем случае видовая микробная активность (объем продуцированного газа на 1 г сухого вещества) встречающихся в природе анаэробных осадков, отложений, грунтов и т.п., значительно ниже, чем этот показатель для анаэробного ила, полученного из сточных вод. В результате этого ингибирующие эффекты химических веществ в данных, менее активных пробах следует измерять в измененных условиях испытания. Для данных, менее активных проб возможно два общих алгоритма:
a) проведение модифицированного предварительного испытания (см. 8.11) с неразведенной пробой ила, грунта и т.д. при (35 ± 2) °С или при температуре места отбора проб для более точной имитации (как описано в [3]);
b) проведение испытания с разведенным 1:100 метантенковым илом для имитации ожидаемой низкой активности пробы из окружающей среды, но при поддержании температуры на уровне (35 ± 2) °С (как описано в [4]).
D.2 Возможный вариант (a). Следует проводить испытание в соответствии с представленной в стандарте процедурой (аналогично, как описано в [3]). Особенно важно провести предварительное испытание (см. 8.11) для установления оптимальных условий, если они еще неизвестны из предшествующего испытания. Пробу ила или осадка следует тщательно перемешать, например в смесителе, при необходимости развести небольшим количеством бескислородной воды для разведения (см. 8.3) таким образом, чтобы проба была достаточно разбавленной для переноса пипеткой с широким носиком или с помощью мерного цилиндра. Если предполагается, что питательные вещества могут отсутствовать, то пробу ила следует отцентрифугировать (в анаэробных условиях) и повторно суспендировать в минеральной среде, содержащей дрожжевой экстракт (см. D.11).
D.3 Возможный вариант (b). Вариант (b) предполагает имитацию низкой активности проб из окружающей среды, но при отсутствии высокого содержания взвешенных твердых частиц, присутствующих в данных пробах. Влияние таких твердых частиц на ингибирование неизвестно, но, возможно, что взаимодействие тестируемых химических веществ и составляющих компонентов ила, а также адсорбция тестируемых химических веществ на твердых частицах могут привести к снижению токсичности тестируемого химического вещества.
D.4 Температура
Для строгой имитации испытание проводят при температуре места отбора пробы, поскольку известно, что различные группы метанобразующего консорциума бактерий функционируют в разных температурных диапазонах, а именно термофилы (≈ 30 - 35 °С), мезофиллы (20 - 25 °С) и психрофилы (< 20 °С), и демонстрируют различные модели ингибирования.
D.5 Продолжительность
В общем испытании с использованием неразведенного ила (а) обычно достаточно 2 - 4 сут для образования газа. В испытании с разведенным илом (b) за данный период времени образуется недостаточное количество газа, если он вообще образуется (по результатам межлабораторного теста). Считается, что для проведения испытания (b) требуется не менее 7 сут.
Испытание с низкой концентрацией биомассы (b):
В процедуру испытания, представленную в настоящем стандарте, должны быть внесены следующие изменения и дополнения.
D.6 Добавить в раздел 3 «Принцип метода»:
«Данный метод проводят с разведенным 1 : 100 анаэробным илом, частично для имитации низкой активности осадков и отложений. Температура инкубации составляет 35 °С или соответствует температуре места отбора проб. Поскольку бактериальная активность в данном случае значительно ниже, чем для неразведенного ила, то период инкубации следует увеличить по меньшей мере до 7 сут».
«Термостат должен обеспечивать возможность работы при температуре до 15 °С».
D.8 Добавить дополнительный реактив после 8.2:
«Фосфорная кислота H3PO4, 85 мас.% в воде».
D.9 Добавить в конце 8.5:
«В испытании используют конечную концентрацию общего сухого вещества на уровне (0,20 ± 0,05) г/л».
D.10 Подраздел 8.6 «Тестовый субстрат»:
«Данный субстрат не используют и заменяют дрожжевым экстрактом» (8.6; D.11, D.12, D.13).
D.11 Требуется минеральная среда, содержащая микроэлементы, для разведения анаэробного ила. Для удобства органический субстрат, дрожжевой экстракт добавляется к этой среде.
Добавить после 8.6:
«а) Минеральная среда для испытаний с дрожжевым экстрактом.
Среду готовят из 10-кратной концентрированной тестовой среды (см. 8.6); D.12, содержащей раствор микроэлементов (см. 8.6); D.13. Используют свежий сульфид натрия нонагидрат (см. 8.6); D.12, или промывают и высушивают его перед использованием для гарантии того, что он обладает достаточной восстановительной способностью. Если испытание проводят без использования перчаточного бокса (см. 8.1, j), то концентрацию сульфида натрия в основном растворе следует увеличить до 2 г/л (в отличие от 1 г/л). Также сульфид натрия добавляют из соответствующего основного раствора через крышку закрытых тестовых сосудов, поскольку эта процедура будет приводить к снижению риска окисления, с получением конечной концентрации 0,2 г/л. В альтернативном случае используют цитрат титана (III). Его добавляют через крышку закрытых тестовых сосудов с получением концентрации в пределах от 0,8 до 1,0 ммоль/л. Цитрат титана (III) является высокоэффективным и низкотоксичным восстановителем, который готовят следующим образом: растворяют 2,94 г цитрата натрия дигидрата в 50 мл бескислородной воды для разведения (см. 8.3) (что дает раствор с концентрацией 200 ммоль/л) и добавляют 5 мл раствора хлорида титана (III) (15 г/100 л воды для разведения). Раствор нейтрализуют до pH (7 ± 0,5) карбонатом натрия и разливают в соответствующие бутыли в потоке газообразного азота. Концентрация цитрата титана (III) в данном основном растворе составляет 164 ммоль/л. Тестовую среду используют сразу же или хранят при 4 °С не более 1 сут.
D.12 b) Десятикратную концентрированную тестовую среду готовят следующим образом. Следующие реактивы:
|
безводный дигидрофосфат калия KH2PO4 |
2,7 г |
|
динатрийфосфат Na2HPO4 (или 11,2 г додекагидрат) |
4,4 г |
|
хлорид аммония NH4Cl |
5,3 г |
|
хлорид кальция дигидрат CaC12 ∙ 2H2O |
0,75 г |
|
хлорид магния гексагидрат MgCl2 ∙ 6H2O |
1,0 г |
|
хлорид железа (II) тетрагидрат FeSO4 ∙ 4H2O |
0,2 г |
|
резазурин (окислительно-восстановительный индикатор) |
0,01 г |
|
сульфид натрия нонадигидрат Na2S ∙ 9H2O |
1,0 г |
|
(или цитрат титана (III)) конечная концентрация |
0,8 ммоль/л до 1,0 ммоль/л |
|
раствор микроэлементов (D.13) |
10,0 мл |
|
дрожжевой экстракт |
100 г |
растворяют в воде для разведения (см. 8.3) и доводят водой для разведения до 1000 мл.
D.13 c) Раствор микроэлементов готовят следующим образом. Следующие реактивы:
|
хлорид марганца (II) тетрагидрат MnCl2 ∙ 4H2O |
0,5 г |
|
ортоборная кислота H3ВO3 |
0,05 г |
|
хлорид цинка ZnCl2 |
0,05 г |
|
хлорид меди (II) CuCl2 |
0,03 г |
|
молибдат натрия дигидрат Na2MoO4 ∙ 2H2O |
0,01 г |
|
хлорид кобальта гексагидрат Cо2C12 ∙ 6H2O |
1,0 г |
|
хлорид никеля гексагидрат NiCl2 ∙ 6H2O |
0,1 г |
|
селенит динатрия Na2SeO3 |
0,05 г |
растворяют в воде для разведения (см. 8.3) и доводят водой для разведения до 1000 мл.
D.14 8.11 «Предварительное испытание»:
Предварительное испытание проводят в соответствии с 8.10.2, за исключением того, что концентрация сухого вещества ила составляет одну сотую от приведенных, то есть 0,1, 0,2 и 0,4 г/л. Продолжительность инкубации составляет не менее 7 сут.
Примечание - В межлабораторном испытании [5] объем свободного пространства является слишком большим и составляет 75 % от общего объема. Свободный объем следует поддерживать в рекомендуемом диапазоне от 10 % до 40 %. Соответствующий критерий, которым является объем образованного газа на уровне примерно 80 % ингибирования, следует измерять с приемлемой точностью (например, от ± 5 % до ± 10 %).
D.15 8.12, 8.13 «Добавление тестируемых веществ, инокулята и субстрата»:
Добавление проводят аналогично тому, как описано в данных пунктах, но раствор субстрата (см. 8.6) заменяют тестовой средой и дрожжевым экстрактом (D.11). Также конечная концентрация сухого вещества ила снижается с 2 - 4 до (0,2 ± 0,05) г/л (D.9). Два примера добавления компонентов в тестовую смесь, приведенные в таблице D.1, которая заменяет таблицу в 8.13.2.
D.16 8.15 «Инкубация сосудов»:
Вследствие ожидаемого низкого образования газа инкубацию проводят в течение не менее 7 сут.
D.17 8.16.1 - «измерение давления»:
Для измерения давления в свободном пространстве сосудов используют методику, аналогичную методике, описанной в 8.16.1. Если определяют общие количества углекислого газа и метана, то pH жидкой фазы снижают примерно до pH 2 добавлением фосфорной кислоты в каждый соответствующий сосуд и измеряют давление через 30 мин встряхивания при температуре испытания. Более подробная информация о качестве инокулята может быть получена путем измерения давления в каждом сосуде до и после подкисления. Например, когда скорость образования углекислого газа значительно выше, чем метана, то чувствительность ферментативных бактерий может измениться и/или метаногенные бактерии будут преимущественно подвергаться воздействию тестируемого вещества.
Если фосфорную кислоту используют в некоторых дополнительных сосудах, в отличие от тех, в которые не добавляют фосфорную кислоту, то их следует подготовить отдельно для измерения pH [14].
Таблица D.1 - Примеры подготовки партий к испытанию
|
Компоненты тестовой смеси |
Пример 1 |
Пример 2 |
Стандартный порядок добавления |
|
Концентрация приготовленного инокулята, г/л |
0,42 |
2,1 |
- |
|
Объем добавленного инокулята, мл |
45 |
9 |
4 |
|
Концентрация инокулята в тестовых сосудах, г/л |
0,20 |
0,20 |
- |
|
Объем добавленной тестовой среды, мл |
9 |
9 |
2 |
|
Объем добавленной воды для разведения, мл |
36 |
72 |
3 |
|
Концентрация дрожжевого экстракта в тестовых сосудах, г/л |
9,7 |
9,7 |
- |
|
Объем основного раствора тестируемого вещества, мл |
3 |
3 |
1 |
|
Общий объем жидкости, мл |
93 |
93 |
- |
Приложение ДА
(справочное)
Сопоставление структуры настоящего стандарта
со структурой международного документа
Таблица ДА.1
|
Структура настоящего стандарта |
Структура международного документа |
||
|
Разделы |
Подразделы |
Пункты |
Разделы |
|
- |
- |
1 |
|
|
- |
- |
2 |
|
|
- |
- |
3 |
|
|
- |
- |
4 |
|
|
- |
- |
5 |
|
|
- |
- |
6 |
|
|
- |
- |
7 |
|
|
- |
- |
8 |
|
|
- |
- |
9 |
|
|
- |
- |
10 |
|
|
- |
- |
11 |
|
|
- |
- |
12 |
|
|
- |
- |
13 |
|
|
- |
- |
14 |
|
|
- |
- |
15 |
|
|
- |
- |
16 |
|
|
- |
|
17 |
|
|
- |
- |
18 |
|
|
- |
- |
19 |
|
|
- |
- |
20 |
|
|
- |
- |
21 |
|
|
- |
- |
22 |
|
|
- |
- |
23 |
|
|
- |
- |
24 |
|
|
- |
- |
25 |
|
|
- |
- |
26 |
|
|
- |
- |
27 |
|
|
- |
- |
28 |
|
|
- |
- |
29 |
|
|
- |
- |
30 |
|
|
- |
- |
31 |
|
|
- |
- |
32 |
|
|
- |
- |
33 |
|
|
- |
- |
34 |
|
|
- |
- |
35 |
|
|
- |
- |
36 |
|
|
- |
- |
37 |
|
|
- |
- |
||
|
- |
- |
38 |
|
|
- |
- |
39 |
|
|
- |
- |
40 |
|
|
- |
- |
41 |
|
|
- |
- |
42 |
|
|
- |
- |
Литература |
|
|
- |
- |
Приложение 1 |
|
|
- |
- |
Приложение 2 |
|
|
- |
- |
Приложение 3 |
|
|
|
|
Приложение 4 |
|
Библиография
|
ГОСТ 32290-2013 Методы испытаний химической продукции, представляющей опасность для окружающей среды. Определение биоразлагаемости по угнетению потребления кислорода активным илом |
OECD Guidelines fortesting chemicals (2010). 209: Activated Sludge, Respiration Inhibition Test, Organisation for Economic Cooperation and Development, Paris. (ОЭСР, Тест № 209 Определение биоразлагаемости по угнетению потребления кислорода активным илом) |
|
|
ГОСТ 32475-2013 Методы испытаний химической продукции, представляющей опасность для окружающей среды. Оценка биоразлагаемости органических соединений в сброженном осадке сточных вод в анаэробных условиях) |
OECD Guidelines for testing chemicals (2006). 311: Anaerobic biogradability of organic compounds in digested sludge: method by measurement of gas production. Organisation for Economic Cooperation and Development, Paris (ОЭСР, Тест № 311 Оценка биоразлагаемости органических соединений в сброженном осадке сточных вод в анаэробных условиях) |
|
|
ISO 13641-1:2003 Water quality - Determination of inhibition of gas production of anaerobic bacteria - Part 1: General test (Качество воды. Расчет процесса торможения газообразования анаэробными бактериями. Часть 1. Общий тест) |
||
|
ISO 13641-2:2003 Water quality - Determination of inhibition of gas production of anaerobic bacteria - Part 2: Test for low biomass concentrations (Качество воды. Расчет процесса торможения газообразования анаэробными бактериями. Часть 2. Тест на низкие концентрации биомассы) |
||
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition activity of anaerobic bacteria. BL6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BAUK. |
||
|
Swanwick J.D., Foulkes M. (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons, wat. Pollut. Control, 70, 58 - 70 |
||
|
HMSO (1986) Determination of inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK |
||
|
Selection D.R., Tiedje J.M. (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol., 47, 850 - 857 |
||
|
Battersby N.S. and Wilson V. (1988). Evaluation of serum bottle technique for assessing the abaerobic biodegradability of organic compounds under methanogenic conditions. Chemospere, 17, 2441 - 2460 |
||
|
Wilson V., Painter H.A. and Battersby N.S. (1992). A screening method for assessing the inhibition of anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology, Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds., Steinberg C. and Kettrup A., pp. 117 - 132 (1992) |
||
|
Kawahara K., Yakabe Y., Chida T. and Kida (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemospere, 39(12), 2007 - 2018 |
||
|
ISO 10634:1995 Water quality - Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium (Качество воды. Руководящие указания по подготовке и обработке малорастворимых в воде органических соединений для последующей оценки их способности к биоразложению в водной среде) |
||
|
ISO 11923:1997 Water quality - Determination of suspended solids by filtration through glass-fibre filters (Качество воды. Определение содержания взвешенных твердых частиц путем фильтрации через стекловолокнистые фильтры) |
||
|
Madsen Т, Rasmussen Н.В. and Nilsson L. (1996). Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No:336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen |
||
Ключевые слова: химическая продукция, окружающая среда, анаэробные бактерии, анаэробное расщепление, сточные воды, ил