МИНИСТЕРСТВО РОССИЙСКОЙ
ФЕДЕРАЦИИ ПО ДЕЛАМ
ГРАЖДАНСКОЙ ОБОРОНЫ, ЧРЕЗВЫЧАЙНЫМ СИТУАЦИЯМ
И ЛИКВИДАЦИИ ПОСЛЕДСТВИЙ СТИХИЙНЫХ БЕДСТВИЙ
|
|
ФЕДЕРАЛЬНОЕ
ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ |
ОБНАРУЖЕНИЕ И ИССЛЕДОВАНИЕ
ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ,
ПРИМЕНЯЕМЫХ ПРИ ПОДЖОГАХ
Методическое пособие
Москва 2012
Авторский коллектив: И.Д. Четко, М.А. Охотников, М.Ю. Принцева, Е.Д. Андреева, А.Ю. Мокряк (СПбФ ФГБУ ВНИИПО МЧС России)
Рецензенты: Н.В. Сиротинкин, д-р хим. наук, проф. (СПбГТИ (ТУ)), С.Г. Ивахнюк, канд. техн. наук (ЭКУ ГУВД по г. Санкт-Петербургу и Ленинградской области)
Рассмотрены методические основы полевого и лабораторного обнаружения и исследования остатков зажигательных составов, применяемых при поджогах. Освещены вопросы, касающиеся осмотра места пожара, отбора проб для лабораторных исследований, осуществлена разработка различных аналитических схем обнаружения остатков зажигательных составов в зависимости от технической оснащенности лабораторий.
Предлагаемое методическое пособие может быть использовано для обнаружения не только инициаторов горения, но и остатков фейерверочных составов в случае отработки версии об их причастности к возникновению пожара.
Издание предназначено для обучения пожарных экспертов и практического применения в системе судебно-экспертных учреждений и экспертных подразделений ФПС МЧС России. Также пособие может быть рекомендовано для специалистов-взрывотехников экспертных подразделений МВД России.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ
Негативной, крайне опасной тенденцией, наблюдаемой в настоящее время в большинстве развитых стран, является рост числа поджогов. Основная часть раскрытых преступлений в данной области связана с применением ЛВЖ и ГЖ. Для поисков следов ЛВЖ и ГЖ существуют методики и технические средства, позволяющие обнаруживать их на месте пожара [1]. Однако увеличивается вероятность применения и менее тривиальных средств поджога - так называемых зажигательных составов, к которым в первую очередь относятся составы на основе сильных окислителей.
В настоящее время в экспертных подразделениях ФПС МЧС России, как, впрочем, и других ведомств, отсутствуют методики обнаружения на месте пожара остатков подобных инициаторов горения, а также установления их природы и компонентного состава. В связи с этим разработка такой методики и ее внедрение в практику исследования и экспертизы пожаров является весьма актуальной задачей, решение которой будет способствовать выявлению такого рода поджогов и получению криминалистически значимой информации, необходимой для их расследования и раскрытия.
Пособие посвящено техническим вопросам обнаружения на месте пожара остатков ЗС и установлению их компонентов с использованием современных физико-химических методов исследования. Особое внимание уделено исследованию пиротехнических (фейерверочных) составов, близких по химической природе к ЗС и в последнее время все чаще становящихся объектом экспертного исследования.
ОБОЗНАЧЕНИЯ И СОКРАЩЕНИЯ
ГЖ - горючие жидкости
ГЖХ - газожидкостная хроматография
ЗС - зажигательные составы (смеси)
ИГ - инициаторы (интенсификаторы) горения
ИК - инфракрасный
ИХ - ионная хроматография
ИКС - инфракрасная спектроскопия
ЛВЖ - легковоспламеняющиеся жидкости
РИБ - реактивные индикаторные бумаги
РИК - реактивные индикаторные комплекты
РИС - реактивные индикаторные средства
РФА - рентгенофлуоресцентный анализ
УФ - ультрафиолетовый
УФС - ультрафиолетовая спектроскопия
ЭА - элементный анализ
1. ЗАЖИГАТЕЛЬНЫЕ СОСТАВЫ, ПРИМЕНЯЕМЫЕ С ЦЕЛЬЮ ПОДЖОГА
Одним из основных квалификационных признаков поджога является обнаружение на месте пожара остатков веществ, которые могли быть использованы как средства поджога. Вещества и материалы, свойства которых благоприятствуют возникновению и развитию горения, или, как принято их называть, инициаторы (интенсификаторы) горения (акселераты), подразделяются на две группы: традиционные, куда входят ЛВЖ и ГЖ, и нетрадиционные, так называемые зажигательные составы. К последним относятся составы на основе соединений, способных при смешивании друг с другом или на воздухе к воспламенению. Близки к ним по химической природе и пиротехнические составы, которые могут стать средством поджога.
При экспертном исследовании после пожара остатков ЗС решаются, как известно, две задачи [2]. Первая подразумевает обнаружение на месте пожара следов ЗС, вторая - анализ химического состава обнаруженных остатков. Для решения этих задач необходимо обладать информацией о типах, видах, отдельных представителях анализируемых объектов и их индивидуальных характеристиках.
Основная масса подобных составов включает в себя сильные окислители и легкоокисляемое вещество. Простейшими кислородсодержащими окислителями, используемыми в основном в термитных составах, являются оксиды, поскольку реакция горючего с ними заключается в восстановлении чистого металла или неметаллического элемента. Например, оксиды железа Fe2О3 и Fe3O4, свинца Pb3O4, меди СuО, Сu2О, цинка ZnO, кремния SiO2, висмута Вi2О3, вольфрама WO3, а также оксиды хрома и ванадия. В качестве горючего в смесях с оксидами (термитные составы) используют активные металлы-восстановители (порошкообразные алюминий и магний). Несмотря на то, что термитные смеси в ходе окислительно-восстановительных реакций выделяют большое количество тепловой энергии (температура может достигать 2000 - 2500 °С) и способны гореть даже без доступа кислорода воздуха, в качестве ЗС они применяются довольно редко. Это обусловлено как худшей отдачей оксидами кислорода по сравнению со многими другими окислителями, так и тем фактом, что инициирование процесса горения требует значительных затрат энергии.
Более широкое распространение в ЗС получили пероксиды и надпероксиды щелочных и щелочноземельных металлов: Na2О2, ВаO2, КO2. Эти соединения, будучи сильными окислителями, способны в определенных условиях приводить к воспламенению легкогорючих материалов.
Окислителями также являются некоторые галогениды, сульфиды и нитриды малоактивных металлов. Применяются также и чистые элементы. Например, еще в XIX веке злоумышленники использовали в целях поджога металлические натрий и калий, а также белый фосфор. В настоящее время приведенные классы соединений и вещества в элементном виде редко употребляются для поджогов, что объясняется их малой доступностью для поджигателя и высокой токсичностью большинства из них.
Чаще в ЗС используют сильные концентрированные минеральные кислоты - серную H2SO4 и азотную HNO3. Эти кислоты вызывают воспламенение легкогорючих материалов, таких, как бумага, ткани, древесная стружка, различного рода ЛВЖ и ГЖ. Злоумышленниками могут применяться различные ЗС на основе этих кислот, действие которых заключается в том, что в ходе химических превращений образуется сильный окислитель (например, высшие оксиды хлора, марганца, хрома и др.), также способный к воспламенению легкогорючих материалов. Так, известен следующий состав: в стеклянную бутылку наливается концентрированная серная кислота и бензин в соотношении 1:2, бутылка надежно закрывается пробкой. С внешней стороны бутылка обвязывается тканью, пропитанной концентрированным раствором хлората калия и сахара. При разбивании бутылки в результате реакции серной кислоты и хлората калия образуется сильный окислитель - оксид хлора (V), при взаимодействии которого с сахаром происходит выделение большого количества энергии, вызывающего воспламенение основного горючего вещества - бензина. Хлорат калия может быть заменен перманганатом калия, бихроматом калия или перхлоратом калия, поскольку оксиды марганца (VII), хрома (VI) и хлора (VII) также являются сильными окислителями [3].
Наиболее многочисленную группу окислителей, входящих в ЗС и применяемых в основном в пиротехнике, образуют неорганические кислородсодержащие соли (нитраты, перманганаты, хлораты, перхлораты, сульфаты, хроматы и бихроматы и т.п.). Для составления зажигательных смесей эти соединения наиболее пригодны. Они легкодоступны, нетоксичны, химически устойчивы в широком интервале температур и с легкостью отдают активный кислород. Чаще используют соли аммония, калия, натрия, бария и стронция; соли лития, кальция, тяжелых металлов, вследствие их дефицитности и/или гигроскопичности, употребляются значительно реже.
В качестве горючих веществ в ЗС могут входить органические углеродсодержащие материалы, такие, как, например, древесный уголь (используемый, в частности, в дымном порохе), сахар, глицерин, спирт, ацетон, уксусная кислота, скипидар. В роли горючего-восстановителя выступают также неорганические вещества, включающие такие неметаллические элементы, как сера, красный фосфор, углерод, а также химически активные металлы (алюминий, магний, титан и т.п.).
Вещества, применяемые для инициирования горения при поджоге, в ходе пожара в большинстве случаев изменяют свое первоначальное состояние, образуя новые соединения. Это происходит в результате химического взаимодействия окислителя с горючими веществами и термической деструкции под воздействием высокой температуры на пожаре. Тем не менее на месте пожара можно обнаружить остатки ИГ и в первоначальной (непрореагировавшей) форме, поскольку на практике редко удается изготовить смесь горючего и окислителя с соблюдением стехиометрического соотношения компонентов.
В табл. 1 представлены наиболее часто используемые компоненты ЗС, а также продукты их химических превращений.
Обнаружение повышенного по сравнению с фоновым уровнем содержания в зоне очага пожара компонентов ЗС и продуктов их химического превращения может служить основанием выдвижения версии о поджоге.
Таблица 1
Компоненты ЗС и продукты их превращения, которые могут быть обнаружены на месте пожара
|
Продукты химического превращения |
|
|
Окислители |
|
|
Нитраты (KNO3, NaNO3, NH4NO3, Ca(NO3)2, Sr(NO3)2, Ва(NO3)2) |
К+, Na+, Ca2+, Sr2+, Ba2+, NO2-, ОН- |
|
Перманганаты (KMnO4) |
К+, Мn2+, МnO2, Мn2O3 |
|
Хлораты (КСlO3), броматы (КВrO3), йодаты (KIO3) |
К+, Cl-, Вr-, I- |
|
Перхлораты (КСlO4, NH4CIO4) |
К+, NH4+, Cl- |
|
Хроматы и бихроматы (К2СrО4, К2Сr2О7) |
К+, Сr3+, Сr2O3 |
|
Пероксиды и надпероксиды (Na2O2, ВаO2, КO2) |
Na+, К+, Ba2+, ОН- |
|
Минеральные кислоты (H2S04, HNO3) |
SO42-, S2-, NO3-, NO2- |
|
Горючее |
|
|
Активные металлы (Na, К, Са, Mg, Al) |
Mg2+, Аl3+, MgO, Mg(OH)2, Al2O3, Na+, K+, Ca2+, OH- |
|
Другие вещества (сера, фосфор) |
so42-, po43-, h+ |
Существуют различные методы анализа неорганических соединений, к которым в большинстве своем относятся ЗС. Наиболее целесообразным при поиске остатков этих составов следует признать сочетание полевых и лабораторных методов исследования.
2. ПОЛЕВЫЕ МЕТОДЫ ОБНАРУЖЕНИЯ И ИССЛЕДОВАНИЯ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ
Существует несколько аналитических методов экспрессного обнаружения остатков ЗС на месте пожара. Однако их применение лишь помогает пожарно-техническому эксперту определиться с выбором наиболее целесообразного места для отбора проб, но выводы, сделанные только на основании этих методов без лабораторных исследований, могут привести к принципиальным ошибкам, что является недопустимым.
2.1. Обнаружение остатков зажигательных составов в очаге пожара и прилегающих к нему зонах
Остатки ЗС могут быть обнаружены как в зоне очага пожара, так и в непосредственной близости от него.
После сгорания зажигательных составов на поверхности конструкций и предметов остаются следы в виде небольших локальных зон глубокого обугливания древесины, обивки мягкой мебели и т.п.
На поверхности бетона, керамической плитки, металла остатки ЗС бывают в виде спекшейся массы различной формы черного, сине-черного, зелено-черного цвета (перманганаты, гексацианоферраты, перхлораты, хлораты, нитраты), застывшего расплава (окись свинца), рассеянных хлопьев темно-зеленого оттенка (бихроматы). При использовании поджигателем смесей, содержащих магний или алюминий, в зонах, прилегающих к очагу пожара, может быть обнаружен мелкий кристаллический порошок белого или светло-серого цвета. Горение термитных составов сопровождается образованием частиц расплавленного металла (железа, меди и др.), которые после застывания превращаются в твердые частицы округлой формы.
В этой связи поиск остатков ЗС и места отбора проб для лабораторных исследований целесообразно начинать на стадии визуального осмотра места пожара.
В ходе пожаротушения растворимые компоненты ЗС переходят в водный раствор, что в определенных случаях приводит к образованию на поверхности древесины, бетона и других материалов потеков желтого (хроматы), красного (бихроматы), фиолетового (перманганаты) и другого цвета.
Наличие таких пятен и остатков отмечается в протоколе осмотра, они фотографируются; затем производится отбор проб для лабораторных исследований.
2.2. Установление места для отбора проб по изменению величины рН водных растворов
Визуально обнаружить остатки ЗС удается редко, при очень благоприятном стечении обстоятельств. Необходимо применение метода, позволяющего при отсутствии внешних признаков выявить место, где могут быть остатки ЗС, и отобрать пробу для лабораторных исследований. Анализ исходных компонентов и продуктов превращений наиболее доступных преступнику зажигательных и пиротехнических составов показывает, что в результате химических реакций может происходить изменение кислотно-основного равновесия (значения рН) в зоне очага пожара. Поэтому значительное отклонение рН от нейтрального значения (рН < 6,0 или рН > 8,0) является признаком, указывающим на целесообразность отбора проб для лабораторных исследований.
Ниже рассмотрены исходные компоненты и продукты химических превращений основных ЗС и пиротехнических составов, присутствие которых на месте пожара определяется по изменению кислотно-основного равновесия.
Кислотная реакция среды (рН < 6,0)
В указанную группу входят смеси на основе сильных кислот, в частности, серной и азотной. При использовании поджигателем данных соединений в очаге пожара и прилегающих зонах вероятно существенное снижение рН водной среды по сравнению со стандартным (нейтральным) значением - рН = 7,0. Установленное значение варьируется в различных пределах (в зависимости от концентрации остатков кислоты) и составляет 0 - 6,0. Зона наиболее низкого значения рН среды может рассматриваться пожарно-техническим экспертом как наиболее оптимальное место отбора пробы для лабораторных исследований.
Необходимо отметить, что концентрированные кислоты являются достаточно опасными в обращении веществами и, как правило, ЗС на их основе транспортируются в стеклянной или пластиковой таре. В связи с этим при получении данных о низком рН имеет смысл произвести тщательный осмотр на предмет осколков стекла или остатков пластиковых емкостей или контейнеров.
При использовании концентрированных серной и азотной кислот могут протекать различные химические реакции с образованием ряда продуктов:
Азотная кислота (HNO3) - при реакции вероятно образование следующих соединений: оксиды азота NO2, NO, N2O (оксид азота (IV) NO2 имеет бурую окраску, поэтому появление при пожаре бурого дыма необходимо учитывать как косвенный признак поджога). Также в ходе химических превращений с участием азотной кислоты могут получиться нитрат- и нитрит-ионы (NO3- и NO2-).
Серная кислота (H2SO4) - в результате окислительно-восстановительных реакций возможно получение сульфатов (ионы SO42-), сульфитов (ионы SO32-), сульфидов (ионы S2-).
Щелочная реакция среды (рН > 8,0)
В эту группу входят различные смеси на основе щелочных и щелочноземельных металлов (Na, К, Са, Сr, Ва), их оксиды и пероксиды (Nа2О2, КО2, ВаО2 и др.), при взаимодействии которых с водой (влагой воздуха) образуются сильные щелочи.
Щелочную реакцию среды дают также некоторые составы на основе нитратов, при разложении которых появляются оксиды металлов (CaO, SrO, BaO), а также различные смеси с магнием (MgO, Mg(OH)2).
Нейтральная реакция среды (рН = 6,0 - 8,0)
Нейтральную реакцию среды дают смеси на основе солей-окислителей (нитраты, хлораты, перхлораты, перманганаты, хроматы) и таких восстановителей, как алюминий, углерод, глицерин, сахар и др. В этом случае в результате взаимодействия окислителя и горючего образуются негидролизующиеся соли, нерастворимые в воде оксиды или газообразные вещества.
В табл. 2 приведена общая классификация компонентов ЗС и продуктов их разложения по изменению рН среды.
Простейшим средством измерения рН и обнаружения таким образом остатков ЗС является использование универсальных индикаторных бумаг, относящихся к классу РИС.
Для проведения анализа индикаторную бумагу окунают в лужицу воды в предполагаемых очаговых зонах или прикладывают к влажным поверхностям конструкций и предметов, в том числе обгоревших.
В зонах повышенной кислотности (рН £ 6) или щелочности (рН ³ 8) индикаторная бумага приобретает соответственно красный или фиолетовый цвет (необходимо свериться со шкалой). Такое изменение окраски может служить сигналом для изъятия пробы с целью исследований.
В последнее время в России и за рубежом широко применяются портативные рН-метры, позволяющие в полевых условиях проводить измерения рН водных растворов и некоторых других показателей. Так, портативный прибор рН-410, производимый фирмой «Аквилон» (Россия), предназначен для измерения активности ионов водорода (рН), окислительно-восстановительного потенциала (Eh) и температуры водных растворов. Портативные рН/ионометры HI 9024 и HI 9025 фирмы «Hanna Instruments» (Германия) - микропроцессорные рН-метры в водонепроницаемых прочных корпусах с встроенной защитой от электрических полей, обеспечивающих стабильную работу рН-метров в экстремальных условиях. Например, рН-метр HI 9024 измеряет рН и температуру, HI 9025 работает также в режиме мВ и в комплекте с соответствующими электродами может измерять окислительно-восстановительный потенциал и концентрации ионов.
Таблица 2
Общая классификация основных компонентов ЗС и продуктов их реакций по изменению рН среды
|
РН среда |
Компоненты ЗС |
Продукты реакций ЗС и их непрореагировавшие остатки |
|
< 6,0 |
Минеральные кислоты (H2SO4, HNO3) |
H+, SO42-, NO3-, NO2-, SO32-, S2- |
|
Фосфор + окислители (хлораты, перхлораты, нитраты, перманганаты натрия, калия, аммония, кальция, стронция, бария и др.) |
Р2O5, H+, PO43-, HPO42-, H2PO4-, K+, Na+, NH4+, Ca2+, Ba2+, Sr2+, Cl-, ClO3-, ClO4-, MnO4-, MnO42-, Mn2+, NO3-, NO2- и др. |
|
|
Сера + окислители (хлораты, перхлораты, нитраты, перманганаты натрия, калия, аммония, кальция, стронция, бария и др.) |
SO2, Н+, SO32-, SO42-, S2-, K+, Na+, NH4+, Ca2+, Ba2+, Sr2+, Cl-, ClO3-, ClO4-, MnO4-, MnO42-, Mn2+, NO3-, NO2- и др. |
|
|
> 8,0 |
Щелочные и щелочноземельные металлы (Na, К, Са, Ва) + вода |
OH-, Na+, K+, Ca2+, Ba2+ |
|
Перекиси активных металлов (Nа2О2, ВаО2, КО2 и др.) + вода |
OH-, Na+, К+, BA2+ и др. |
|
|
Магний + окислители (нитраты, хлораты, перхлораты, перманганаты, хроматы и др.) |
Mg2+, MgO, Mg(OH)2, Сl-, ClO- , ClO4-, MnO4-, MnO42-, Mn2+, NO3-, NO2-, Cr2O3, MnO2 и др. |
|
|
6,0 - 8,0 |
Соли-окислители (нитраты, хлораты, перхлораты, перманганаты, хроматы) + углерод, алюминий, глицерин, сахар и др. |
Сl-, СlO3-, ClO4-, MnO4-, MnO42-, Mn2+, NO3-, NO2-, CrO42-, Cr2O72-, Cr3+, Al3+, Al2O3, Cr2O3, MnO2 и др. |
Отметим также портативный рН-метр HI 8314 фирмы «Hanna Instruments», преимущества которого заключаются в возможности проводить определение рН не только водного раствора, но и непосредственно на любых влажных поверхностях. Такой рН-метр может быть рекомендован в качестве экспресс-анализатора для поиска кислотных и щелочных остатков ЗС.
2.3. Исследование рН сгоревших проб зажигательных составов на различных объектах-носителях с использованием портативного прибора HI 8314
При разработке данного методического пособия производилось сжигание различных ЗС на ряде объектов-носителей, таких, как древесина, линолеум, ковролин, неорганические строительные материалы (бетон). После сжигания составов осуществлялось смывание основной массы продуктов реакции с объекта-носителя водой, имитирующее пожаротушение, а затем определение рН влажных поверхностей. Параллельно исследовались пробы объектов-носителей как в исходном состоянии, так и в сгоревшем виде. Было установлено, что некоторые объекты-носители и добавки к ним различных соединений изменяют кислотно-основное равновесие, что необходимо учитывать эксперту.
Результаты исследования образцов древесины, линолеума, ковролина и бетона приведены в табл. 3.
Таблица 3
Значения рН различных объектов-носителей в исходном состоянии и подвергнутых термической обработке
|
рН образца |
||
|
исходного |
сгоревшего |
|
|
Древесина |
6,84 |
7,14 |
|
Линолеум |
6,78 |
6,02 |
|
Ковролин |
6,89 |
6,68 |
|
Бетон |
9,22 |
10,24 |
Данные, приведенные в табл. 3, свидетельствуют о том, что рН исследованных образцов древесины, линолеума и ковролина в исходном состоянии и после термообработки является нейтральным в пределах погрешности определения. Однако строительные неорганические материалы, содержащие известь (бетон, цемент и др.), и в исходном состоянии демонстрируют щелочную реакцию. Это необходимо принимать во внимание при анализе подобных объектов.
Для сравнения в табл. 4 представлены результаты измерения рН некоторых составов на различных объектах-носителях.
Необходимо подчеркнуть, что наиболее распространенные ЗС чаще всего при сгорании демонстрируют увеличение щелочности среды (составы на основе нитратов щелочноземельных металлов, нитрата аммония, перекисей (калия, натрия, бария), магния). Однако в результате сгорания некоторых смесей, наоборот, происходит повышение кислотности среды (составы на основе минеральных кислот, серы, фосфора). Таким образом, изменение рН в ту или иную сторону от нейтральной реакции (7,0) (с учетом анализа пробы сравнения) должно служить основанием для изъятия пробы в целях более детальных лабораторных исследований.
Таблица 4
рН некоторых ЗС после сгорания на различных объектах-носителях
|
рН |
|
|
КСlO3 + Mg (древесина) |
9,50 |
|
КСlO3 + Mg (ковролин) |
8,70 |
|
Ва(NO3)2 + Ca(NO3)2 + NH4NO3 + Аl (линолеум) |
8,37 |
|
КNO3 + Аl (древесина) |
7,62 |
2.4. Применение реактивных индикаторных бумаг для обнаружения остатков зажигательных составов
Информативным экспрессным методом обнаружения остатков ЗС на месте пожара также является использование РИС и, в частности, реактивных индикаторных бумаг, селективных по отношению к определенным компонентам ЗС. Данный метод может применяться в случае, когда значение рН водных растворов в предполагаемом очаге пожара приближается к нейтральному (рН = 6 - 8) и остатки ЗС не обнаруживаются, как было описано выше, по кислотно-щелочной реакции.
Химические тест-методы анализа отличает много достоинств:
- экспрессность - длительность анализа не превышает 20 мин;
- возможность проведения анализа в полевых условиях;
- низкая стоимость анализа;
- простота в использовании, так как не требуется высокой квалификации персонала, выполняющего анализ;
- хорошая чувствительность метода - от 0,5 мг/л в зависимости от типа тест-средства.
Все перечисленные достоинства тест-методов анализа предполагают возможность их использования в пожарно-технической экспертизе, в частности, для обнаружения остатков ЗС на месте пожара.
Метод обнаружения при помощи РИБ основан на химическом взаимодействии индикатора с остатками ЗС, как прореагировавшими, так и не прореагировавшими в ходе реакции. Содержание компонентов определяют по тону или интенсивности окраски индикаторной бумаги после контакта индикатора с исследуемым веществом или его раствором, путем сравнения ее с цветной шкалой. При помощи РИБ возможно обнаружение NO3-, NO2-, Cr2O72-, СrO42-, СlO- и других ионов.
Поскольку подобные тест-системы предназначены в основном для анализа ионного состава водных растворов, предварительно необходимо провести растворение исследуемого неизвестного вещества в дистиллированной воде. С этой целью небольшое количество пробы (на кончике пинцета или шпателя) помещают в пробирку, заливают дистиллированной водой (3 - 5 мл), перемешивают путем встряхивания пробирки в течение 1 - 2 мин, отфильтровывают с помощью бумажного фильтра и проводят обнаружение остатков ЗС с использованием РИБ по методикам, описанным в инструкциях по применению.
Так как в природных, сточных и питьевых водах содержатся в незначительных количествах все вышеупомянутые ионы, необходимо изначально проводить анализ воды, как используемой при приготовлении растворов, так и применяемой в ходе тушения пожара, на наличие этих ионов.
Если РИБ не дали положительных результатов на наличие тех или иных ионов, но заметны характерные внешние признаки присутствия на поверхности бетона, керамической плитки, металла остатков ЗС в виде спекшейся массы различной формы и оттенков, необходимо отобрать пробы в этих местах для детального исследования их в лаборатории инструментальными методами анализа. Причем требуются две пробы: объект-носитель, содержащий остатки предполагаемого ЗС, и тот же носитель без следов инородных веществ (проба сравнения).
2.5. Аналитическая схема исследования следов зажигательных составов на месте пожара
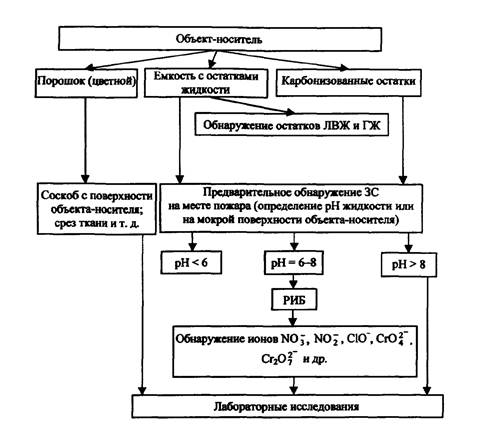
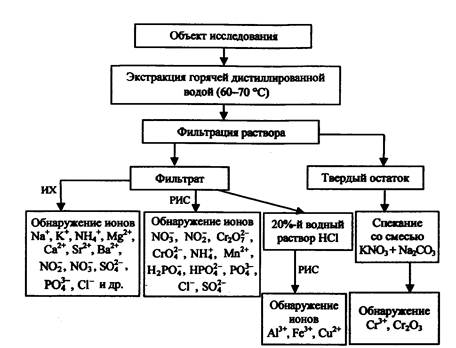
Подытоживая вышесказанное, делаем вывод: анализ следов ЗС на месте пожара целесообразно проводить по схеме, приведенной на рис. 1.
На первой стадии осуществляется визуальный осмотр места пожара, определяется предполагаемый очаг. В районе очага пожара и прилегающих к нему зонах отмечается наличие возможных остатков либо цветного порошка, либо цветных разводов, подтеков сплавленных агломератов. В этом случае методом соскоба с твердой поверхности или путем среза ткани (если вещество обнаружено, например, на мягкой мебели) производится изъятие предполагаемых следов ЗС для лабораторных исследований. В случае обнаружения емкостей с остатками жидкости измеряется рН (в последнем случае остатки неизвестной жидкости анализируются на наличие также следов ЛВЖ и ГЖ). В случае, если рН больше 8,0 или меньше 6,0, пробу неизвестного вещества отправляют на лабораторные исследования. При рН = 6 - 8 дополнительно проводят анализ с использованием РИБ на наличие ионов NO3-, NO2-, Сr2О72-, СrО42-, СlO- и др.
Рис. 1. Схема исследования ЗС на месте пожара
2.6. Отбор и упаковка проб
Для исследования в лаборатории пробы отбираются:
- в зонах положительной реакции РИБ;
- по месту нахождения визуально выявленных остатков ИГ;
- в других подозрительных местах (места обнаружения корпусов каких-либо зажигательных устройств, стеклянных или пластмассовых емкостей, содержащих остатки жидкости, фитилей и других элементов зажигательных устройств и т.п.).
Пробы отбирают путем соскоба, состругивания, вырезания отдельных участков предмета-носителя.
При наличии на поверхности конструкции или предмета спекшейся массы, расплава, приставшего к поверхности или въевшегося в нее, отбор пробы может производиться посредством протирки подозрительного участка куском чистой наждачной шкурки на тканевой основе размером не менее 5´5 см. Марка используемого абразивного материала - по ГОСТ 5009-82 или по ГОСТ 5009-82. Отбор пробы выполняется посредством втирания в наждачный материал мелких частиц с поверхности объекта-носителя. Шкурка со снятыми с поверхности предмета остатками ИГ упаковывается и оформляется аналогично другим пробам.
Осторожно следует подходить к отбору проб с окрашенных поверхностей. Наличие в пробе мелких частиц деструктированного слоя краски может существенно исказить результаты качественного ЭА пробы. Известно, что в состав красок входят пигменты, среди которых могут быть оксиды металлов (титана, цинка, хрома, железа, свинца, кобальта, алюминия, никеля и др.) и соли (хроматы свинца, цинка, стронция, кальция, бария). Соединения хрома, железа также могут существенно исказить результаты диагностики сильных окислителей в пробах. В этой связи при отсутствии возможности отделения изымаемого для лабораторных исследований вещества от частиц краски следует отобрать несколько проб сравнения этой краски для надежного определения уровня фона примесей.
Возможен отбор на исследование проб воды, скопившейся после тушения в углублениях на полу, других конструкциях и предметах, в местах, где, судя по обстоятельствам пожара, мог находиться ИГ.
При отборе проб древесины следует обращать внимание на обугленную часть, так как на ней достаточно хорошо сохраняются остатки ЗС, а также продукты их реакции. Обугленная поверхность древесины после горения имеет трещины, в которых может концентрироваться искомый окислитель, смываемый туда потоками воды при тушении пожара.
На других объектах-носителях, таких, как керамическая плитка и окрашенная металлическая поверхность, остатки ИГ могут находиться в виде спекшейся массы различной формы (перманганат, гексацианоферрат, перхлораты, хлораты, нитраты), застывшего расплава (окись свинца) и рассеянных хлопьев темно-зеленого оттенка (бихроматы).
Материалы мягкой мебели (ткани, ватин, пенополиуретан и т.п.), а также их обгоревшие остатки с предполагаемыми ЗС вырезаются ножом, скальпелем, ножницами.
Обязательно следует отбирать пробу сравнения. Особенно это актуально для полимеров и материалов на их основе (например, линолеума), полов, покрытых мастикой и лаком. Пробу сравнения отбирают там, куда при поджоге гарантированно не мог попасть ИГ, - в наиболее удаленном от очага углу комнаты, в закрытой каким-либо предметом зоне и т.д.
Капли и лужицы жидкости могут быть собраны шприцем или стеклянными капиллярами. К отбору проб с использованием ватных тампонов или фильтровальной бумаги следует подходить с известной осторожностью, поскольку в качестве одного из компонентов ЗС могла быть использована концентрированная серная или азотная кислота. В этой связи рекомендуется предварительное определение рН жидкости. Чистый образец ваты или бумаги при отборе проб с использованием этих материалов также представляется на экспертизу для сравнительного исследования. Смоченные тампоны, бумагу складывают в герметически закрывающуюся емкость.
Требования к объему или массе отбираемых проб могут варьироваться в зависимости от их природы - для анализа в лабораторных условиях необходимо не менее 0,5 - 1,0 г остатков от сгорания ЗС; в случае подозрения на присутствие ЗС в местах сильного обугливания древесины и других материалов отбор обуглившихся остатков следует производить в количестве не менее 5 - 10 г, а при отборе проб водных растворов и других жидкостей оптимальным объемом можно считать 50 - 100 мл, что продиктовано особенностями различных методов исследования.
Основными требованиями, предъявляемыми к таре для проб, являются ее прочность, чистота и химическая инертность [4]. Для упаковки небольших проб твердых веществ вполне пригодна как стеклянная тара, так и полиэтиленовые пакеты и емкости. Не допускается использование для упаковки ЗС металлических банок или контейнеров. Пакеты для упаковки должны быть плотные (из толстой полимерной пленки), новые и целые. После помещения в пакеты остатков ЗС их герметично закрывают.
Если на месте пожара обнаружены жидкие остатки ЗС в бутылках (например, концентрированные кислоты), их следует закупорить чистыми полиэтиленовыми или корковыми пробками. Ecли остатки ЗС обнаружены в таре, которую трудно герметизировать, жидкость нужно перелить в чистую бутылку или пробирку с притертой стеклянной, корковой или полиэтиленовой пробкой. Использование бумажных, а также металлических пробок или крышек не допускается.
В целях обеспечения безопасности персонала мероприятия по отбору и упаковке проб следует проводить в резиновых или полиэтиленовых перчатках с использованием подходящего инструмента: пинцета, шпателя и т.п.
3. ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ
Для эффективного решения задачи установления наличия и природы остатков ЗС в объектах, изъятых с места пожара, могут применяться современные физико-химические методы, такие, как элементный анализ (в частности, РФА), рентгенофазовый анализ, ИКС, УФС, ИХ. Ряд этих инструментальных методов исследования находится на вооружении СЭУ ФПС ИПЛ и экспертно-криминалистических лабораторий МВД России.
3.1. Определение элементного состава проб
Элементный анализ проводится для качественного и количественного определения элементов в материалах сложного состава.
Существует ряд инструментальных методов, которые можно применять при элементном анализе: рентгено-флуоресцентном, атомно-эмиссионном, атомно-абсорбционном анализе. Все эти методы, имеющие свои достоинства и недостатки, эффективны при исследовании остатков зажигательных и пиротехнических составов.
Самым распространенным в настоящее время методом установления элементного состава веществ и материалов является РФА. В ряде экспертных подразделений МЧС и МВД России для этих целей используется универсальный прибор рентгеновского анализа СУР-01 «Реном». Данный спектрометр предназначен для определения содержания химических элементов от К до U в различных веществах, находящихся в твердом, порошкообразном или растворенном состоянии, а также нанесенных на поверхности и осажденных на фильтры. Более современная модель - вакуумный спектрометр «Реном ФВ» - позволяет определять элементы в диапазоне Na - U.
Преимуществами метода РФА являются: экспрессность, отсутствие необходимости в сложной пробоподготовке. Кроме того, метод является неразрушающим, пробу после анализа можно исследовать другими методами.
Из недостатков можно отметить невозможность анализа пробы на наличие в ее составе некоторых легких элементов (натрий, магний, алюминий и др.). Также на спектрах всегда присутствуют полосы поглощения материала анодной трубки.
Для проведения анализа пробу неизвестного вещества измельчают (например, растиранием в ступке), помещают в кювету для сыпучих материалов и проводят съемку рентгеновского спектра. Необходимо подчеркнуть, что приборы этого типа более чувствительны при определении тяжелых элементов (марганец, хром и т.п.), чем при анализе более легких элементов (калий, кальций). Также предел обнаружения элементов зависит от электронной конфигурации их атомов. Пределы обнаружения с помощью СУР «Реном» некоторых элементов (время экспозиции - 100 с) составляют: Cd, Pb - 5 × 10-4 %; Ti, V, Cr - 1 × 10-4 %; Co, Ni - 5 × 10-5 %.
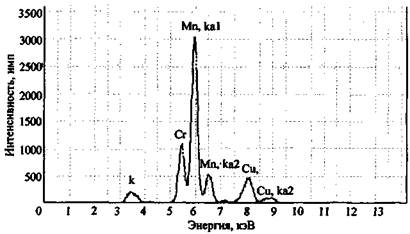
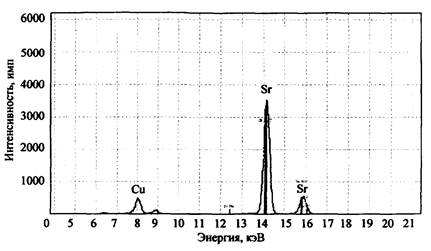
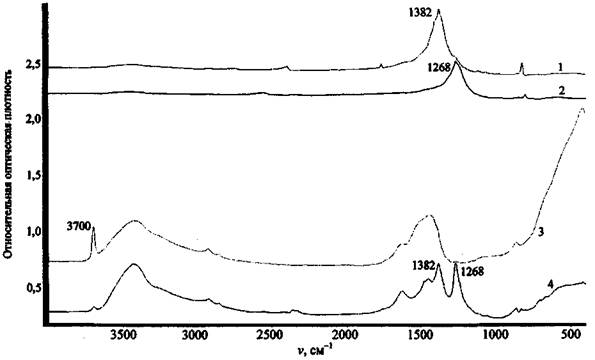
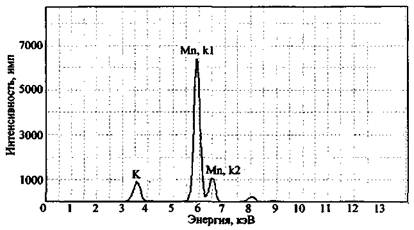
Для примера на рис. 2 представлен спектр остатков после сгорания состава КМnO4 + К2Сr2О7 + Mg + глицерин. На спектре четко фиксируется наличие в сгоревшем остатке марганца, хрома и калия. Магний прибором данного типа не определяется, для его обнаружения необходим вакуумный спектрометр (например, «Реном ФВ»).
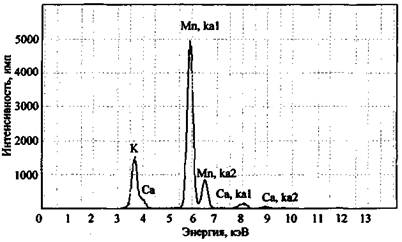
При анализе элементного состава изучаемой смеси необходимо всегда проводить исследование нулевой пробы (пробы сравнения). Так, на рис. 3 представлен спектр остатков после сгорания смеси КМnО4 + S (объект-носитель - ковролин).
Рис. 2. Рентгенофлуоресцентный спектр остатков сгорания смеси K2Cr2O7 + КМnO4 + Mg + глицерин (объект-носитель - древесина). СУР-01 «Реном»
Рис. 3. Рентгенофлуоресцентный спектр остатков сгорания смеси КМпO4 + S (объект-носитель - ковролин). СУР-01 «Реном»
На рентгеновском спектре помимо спектральных полос, соответствующих калию и марганцу, наблюдается наличие полосы кальция, который изначально не мог содержаться в ЗС. Исследование нулевой пробы (несгоревшего ковролина) показало наличие в ней соединений кальция (вероятно, в качестве добавок, входящих в состав ковролина) и объяснило появление полосы кальция на спектре рис. 3.
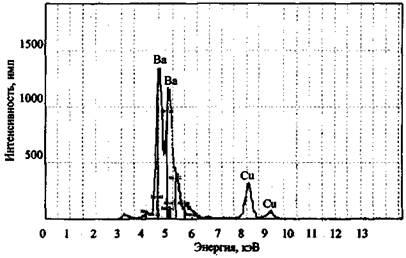
Методом РФА могут исследоваться и остатки сгорания промышленно изготавливаемых пиротехнических составов. На рис. 4 и 5 в качестве примера приведены результаты элементного анализа факелов зеленого и красного огня.
Рис. 4. Рентгенофлуоресцентный спектр остатков сгорания факела зеленого огня. СУР-01 «Реном»
Обнаружение в пробе неизвестного соединения таких относительно редких элементов, как барий или стронций, дает основание предполагать, что это может быть компонентом пиротехнического или зажигательного состава, использованного для поджога.
Рис. 5. Рентгенофлуоресцентный спектр остатков сгорания факела красного огня. СУР-01 «Реном»
Помимо качественного анализа, метод рентгенофлуоресцентной спектроскопии пригоден также для осуществления экспрессного полуколичественного анализа. С этой целью в программное обеспечение приборов «Реном» заложена возможность вычисления относительной концентрации атомов в веществе или материале. Данная возможность (расчет относительной концентрации по «фундаментальным параметрам») позволяет в первом приближении без предварительной калибровки прибора проводить полуколичественный анализ элементного состава исследуемых объектов (относительная ошибка вычислений - 10 - 20 % (отн.)).
3.2. Рентгенофазовый анализ
Разновидностью рентгеновского анализа является рентгеновский анализ фазового состава вещества.
В основе метода рентгенофазового анализа лежит явление дифракции рентгеновских лучей на кристаллической решетке [5]. Рентгеновское излучение, попадая на кристалл, отражается под определенным дифракционным углом. Угол дифракции и длина волны излучения связаны постоянным соотношением. В это соотношение входит и расстояние между атомными плоскостями. Таким образом, расстояние между атомными плоскостями и, в общем случае, расположение атомов в кристалле можно определить, измеряя дифракционные углы. Первый этап анализа - определение межплоскостных расстояний d и относительных интенсивностей для каждой линии I. Если нужно идентифицировать материал, достаточно сравнить полученный набор d и I со справочными данными. С этой целью в программное обеспечение современных рентгеновских дифрактометров входит база данных рентгенофазовых стандартов (эталонных спектров чистых фаз). База данных содержит данные о рентгенограммах большого количества соединений и дает возможность проводить быстро (иногда за несколько минут) идентификацию вещества. У разных веществ могут быть совпадающие в пределах точности эксперимента межплоскостные расстояния, но набор межплоскостных расстояний уникальный, т.е. является «паспортом» вещества.
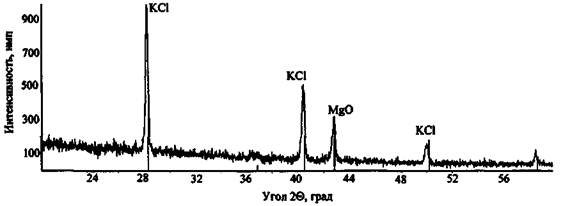
На рис. 6 представлена дифрактограмма сгоревшего состава КСlO3 + Mg, снятая на приборе СУР-01 «Реном» (напряжение анодной трубки 30 кВ, сила тока 6 мА, диапазон углов сканирования 20 - 60°, шаг съемки 0,03°, экспозиция 1 с). Идентификация фаз по базе данных эталонных спектров позволила установить, что сгорание ЗС прошло полностью - обнаружены фазы, соответствующие исключительно конечным продуктам реакции (хлорид калия, оксид магния):
КСlO3 + 3Mg → КСl + 3MgO
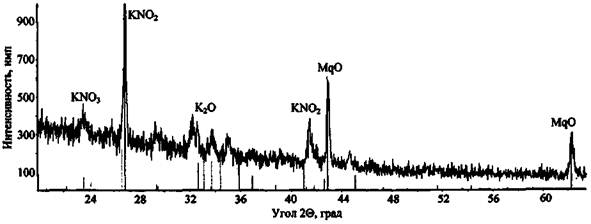
Более сложным образом проходит сгорание состава KNO3 + Mg (рис. 7). Дифрактограмма характеризуется большим количеством дифракционных максимумов, сопоставление которых с эталонными спектрами показывает наличие в составе пробы как непрореагировавшего окислителя (KNO3), так и различных продуктов реакции (KNO2, MgO, K2O и др.).
Рис. 6. Дифрактограмма сгоревшего состава КСlO3 + Mg
Рис 7. Дифрактограмма сгоревшего состава KNO3 + Mg
Рентгенофазовый анализ можно рассматривать как один из возможных методов определения компонентов остатков ЗС. Однако для успешного проведения исследований этим методом желательно знать элементный состав пробы (для этих целей могут быть использованы данные рентгенофлуоресцентного либо химического анализа). Также необходима тщательная пробоподготовка (размер частиц анализируемого вещества должен быть порядка 1 - 10 мкм). В случае, когда остатки ЗС, привезенные с места пожара, находятся в смеси с частицами объекта-носителя (волокна древесины, кусочки линолеума и т.п.), требуется их разделение, поскольку последние могут существенно исказить дифракционную картину. Перечисленные выше факторы, безусловно, усложняют применение данного метода на практике.
3.3. Применение реактивных индикаторных средств в лабораторных условиях
Реактивные индикаторные средства бывают нескольких видов: индикаторные бумаги (см. гл. «Полевые методы обнаружения и исследования зажигательных составов»), индикаторные растворы, индикаторные порошки и трубки, таблетки и др. Метод РИС нашел широкое применение при анализе почв; сточных, природных и питьевых вод; при контроле пищевых продуктов и др. [6].
В качестве РИС, помимо РИБ, могут применяться и реактивные индикаторные комплекты, в состав которых входят как буферные растворы, так и различные химические реагенты. Применение РИК в полевых условиях сопряжено с определенными трудностями, по этой причине целесообразнее их использование в лаборатории.
При помощи РИС возможно обнаружение NO3-, NO2-, Cr2O72-, CrO42-, NH4+, Mn2+, al3+, н2Pо4-, нро42-, ро43-, Cl-, so42- и других ионов.
Обнаружение остатков ЗС может осуществляться как индикаторными средствами отечественного производства, так и выпускаемыми зарубежными производителями. К примеру, при отработке данной методики использовались РИС, изготавливаемые ЗАО «Крисмас+» (Санкт-Петербург), а также РИБ для определения Мn2+, выпускаемые фирмой «Merck» (Германия).
В ходе отработки методики экспресс-анализа с применением РИС было установлено, что для растворения анализируемого вещества и его извлечения с объектов-носителей (например, обгоревших участков древесины, тканей, линолеума) целесообразно использовать горячую дистиллированную воду (температура воды 60 - 70 °С), поскольку в этом случае достигается наиболее эффективное растворение остатков ЗС.
Нерастворившиеся в воде остатки пробы, отделенные от раствора фильтрованием, также могут представлять определенную ценность для эксперта в плане получения полезной информации. В качестве остатков ЗС, нерастворимых в воде, могут выступать, в частности, оксиды тяжелых металлов (СuО, Fе2О3, Fе3О4, MnO2), а также некоторые металлы в чистом виде (Al, Fe, Mn). Для перевода этих веществ в раствор можно использовать минеральные кислоты, из которых наиболее оптимальным вариантом следует признать разбавленную соляную кислоту (15 - 20 %-й водный раствор). Это связано как с хорошей растворимостью большинства хлоридов металлов в воде, так и со слабыми окислительными свойствами хлористого водорода Растворение пробы в разбавленной соляной кислоте проводится аналогично растворению в дистиллированной воде. После приготовления раствора его исследуют тест-методами на присутствие алюминия, меди (II), железа и марганца.
С учетом вышеизложенного обнаружение остатков ЗС при помощи РИС в лаборатории рекомендуется проводить по следующей схеме: 1) часть исследуемого образца растворяется в горячей дистиллированной воде, раствор фильтруется и проверяется при помощи РИБ и РИК на наличие водорастворимых ионов NO3-, NO2-, CrO42-, Сr2О72-, Mn2+, Al3+, NH4+, SO42-; 2) нерастворившийся в воде остаток растворяется в разбавленной соляной кислоте, после чего раствор исследуется на наличие следов марганца, хрома, меди, железа.
Определение марганца в нерастворимой в воде пробе может быть проведено до ее обработки соляной кислотой.
Так как в природных, сточных и питьевых водах содержатся в незначительных количествах все вышеупомянутые ионы, параллельно осуществляется анализ нулевой пробы.
3.4. Обнаружение и исследование остатков ЗС по электронным спектрам пропускания
Менее информативными, нежели методы элементного и фазового анализа, являются при исследовании остатков ЗС методы молекулярной спектроскопии. Однако, учитывая наличие ИК спектрометров и спектрофлуориметров в СЭУ ФПС ИПЛ и экспертных организациях других ведомств (проводящих также фотометрические исследования), необходимо рассмотреть возможность их использования для решения данных задач.
Электронные спектры молекул проявляются в видимой (350 - 800 нм) и ультрафиолетовой (200 - 350 нм) областях спектра. Их возникновение связано с возбуждением внешних валентных электронов, которые в основном определяют химические свойства вещества. Молекулы, содержащие простые связи, поглощают в области длин волн короче 160 нм; молекулы, имеющие кратные (двойные или тройные) связи, поглощают в области спектра ниже 240 им, а молекулы, которые содержат атомы с неподеленными парами электронов (N, О, S, галогены и др.), - в области длин волн короче 350 нм.
Число веществ, электронный спектр пропускания которых расположен в легко доступной для большинства спектрофлуориметров области (200 - 800 нм), очень велико.
В состав ЗС также входят вещества, имеющие спектры пропускания в видимой и ультрафиолетовой областях. К ним относятся нитраты NO3-, хроматы Cr42-, бихроматы Cr2O72-, перманганаты MnO4-, соединения Fe3+ (Fe2O3). Спектры пропускания в видимой и ультрафиолетовой областях имеют и вещества, образующиеся в ходе термического разложения ЗС: нитриты NO2-, соединения Сr3+ (Сr2О3), йодиды I- и др.
В табл. 5 приведены характеристические полосы пропускания перечисленных выше неорганических соединений в водных растворах [9 - 11].
Чувствительность этого метода зависит от молярного коэффициента экстинкции конкретного иона Чем выше коэффициент экстинкции, тем, при прочих равных условиях, будет выше чувствительность метода. Для ионов I- предел обнаружения составляет около 10-5 % (масс.), для NO2- ~ 1 % (масс.), для NO3- ~ 0,1 % (масс), для хромат- и бихромат-ионов ~ 10 % (масс). По чувствительности данный метод пригоден для определения следовых количеств вещества, что немаловажно при обнаружении остатков ЗС.
Исследование остатков ЗС может осуществляться на любом современном спектрофлуориметре, позволяющем проводить изучение фотометрических характеристик. К таким приборам можно отнести и спектрофлуориметр «Флуорат-02-Панорама», имеющийся в наличии в СЭУ ФПС ИПЛ и экспертных организациях других ведомств.
Таблица 5
Характеристические полосы пропускания неорганических соединений, входящих в состав зажигательных составов и образующихся в результате химических реакций при их сгорании [7, 8]
|
Положение полосы пропускания, нм |
Молярный коэффициент экстинкции ε |
|
|
NO3- |
303 |
7 |
|
194 |
8800 |
|
|
NO2- |
354 |
23 |
|
210 |
5380 |
|
|
287 |
9 |
|
|
Сr3+ |
588 |
14 |
|
416 |
15 |
|
|
I- |
226 |
12600 |
|
194 |
12600 |
|
|
Fe3+ |
714 |
14000 |
|
МnO4- |
528 |
240 |
|
Cr42- |
370 |
1400 |
|
Cr2O72- |
350 (0,9 н. раствор H2SО4) |
750 |
Для проведения анализа некоторое количество пробы, изъятой с места пожара, растворяется в горячей дистиллированной воде (60 - 70 °С) при перемешивании в течение 30 - 40 мин с использованием любого лабораторного перемешивающего устройства. Полученный водный раствор отфильтровывается с помощью бумажного фильтра, после чего проводится съемка спектров пропускания в диапазоне измерений 200 - 600 нм с частотой повторения 25 Гц и шагом сканирования 1 нм.
Анализ полученных спектров осуществляется путем сопоставления полос пропускания компонентов пробы с табличными значениями индивидуальных ионов (табл. 5).
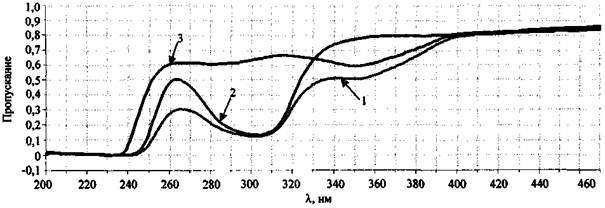
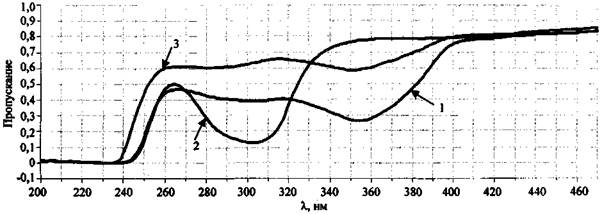
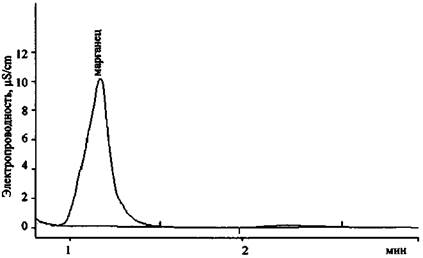
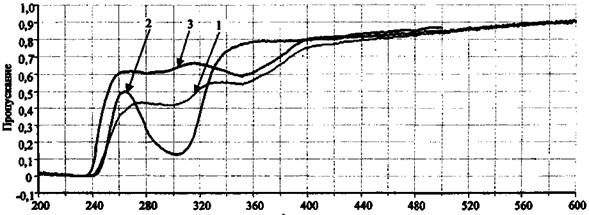
Для примера на рис. 8 представлены спектры пропускания водных растворов сожженного на ковролине состава NaNO3 + S, а также KNO3 (концентрация 1 % (масс.)) и KNO2 (концентрация 0,1 % (масс.)).
Спектр пропускания сожженного на ковролине состава NaNO3 + S имеет две полосы - 305 и 354 нм (рис. 8). Полоса 305 нм свидетельствует о присутствии в исследуемом образце непрореагировавшего нитрат-иона, полоса 354 нм относится к нитрит-иону, образовавшемуся в результате химической реакции между нитратом натрия и серой. Слабая полоса пропускания 287 нм (ε = 9), также характерная для NO2- аниона, в исследуемом образце перекрывается полосой 305 нм для NO3- иона. При исследовании чистого сгоревшего ковролина полосы пропускания в области 200 - 600 нм не наблюдаются.
В спектре пропускания образца сожженного состава KNO3 + Mg присутствуют полосы нитрит- и нитрат-ионов (305 и 354 нм) (рис. 9), что также объясняется наличием в исследуемом образце остатков непрореагировавшего нитрата калия и образовавшегося в результате реакции нитрита калия. Оксид магния, образовавшийся в результате химической реакции, не имеет полос пропускания в видимой и ультрафиолетовой областях.
Рис. 8. Спектры пропускания отдельных компонентов ЗС.
Спектрофлуориметр «Флуорат-02-Панорама»:
1 - выгоревший состав NaNO3 + S (на ковролине); 2 - KNO3 (конц. 1 % (масс.));
3 - KNO2 (конц. 0,1 % (масс.))
Рис. 9. Спектры пропускания отдельных компонентов ЗС.
Спектрофлуориметр «Флуорат-02-Панорама»:
1 - выгоревший состав KNO3 + Mg; 2 - KNO3 (кони. 1 % (масс.))
3 - KNO2 (кони. 0,1 % (масс.))
Рис. 10. Спектры пропускания отдельных компонентов ЗС.
Спектрофлуориметр «Флуорат-02-Панорама»:
1 - выгоревший состав КIO3 + Mg; 2 - KI
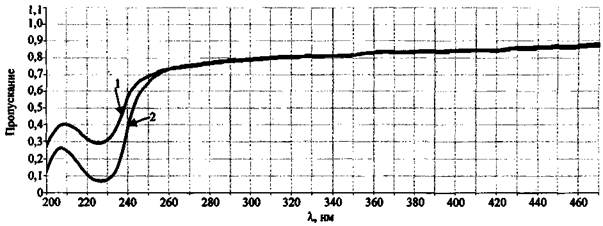
В спектре пропускания сгоревшего состава КIO3 + Mg, как и предполагалось, наблюдается только одна полоса 227 нм (рис. 10), характерная для йодид-иона, образовавшегося в ходе реакции между КIO3 и Mg. Йодат калия, участвующий в химической реакции как окислитель и оксид магния, также образующийся в результате реакции, не имеет полос пропускания в видимой и ультрафиолетовой областях.
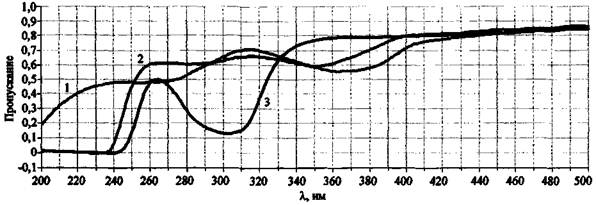
В случае, если ЗС состоит из веществ, имеющих спектры с находящимися близко друг к другу полосами пропускания с разными значениями молярных коэффициентов экстинкции, то в спектре пропускания исследуемого состава слабые полосы могут маскироваться более интенсивными (с наибольшим молярным коэффициентом экстинкции). Поэтому, например, при обнаружении в спектре пропускания интенсивной полосы, отвечающей хромат-иону (370 нм), нельзя констатировать отсутствие слабых полос, отвечающих нитрат- и нитрит-ионам (рис. 11).
Таким образом, метод УФ спектроскопии применим для обнаружения остатков ЗС в случае сохранения в них даже незначительных количеств водорастворимых ионов, имеющих спектр пропускания в области 200 - 700 нм, таких, как NO2-, CrO42-, I-, MnO4-. Если раствор исследуемого образца не имеет спектра пропускания в видимой и ультрафиолетовой областях, однако представляет собой спекшуюся массу различной формы черного, сине-черного, зелено-черного цвета (перманганаты, гексацианоферраты, нитраты), рассеянных хлопьев темно-зеленого оттенка (дихроматы, оксид хрома), необходимо исследование его в лаборатории другими инструментальными методами.
Рис. 11. Спектры пропускания отдельных компонентов ЗС.
Спектрофлуориметр «Флуорат-02-Панорама»:
1 - выгоревший состав K2Cr2O7 + KNO3 + сахар; 2 - K2Cr2O7 (конц. 10-3 % (масс.));
3 - KNO3 (конц. 1 % (масс.))
3.5. ИК спектроскопия
ИК спектр вещества содержит полосы поглощения, соответствующие колебаниям определенных групп атомов, функциональных групп и молекул, входящих в состав данного вещества, и служит его характеристикой. Поэтому спектроскопические данные позволяют идентифицировать неизвестные химические соединения. Однако данный метод имеет и свои ограничения, связанные с аддитивностью, в силу которой спектр смеси нескольких веществ представляет собой наложение спектров входящих в ее состав индивидуальных соединений. Это существенно снижает возможность использования спектральных данных для обнаружения неизвестных веществ [12].
Обнаружение и исследование остатков ЗС проводят на инфракрасном спектрофотометре с фурье-преобразованием (например, ФСМ 1201), используя методику приготовления образцов в таблетке с бромидом калия (КВr). Для этого приблизительно 2 мг анализируемого вещества растирается с порошком КВr в агатовой ступке, затем смесь запрессовывается в таблетки в специальной пресс-форме под высоким давлением (более 550 МПа) с непрерывной откачкой воздуха до 0,1 Па и проводится съемка ИК спектров в диапазоне длин волн 4000 - 400 см-1. Анализ полученных экспериментальных данных осуществляется путем сопоставления по длинам волн полос поглощения исследуемого вещества с полосами поглощения, отвечающими колебаниям связей в структурных фрагментах индивидуальных веществ-эталонов по базе данных спектров.
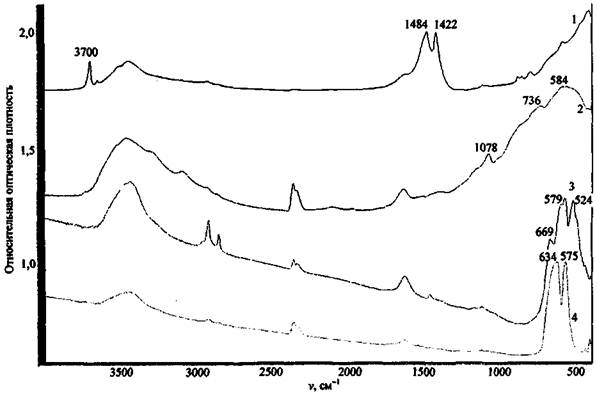
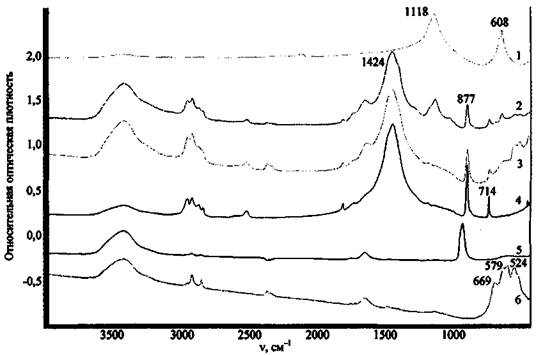
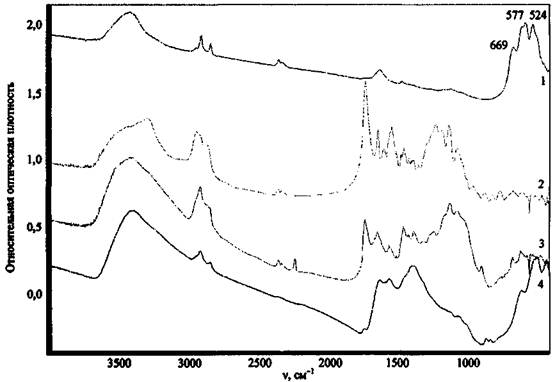
На рис. 12 приведены спектры ряда оксидов металлов, как одних из наиболее вероятных соединений, способных остаться на месте пожара после поджога.
Рис. 12. ИК спектры некоторых компонентов ЗС и продуктов их превращения:
1 - MgO; 2 - Al2O3; 3 - МпО2; 4 - Сr2О3
Большинство оксидов имеют широкие полосы поглощения сложной структуры в области ниже 1000 см-1, за исключением MgO (полосы поглощения при 1422 и 1484 см-1). Все исследованные оксиды имеют широкие .полосы поглощения при 3300 - 3600 см-1, отвечающие валентным колебаниям связей О-Н ассоциированных гидроксильных групп, что может указывать на содержащуюся в соединениях влагу. MgO, помимо этого, имеет полосу поглощения валентных колебаний неассоциированных гидроксильных групп. Это может служить косвенным признаком содержания в веществе примеси гидроксида магния Mg(OH)2 и объясняется наибольшей реакционной способностью MgO по отношению к воде.
Приведенный пример свидетельствует о том, что если в экспериментальном спектре присутствует широкая полоса в области длин волн 900 - 400 см-1, это может указывать на присутствие в пробе исследуемого вещества соединений класса оксидов.
Помимо оксидов методом ИК спектроскопии возможно обнаружение и некоторых других компонентов ЗС или их остатков.
На рис. 13 приведен спектр сожженного состава КIO3 + Mg. При сравнении полученного спектра со спектром индивидуального оксида магния обнаруживается совпадение ряда полос поглощения. В частности, в спектрах присутствуют полосы поглощения в области 1420 - 1490 см-1, относящиеся к поглощению MgO; дополнительно присутствует полоса, относящаяся к Mg(OH)2 при 3700 см-1, и полоса при 763 см-1, относящаяся к КIO3.
Рис. 13. ИК спектры некоторых ЗС и продуктов их превращения:
1 - КIO3; 2 - выгоревший и промытый водой состав КIO3 + Mg с объекта-носителя; 3 - Mg(OH)2
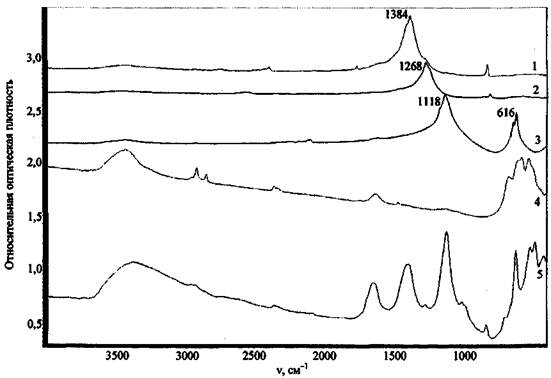
В качестве еще одного примера приведем спектр сожженного состава KNO3 + Mg (рис. 14). После сжигания состава поверхность объекта-носителя в отдельных опытах промывали водой, имитируя тушение, затем отбирали пробу. При сравнении спектра образца со спектрами MgO, KNO3 и KNO2 установлено, что в спектрах не промытых водой образцов присутствуют полосы поглощения KNO2 - 1268 см-1 и KNO3 - 1382 см-1, которых нет в спектре пробы образца, промытого водой. Спектр последнего содержит полосы поглощения, относящиеся к Mg(OH)2 (v = 3700 см-1) и, возможно, к MgO (широкая размытая полоса в области 400 - 700 см-1).
В случае, если объектом-носителем остатков ЗС является какой-либо полимерный материал, ИК спектр может дополнительно содержать определенное количество полос поглощения, относящихся к структурным фрагментам этих материалов, что затрудняет интерпретацию спектров. Так, в спектре сгоревшего на ковролине состава KMnO4 + S (рис. 15) в основном наблюдаются полосы поглощения, относящиеся к разложившемуся при высокой температуре ковролину (полосы 1450, 2800 - 3000 см-1), а также слабое поглощение в области 600 - 450 см-1, которое указывает на присутствие оксида металла.
Резюмируя вышесказанное, отметим определенную информативность метода ИК спектроскопии при решении задачи идентификации остатков ЗС. В частности, широкая полоса в области частот 1000 - 400 см-1 предположительно указывает на присутствие в пробе оксидов металлов (наиболее вероятные продукты сгорания ЗС), которые можно обнаружить на месте пожара, а наличие в спектре узкой полосы поглощения при 3650 - 3750 см-1 - на присутствие в пробе гидроксидов, также являющихся возможными остатками ЗС.
Рис. 14. ИК спектры некоторых компонентов ЗС и продуктов их превращения:
1 - KNO3; 2 - KNO2; 3 - выгоревший состав KNO3 + Mg после промывания водой с объекта-носителя; 4 - выгоревший состав KNO3 + Mg
Рис. 15. ИК спектры компонентов ЗС, продуктов их разложения и объекта-носителя (ковролина):
1 - NaSO4; 2 - сгоревший состав КМпO4 + S; 3 - сгоревший состав КМnO4 + S после промывания водой; 4 - сожженного ковролина; 5 - КМпO4; 6 - МпO2
В очень благоприятных случаях, когда на месте пожара удается обнаружить исходные, неразложившиеся компоненты ЗС, ИК спектроскопия может действительно помочь в установлении природы неизвестного вещества. Однако, как правило, в результате воздействия высоких температур исходные окислители и «горючее» остаются довольно редко, а сгоревшие на месте пожара материалы (древесина, полимерные соединения, бумага и т.д.), находясь в смеси с остатками ЗС, способны существенно затруднить расшифровку ИК спектров.
Таким образом, метод ИК спектроскопии можно рассматривать как дополнительный при исследовании остатков ЗС.
3.6. Ионная хроматография
Для анализа ионов в водных растворах может использоваться ионообменная хроматография. Данный метод основан на разделении ионных частиц с применением специальных ионообменных сорбентов. Для определения ионов после их разделения применяют кондуктометрические, потенциометрические, полярографические и другие методы детектирования.
Исследование проб на присутствие в их составе компонентов ЗС проводится на любом современном ионном хроматографе, обеспечивающем высокую чувствительность, воспроизводимость результатов и скорость анализа (в пределах 15 - 20 мин). Таким прибором является, в частности, ионный хроматограф «Стайер» отечественного производства.
Хроматограф «Стайер» и аналогичные приборы предназначены для качественного и количественного определения неорганических (Cl-, NO3-, NO2-, Вr-, SO42-, PO43-, Na+, NaH4+, K+, Mg2+, Ca2+, Sr2+, Ba2+ и др.) и органических ионов в водных растворах, водах различного происхождения (природных, сточных), а также в водных экстрактах.
Нижний предел обнаружения неорганических ионов находится в диапазоне 0,1 - 1,0 мг/л. Образцы с концентрацией ионов более 100 мг/л перед анализом рекомендуется разбавлять.
Существуют стандартные методики качественного и количественного анализа различных катионов и анионов. Ниже приводится методика определения смесей катионов и анионов в водных растворах, которая может быть использована для обнаружения в водных средах остатков ЗС.
Методика выполнения измерений массовой концентрации катионов (аммония, калия, натрия, магния, кальция и стронция) и анионов (фторид-, хлорид-, нитрат-, фосфат- и сульфат-ионов) в водных растворах методом ионной хроматографии
Методика предназначена для исследования катионного и анионного состава водных растворов остатков ЗС в диапазоне концентраций 1,0 - 20 мг/л.
Отбор проб воды производят в пластиковые емкости с плотными крышками. Пробоподготовка анализируемых водных растворов вещества состоит из стадий отбора пробы и фильтрования ее через фильтр «синяя лента». Пробы воды, загрязненные органическими веществами, необходимо предварительно отцентрифугировать, отфильтровать и провести твердофазовую экстракцию (ТФЭ) на картриджах Strata С 18-Е.
Параллельно с пробоподготовкой проводят подготовку ионного хроматографа к анализу. Для этого включают хроматограф и подготавливают линии (заполняют систему предварительно приготовленным элюентом). Колонку уравновешивают подвижной фазой, для чего устанавливают необходимую скорость потока элюента. Ориентировочное время достижения равновесия составляет 40 - 50 мин. Одновременно с этим включают персональный компьютер с соответствующим программным обеспечением; запускают сбор данных. О том, что равновесие в системе достигнуто, следует судить по отсутствию дрейфа и заметных флуктуаций базовой линии.
Хроматографическое разделение и детектирование катионов 1-й группы (катионов аммония, натрия и калия) выполняют в следующих условиях:
- изократический режим;
- колонка: «AQUILINE C1 P» 100´4,6 мм;
- защитная колонка: «AQUILINE C1 P» 3´8 мм;
- подвижная фаза: раствор азотной кислоты концентрации 0,004 моль/л;
- скорость потока подвижной фазы: 1,1 мл/мин;
- объем петли: 100 мкл.
Хроматографическое разделение и детектирование катионов 2-й группы (катионов магния, кальция, стронция и бария) выполняют в следующих условиях:
- изократический режим;
- колонка: «AQUILINE C2» 50´4,6 мм;
- защитная колонка: «AQUILINE C2» 3´8 мм;
- подвижная фаза: раствор, содержащий щавелевую кислоту с концентрацией 0,004 моль/л и этилендиамин с концентрацией 0,004 моль/л;
- скорость потока подвижной фазы: 1,5 мл/мин;
- объем петли: 100 мкл.
Хроматографическое разделение и детектирование анионов (фториды, хлориды, нитриты, нитраты, фосфаты, сульфаты и др.) проводят в следующих условиях:
- изократический режим;
- колонка: «AQUILINE IС А1.2»; «STARION A300» (100´4,6 мм);
- защитная колонка: «AQUILINE IС А1.2»; «STARION А300»;
- подвижная фаза: раствор натрия углекислого концентрации 1,8 ммоль/л и натрия углекислого кислого концентрации 1,7 ммоль/л;
- скорость потока подвижной фазы: 1,5 мл/мин;
- объем петли: 100 мкл;
- детектирование: кондуктометрическое с подавлением фоновой электропроводности (подавитель - 2,5 мл концентрированной серной кислоты на 1000 мл раствора).
Разделение и детектирование анионов и катионов осуществляется при температуре термостатирования Т = 30 °С.
При необходимости определения количественного содержания компонентов пробы (катионов, анионов) проводят хроматографический анализ одного из градуировочных растворов и далее хроматографический анализ подготовленной пробы. Параллельно производится анализ пробы сравнения.
Ниже приведены хроматограммы стандартных смесей анионов и катионов 1-й и 2-й групп (рис. 16 - 18) в стандартных условиях (концентрация ионов в стандартных смесях составляла 100 мг/л).
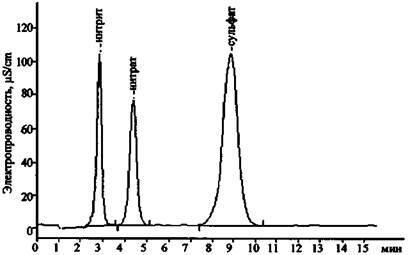
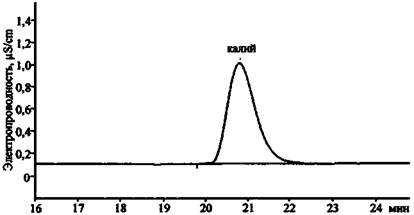
Необходимо отметить, что метод ионной хроматографии применяют в основном для анализа наиболее распространенных в минеральных и сточных водах катионов и анионов. Однако анализ других ионов, в частности, составляющих основу компонентов ЗС (CrO42-, Сr2О72-, СIO3-, Мn2+, Сr3+, Рb2+ и др.), также возможен (рис. 19 - 22).
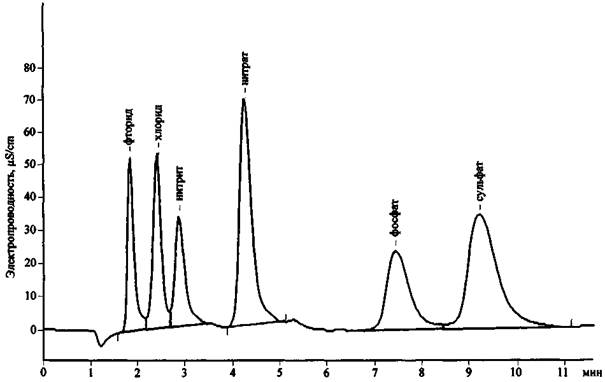
Рис. 16. Хроматограмма смеси анионов
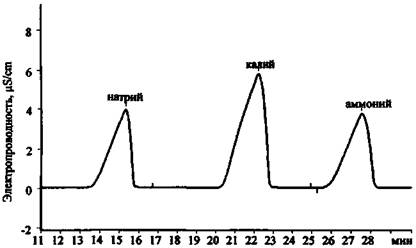
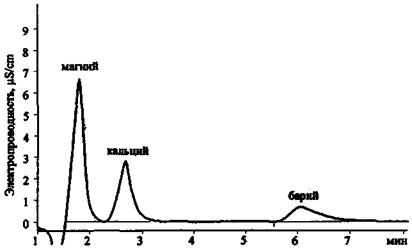
Рис. 17. Хроматограмма смеси катионов 1-й группы
Рис 18. Хроматограмма смеси катионов 2-й группы
Рис. 19. Хроматограмма раствора MnSO4 (колонка для анализа катионов 2-й группы)
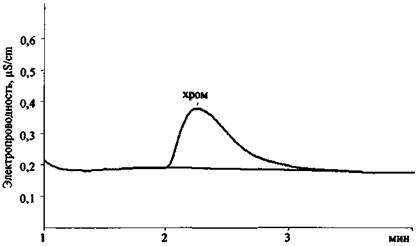
Рис. 20. Хроматограмма раствора Cr2(SO4)3 (колонка для анализа катионов 2-й группы)
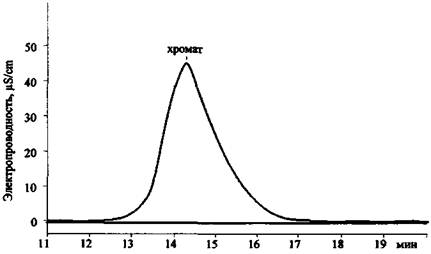
Рис. 21. Хроматограмма раствора K2Cr2O7 (колонка для анализа анионов)
Рис. 22. Хроматограмма КСIO3 (колонка для анализа анионов)
В табл. 6 приведены экспериментальные данные по времени удерживания катионов и анионов, которые могут содержаться в остатках ЗС, на колонках AQUILINE.
Таблица 6
Значения времени удерживания некоторых катионов и анионов на хроматографических колонках AQUILINE в стандартных условиях съемки хроматограмм
|
Время удерживания τi, мин |
Среднее время удерживания τcp, мин |
|||
|
τi=1 |
τi=2 |
τi=3 |
||
|
Катионы 1-й группы |
||||
|
Na+ |
14,8 |
15,2 |
15,0 |
15,0 |
|
K+ |
20,8 |
22,3 |
21,0 |
21,3 |
|
NH4+ |
26,7 |
27,1 |
27,5 |
27,1 |
|
Катионы 2-й группы |
||||
|
Мg2+ |
1,79 |
1,62 |
1,74 |
1,72 |
|
Cа2+ |
2,69 |
2,67 |
2,56 |
2,64 |
|
Sr2+ |
5,25 |
5,08 |
5,18 |
5,17 |
|
Ва2+ |
6,42 |
6,09 |
6,39 |
6,30 |
|
Мn2+ |
1,18 |
1,08 |
1,17 |
1,14 |
|
Сr3+ |
2,26 |
2,12 |
2,22 |
2,20 |
|
Анионы |
||||
|
F- |
1,65 |
1,87 |
1,84 |
1,79 |
|
Сl- |
2,47 |
2,32 |
2,41 |
2,40 |
|
NO2- |
2,48 |
2,77 |
2,81 |
2,69 |
|
NO3- |
4,42 |
4,34 |
4,25 |
4,34 |
|
Фосфаты (po43-, hpo42-, H2PO4-) |
7,91 |
7,33 |
7,45 |
7,56 |
|
ClO3- |
7,73 |
8,06 |
7,88 |
7,89 |
|
so42- |
8,93 |
9,12 |
9,65 |
9,23 |
|
Хроматы (Сr2O72-, СrO42-) |
14,72 |
12,93 |
14,28 |
13,98 |
При исследовании остатков неизвестного ЗС наиболее полная информация может быть получена только при последовательном применении экспертом всех трех хроматографических колонок. На рис. 23 - 25 приведены в качестве примера хроматограммы смыва с поверхности обгоревшего ковролина продуктов сгорания смеси КСlO3 + Mg.
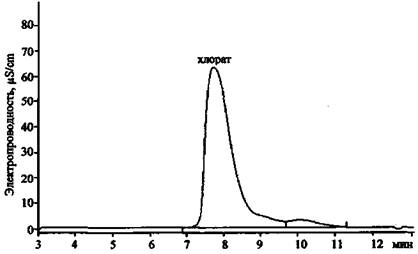
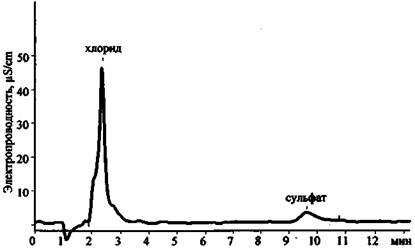
Рис. 23. Хроматограмма продуктов сгорания смеси КСlO3 + Mg (колонка для анализа анионов)
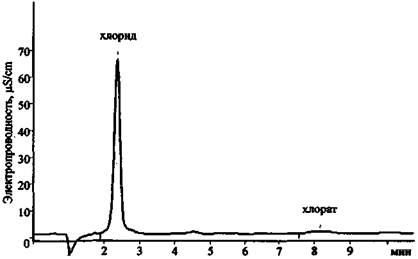
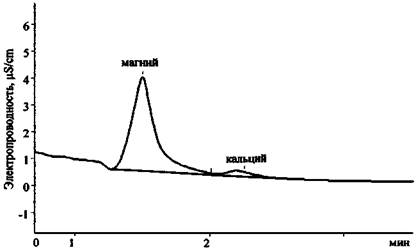
Результаты анализа трех хроматограмм (рис. 23 - 25) свидетельствуют о том, что в сгоревшем составе присутствуют следующие ионы: К+, Mg2+, Са2+, Сl-, СlO3- . Наличие пары анионов Cl- и ClO3- дает основание предположить, что в качестве основного окислителя в составе использовался хлорат (при разложении соединений этого типа основным продуктом реакции являются хлориды). Наличие иона К+ показывает, что это был хлорат калия. Наиболее доступен и чаще всего применяется в зажигательных и пиротехнических составах хлорат. Наличие же в смеси ионов Mg2+ и Са2+ (при существенно большей концентрации первого) позволяет сделать вывод о том, что, вероятно, в качестве горючего вещества (восстановителя) использовался металлический магний, в то время как кальций мог выступать в качестве примеси к магнию или в качестве добавки присутствовать в составе объекта-носителя.
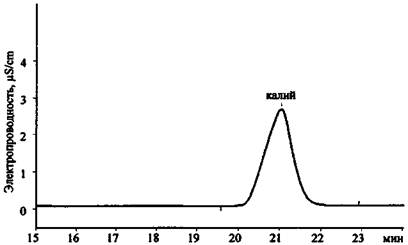
Рис. 24. Хроматограмма продуктов сгорания смеси КСlO3 + Mg (колонка для анализа катионов 1-й группы)
Необходимость проводить анализ пробы сравнения еще раз подтверждает рис. 26. В пробе сгоревшего ковролина (проба сравнения) были обнаружены анионы Сl- и SO42-, которые могут входить в состав продуктов разложения синтетической основы (например, поливинилхлорида) и/или антипиреновых добавок.
Рис. 25. Хроматограмма продуктов сгорания смеси КСlO3 + Mg (колонка для анализа катионов 2-й группы)
Рис. 26. Хроматограмма сгоревшего ковролина (проба сравнения). Колонка для анализа анионов
4. АНАЛИТИЧЕСКИЕ СХЕМЫ ИССЛЕДОВАНИЯ ОБЪЕКТОВ С ОСТАТКАМИ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ, ПРИМЕНЯЕМЫХ ПРИ ПОДЖОГАХ
Рассмотренные в предыдущих разделах химические и инструментальные методы исследования остатков ЗС имеют свои достоинства, недостатки и пределы аналитических возможностей. В этой связи наиболее полную информацию о предполагаемом химическом составе средства поджога пожарно-технический эксперт может получить лишь в случае комплексного использования указанных физико-химических методов. К сожалению, редкая лаборатория СЭУ ФПС имеет полный комплекс необходимого оборудования. Поэтому ниже рассмотрены различные варианты аналитических схем, которые рекомендуется применять в зависимости от наличия в экспертных подразделениях тех или иных приборов физико-химического анализа.
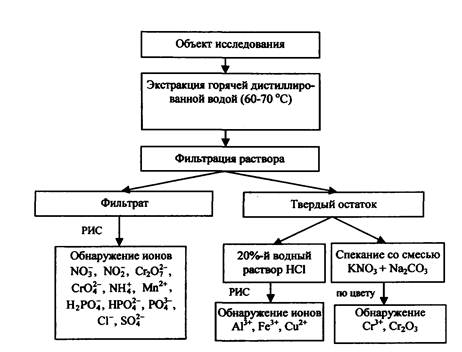
4.1. Схема I. Использование реактивных индикаторных средств и некоторых других методов химического анализа
В наиболее сложном случае, при отсутствии какой-либо инструментальной базы, получить определенную информацию о химической природе предполагаемого поджигающего средства можно исключительно с помощью РИС. Как уже отмечалось, относительная простота и экспрессность данного метода исследования позволяют использовать РИС непосредственно на месте пожара в качестве способа установления мест локализации остатков ЗС. В случае отсутствия других методов исследования анализ изъятых с места пожара проб необходимо провести повторно этим методом, но уже в лабораторных условиях. В лаборатории может быть осуществлена более тщательная и качественная пробоподготовка объектов для исследования (включающая экстрагирование как водой, так и кислыми растворами), что не всегда возможно в полевых условиях.
Определенную трудность представляет анализ труднорастворимых в кислотах и щелочах оксидов - Сr2О3, МnО2; особенно это относится к оксиду хрома. Для обнаружения хрома может быть использована реакция его окисления сплавлением оксида с KNO3 и Na2СО3.
Практически реакция осуществляется следующим образом: приготавливают смесь, состоящую (приблизительно) из 1 массовой части KNO3 и 2 массовых частей Nа2СО3. Затем берут немного сухого вещества, которое хотят испытать на хром, смешивают его с шестикратным количеством смеси КNO3 + Nа2СО3 и все это сплавляют в фарфоровом тигле в муфельной печи при температуре 400 - 450 °С. Когда вся масса сплавится, то после охлаждения в присутствии хрома она должна быть желтого (весь Сr2О3 прореагировал) или желто-зеленого (примесь Сr2О3) цвета.
Необходимо отметить, что спекание следует производить после осуществления анализа пробы на наличие таких ионов, как NO3- и NO2-.
Как видно из аналитической схемы (рис. 27), химические экспресс-методы анализа вполне могут предоставить пожарно-техническому эксперту информацию о присутствии в пробах, изъятых с места пожара, основных (наиболее распространенных) компонентов ЗС и пиротехнических изделий. К таким ЗС можно отнести смеси на основе нитратов, перманганатов, хроматов и бихроматов, а также белого фосфора и сильных минеральных кислот. Тем не менее ввиду относительно низкой чувствительности РИС рекомендуется подтвердить правильность полученных результатов, применив более чувствительные инструментальные методы.
Рис. 27. Аналитическая схема исследования ЗС химическими методами
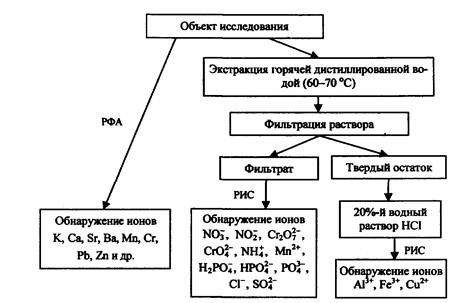
4.2. Схема II. Применение РИС совместно с элементным анализом
Применение элементного анализа в дополнение к результатам, полученным с использованием РИС, позволяет как уточнить имеющиеся данные, так и расширить объем получаемой информации.
Так, если химический метод с применением РИС показал наличие в пробе соединений хрома (VI), и ЭА также подтвердил присутствие хрома, то можно говорить о том, что полученная информация весьма надежна. Данные ЭА, в частности, РФ А, очень полезны при обнаружении тяжелых металлов (Sr, Ва, Мn, Сr, Рb и др.); поэтому в случае использования поджигателем ЗС на основе перманганатов, хроматов и бихроматов, соединений стронция, бария, свинца и т.д. результаты использования обоих методов, несомненно, более информативны. На рис. 28 представлена аналитическая схема совместного применения РИС и элементного (ренттенофлуоресцентного) анализа. Из схемы видно, что еще до начала пробоподготовки и применения РИС эксперт имеет возможность с использованием ЭА предварительно оценить наличие в пробе тех или иных элементов, что позволяет выбрать оптимальную стратегию дальнейшего анализа. Очевидно, что если данные РФА дают отрицательный результат на наличие в пробе хрома или марганца, то проведение дальнейшего анализа с использованием заведомо менее чувствительного метода (РИС) на присутствие ионов Мn2+, СrО42-, Сr2О72- вряд ли можно считать целесообразным.
Применение РФА позволяет также избежать относительно трудоемкого процесса обнаружения хрома (III) путем перевода его в хром (VI) при сплавлении со смесью КNO3 и Na2СО3.
В дополнение к тем ЗС, которые могут быть обнаружены с использованием РИС (нитраты, перманганаты, хроматы и бихроматы, а также белый фосфор и сильные минеральные кислоты), метод РФА позволяет определять наличие соединений стронция и бария, входящих в целый ряд промышленно выпускаемых пиротехнических изделий.
Рис. 28. Аналитическая схема совместного использования методов элементного и химического анализа
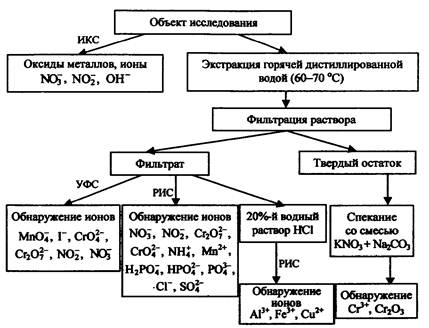
4.3. Схема Ш. Применение методов химического анализа совместно с данными ИК и УФ спектроскопии в исследовании ЗС
При отсутствии возможности осуществления ЭА пожарно-технический эксперт может применять ИК и УФ спектроскопию в качестве методов, расширяющих объем информации относительно исследуемых объектов. Аналитическая схема исследования остатков ЗС и пиротехнических составов при использовании этих методов представлена на рис. 29.
Методы ИК и УФ спектроскопии являются наиболее информативными при анализе органических и комплексных соединений. В случае простых неорганических структур, к которым в большинстве своем относятся остатки ЗС, получаемая информация значительно сужается, что дает основание считать их дополнительными по отношению к методам, предназначенным в первую очередь для исследования неорганических соединений и ионов. Несмотря на это, даже та информация, которую предоставляют методы ИК и УФ спектроскопии, является весьма полезной с точки зрения уверенности в правильности полученных результатов.
Рис. 29. Аналитическая схема применения методов химического анализа, ИК и УФ спектроскопии
На первом этапе исследований, до начала пробоподготовки с целью экстрагирования растворимых в воде соединений, целесообразно провести съемку ИК спектров анализируемых соединений. Наличие широких полос в области 1000 - 400 см-1 может указывать на присутствие в пробе оксидов металлов, являющихся продуктами сгорания некоторых ЗС. Необходимо всегда учитывать возможность присутствия в пробах, доставленных с места пожара, ржавчины и окалины, являющихся смесью оксидов железа, особенно если пробы изымались со стальных поверхностей.
При благоприятных обстоятельствах (проба не загрязнена материалами органического происхождения) методом ИКС могут быть обнаружены ионы NO2- и NO3-.
Методом УФ спектроскопии также могут быть обнаружены (или подтверждено их наличие) нитрат- и нитрит-ионы, хроматы и бихроматы, перманганаты. Отличительной особенностью метода является высокая чувствительность по отношению к йодид-ионам, что позволяет исследовать остатки ЗС на основе йодатов.
4.4. Схема IV. Исследование методами химического анализа и ионной хроматографии
Эффективным способом исследования ЗС и остатков их горения, изъятых с места пожара, можно признать использование сочетания методов химического анализа (РИС; проведение реакции на хром) и ионной хроматографии. К достоинствам метода ИХ можно отнести высокую чувствительность и селективность определения различных неорганических ионов, составляющих основу ЗС. В качестве недостатка нужно отметить определенную сложность метода, связанную с необходимостью периодической калибровки прибора и тщательной пробоподготовки, сопутствующей проведению анализа. На рис. 30 представлена аналитическая схема исследования остатков ЗС с применением химического анализа и метода ИХ.
Рис. 30. Аналитическая схема использования химического анализа и ИХ
Одной из отличительных особенностей метода ИХ является наличие соответствующих стандартных методик по обнаружению в водных растворах ионов щелочноземельных металлов, в частности, ионов магния, кальция и стронция, входящих в зажигательные и пиротехнические составы. В особенности это относится к ионам магния, которые невозможно определить методами РФА (сделать это можно только на приборах с вакуумным измерительным трактом), ИК и УФ спектроскопии.
Приведенная аналитическая схема показывает возможность обнаружения в пробах, доставленных с места похроматы и бихроматы, сильные минеральные кислоты (серная и азотная), белый фосфор, щелочные и щелочноземельные металлы.
4.5. Схема V. Исследование методами химического анализа, рентгенофлуоресцентного анализа, ИК и УФ спектроскопии, ионной хроматографии
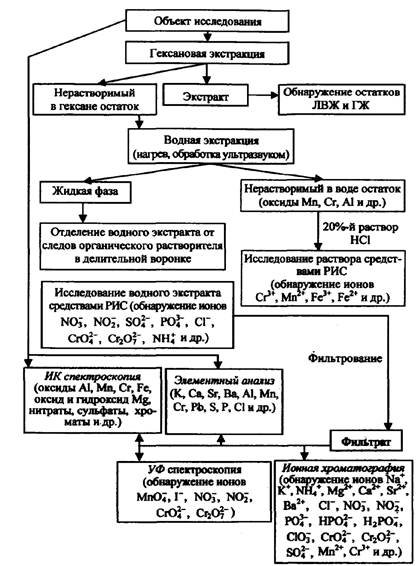
Сочетание методов химического анализа, рентгеновского анализа, а также методов молекулярной спектроскопии (ИК и УФ спектроскопии) и ионной хроматографии можно считать при обнаружении остатков ЗС наиболее информативным.
Применение данных методов в комплексе позволяет определить широкий спектр компонентов ЗС, включающих нитраты, перманганаты, хроматы, бихроматы, минеральные кислоты-окислители, фосфор, серу, соединения тяжелых металлов и т.д. (рис. 31).
Уже на начальной стадии исследования, без специальной пробоподготовки, неизвестное вещество, изъятое с места пожара, может в короткие сроки быть проанализировано методами рентгенофлуоресцентной и ИК спектроскопии на наличие в своем составе элементов, составляющих основу ЗС (К, Са, Sr, Ba, Zn, Fe, Cu, Mn, Cr, Br, I), а также окисных и гидроокисных соединений. Это позволяет эксперту определить стратегию дальнейших экспериментов с использованием методов химического анализа, УФ спектроскопии и ИХ.
Использование метода ЭА, в частности РФА, значительно упрощает исследование остатков ЗС. Можно обойтись без привлечения метода УФ спектроскопии или применять его в случае неоднозначных результатов химического анализа и ИК спектроскопии. Метод с применением РИС также упрощается, отпадает необходимость в окислительном спекании образцов.
Рис 31. Аналитическая схема применения методов химического анализа, рентгеновского анализа, ИК и УФ спектроскопии, ИХ
Необходимо отметить, что поскольку в некоторых ЗС используются ЛВЖ и ГЖ, можно считать целесообразным привлечение существующих методик по обнаружению на месте пожара остатков ЛВЖ и ГЖ методами флуоресцентной спектроскопии и ГЖХ.
В этой связи перед проведением водной экстракции неизвестного образца необходимо провести его гексановую экстракцию. Водная экстракция осуществляется путем растворения пробы в горячей дистиллированной воде (T = 60 - 70 °С). Для более полного перевода ионов в раствор может применяться ультразвуковая ванна. Нерастворимый осадок затем обрабатывается 20 %-м раствором соляной кислоты, определяется наличие ионов Cr3+, Mn2+, Fe3+, Fe2+. Водный экстракт отделяется в делительной воронке от остатков гекса нового слоя, проводится определение с помощью РИС присутствия ионов NO3-, NO2-, SO42-, PO43-, Сl-, CrO42-, Cr2O72-, NH4+ и др. На следующей стадии осуществляется фильтрация водного экстракта и анализ ионного состава инструментальными методами.
4.6. Пример применения аналитических схем
В качестве примера практического использования аналитической схемы V (см. рис. 31) приведем результаты эксперимента, моделирующего поджог с помощью зажигательной смеси, состоящей из двух частей. Компонентами основной части ЗС являлись нитрат калия или калийная селитра (KNO3), и сера. В качестве другой части состава использовали перманганат калия (КМnО4) и глицерин. Смеси составляли исходя из эквивалентного соотношения компонентов. В ходе эксперимента производился поджог сидения деревянного стула, установленного на покрытие пола из ДСП.
Самовоспламенение смеси КМnО4 и глицерина, обусловленное протеканием сильноэкзотермической реакции, происходило примерно через 10 - 15 с, что, в свою очередь, вызывало возгорание основного ЗС (KNO3 + S). В процесс горения были вовлечены обивка и материал наполнителя сидения стула. В ходе горения наблюдалось сквозное прожигание сидения, сопровождающееся попаданием расплавленного материала сидения на пол из ДСП под стулом. По окончании место горения промывали водопроводной водой, имитируя пожаротушение. После этого отбирали образцы обивки сидения стула в местах горения основного и зажигательного составов, а также с пола (ДСП). Параллельно исследовали пробу сравнения, в качестве которой выступал образец негоревшей обивки сидения стула.
Первоначально проводили исследование образцов методами РФА и ИК спектроскопии.
Данные РФА показали повышенное по сравнению с пробой сравнения содержание калия во всех отобранных для исследования пробах. В пробе, изъятой с обивки сидения стула в месте горения зажигательного состава КМnO4 + глицерин, были также обнаружены следы марганца (рис. 32).
Рис 32. Рентгеновский спектр образца обивки стула
По данным ИК спектроскопии в образце, отобранном в месте горения зажигательного состава, было установлено присутствие следов оксидов металлов (полосы 669, 577 и 524 см-1), предположительно диоксида марганца (рис. 33).
Полосы в области 1730 - 800 см-1 принадлежат объекту-носителю - обгоревшим остаткам обивки стула.
Исследование методом ИКС пробы, отобранной в месте горения основного состава KNO3 + S, показало присутствие в пробе полос поглощения, относящихся к ионам NO3- (1384 см-1), NO2- (1268 см-1) и SO42- (1118 и 616 см-1) (рис. 34).
Таким образом, на первом этапе исследования было установлено, что в одной из отобранных с места горения стула проб присутствуют соединения марганца, предположительно его оксиды, в другой обнаружены следы нитратов, нитритов и сульфатов.
Рис. 33. ИК спектр пробы, отобранной с обивки сидения стула в месте горения ЗС:
1 - МпO2; 2 - проба обивки стула (поролон); 3 - проба обивки стула (гобелен); 4 - исследуемая проба
Рис. 34. ИК спектр пробы, изъятой с обивки сидения стула в месте горения основного состава:
1 - KNO3; 2 - KNO2; 3 - Na2SO4; 4 - MnO2; 5 - исследуемая проба
Второй этап исследования включал анализ объектов методами химического анализа (РИС) и УФ спектроскопии по электронным спектрам пропускания.
Образцы сожженной с применением зажигательного состава KNO3 + S + КМnО4 + глицерин обивки стула растирались в ступке. Затем одну часть образцов растворяли в дистиллированной воде при нагревании, растворы отфильтровывали и исследовали на присутствие ионов NO3-, NO2- при помощи РИБ и ионов SO42- при помощи РИК. Вторую часть образцов в небольшом количестве (1 - 3 крупинки) исследовали при помощи РИБ на присутствие ионов Мп2+.
При обнаружении остатков ЗС использовались РИС для определения NO3-, NO2-, SO4-, выпускаемые ЗАО «Крисмас+» (Санкт-Петербург), а также РИБ для определения Mn2+, изготавливаемые фирмой «Merck» (Германия).
В табл. 7 приведены результаты исследований по обнаружению остатков ЗС на сожженном стуле с использованием РИС.
Таблица 7
Результаты исследований по обнаружению остатков ЗС на сожженном стуле с использованием РИС
|
Определяемый компонент |
||||
|
NO3- |
NO2- |
so42- |
Мn2+ |
|
|
Нулевая проба |
- |
- |
- |
- |
|
Проба обгоревшей обивки стула на месте зажигательного состава КМnО4 + глицерин |
- |
- |
- |
+ |
|
Проба обгоревшей обивки стула на месте основного зажигательного состава KNO3 + S |
+ |
+ |
+ |
+ |
|
Проба обгоревшей обивки стула с пола (ДСП) |
+ |
+ |
+ |
+ |
|
Проба остатков зажигательного состава КМnO4 + глицерин с пола (ДСП) |
+ |
+ |
+ |
+ |
Как видно из табл. 7, ион Мn2+(продукт превращения КМnО4) обнаружен с помощью РИС во всех отобранных пробах, в трех пробах из четырех обнаружены нитрат- и нитрит-ионы (остатки селитры) и сульфат-ион (продукт сгорания серы).
Исследование образцов по электронным спектрам пропускания проводили следующим образом: образцы сожженной обивки стула растирали в ступке и заливали дистиллированной водой при комнатной температуре; раствор отфильтровывали и проводили съемку спектров пропускания растворов на спектрофлуориметре «Флуорат-02-Панорама» (НПФ «Люмэкс», Санкт-Петербург), в спектральном диапазоне измерений 200 - 600 нм с частотой повторения 25 Гц и шагом сканирования 1 нм.
На рис. 35 представлены спектры пропускания водных растворов остатков ЗС с выгоревшего стула (поз. 1), а также индивидуальных компонентов KNO3 с концентрацией 1 % (масс.) (поз. 2) и KNO2 с концентрацией 0,1 % (масс.). Спектр пропускания обгоревшей обивки стула с остатками состава ЗС имеет две полосы: 305 и 354 нм. Полоса 305 нм свидетельствует о присутствии в исследуемом образце непрореагировавшего нитрат-иона, полоса 354 нм относится к нитрит-иону, образовавшемуся в результате химической реакции между нитратом калия и серой. Слабая полоса пропускания 287 нм (ε = 9), также характерная для NO2- аниона, в исследуемом образце перекрывается полосой 305 нм для NO3- иона. Полосы пропускания 528 нм, характерной для перманганат-иона, не наблюдается. Это объясняется либо полностью прошедшей реакцией, либо окислением остатков непрореагировавшего перманганата калия водой до оксида марганца, который не имеет полос пропускания в видимой и ультрафиолетовой областях. В спектре водного экстракта нулевой пробы полос пропускания в области 200 - 600 нм не наблюдается.
Рис. 35. УФ спектры пропускания экстрактов обгоревшей обивки стула с остатками ЗС; образцов KNO3 и KNO2:
1 - обгоревшая обивка стула с остатками ЗС KNO3 + S; 2 - KNO3 (конц. 1 % (масс.)); 3 - KNО2 (конц. 0,1 % (масс.)).
Спектр пропускания водного экстракта остатков сгоревшей обивки стула, собранной с пола (ДСП), идентичен вышеприведенному спектру пропускания экстракта сгоревшей обивки стула. В нем также присутствуют полосы нитрит- и нитрат-ионов (305 и 354 нм).
Были также исследованы пробы обгоревших остатков обивки стула, отобранные с места, где находился зажигательный состав КМnO4 + глицерин. В спектре пропускания водного экстракта этих остатков не наблюдается полос пропускания в области 200 - 700 нм, что объясняется, во-первых, отсутствием следов нитрат- и нитрит-ионов в исследуемом образце сожженного стула, во-вторых, образованием в результате химической реакции КМnO4 + глицерин оксида марганца, не имеющего полос пропускания в видимой и ультрафиолетовой областях.
Пробы с обгоревших остатков стула были исследованы и методом ионной хроматографии с использованием хроматографических колонок как на анионы, так и на катионы 1-й и 2-й групп. На рис. 36 и 37 показаны хроматограммы водного экстракта обивки стула в месте горения основного ЗС. Анализ водного экстракта сгоревшей обивки стула с использованием хроматографической колонки на катионы 2-й группы показал их отсутствие (в пределах инструментальной погрешности) в исследуемой пробе.
Таким образом, комплексом методов химического анализа, УФ спектроскопии и ИХ было подтверждено присутствие в анализируемых пробах как соединений марганца (Mn), так и ионов К+, NO3-, NO2-, SO42-, что в реальных условиях проверки версии о поджоге могло бы свидетельствовать об использовании для этой цели ЗС на основе селитры, а также серы или серосодержащих компонентов.
Рис. 36. Хроматограмма водного экстракта (колонка для анализа анионов)
Рис. 37. Хроматограмма водного экстракта (колонка для анализа катионов 1-й группы)
5. ОБНАРУЖЕНИЕ ФЕЙЕРВЕРОЧНЫХ СОСТАВОВ
В последние годы значительную актуальность приобрела проблема обнаружения на месте пожара остатков фейерверочных составов. Это связано с массовым использованием, особенно в новогодние праздники, различного вида фейерверочных изделий (ракет, фонтанов, римских свечей, салютов, петард и т.п.), в результате чего нередко возникают пожары. Самым драматичным из них можно считать пожар, произошедший в декабре 2009 года в клубе «Хромая лошадь» г. Перми.
Фейерверочные составы являются одной из разновидностей пиротехнических. В последние обычно входят следующие компоненты:
- окислители;
- горючее;
- связующее (цементаторы) - органические полимеры, обеспечивающие механическую прочность спрессованных составов;
- ускорители и замедлители горения;
- флегматизаторы (добавки, уменьшающие чувствительность составов к трению или удару);
- вещества технологического назначения;
- вещества, окрашивающие пламя [13, 14].
Окислители, применяемые в пиротехнических составах, - это в основном перхлораты и нитраты щелочных и щелочноземельных металлов, реже - хлораты. Используются также сульфаты, перманганаты, хроматы, бихроматы, пероксиды металлов (бария, в редких случаях стронция и натрия).
В качестве горючих веществ используются:
- мелкодисперсные металлы (магний, алюминий, титан, железо, марганец и др.);
- неметаллы (фосфор, углерод в виде сажи или древесного угля, сера);
- органические горючие (смолы, масла, углеводороды, углеводы и др.).
Дополнительный вклад в разнообразие элементного состава фейерверочных средств вносят вещества, окрашивающие пламя.
В составах красного огня используют соли стронция, кальция или лития. Для улучшения насыщенности цвета в составы красного огня добавляют хлорорганические соединения, например, гексахлорэтан, который способствует образованию в продуктах сгорания легколетучих и хорошо окрашивающих пламя хлоридов.
В составы желтого огня добавляют соли натрия.
В составы зеленого огня вводят соли бария, таллия или меди, дающие зеленую окраску. Хорошую насыщенность зеленого цвета дает двойная смесь хлората и перхлората бария с горючими веществами (сера, смолы).
В составах синего огня обычно применяются соединения меди. Они при сгорании на воздухе окрашивают пламя водорода в зеленый цвет, а пламя гремучего газа - в синий.
Из приведенных выше сведений следует, что, как и в случае с ЗС, для обнаружения остатков фейерверочных составов предпочтительно использовать в качестве основного метода элементный анализ. А при наличии возможности - также качественные реакции и ИХ.
В качестве примера приведем результаты исследования остатков от сгорания фейерверочных фонтанов китайского производства («Бочка меда», «Рио», «Талисман», «Волшебные рыбки», «Инь Ян», «Невский», «Пивной», «Вечерний», «Жасмин», «Домовой» и др.) и отечественных «Факел зеленого огня» и «Факел красного огня» производства ФГУП «Сигнал».
ЭА проводился рентгенофлуоресцентным методом с помощью спектрометра СУР-02 «Реном ФВ».
Цвета пламени, искр и элементный состав обнаруженных частиц приведены в табл. 8.
Таблица 8
Цвет пламени и элементный состав частиц, обнаруженных в радиусе 20 см от места работы пиротехнических изделий
|
Цвет пламени и искр, визуально наблюдаемый в ходе работы пиротехнического изделия |
Элементный состав |
|||||
|
красный |
зеленый |
желтый |
синий |
сиреневый |
||
|
«Бочка меда» |
+ |
+ |
+ |
- |
- |
Сl, К, Ti, Mn, Fe, Сu, Zn, Bi, Sr, Ba |
|
«Рио» |
- |
- |
+ |
- |
- |
Cl, К, Ti, Cr, Fe |
|
«Талисман» |
+ |
+ |
+ |
+ |
- |
К, Mn, Fe, Сu, Zn, Bi, Sr, Ba |
|
«Кристалл» |
+ |
+ |
- |
- |
- |
Cl, K, Ti, Mn, Fe, Сu, Zn, Sr, Ba |
|
«Волшебные рыбки» |
+ |
+ |
+ |
- |
+ |
Cl, K, Ti, Mn, Fe, Сu, Zn, Sr, Ba |
|
«Инь Ян» |
+ |
- |
+ |
- |
+ |
Cl, K, Ti, Mn, Fe, Сu, Zn, Pb, Sr, Ba |
|
«Невский» |
+ |
+ |
+ |
- |
- |
Cl, K, Ti, Mn, Fe, Си, Zn, Sr, Ba |
|
«Пивной» |
+ |
+ |
+ |
- |
- |
Cl, K, Ti, Mn, Fe, Сu, Zn, Pb, Sr, Ba |
|
«Вечерний» |
+ |
+ |
+ |
- |
- |
K, Mn, Fe, Сu, Zn, Pb, Sr, Ba |
|
«Жасмин» |
+ |
+ |
+ |
- |
- |
K, Mn, Fe, Сu, Zn, Pb, Sr, Ba |
|
«Домовой» |
- |
- |
+ |
- |
- |
S, Fe, Ti |
|
«Бенгальский огонь» |
- |
- |
+ |
- |
- |
Al, S, K, Fe, Сu, Ba |
|
«Факел зеленого огня» |
- |
+ |
- |
- |
- |
Cl, K, Ti, Fe, Сu, Ba |
|
«Факел красного огня» |
- |
- |
- |
- |
- |
Cl, К, Fe, Sr |
В спектрах частиц большинства фонтанов обнаружены стронций и барий. Это вполне закономерно, поскольку оксиды бария и стронция являются конечными продуктами разложения нитрата стронция (обеспечивает, как отмечалось выше, красный цвет фейерверка), а также хлората и нитрата бария (зеленый цвет). Исключение составили фонтаны «Рио» и «Домовой», которые при работе давали только желтый цвет. Последний обеспечивается солями натрия (натрий данным типом спектрометра не детектируется).
Во всех фонтанах (кроме «Домового») присутствовал калий. Хлор также присутствовал в большинстве проб. Оба компонента являются, надо полагать, продуктами реакции хлората и перхлората калия.
Помимо указанных выше элементов, в остатках пиротехнических составов присутствовали также железо, титан, медь, цинк, висмут, свинец. Возможно, часть перечисленных элементов могла участвовать в реакциях, отвечающих за шумовые эффекты, возникающие при работе фонтанов.
Пиротехнический фонтан «Домовой», предназначенный для использования в закрытом помещении, при работе почти не выделял дыма, цвет факела и разлетающихся искр был желтым. Элементный анализ показал присутствие в частицах серы, титана, железа.
В частицах, образовавшихся при сгорании отечественного факела красного огня, в значительном количестве присутствовал стронций, а также калий, хлор, титан, железо, медь.
В факеле зеленого огня - барий, калий, хлор, железо.
Из приведенных результатов следует, что основной набор элементов, наличие которого можно рассматривать как признак работы фейерверочных фонтанов и факелов, следующий: К, Ba, Sr, Cl. После пожара в исследуемых образцах могут обнаруживаться следующие комбинации элементов: К-Ba, K-Sr, K-Ba-Sr, в каждой из комбинаций может содержаться хлор. Могут присутствовать также Ti, Mn, Fe, Сu, Zn, Pb и др.
Эксперименты также показали, что при работе фонтанов исследованного типа высота форса пламени составляла 0,1 - 0,15 м, высота полета искр 2,0 - 2,5 м, а максимальный радиус разлета частиц 1,0 - 2,0 м (в зависимости от марки фонтана).
При поисках после пожара выгоревших компонентов пиротехнических фонтанов радиус наиболее эффективной зоны составляет 20 - 30 см.
Визуальное обнаружение после пожара частиц - остатков разлетевшихся искр - практически невозможно. Необходимо провести соскоб с поверхностей конструкций и предметов в указанном радиусе и последующий анализ указанными инструментальными методами.
ЛИТЕРАТУРА
2. Российская Е.Р. Судебная экспертиза в уголовном, гражданском, арбитражном процессе. М., 1996.
3. NFPA-921. Guide for Fire and Explosion Investigations, 1995.
7. Руководство по аналитической химии / под ред. Ю.А. Клячко. М.: Мир, 1975.
8. Ахметов Н.С. Неорганическая химия. М.: Высш. шк., 1975. 670 с.
9. Гордон А., Форд Р. Спутник химика. М: Мир, 1976. 544 с.
10. Драго Р. Физические методы в химии. М.: Мир. Т. 1, 1981. 456 с.
11. Лурье Ю.Ю. Справочник по аналитической химии. М.: Химия, 1979. 480 с.
12. Плюснина И. И. Инфракрасные спектры минералов. М.: Изд-во МГУ, 1977. 176 с.