Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2. МЕТОДЫ КОНТРОЛЯ
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Порядок организации и проведения
лабораторной диагностики холеры для
лабораторий территориального,
регионального и федерального уровней
Методические указания
МУК 4.2.2870-11
Москва 2011
1. Разработаны Федеральным казенным учреждением здравоохранения «Ростовский-на-Дону научно-исследовательский противочумный институт» Роспотребнадзора (Ю.М. Ломов, Э.А. Москвитина, Н.Р. Телесманич, В.Д. Кругликов, И.Я. Черепахина, В.В. Балахнова, И.В. Архангельская); Федеральным казенным учреждением здравоохранения «Российский научно-исследовательский противочумный институт «Микроб» Роспотребнадзора (В.В. Кутырев, Е.С. Казакова, И.Н. Шарова, Н.А. Осина, С.А. Щербакова, Н.И. Смирнова); Федеральным казенным учреждением здравоохранения «Иркутский научно-исследовательский противочумный институт» Роспотребнадзора (С.В. Балахонов, Л.Я. Урбанович, Л.В. Миронова, Е.С. Куликалова, А.С. Кожевникова); Федеральным казенным учреждением здравоохранения «Ставропольский научно-исследовательский противочумный институт» Роспотребнадзора (В.Н. Савельев); Федеральным казенным учреждением здравоохранения «Противочумный центр» Роспотребнадзора (В.Е. Безсмертный, С.М. Иванова); Федеральным бюджетным учреждением здравоохранения «(Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (В.Г. Сенникова, М.В. Зароченцев, В.В. Мордвинова); Федеральным государственным учреждением науки Государственный научный центр прикладной микробиологии и биотехнологии Роспотребнадзора (И.А. Дятлов, С.Ф. Бикетов, Е.И. Баранова, М.В. Храмов, Е.А. Тюрин); Федеральным государственным бюджетным учреждением «ГИСК им. Л.А. Тарасовича» Минздравсоцразвития (И.В. Борисевич, Л.В. Саяпина).
2. Утверждены Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации Г.Г. Онищенко 25 мая 2011 г. и введены в действие с 1 июня 2011 г.
3. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель Федеральной службы Г.Г. Онищенко 25 мая 2011 г. Дата введения: 1 июня 2011 г. |
4.2. МЕТОДЫ КОНТРОЛЯ.
БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Порядок организации и проведения
лабораторной диагностики холеры для
лабораторий территориального, регионального
и федерального уровней
Методические
указания
МУК 4.2.2870-11
1. Область применения
1.1. Настоящие методические указания определяют порядок организации и проведения лабораторной диагностики холеры для лабораторий территориального, регионального и федерального уровней, формы и методы их взаимодействия, номенклатуру и объем исследования, требования к лабораториям, специалистам и персоналу, участвующим в выполнении исследований, материально-техническому обеспечению исследований, биологической безопасности проведения работ.
1.2. Настоящие методические указания предназначены для специалистов органов и учреждений, осуществляющих государственный санитарно-эпидемиологический надзор в Российской Федерации, специалистов противочумных учреждений, органов управления здравоохранением и лечебно-профилактических учреждений.
2. Нормативные ссылки
2.1. Федеральный закон от 30.03.1999 № 52-ФЗ «О санитарно-эпидемиологическом благополучии населения».
2.2. Постановление Правительства Российской Федерации от 29.10.2007 № 720 «О внесении изменений в п. 5 Положения о лицензировании деятельности, связанной с использованием возбудителей инфекционных заболеваний, утвержденного постановлением Правительства Российской Федерации от 22.01.2007 № 31».
2.3. Постановление Главного государственного санитарного врача Российской Федерации от 24.02.2009 № 11 «О представлении внеочередных донесений о чрезвычайных ситуациях в области общественного здравоохранения санитарно-эпидемиологического характера» (Зарегистрировано в Минюсте РФ 10.04.2009 № 13745).
2.4. Приказ Министерства здравоохранения и социального развития Российской Федерации от 7.07.2009 № 415н «Об утверждении квалификационных требований к специалистам с высшим и послевузовским медицинским и фармацевтическим образованием в сфере здравоохранения». (Зарегистрирован в Минюсте РФ 9.07.2009 № 14292).
2.5. Приказ Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека от 17.03.2008 № 88 «О мерах по совершенствованию мониторинга за возбудителями инфекционных и паразитарных болезней».
2.6. Санитарные правила «Порядок учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности»: СП 1.2.036-95 (Утв. постановлением Госкомсанэпиднадзора РФ от 28.08.1995 № 14).
2.7. Санитарно-эпидемиологические правила и нормативы «Санитарно-эпидемиологические требования к обращению с медицинскими отходами». СанПиН 2.1.7.2790-10 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 9.12.2010 № 163. Зарегистрировано в Минюсте РФ 17.02.2011 № 19871).
2.8. Санитарно-эпидемиологические правила «Безопасность работы с микроорганизмами I - II групп патогенности (опасности)». СП 1.3.1285-03 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 15.04.2003 № 42 «О введении в действие санитарно-эпидемиологических правил СП 1.3.1285-03». Зарегистрировано в Минюсте РФ 10.05.2003 № 4545).
2.9. Санитарно-эпидемиологические правила «Порядок выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами». СП 1.3.1318-03 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 30.04.2003 № 85 «О введении в действие санитарно-эпидемиологических правил СП 1.2.1318-03». Зарегистрировано в Минюсте РФ 19.05.2003 № 4558).
2.10. Санитарно-эпидемиологические правила «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней». СП 1.3.2322-08 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 28.O1.2008 № 4 «Об утверждении санитарно-эпидемиологических правил СП 1.3.2322-08». Зарегистрировано в Минюсте РФ 21.02.2008 № 11197).
2.11. Санитарно-эпидемиологические правила «Безопасность работы с микроорганизмами III - IV групп патогенности (опасности) и возбудителями паразитарных болезней» Дополнения и изменения № 1 к СП 1.3.2322-08»: СП 1.3.2518-09 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 2.06.2009 № 42. Зарегистрировано в Минюсте РФ 8.07.2009 № 14280).
2.12. Санитарно-эпидемиологические правила «Санитарная охрана территории Российской Федерации»: СП 3.4.2318-08 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 22.01.2008 № 3 «Об утверждении санитарно-эпидемиологических правил СП 3.4.2318-08». Зарегистрировано в Минюсте РФ 3.04.2008 № 11459).
2.13. Санитарно-эпидемиологические правила «Профилактика холеры. Общие требования к эпидемиологическому надзору за холерой на территории Российской Федерации»: СП 3.1.1.2521-09 (Утв. постановлением Главного государственного санитарного врача Российской Федерации от 9.06.2009 № 43 «Об утверждении санитарно-эпидемиологических правил СП 3.1.1.2521-09». Зарегистрировано в Минюсте РФ 9.07.2009 № 14285).
2.14. Методические указания «Организация работы лабораторий, использующих методы амплификации нуклеиновых кислот при работе с материалом, содержащим микроорганизмы I - IV групп патогенности» МУ 1.3.2569-09.
2.15. Методические указания «Контроль диагностических питательных сред по биологическим показателям для возбудителей чумы, холеры, сибирской язвы, туляремии»: МУ 3.3.2.2124-06.
2.16. Методические указания «Лабораторная диагностика холеры»: МУК 4.2.2218-07.
2.17. Методические указания «Профилактика холеры. Организационные мероприятия. Оценка противоэпидемической готовности медицинских учреждений к проведению мероприятий на случай возникновения очага холеры»: МУ 3.1.1.2232-07.
2.18. Методические указания. «Определение чувствительности возбудителей опасных бактериальных инфекций (чумы, сибирской язвы, холеры, туляремии, бруцеллеза, сапа и мелиоидоза) к антибактериальным препаратам»: МУК 4.2.2495-09.
2.19. Методические указания «Методы контроля бактериологических питательных сред»: МУК 4.2.2316-08.
2.20. Методические указания «Серологические методы в диагностике холеры»: МУК 4.2.2315-08. Дополнения к МУК 4.2.2218-07 «Лабораторная диагностика холеры».
3. Перечень сокращений
АБП - антибактериальные препараты
ИФА - иммуноферментный анализ
ЛПУ - лечебно-профилактическое учреждение
МУ - методические указания
МУК - методические указания по контролю
МФА - метод флуоресцирующих антител
ООИ - особо опасные инфекции
ПБА - патогенный биологический агент
ПЦР - полимеразная цепная реакция
ПЧС - противочумная станция
РАО - реакция агломерации объёмная
РА - реакция агглютинации
РИВ - реакция иммобилизации вибрионов
РВА - реакция вибриоцидных антител
СанПиН - санитарные правила и нормативы
СП - санитарные правила
ИХ-тест - иммунохроматографический тест
4. Общие положения
Характеристика болезни и возбудителя холеры
Холера - особо опасная инфекционная болезнь с диарейным синдромом, фекально-оральным механизмом передачи возбудителя инфекции, водным, пищевым и контактным путями распространения.
Возбудитель холеры - холерный вибрион относится к семейству Vibrionaceae, роду Vibrio и виду Vibrio cholerae.
К виду Vibrio cholerae отнесены грамотрицательные, аспорогенные, полиморфные, слегка изогнутые или прямые палочки длиной 1,5 - 3,0 мкм и шириной 0,2 - 0,6 мкм, с одним полярно расположенным жгутиком, который длиннее тела клетки в 2 - 3 раза.
Холерные вибрионы быстро размножаются в 1 %-й пептонной воде, образуя через 6 - 8 ч на поверхности среды нежную пленку. Через 24 ч роста пленка становится грубой, среда слабо мутнеет. На поверхности плотного питательного агара (щелочной агар, рН 8,0) через 18 - 24 ч инкубации рост холерных вибрионов проявляется в формировании крупных (2 - 3 мм), гладких, прозрачных колоний с ровным краем, которые легко эмульгируются в физиологическом растворе. В косо проходящем свете они отсвечивают голубоватым цветом. На элективной среде TCBS на зеленом фоне среды колонии вибрионов круглые, гладкие с ровным краем, плоские, желтого цвета. При более длительной инкубации желтый цвет колоний часто переходит в зеленый.
Холерные вибрионы образуют индофенолоксидазу - тест дифференциации от представителей семейства Enterobacteriaceae, ферментируют глюкозу в аэробных и анаэробных условиях до кислоты без газа - тест дифференциации от представителей родов Pseudomonadaceae, декарбоксилируют лизин и орнитин, но не дигидролизуют аргинин - тесты дифференциации от представителей других семейств (Aeromonas spp., Plesiomonas spp., Enhydrobacter spp., Photobacterium spp.) и отдельных видов рода Vibrio.
Помимо этого, холерные вибрионы расщепляют до кислоты без газа сахарозу, маннозу, крахмал, маннит, не расщепляют арабинозу, салицин, дульцит, инозит. В отдельных случаях ферментацию маннозы холерными вибрионами возможно определить только в анаэробных условиях. Холерные вибрионы восстанавливают нитраты в нитриты, образуют индол, разжижают желатину, продуцируют нейраминидазу, лецитиназу, триглицероллипазу.
V.cholerae по наличию специфического О антигена распределяются на серологические группы. В настоящее время известно 206 серологических О групп холерных вибрионов. Возбудителями холеры являются холерные вибрионы O1 и O139 серологических групп. Холерные вибрионы других не O1/не O139 серологических групп могут вызывать спорадические или групповые случаи диарей, не склонные к эпидемическому распространению.
Холерные вибрионы O1 серогруппы по различиям в полисахаридном компоненте О-антигена делятся на три серовара: Огава, Инаба и Гикошима. Серовар Гикошима не стабилен и реверсирует в один из основных сероваров, преимущественно - Огава. Известен R-антиген холерных вибрионов, описаны штаммы, агглютинирующиеся RO сывороткой и не агглютинирующиеся сыворотками O1, Огава или Инаба.
У холерных вибрионов имеется общий жгутиковый Н-антиген.
Холерные вибрионы в пределах O1 серогруппы делятся на два биовара: классический и эльтор, имеющие существенные фенотипические и генетические отличия. Деление на биовары основывается на чувствительности к холерным диагностическим бактериофагам - классическому и эльтор, чувствительности к 50 ед./мл полимиксина В, агглютинации куриных эритроцитов, образовании ацетилметилкарбинола в реакции Фогес-Проскауэра.
Холерные вибрионы являются носителями умеренных фагов с низкой литической активностью. Известны фаги, активные в отношении холерных вибрионов O1 и не O1, включая O139 серологическую группу, а также с более узким спектром литического действия, в пределах отдельных групп штаммов, например ctx+ и ctx- холерных вибрионов.
Одним из основных факторов вирулентности (и эпидемической значимости) холерных вибрионов, определяющих тяжесть клинической картины при холере, является холерный энтеротоксин или СТ (от англ. - cholera toxin), синтез которого контролируется кластером генов ctxAB.
Описан ряд дополнительных токсинов: Zot и Асе токсины, цитотоксический комплекс RTX, цитотонический фактор Cef, термостабильный токсин ST, NMDCY токсин, шигаподобный токсин Slt, WO7 токсин, cholix toxin. He менее важным фактором вирулентности холерных вибрионов являются токсин-корегулируемые пили адгезии или TCP (от англ. - toxin-coregulated pilus) - ключевой фактор колонизации. За синтез пилей TCP отвечают гены tcpA-F, среди них ген tcpA - за биосинтез основной субъединицы пилей.
Нетоксигенные штаммы холерных вибрионов обладают гемолитической активностью, которая включает активность нескольких компонентов: рициноподобного галактозоспецифичного лектина (hlyA) и комплекса ферментов гидролаз, ведущим из которых является липаза (liрА). Гемолитическая активность является ведущим фактором патогенности у штаммов возбудителей холеры O1 и O139 серогрупп, не имеющих ген холерного токсина. Такие штаммы могут вызывать спорадические случаи диареи различной степени тяжести, но не склонны к широкому распространению. Способность к гемолизу эритроцитов барана в тесте Грейга, коррелирующая с липазной активностью, является визуализированным тестом, свидетельствующим о том, что штамм не может вызывать тяжёлую клиническую картину холеры и не способен к широкому эпидемическому распространению.
Понятие эпидемической значимости базируется на определении комплекса показателей:
· прямые - выявление гена холерного токсина в ПЦР и определение активности его продукции на кроликах-сосунках;
· косвенные - отсутствие гемолитической, липазной активности, поздняя ферментация маннита, высокая адгезивная активность in vitro (на модели эритроцитов).
Холерные вибрионы имеют две хромосомы: первую (или большую размером 2960 т.п.н.) и вторую (или малую размером 1070 т.п.н.). На большой хромосоме V.cholerae расположены гены патогенности: ctxAB, кодирующий биосинтез СТ, гены, определяющие продукцию дополнительных холерных токсинов, гены tcpA - F, кодирующие продукцию TCP, а также гены, необходимые для репликации, транскрипции, репарации ДНК, биосинтеза клеточной стенки и О-антигена. Биосинтез O1 антигена определяет кластер генов, обозначенный как wbe. Продукция O139 антигена кодируется кластером генов, также локализованном на большой хромосоме и имеющим обозначение wbf. Выявление с помощью ПЦР генов wbe и wbf, специфичных для холерных вибрионов O1 и O139 серологических групп, позволяет определить серогруппу возбудителя холеры. На малой хромосоме, помимо генов с неустановленной функцией, локализованы структурные гены hlyA, отвечающие за синтез термолабильного гемолизина, а также остров интегронов, содержащий гены, кодирующие антибиотикоустойчивость, и участвующий в приобретении новых генов. Следует отметить, что ген hlуА присутствует в хромосоме всех штаммов V.cholerae, как способных к биосинтезу термолабильного гемолизина, так и не продуцирующих этот белок. Однако в гене hlуА холерных вибрионов классического биовара, в отличие от такового V.cholerae эльтор, имеется делеция протяженностью 11 п.н., вследствие чего продукция гемолизина вибрионами этого биовара невозможна.
Штаммы холерных вибрионов O1 и O139 серогрупп, содержащие гены ctxAB и tcpA-F, вызывают холеру и являются эпидзначимыми. Эти штаммы не лизируют эритроциты барана в пробе Грейга. Эпидемически не значимые штаммы холерных вибрионов, не содержащие генов ctxAB и tcpA-F, лизируют эритроциты барана в пробе Грейга. Нетоксигенные (не содержащие гена холерного токсина) ctxАВ варианты холерных вибрионов O1, также как и других серогрупп, могут вызывать спорадические (единичные) или групповые (при общем источнике инфицирования) заболевания, не склонные к эпидемическому распространению.
Известна изменчивость холерных вибрионов по морфологии колоний и клеток, по образованию некультивируемых и Л-форм, по агглютинабельности диагностическими О, Инаба и Огава сыворотками (вплоть до полной утраты) и агглютинабельности RO сывороткой. Нередко сочетается изменчивость по культурально-морфологическим признакам, агглютинабельности холерными сыворотками и чувствительности к фагам.
Холерные вибрионы O1 и O139 серогрупп, как правило, чувствительны к набору антибактериальных препаратов. Однако широкое применение антибактериальных препаратов в очагах холеры способствовало увеличению резистентности холерных вибрионов к ним.
При проведении лабораторной диагностики холеры регламентируется использование зарегистрированных диагностических препаратов и тест-систем в соответствии с прилож. 4, позволяющих выявлять определённые фено- и генотипические признаки холерных вибрионов.
5. Порядок организации и проведения лабораторной диагностики холеры для лабораторий территориального уровня
5.1. Порядок организации и проведения лабораторной диагностики холеры для лабораторий лечебно-профилактических учреждений
5.1.1. Требования к бактериологическим лабораториям лечебно-профилактических учреждений, осуществляющим диагностические исследования на холеру
Наличие разрешительных и регламентирующих работу документов
Лечебно-профилактические учреждения, лаборатории которых осуществляют диагностические исследования на холеру, должны иметь лицензию на осуществление деятельности, связанной с использованием возбудителей III - IV групп патогенности (опасности).
Лаборатории ЛПУ должны иметь санитарно-эпидемиологическое заключение о возможности проведения работ с микроорганизмами III - IV групп патогенности (опасности) в соответствии с действующими санитарными правилами о порядке выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности), генно-инженерно-модифицированными микроорганизмами, ядами биологического происхождения и гельминтами.
Учет, хранение, передача и транспортирование выделенных культур холерных вибрионов (подозрительных) должны осуществляться в соответствии с действующими нормативными документами о порядке учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
Утилизация отходов должна осуществляться в соответствии с действующими санитарными правилами по сбору, хранению и удалению отходов лечебно-профилактических учреждений.
Проведение исследований на всех этапах: отбор проб, их хранение, доставка в лабораторию, регистрация, порядок исследования, выдача результатов, взаимодействие с учреждениями Роспотребнадзора должны соответствовать требованиям действующих нормативных и распорядительных документов.
Требования к специалистам и вспомогательному персоналу, участвующим в выполнении исследований на холеру
Исследования на холеру могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим образованием, окончившие соответствующие курсы по специальности «Бактериология», имеющие допуск к работе с ПБА III - IV групп на основании приказа руководителя учреждения.
Специалисты должны повышать квалификацию не реже одного раза в пять лет и иметь сертификат специалиста.
Инженерно-технический персонал, дезинфекторы и санитарки проходят специальную подготовку по месту работы в соответствии с должностными обязанностями.
Необходимый уровень подготовки специалистов с высшим медицинским (биологическим) образованием и средним медицинским образованием, повышение их квалификации по лабораторной диагностике холеры представлен в прилож. 1.
Требования к знаниям и умениям специалистов ЛПУ, выполняющих бактериологические исследования на холеру, приведены в прилож. 2.
Требования к обеспечению безопасности работы персонала
Каждая бактериологическая лаборатория должна иметь пакет документов, определяющих режим безопасной работы сотрудников с учетом характера работ, особенностей технологии, свойств микроорганизмов. Документы должны быть согласованы с комиссией по контролю соблюдения требований биологической безопасности, специалистами по охране труда, противопожарным мероприятиям и утверждены руководителем учреждения. Результаты проверок знаний правил техники безопасности персонала при проведении работ фиксируются в специальном журнале.
Все сотрудники должны выполнять требования по обеспечению безопасности работы с материалом, подозрительным или зараженным возбудителями инфекционных болезней III - IV групп патогенности (опасности) в соответствии с действующими нормативными документами.
Порядок организации внутреннего контроля качества лабораторных исследований
Контроль качества диагностических исследований на холеру в лабораториях ЛПУ включает:
· контроль качества питательных сред, диагностических препаратов, дистиллированной воды, химических реактивов и дезинфицирующих средств;
· своевременную поверку средств измерений, аттестацию испытательного оборудования;
· контроль качества стерилизации лабораторной посуды;
· контроль работы паровых и суховоздушных стерилизаторов;
· контроль работы бактерицидных ламп;
· контроль температурного режима работы холодильников и термостатов;
· проверку состояния воздуха производственных помещений и боксов, температурного режима, влажности;
· проверку санитарного состояния помещений, включая условия уборки, дезинфекции, контроль смывов с поверхностей и оборудования.
Результаты контроля фиксируют в специальных журналах.
Правила ведения документации
Ведение лабораторной документации, включая регистрационные и рабочие журналы, осуществляют в соответствии с требованиями действующих нормативно-методических документов.
Требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру
Для проведения диагностических исследований на холеру в лабораториях ЛПУ должны быть в наличии:
· питательные среды, зарегистрированные в установленном порядке (прилож. 3, 8);
· диагностические препараты, зарегистрированные в установленном порядке (прилож. 4, 8);
· химические реактивы (прилож. 5);
· приборы, оборудование, расходные материалы (прилож. 6).
5.1.2. Номенклатура и объем исследований
В лабораториях ЛПУ проводят диагностические исследования материала от лиц, подлежащих обследованию на холеру при проведении эпидемиологического надзора в соответствии с требованиями действующих санитарных правил по профилактике холеры, в периоды обследования дифференцированно для территорий, различных по типам эпидемических проявлений холеры.
В лабораториях ЛПУ проводят диагностические исследования материала в следующем объеме:
1) посев на среды накопления и дифференциально-диагностические, выделение культуры, подозрительной на холерный вибрион по морфологическим признакам;
2) идентификация культуры, подозрительной на холерный вибрион, по следующим тестам:
· ферментация на полиуглеводной среде;
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с холерными диагностическими сыворотками;
3) экспресс и ускоренная диагностика: методы МФА и РИВ (при исследовании материала с подозрением на холеру).
5.1.3. Порядок лабораторной диагностики холеры в лабораториях лечебно-профилактических учреждений
Отбор и транспортирование проб клинического материала
При проведении бактериологического анализа на холеру исследуется клинический материал: испражнения, рвотные массы, желчь и секционный материл от умерших, причиной смерти которых явились кишечные инфекции неустановленной этиологии.
Отбор, упаковка и транспортирование проб клинического материала для исследования осуществляются в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
Материал от больных забирает медицинский персонал ЛПУ немедленно при выявлении больного, до начала лечения антибиотиками. Кратность отбора проб - в соответствии с действующими санитарно-эпидемиологическими правилами по эпидемиологическому надзору за холерой.
В зависимости от времени забора материала и времени работы лаборатории пробы на исследование отбирают в соответствии со следующей схемой:
1. При круглосуточном режиме работы лаборатории материал забирают в нативном виде, в 5 - 10 мл 1 %-й пептонной воды рН 8,4 ± 0,1 (транспортная среда) или в 50 мл 1 %-й пептонной воды рН 8,4 ± 0,1 (1-я среда накопления);
2. При односменной работе лаборатории:
а) при взятии материала в 6.00 - 10.00 ч утра и доставке в бактериологическую лабораторию до 10 ч утра материал забирают в 5 - 10 мл 1 %-й пептонной воды (транспортная среда) или в 50 мл 1 %-й пептонной воды (1-я среда накопления);
б) при взятии материала после 10 ч утра и доставке в течение рабочего дня лаборатории материал забирают в 5 - 10 мл 1 %-й пептонной воды (транспортная среда);
в) при взятии материала по окончании рабочего дня лаборатории и доставке в лабораторию до 10 ч утра следующего рабочего дня материал забирают в 5 - 10 мл 1 %-й пептонной воды (транспортная среда);
г) при взятии материала в выходные дни лаборатории и доставке материала до 10 ч утра следующего рабочего дня материал забирают в 50 мл 1 %-й пептонной воды с теллуритом калия (транспортная среда).
Флаконы и пробирки с 1 %-й пептонной водой должны быть этикетированы с указанием названия среды и даты ее изготовления. При этом
1 %-я пептонная вода хранится при температуре не выше (10 ± 0,2) °С.
От больных тяжелой формой материал направляют в лабораторию нативным и в 1 %-й пептонной воде. В транспортную среду вносят 1 - 2 мл или 1 - 2 г материала на 5 - 6 мл среды.
Обильные водянистые испражнения и рвотные массы в количестве 10 - 20 мл отбирают из индивидуального судна в стерильные контейнеры объемом 60 - 100 мл стерильными ложками или автоматической пипеткой переменного объема.
У больных легкими формами - 1 - 2 г испражнений собирают в стерильный контейнер объемом 60 - 100 мл или петлю (зонд) ректальную стерильную смачивают стерильным физиологическим раствором и вводят в прямую кишку на глубину 5 - 6 см. Материал помещают в пробирку с транспортной средой.
Желчь берут при дуоденальном зондировании в лечебном учреждении. В отдельные полимерные контейнеры объемом 60 мл собирают две порции: из желчного пузыря и желчных протоков (В и С). Материал доставляют нативным.
Пробы маркируют, обрабатывают снаружи дезинфицирующим раствором, упаковывают в полиэтиленовый пакет с застежкой-молнией, заполняют бланк-направление и помещают в контейнер (кейс) для транспортирования биологического материала на исследование.
При необходимости пробы сохраняют при комнатной температуре (24,0 ± 1,0 °С) в биксе, ящике, шкафу в специально выделенной комнате, закрывающейся на замок.
Исследование клинического материала
Профилактические исследования клинического материала на холеру проводят в течение рабочего дня, диагностические исследования материала от больного с подозрением на холеру, а также в случае выделения культуры, подозрительной на холерный вибрион - в условиях круглосуточного режима работы лаборатории с включением экспресс и ускоренных методов диагностики. При исследовании материала от больных холерой (подозрительных) среды накопления с ингибиторами не используются.
Методы исследования клинического материала на холеру в лабораториях ЛПУ: бактериологический и ускоренные (слайд-агглютинация, РИВ и МФА).
Все изолированные от людей культуры, подозрительные на холерные вибрионы, независимо от результатов слайд-агглютинации холерными сыворотками, передаются для дальнейшей идентификации в установленном порядке.
1. Исследование клинического материала на холеру при круглосуточном режиме работы лаборатории
I этап исследования
Посев нативного материала (испражнения, рвотные массы и др.) и материала, доставленного в транспортной среде, в первую жидкую среду накопления (1 %-ю пептонную воду) и на плотные питательные среды: щелочной агар и элективную среду типа TCBS.
Материал, доставленный в 5 мл 1 %-й пептонной воды полностью засевают в 50 мл среды накопления.
При доставке материала в 50 мл 1 %-й пептонной воды не позже 2 ч после забора, пробу помещают в термостат на 6 ч (первая среда накопления). При доставке в более поздние сроки 5 мл материала засевают в 50 мл 1 %-й пептонной воды.
Материал от лиц, принимавших антибиотики, активные по отношению к возбудителю холеры, засевают в большой объем жидкой накопительной среды (200 - 300 мл) и на 2 чашки щелочного агара. Посевы инкубируют при 37 °С в течение 24 ч, производя высев через каждые 8 - 10 ч на пластинки щелочного агара. Вторую среду накопления при этом не используют.
Постановка ускоренных методов исследования с нативным материалом: МФА и РИВ.
При получении положительного результата в двух методах выдают устный предварительный положительный ответ по предусмотренной в учреждении схеме, в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
II этап исследования
(через 6 - 8 ч от начала исследования)
Высев с первой среды накопления на щелочной агар, элективную среду и во вторую среду накопления (1 %-ю пептонную воду).
Постановка ускоренных методов исследования с материалом из I среды накопления при отрицательных результатах в МФА и РИВ на I этапе исследования.
Выдача устного предварительного положительного ответа при положительном результате в двух методах по предусмотренной схеме.
III этап исследования
(через 12 - 16
ч от начала исследования)
Высев из второй среды накопления на щелочной агар.
Просмотр посевов на щелочном агаре, засеянных на I этапе исследования, в косо проходящем свете стереоскопического микроскопа.
Производят отбор подозрительных колоний на полиуглеводную среду и щелочной или другой питательный агар для накопления культур.
При наличии достаточного количества подозрительных колоний ставят следующие тесты:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO, при отрицательном результате - с сывороткой O139 серогруппы;
· постановка МФА, РИВ.
Выдача устного предварительного положительного ответа при положительном результате в двух методах (наличие индофенолоксидазы, положительный результат слайд-агглютинации, МФА или РИВ) по предусмотренной схеме.
IV этап исследования
(через 18 - 24
ч от начала исследования)
Просмотр посевов на щелочном агаре и на элективной среде, сделанных на I - II этапах исследования в косо проходящем свете стереоскопического микроскопа.
Отбор колоний, подозрительных на колонии холерных вибрионов, постановка тестов, предусмотренных на III этапе исследования.
Отсев подозрительных на холерные вибрионы колоний на одну из полиуглеводных сред и щелочной агар для накопления культуры.
Выдача устного предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками;
· положительные результаты ускоренной диагностики методами МФА и РИВ.
V этап исследования
(через 24 - 36 ч от начала исследования)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре, постановка тестов, предусмотренных на III этапе исследования.
Выдача устного предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками;
· положительные результаты ускоренной диагностики методами МФА и РИВ.
Подготовка выделенной культуры к транспортированию.
Передача выделенной культуры для идентификации в установленном порядке.
2. Исследование клинического материала на холеру при односменной работе лаборатории
В течение рабочей недели для отбора проб используют 1 %-ю пептонную воду без теллурита калия в объеме 5-10 мл (транспортная среда) или 50 мл (среда накопления).
В качестве 1-й или 2-й среды накопления используют 1 %-ю пептонную воду (рН 8,4 ± 0,1) с теллуритом калия в конечной концентрации 1:100000 - 1:200000 в соответствии с результатами его контроля.
1-й вариант. Клинический материал поступил в лабораторию до 10 ч утра. Время взятия материала - 6.00 - 10.00 ч утра
I этап исследования
а) материал доставлен в транспортной среде (5 - 10 мл 1 %-й пептонной воды) или нативным (испражнения, рвотные массы и др.).
Посев материала в 50 мл 1 %-й пептонной воды - 1-я среда накопления. Кроме того, нативный материал засевают на плотные питательные среды: щелочной агар и элективную среду типа TCBS.
б) материал доставлен не позже 2 ч после забора в 50 мл 1 %-й пептонной воды. Помещают в термостат на инкубацию как 1-ю среду накопления.
II этап исследования
через 6 ч (в течение 1-го рабочего
дня)
Пересев с 1-й среды накопления во 2-ю среду накопления с теллуритом калия и высев на щелочной агар и элективную среду типа TCBS.
III этап исследования
через 24 - 26 ч от начала исследования
(в начале 2-го рабочего дня)
Высев со 2-й среды накопления на щелочной агар и элективную среду типа TCBS.
Просмотр посевов на щелочном агаре и элективной среде, засеянных на I и II этапах исследования, в косо проходящем свете стереоскопического микроскопа.
Отсев колоний, подозрительных на колонии холерных вибрионов, на одну из полиуглеводных сред и щелочной агар для накопления культуры.
При достаточном количестве подозрительные на холерные вибрионы колонии изучают с использованием следующих тестов:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача устного предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими колерными диагностическими сыворотками.
IV этап исследования
через 48 - 50 ч от начала исследования
(в течение 3-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре, постановка тестов, предусмотренных на III этапе исследования.
Просмотр посевов на щелочном агаре и элективной среде, сделанных на I - III этапах исследования, в косо проходящем свете стереоскопического микроскопа.
Отбор со щелочного агара и элективной среды подозрительных на холерные вибрионы колоний на одну из полиуглеводных сред и щелочной агар для накопления культуры.
Подозрительные на холерные вибрионы колонии изучают с использованием следующих тестов:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками.
V этап исследования
через 72 - 74
ч (в течение 4-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре и изучение их по тестам, указанным для IV этапа исследования.
Подготовка выделенной культуры к транспортированию. Передача выделенной культуры для дальнейшей идентификации в установленном порядке возможна на любом этапе.
2-й вариант. Клинический материал поступил после 10 ч утра, в течение рабочего дня лаборатории. Время взятия материала - 10.00 - до конца рабочего дня лаборатории
Материал доставлен в транспортной среде (5 - 10 мл 1 %-й пептонной воды).
I этап исследования
(в течение 1-го рабочего дня)
Посев 5 - 10 мл транспортной среды с материалом в 50 мл 1 %-й пептонной воды с теллуритом калия - 1-я среда накопления и высев на щелочной агар и элективную среду типа TCBS.
II этап исследования
через 24 - 26 ч от начала исследования
(в начале 2-го рабочего дня)
Высев с 1-й среды накопления во 2-ю среду накопления без теллурита калия, на щелочной агар и элективную среду типа TCBS.
Просмотр в косо проходящем свете стереоскопического микроскопа посевов на щелочном агаре и элективной среде, сделанных на I этапе исследования.
Отсев подозрительных на холерные вибрионы колоний на полиуглеводную среду и щелочной или другой питательный агар для накопления культуры.
Подозрительные на холерные вибрионы колонии изучают с использованием следующих тестов:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками.
III этап исследования
через 30 - 32
ч от начала исследования (в конце 2-го
рабочего дня)
Высев через 6 ч инкубации со 2-й среды накопления на щелочной агар.
IV этап исследования
через 48 - 50
ч от начала исследования (в течение 3-го
рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре, постановка тестов, предусмотренных на II этапе исследования.
Просмотр в косо проходящем свете стереоскопического микроскопа посевов на щелочном агаре и элективной среде, сделанных на II и III этапах исследования.
Отсев подозрительных на холерные вибрионы колоний на полиуглеводную среду и щелочной или другой питательный агар для накопления культуры.
Подозрительные на холерные вибрионы колонии изучают с использованием следующих тестов:
определение индофенолоксидазы;
микроскопия мазка, окрашенного по Граму;
слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача устного предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками.
V этап исследования
через 72 - 74
ч (в течение 4-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре.
Изучение по тестам, предусмотренным на IV этапе.
Подготовка выделенной культуры к транспортированию. Передача выделенной культуры для дальнейшей идентификации в установленном порядке возможна на любом этапе.
3-й вариант. Время взятия материала - по окончании рабочего дня лаборатории. Клинический материал доставлен в лабораторию до 10 ч утра следующего рабочего дня
I этап исследования
(1-й рабочий день)
Материал доставлен в транспортной среде (5 - 10 мл 1 %-й пептонной воды без теллурита калия).
Посев материала в 50 мл 1 %-й пептонной воды (1-я среда накопления), на щелочной агар и элективную среду типа TCBS.
II этап исследования
через 6 ч от начала исследования (в
течение 1-го рабочего дня)
Пересев с 1-й среды накопления во 2-ю среду накопления (1 %-я пептонная вода с теллуритом калия), высев на щелочной агар и элективную среду типа TCBS.
III этап исследования
через 24 - 26 ч от начала исследования
(в начале 2-го рабочего дня)
Высев со 2-й среды накопления на щелочной агар.
Просмотр в косо проходящем свете стереоскопического микроскопа посевов на щелочном агаре и элективной среде, засеянных на I и II этапах исследования.
Отсев подозрительных на холерные вибрионы колоний на полиуглеводную среду и на щелочной или другой питательный агар для накопления культуры.
Подозрительные на холерные вибрионы колонии изучают с использованием следующих тестов:
· микроскопия мазка, окрашенного по Граму;
· определение индофенолоксидазы;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
При положительном результате в двух методах - выдача устного предварительного положительного ответа по предусмотренной схеме.
IV этап исследования
через 48 - 50 ч от начала исследования
(в течение 3-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре, постановка тестов, предусмотренных на III этапе исследования.
Просмотр в косо проходящем свете стереоскопического микроскопа посевов на щелочном агаре и элективной среде.
Отсев на полиуглеводную среду и щелочной или другой питательный агар для накопления культуры, подозрительной на холерные вибрионы.
Определение индофенолоксидазы.
Микроскопия мазка, окрашенного по Граму.
Слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача предварительного положительного ответа об обнаружении в исследуемом материале культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками.
V этап исследования
через 72 - 74
ч от начала исследования (в течение 4-го
рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре. Изучение культур по тестам предыдущего этапа. Подготовка выделенной культуры к транспортированию. Передача выделенной культуры для дальнейшей идентификации в установленном порядке возможна на любом этапе.
4-й вариант. Время взятия материала - выходные дни лаборатории. Клинический материал поступил до 10 ч утра следующего рабочего дня
I этап исследования (1-й рабочий день)
Материал доставлен в транспортной среде (50 мл 1 %-й пептонной воды с теллуритом калия).
Посев 5 - 10 мл среды с материалом в 50 мл 1 %-й пептонной воды - 1-я среда накопления.
II этап исследования
через 6 ч от начала исследования (в
течение 1-го рабочего дня)
Пересев с 1-й среды накопления во 2-ю среду накопления (1 %-я пептонная вода с теллуритом калия), высев на щелочной агар и элективную среду типа TCBS.
III этап исследования
через 24 - 26 ч от начала исследования
(в начале 2-го рабочего дня)
Высев со 2-й среды накопления на щелочной агар.
Просмотр в косо проходящем свете стереоскопического микроскопа посевов на щелочном агаре и элективной среде типа TCBS.
Отсев колоний, подозрительных на колонии холерного вибриона, на полиуглеводную среду и щелочной или другой питательный агар для накопления культуры.
При достаточном количестве подозрительных на холерные вибрионы колоний ставят тесты:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Грамму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача устного предварительного положительного ответа по предусмотренной схеме.
IV этап исследования
через 48 - 50 ч от начала исследования
(в течение 3-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре, постановка тестов, предусмотренных на III этапе исследования.
Просмотр посевов в косо проходящем свете стереоскопического микроскопа на щелочном агаре и на элективной среде, засеянных на II и III этапах исследования.
Отсев колоний, подозрительных на колонии холерного вибриона, на полиуглеводную среду и на щелочной или другой питательный агар для накопления культуры.
Определение индофенолоксидазы.
Микроскопия мазка, окрашенного по Граму.
Слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO и O139 серогруппы.
Выдача предварительного положительного ответа по предусмотренной схеме.
V этап исследования
через 72 - 74 ч от начала исследования
(в течение 4-го рабочего дня)
Отбор культур с характерным ростом на полиуглеводной среде и щелочном агаре.
Изучение культуры по тестам, предусмотренным на IV этапе. Передача выделенной культуры для дальнейшей идентификации в установленном порядке возможна на любом этапе.
5.1.4. Оформление результатов исследования
Регистрация результатов анализа в лаборатории ЛПУ производится по учетным формам в соответствии с действующими МУК по лабораторной диагностике холеры. Выдача ответов для историй болезней - по унифицированным формам.
5.1.5. Порядок взаимодействия лечебно-профилактических учреждений с учреждениями Роспотребнадзора
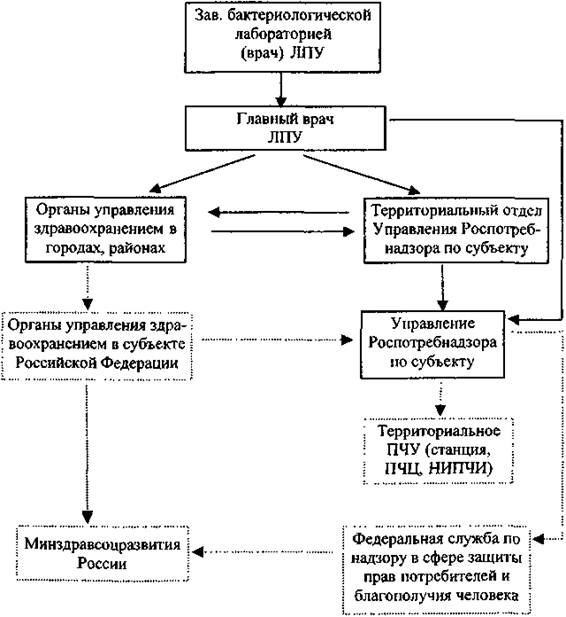
Информация о выделенной в лаборатории ЛПУ культуре холерного вибриона передается в соответствии со схемой выдачи результатов исследований (прилож. 9).
Культуры холерных вибрионов направляют в лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии» в субъекте, при ее отсутствии в лаборатории Регионального центра по мониторингу за возбудителями инфекционных болезней I - II групп патогенности или Центра индикации и диагностики опасных инфекционных болезней (территориальное противочумное учреждение). Передачу и транспортирование осуществляют в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
5.2. Порядок организации и проведения лабораторной диагностики холеры для филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании (городе, административном районе) в субъекте Российской Федерации
5.2.1. Требования к лабораториям филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании (городе, административном районе) в субъекте Российской Федерации, осуществляющим бактериологические исследования на холеру
Наличие разрешительных и регламентирующих работу документов
ФБУЗ «Центр гигиены и эпидемиологии» в субъекте, на базе филиалов которого функционируют бактериологические лаборатории, должен иметь лицензию на осуществление деятельности, связанной с использованием возбудителей III-IV групп патогенности (опасности).
Бактериологические лаборатории филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании в субъекте Российской Федерации должны иметь санитарно-эпидемиологическое заключение о возможности проведения работ с микроорганизмами III - IV групп патогенности (опасности) в соответствии с действующими санитарными правилами о порядке выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных болезней человека I - IV групп патогенности (опасности).
Лаборатории филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании в субъекте Российской Федерации должны быть аккредитованы на техническую компетентность в установленном порядке в соответствии с действующей законодательной базой Российской Федерации.
Учет, хранение, передача и транспортирование выделенных культур, подозрительных на холерные вибрионы, должны осуществляться в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
Утилизация отходов должна осуществляться в соответствии с действующими санитарными правилами по санитарно-эпидемиологическим требованиям к обращению с медицинскими отходами.
Проведение исследований на всех этапах: отбор проб, их хранение, доставка в лабораторию, регистрация, порядок исследования, выдача результатов, взаимодействие с учреждениями Роспотребнадзора должны соответствовать требованиям действующих нормативных и распорядительных документов.
Требования к специалистам и персоналу, участвующим в выполнении исследований на холеру
Исследования на холеру могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим образованием, окончившие курсы по специальности «Бактериология», имеющие допуск к работе с ПБА III - IV групп на основании приказа руководителя учреждения.
Инженерно-технический персонал, дезинфекторы и санитарки проходят специальную подготовку по месту работы в соответствии с должностными обязанностями.
Специалисты, осуществляющие деятельность, связанную с использованием возбудителей инфекционных болезней, должны повышать квалификацию не реже одного раза в 5 лет и иметь сертификат специалиста.
Необходимый уровень подготовки специалистов с высшим медицинским (биологическим) образованием и средним медицинским образованием, и повышение их квалификации по лабораторной диагностике холеры представлены в прилож. 1.
Требования к знаниям и умениям специалистов, выполняющих бактериологические исследования на холеру, приведены в прилож. 2.
Требования к обеспечению безопасности работы персонала
Каждая лаборатория должна иметь пакет документов, определяющих режим безопасной работы сотрудников с учетом характера работ, особенностей технологии, свойств микроорганизмов. Документы должны быть согласованы с комиссией по контролю соблюдения требований биологической безопасности, специалистами по охране труда, противопожарным мероприятиям и утверждены руководителем учреждения. Результаты проверок знаний правил техники безопасности персонала при проведении работ фиксируются в специальном журнале.
Все сотрудники должны выполнять требования по обеспечению безопасности работы с материалом, подозрительным или зараженным возбудителями инфекционных болезней III - IV групп патогенности (опасности) в соответствии с действующими нормативными документами.
Порядок организации внутреннего контроля качества лабораторных исследований
Контроль качества диагностических исследований на холеру в лабораториях филиалов ФБУЗ ЦГиЭ в субъекте Российской Федерации включает:
· контроль качества питательных сред, диагностических препаратов и тест-систем, дистиллированной воды, дезинфицирующих средств, химических реактивов;
· своевременную поверку средств измерений, аттестацию испытательного оборудования;
· контроль качества стерилизации фильтровальных установок, лабораторной посуды;
· контроль качества стерилизации паровых и суховоздушных стерилизаторов;
· контроль работы бактерицидных ламп;
· контроль температурного режима работы холодильников и термостатов;
· проверку состояния воздуха производственных помещений и боксов, температурного режима, влажности;
· проверку санитарного состояния помещений, включая условия уборки, дезинфекции, контроль смывов с поверхностей и оборудования.
Результаты контроля фиксируют в специальных журналах.
Правила ведения документации
Ведение лабораторной документации, включая регистрационные и рабочие журналы, осуществляют в соответствии с требованиями действующих методических документов.
Требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру
Для проведения диагностических исследований на холеру в лабораториях должны быть в наличии:
· питательные среды, зарегистрированные в установленном порядке и прошедшие контроль качества (прилож. 3, 8);
· диагностические препараты и тест-системы, зарегистрированные в установленном порядке (прилож. 4, 8);
· химические реактивы (прилож. 5);
· приборы, оборудование, расходные материалы (прилож. 6).
5.2.2. Номенклатура и объем исследований
Лаборатории филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании в субъекте Российской Федерации при осуществлении эпидемиологического надзора проводят плановые профилактические исследования на холеру в сроки, определённые для территорий, различных по типам эпидемических проявлений холеры, в действующих санитарных правил:
· материала от лиц, подлежащих лабораторному обследованию;
· проб из объектов окружающей среды.
В лабораториях филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании, (городе, административном районе) в субъекте проводят диагностические исследования материала в следующем объеме:
1) посев на среды накопления и дифференциально-диагностические, выделение культуры, подозрительной на возбудителя холеры;
2) идентификация культуры, подозрительной на возбудителя холеры, по следующим тестам:
· микроскопия мазка, окрашенного по Граму;
· выявление индофенолоксидазы;
· слайд-агглютинация с холерными диагностическими сыворотками;
3) экспресс и ускоренная диагностика: методы МФА и РИВ.
5.2.3. Порядок лабораторной диагностики холеры в лабораториях филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании (городе, административном районе) в субъекте Российской Федерации
5.2.3.1. Порядок исследования клинического материала
1. Отбор проб клинического материала
При проведении бактериологического анализа на холеру исследуется клинический материал: испражнения, рвотные массы, желчь.
Отбор, упаковка проб клинического материала для исследования, транспортирование, форма направления - в соответствии с действующими МУК по лабораторной диагностике холеры.
Материал от больных с дисфункцией кишечника забирает медицинский персонал ЛПУ в соответствии с разделом 5.1.3.
2. Исследование клинического материала
Методы исследования клинического материала на холеру в лабораториях филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальных образованиях (городах и административных районах субъекта, объединенных по территориальному признаку)»: бактериологический и ускоренные (слайд-агглютинация, МФА и РИВ).
Профилактические исследования клинического материала на холеру проводят в течение рабочего дня, диагностические исследования материала от больного с подозрением на холеру, а также в случае выделения культуры, подозрительной на холерный вибрион - в условиях круглосуточного режима работы лаборатории с включением экспрессных и ускоренных методов диагностики. При исследовании материала от больных холерой (подозрительных) среды накопления с ингибиторами не используются.
Порядок исследования материала от лиц, подлежащих обследованию при эпидемиологическом надзоре за холерой, при круглосуточной работе лаборатории осуществляется в соответствии с изложенным в п. 5.1.3 (1. Исследование клинического материала на холеру при круглосуточном режиме работы лаборатории).
Порядок исследования на холеру материала от лиц, подлежащих обследованию при эпидемиологическом надзоре, при односменной работе лаборатории осуществляется в зависимости от времени забора и доставки материала в лабораторию - варианты 1 - 4, изложенные в п. 5.1.3 (2. Исследование клинического материала при осуществлении эпидемиологического надзора за холерой при односменной работе лаборатории).
Все изолированные от людей культуры, подозрительные на холерные вибрионы, независимо от результатов слайд-агглютинации холерными сыворотками, передаются для дальнейшей идентификации в установленном порядке.
Регистрация результатов анализа и выдача ответов производится по учетным формам, предусмотренным в действующих методических указаниях по лабораторной диагностике холеры.
5.2.3.2. Порядок исследования на холеру проб из объектов окружающей среды
1. Отбор и транспортирование проб из объектов окружающей среды
Отбор и доставка для исследования проб воды из поверхностных водоёмов, хозяйственно-бытовых и сточных вод, содержимого выгребных туалетов, ила, гидробионтов, мух, смывов с объектов окружающей среды, пищевых продуктов и другие, и форма направления - в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
2. Исследование проб воды из поверхностных водоемов
I этап исследования
Посевы проб воды из поверхностных водоемов с целью первичного накопления холерных вибрионов в зависимости от времени доставки (варианты).
1-й вариант - к пробе воды добавляют раствор основного пептона до 1 %-й концентрации; определяют рН; подщелачивают 10 %-м раствором едкого натра до рН 8,4 ± 0,1 (1-я среда накопления). Время инкубации в 1-й среде накопления - 8 - 10 ч.
2-й вариант - в воду добавляют раствор основного пептона до 1 %-й концентрации и теллурит калия из рабочего разведения 1:1000 до конечной концентрации 1:100000 или 1:200000 в соответствии с результатами его контроля; устанавливают рН 8,4 ± 0,1 (1-я среда накопления). Время инкубации в 1-й среде накопления - 18 - 24 ч.
3-й вариант - производят фильтрование воды через мембранные фильтры № 2 или 3, смыв с фильтров сеют в 1-ю среду накопления (1 %-я пептонная вода рН 8,4 ± 0,1) и на щелочной агар.
II этап исследования
1-й вариант - через 8 - 10 ч от начала исследования:
· пересев с 1-й среды накопления во 2-ю (1 %-ю пептонную воду с теллуритом калия и без него; при этом время инкубации в среде без теллурита калия - 6 ч, а с теллуритом калия - 18 - 20 ч) и на щелочной агар.
2-й вариант - через 18 - 24 ч от начала исследования:
· пересев с 1-й среды накопления во 2-ю (1 %-ю пептонную воду без теллурита калия; при этом время инкубации в среде без теллурита калия - 6 - 8 ч) и на щелочной агар.
3-й вариант - через 12 - 18 ч от начала исследования:
· пересев с 1-й среды накопления во 2-ю среду накопления и на щелочной агар.
При интенсивном бактериальном загрязнении проб используют 3-ю среду накопления.
III этап исследования
Высев со 2-й среды накопления на щелочной агар.
IV этап исследования
Отбор колоний, подозрительных на колонии холерного вибриона, со щелочного агара в косо проходящем свете стереоскопического микроскопа.
Отсев колоний, подозрительных на колонии холерного вибриона, на одну из полиуглеводных сред и щелочной агар для накопления чистой культуры.
В случае проведения срочного анализа и при достаточном количестве подозрительных колоний:
· определение индофенолоксидазы;
· микроскопия мазка, окрашенного по Граму;
· слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO, O139 серогруппы;
· возможно использование методов МФА и РИВ.
В этом случае выдача устного предварительного положительного ответа по предусмотренной схеме об обнаружении в исследуемых пробах культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы, на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками;
· положительные результаты ускоренной диагностики методами МФА и РИВ.
V этап исследования
Отбор культуры с характерным ростом на полиуглеводной среде и щелочном агаре.
Определение индофенолоксидазы.
Микроскопия мазка, окрашенного по Граму.
Слайд-агглютинация с сыворотками холерными O1 серогруппы (при положительном результате - с Инаба, Огава), RO, O139 серогруппы.
Возможно использование методов МФА и РИВ.
Выдача устного предварительного положительного ответа по предусмотренной схеме об обнаружении в исследуемых пробах культур, подозрительных на холерные вибрионы O1, RO или O139 серогруппы, на основании результатов следующих тестов:
· характерные морфологические и культуральные признаки;
· положительный тест на индофенолоксидазу;
· положительная реакция слайд-агглютинации с соответствующими холерными диагностическими сыворотками;
· положительные результаты ускоренной диагностики методами МФА и РИВ.
Подготовка выделенной культуры к транспортированию.
Срочная передача выделенной культуры для дальнейшей идентификации в установленном порядке.
Неагглютинирующиеся холерными сыворотками O1 серогруппы, RO и O139 серогруппы культуры идентифицируют на месте по биохимическим признакам с целью уточнения родовой и видовой принадлежности или по согласованию передают в лабораторию ФБУЗ «Центр гигиены и эпидемиологии».
3. Исследование хозяйственно-бытовых сточных вод
Подготовка проб сточной воды. Фильтрация сточной воды (1 л) через фильтр для освобождения от механических примесей (при необходимости).
При заборе сточных вод марлевыми тампонами, их помещают в емкости с накопительной средой (1 %-й раствор пептона); устанавливают рН 8,4 ± 0,1 (1-я среда накопления). Время инкубации 1-й среды накопления - 8 - 10 ч, в случае добавления теллурита калия - 18 - 24 ч.
Далее этапы исследования хозяйственно-бытовых сточных вод осуществляются в соответствии с изложенными в п. 5.2.3.2 пп. 2 (Порядок исследования проб воды из поверхностных водоемов).
5.2.4. Оформление результатов исследования
Регистрация результатов анализа в лабораториях филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании в субъекте Российской Федерации производится по учетным формам в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
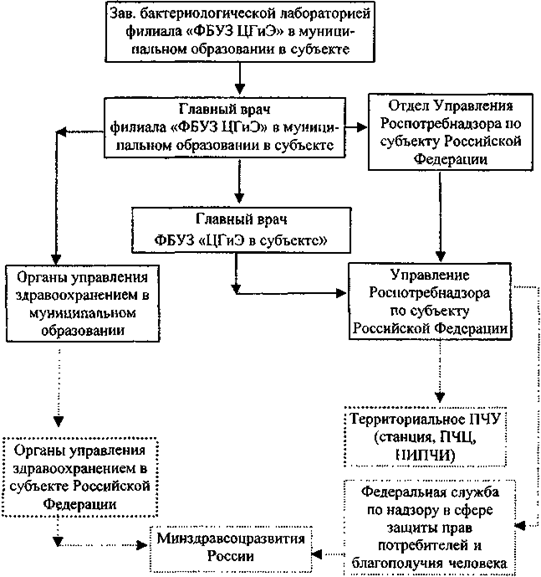
5.2.5. Порядок взаимодействия филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании (городе, административном районе) в субъекте Российской Федерации с учреждениями Роспотребнадзора
Информация о культуре холерного вибриона, выделенной в лаборатории филиала ФБУЗ «Центр гигиены и эпидемиологии» в муниципальном образовании в субъекте Российской Федерации из объектов окружающей среды передаётся в соответствии со схемой выдачи результатов исследований на холеру (прилож. 10).
Культура холерного вибриона направляется в лабораторию ООИ ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации, а при ее отсутствии в Региональный центр по мониторингу за возбудителями инфекционных болезней I - II групп патогенности или Центр индикации и диагностики возбудителей опасных инфекционных болезней (региональное противочумное учреждение). Доставку осуществляют в соответствии с действующими СП по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
5.3. Порядок организации и проведения лабораторной диагностики холеры для лабораторий ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации
5.3.1. Порядок организации и проведения лабораторной диагностики холеры для лабораторий ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации, в структуре которых отсутствуют отделы и лаборатории особо опасных инфекций
Лаборатории ФБУЗ «Центр гигиены и эпидемиологии» в субъектах Российской Федерации, в структуре которых отсутствуют отделы и лаборатории особо опасных инфекций (имеющие санитарно-эпидемиологическое заключение на право работы с микроорганизмами III - IV групп патогенности), при осуществлении эпидемиологического надзора за холерой проводят плановые профилактические исследования на холеру материала от лиц, подлежащих обследованию, и проб из объектов окружающей среды до этапа выделения культуры в следующем объеме:
1. Посев на среды накопления и элективную среду типа TCBS, выделение культуры, подозрительной на холерный вибрион;
2. Идентификация культуры, подозрительной на холерный вибрион, по следующим тестам:
· микроскопия мазка, окрашенного по Граму;
· выявление индофенолоксидазы;
· слайд-агглютинация с холерными диагностическими сыворотками;
3. Экспресс и ускоренная диагностика: методы МФА и РИВ.
Порядок организации и проведения лабораторной диагностики холеры для лабораторий ФБУЗ «Центр гигиены и эпидемиологии» в субъектах Российской Федерации, в структуре которых отсутствуют отделы или лаборатории особо опасных инфекций, соответствует порядку для лабораторий филиалов ФБУЗ «Центр гигиены и эпидемиологии» в муниципальных образованиях в субъектах Российской Федерации (раздел 5.2).
5.3.2. Порядок организации и проведения лабораторной диагностики холеры для лабораторий особо опасных инфекций ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации
5.3.2.1. Требования к лабораториям особо опасных инфекций ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации, осуществляющим бактериологические исследования на холеру
Наличие разрешительных и регламентирующих работу документов
ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации, на базе которого функционируют лаборатории ООИ, должны иметь лицензию на осуществление деятельности, связанной с использованием возбудителей II - IV групп патогенности (опасности).
Лаборатории ООИ должны иметь санитарно-эпидемиологическое заключение о возможности проведения работ с микроорганизмами II - IV групп патогенности (опасности) в соответствии с действующими санитарными правилами о порядке выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности).
Лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации должны быть аккредитованы на техническую компетентность в установленном порядке в соответствии с действующей законодательной базой Российской Федерации.
Учет, хранение, передача и транспортирование выделенных культур холерных вибрионов должны осуществляться в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
Утилизация отходов должна осуществляться в соответствии с действующими санитарными правилами по санитарно-эпидемиологическим требованиям к обращению с медицинскими отходами.
Проведение исследований на всех этапах: отбор проб, их хранение, доставка в лабораторию, регистрация, порядок исследования, выдача результатов, взаимодействие с учреждениями Роспотребнадзора должны соответствовать требованиям, действующих нормативных и распорядительных документов.
Требования к специалистам и персоналу, участвующим в выполнении исследований на холеру
Исследования на холеру могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим образованием, окончившие курсы специализации по особо опасным инфекциям, имеющие допуск к работе с ПБА II - IV групп на основании приказа руководителя учреждения.
Инженерно-технический персонал, дезинфекторы и санитарки проходят специальную подготовку по месту работы в соответствии с должностными обязанностями.
Специалисты, осуществляющие деятельность, связанную с использованием возбудителей инфекционных болезней, должны повышать квалификацию не реже одного раза в 5 лет и иметь сертификат специалиста.
Необходимый уровень подготовки специалистов с высшим медицинским (биологическим) образованием и средним медицинским образованием, повышение их квалификации по лабораторной диагностике холеры представлен в прилож. 1.
Требования к знаниям и умениям специалистов лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии», выполняющих бактериологические исследования на холеру, приведены в прилож. 2.
Требования к обеспечению безопасности работы персонала
Каждая лаборатория должна иметь пакет документов, определяющих режим безопасной работы сотрудников с учетом характера работ, особенностей технологии, свойств микроорганизмов. Документы должны быть согласованы с комиссией по контролю требований биологической безопасности, специалистами по охране труда, противопожарным мероприятиям и утверждены руководителем учреждения. Результаты проверок знаний правил техники безопасности персонала при проведении работ фиксируются в специальном журнале.
Все сотрудники должны выполнять требования по обеспечению безопасности работы с материалом, подозрительным и зараженным возбудителями инфекционных болезней II - IV групп патогенности (опасности), в соответствии с действующими нормативными документами.
Порядок организации внутреннего контроля качества лабораторных исследований
Контроль качества диагностических исследований на холеру в лабораториях ООИ ФБУЗ «Центр гигиены и эпидемиологии» включает:
· контроль качества питательных сред, диагностических препаратов и тест-систем, эталонных штаммов, дисков с антибактериальными препаратами, дистиллированной воды, дезинфицирующих средств, химических реактивов;
· контроль эффективности мембранных фильтров;
· своевременную поверку средств измерений, аттестацию испытательного оборудования;
· контроль качества стерильности фильтровальных установок, лабораторной посуды;
· контроль качества стерилизации паровых и суховоздушных стерилизаторов;
· контроль работы бактерицидных ламп;
· контроль температурного режима работы холодильников и термостатов;
· проверку состояния воздуха производственных помещений и боксов, температурного режима, влажности;
· проверку санитарного состояния помещений, включая условия уборки, дезинфекции, контроль смывов с поверхностей и оборудования.
Результаты контроля фиксируют в специальных журналах.
Правила ведения документации
Ведение лабораторной документации, включая регистрационные и рабочие журналы, осуществляют в соответствии с требованиями действующих нормативно-методических документов.
Требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру
Для проведения диагностических исследований на холеру в лабораториях должны быть в наличии:
· питательные среды, зарегистрированные в установленном порядке (прилож. 3, 8);
· диагностические препараты, тест-системы, антибактериальные препараты, зарегистрированные в установленном порядке (прилож. 4, 7, 8);
· химические реактивы (прилож. 5);
· приборы, оборудование, расходные материалы (прилож. 6).
5.3.2.2. Номенклатура и объем исследований
Лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии» в субъектах Российской Федерации, проводят:
· исследование материала от больных и умерших с подозрением на холеру;
· профилактические исследования материала от лиц, подлежащих обследованию на холеру в соответствии с требованиями эпиднадзора (по согласованию);
· исследования проб из объектов окружающей среды;
· идентификацию культур холерных вибрионов по полной схеме с определением эпидемической значимости в ПЦР по наличию генов ctxA и tcpA и антибиотикограммы диско-диффузионным методом;
· контроль качества питательных сред.
5.3.2.3. Порядок диагностических исследований на холеру в лабораториях особо опасных инфекций ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации
Порядок исследования клинического материала осуществляется в соответствии с изложенным в п. 5.2.3.1.
Порядок бактериологического анализа на холеру проб из объектов окружающей среды соответствует п. 5.2.3.2.
В порядок бактериологического исследования на холеру (клинического материала и проб из объектов окружающей среды) дополнительно включены тесты идентификации культур холерных вибрионов, выделенных на различных этапах, а также культур, поступивших из ЛПУ и филиалов ФБУЗ:
· изучение культуральных, морфологических свойств и подвижности микробных клеток;
· определение типа расщепления глюкозы (тест Хью-Лейфсона);
· определение ферментации углеводов и многоатомных спиртов (сахарозы, маннозы, арабинозы и маннита);
· определение декарбоксилазной и дигидролазной активности по отношению к аминокислотам (аргинин, лизин, орнитин);
· постановка развернутой реакции агглютинации с холерными агглютинирующими сыворотками O1, Инаба, Огава, RO и реакции слайд-агглютинации с холерной сывороткой O139 серогруппы;
· оценка эпидемической значимости культуры комплексным методом - по гемолитической активности в пробе Грейга, чувствительности к холерным эльтор фагам ctx+ и ctx- (кроме холерных вибрионов O139), в ПЦР на наличие генов ctxA и tcpA, в реакции объемной агломерации с полимерным антилипазным иммуноглобулиновым диагностикумом (РАО);
· определение принадлежности к биовару холерных вибрионов O1 серогруппы (определение чувствительности к диагностическим бактериофагам классическому и эльтор, постановка реакции гемагглютинации с куриными эритроцитами, определение чувствительности к 50 ед./мл полимиксина В, постановка реакции Фогес-Проскауэра);
· определение чувствительности к антибиотикам диско-диффузионным методом;
· ИХ-тест на определение O1 серогруппы (при положительном результате - ИХ-тест на определение серовара Инаба, Огава) или O139 серогруппы.
5.3.2.4. Оформление результатов исследования
Регистрация результатов анализа в лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии» производится по учетным формам в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
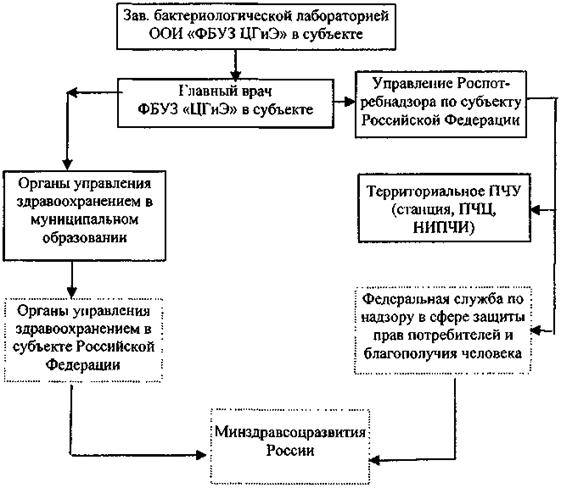
5.3.2.5. Порядок взаимодействия лабораторий особо опасных инфекций ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации с учреждениями Роспотребнадзора
Информация о выделенных или идентифицированных культурах холерного вибриона передается в соответствии со схемой выдачи результатов исследований на холеру (прилож. 11) и направляется в Референс-центр по мониторингу за холерой.
Культуры холерного вибриона, выделенные от людей, из объектов окружающей среды и идентифицированные в лаборатории ООИ ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации направляют в Региональный центр по мониторингу за возбудителями инфекционных болезней I - II групп патогенности или Центр индикации и диагностики возбудителей опасных инфекционных болезней (региональное противочумное учреждение). Срок доставки эпидемически значимых культур - не более 5 суток, остальные культуры доставляются не позднее одного месяца. Передачу и транспортирование осуществляют в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
6. Порядок организации и проведения лабораторной диагностики холеры для лабораторий регионального уровня
6.1. Порядок организации и проведения лабораторной диагностики холеры для лабораторий Региональных центров по мониторингу за возбудителями инфекционных и паразитарных болезней II - IV групп патогенности в федеральных округах
Лаборатории Региональных центров по мониторингу за возбудителями инфекционных и паразитарных болезней II - IV групп патогенности осуществляют:
· диагностические исследования материала от больных и умерших с подозрением на холеру;
· профилактические исследования материала от лиц, подлежащих обследованию на холеру в соответствии с требованиями эпидемиологического надзора (по согласованию);
· исследования проб из объектов окружающей среды в соответствии с требованиями эпидемиологического надзора;
· идентификацию культур холерных вибрионов по полной схеме;
· контроль качества питательных сред.
Порядок организации и проведения лабораторной диагностики холеры для лабораторий Региональных центров по мониторингу за возбудителями инфекционных и паразитарных болезней II - IV групп патогенности в федеральных округах соответствует п. 5.3.2. «Порядок организации и проведения лабораторной диагностики холеры для лабораторий особо опасных инфекций ФБУЗ «Центр гигиены и эпидемиологии» в субъекте Российской Федерации.
Культуры холерных вибрионов O1 и O139 серогрупп, выделенные от людей, из объектов окружающей среды и идентифицированные в лаборатории Региональных центров по мониторингу за возбудителями инфекционных и паразитарных болезней II - IV групп патогенности передают в Региональный центр по мониторингу за возбудителями инфекционных болезней I - II групп патогенности или Центр индикации и диагностики возбудителей опасных инфекционных болезней (региональное противочумное учреждение). Срок доставки эпидемически значимых культур - не более 5 суток, остальные культуры доставляются не позднее одного месяца. Передачу и транспортирование осуществляют в соответствии с действующими СП по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
6.2. Порядок организации и проведения лабораторной диагностики холеры для лабораторий Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней
6.2.1. Требования к лабораториям Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней
Наличие разрешительных и регламентирующих работу документов
Учреждения, на базе которых функционируют Региональные центры по мониторингу за возбудителями инфекционных и паразитарных болезней I - II групп патогенности и Центры индикации и диагностики возбудителей опасных инфекционных болезней, должны иметь лицензию на деятельность, связанную с использованием возбудителей I - II групп патогенности (опасности).
Лаборатории Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней должны иметь санитарно-эпидемиологическое заключение о возможности проведения работ с микроорганизмами I - II групп патогенности (опасности) в соответствии с действующими санитарными правилами о порядке выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности).
Лаборатории Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней должны быть аккредитованы на техническую компетентность в установленном порядке в соответствии с действующей законодательной базой Российской Федерации.
Учет, хранение, передача и транспортирование выделенных культур холерных вибрионов должны осуществляться в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
Утилизация отходов должна осуществляться в соответствии с действующими санитарными правилами по санитарно-эпидемиологическим требованиям к обращению с медицинскими отходами.
Проведение исследований на всех этапах: отбор проб, их хранение, доставка в лабораторию, регистрация, порядок исследования, выдача результатов, взаимодействие с учреждениями Роспотребнадзора должны соответствовать требованиям действующих нормативных и распорядительных документов.
Требования к специалистам и персоналу, участвующим в выполнении исследований на холеру
Исследования на холеру могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим образованием, окончившие курсы первичной специализации по ООИ по специальности «Бактериология», имеющие допуск к работе с ПБА I - II групп на основании приказа руководителя учреждения.
Инженерно-технический персонал и дезинфекторы проходят специальную подготовку по месту работы в соответствии с должностными обязанностями.
Специалисты, осуществляющие деятельность, связанную с использованием возбудителей инфекционных заболеваний, должны повышать квалификацию не реже одного раза в 5 лет и иметь сертификат специалиста.
Необходимый уровень подготовки специалистов с высшим медицинским (биологическим) образованием и средним медицинским образованием, повышение их квалификации по лабораторной диагностике холеры представлен в прилож. 1.
Требования к обеспечению безопасности работы персонала
Каждая лаборатория должна иметь пакет документов, определяющих режим безопасной работы сотрудников с учетом характера работ, особенностей технологии, свойств микроорганизмов. Документы должны быть согласованы с комиссией по контролю соблюдения требований биологической безопасности, специалистами по охране труда, противопожарным мероприятиям и утверждены руководителем учреждения. Результаты проверок знаний правил техники безопасности персонала при проведении работ фиксируются в специальном журнале.
Все сотрудники должны выполнять требования по обеспечению безопасности работы с материалом, подозрительным или зараженным возбудителями инфекционных болезней I - II групп патогенности (опасности) в соответствии с действующими нормативными документами.
Порядок организации внутреннего контроля качества лабораторных исследований
Контроль качества диагностических исследований на холеру в лабораториях Региональных центров по мониторингу за возбудителями инфекционных и паразитарных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней включает:
· контроль качества питательных сред, диагностических препаратов и тест-систем, эталонных штаммов, дисков с антибактериальными препаратами, дистиллированной воды, дезинфицирующих средств, химических реактивов;
· контроль эффективности мембранных фильтров;
· своевременную поверку средств измерений, аттестацию испытательного оборудования;
· контроль качества стерильности фильтровальных установок, лабораторной посуды;
· контроль качества стерилизации паровых и суховоздушных стерилизаторов;
· контроль работы бактерицидных ламп;
· контроль температурного режима работы холодильников и термостатов;
· проверку состояния воздуха производственных помещений и боксов, температурного режима, влажности;
· проверку санитарного состояния помещений, включая условия уборки, дезинфекции, контроля смывов с поверхностей и оборудования.
Результаты контроля фиксируют в специальных журналах.
Правила ведения документации
Ведение лабораторной документации, включая регистрационные и рабочие журналы, осуществляют в соответствии с требованиями действующих нормативно-методических документов.
Требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру
Для проведения диагностических исследований на холеру в лабораториях должны быть в наличии:
· питательные среды, зарегистрированные в установленном порядке (прилож. 3, 8);
· диагностические препараты, тест-системы, антибактериальные препараты, зарегистрированные в установленном порядке (прилож. 4, 7, 8);
· химические реактивы (прилож. 5);
· приборы, оборудование, расходные материалы (прилож. 6).
6.2.2. Номенклатура и объем исследований
Лаборатории Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней проводят:
· исследования материала от больных и умерших с подозрением на холеру;
· исследования проб из объектов окружающей среды;
· идентификацию культур холерных вибрионов, выделенных в прикреплённых субъектах, по полной схеме с определением эпидемиологической значимости;
· определение чувствительности холерных вибрионов к антибактериальным препаратам;
· серологическое обследование больных холерой, вибриононосителей и других контингентов населения - по эпидпоказаниям;
· проверку качества питательных сред и ингибиторов сопутствующей микрофлоры.
6.2.3. Порядок диагностических исследований на холеру в лабораториях Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней
Порядок исследования клинического материала и проб из объектов окружающей среды соответствует п. 5.2.3.
Идентификация культур холерных вибрионов осуществляется по полной схеме, изложенной в действующих методических указаниях по лабораторной диагностике холеры.
В порядок бактериологического исследования на холеру дополнительно включены исследования сывороток крови больных (переболевших) холерой, вибриононосителей, а также других контингентов населения (по эпидпоказаниям) на наличие агглютининов и вибриоцидных антител.
При определении агглютининов в сыворотке крови ставят:
· реакцию агглютинации с живыми культурами холерных вибрионов, выделенных от больных (вибриононосителей) в очаге в макро- или микрообъеме.
При определении вибриоцидных антител в сыворотке крови ставят:
· реакцию вибриоцидных антител (РВА) на основе чашечного метода (Finkelstein);
· РВА на основе ферментации углеводов.
6.2.4. Оформление результатов исследования
Регистрация результатов анализа в лаборатории Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней производится по учетным формам в соответствии с действующими методическими указаниями по лабораторной диагностике холеры.
6.2.5. Порядок взаимодействия лабораторий Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и Центров индикации и диагностики возбудителей опасных инфекционных болезней с учреждениями Роспотребнадзора
Информация о выделенных и/или идентифицированных культурах холерного вибриона передается в соответствии с действующей нормативной документацией и направляется в Референс-центр по мониторингу за холерой и в Национальный Центр верификации диагностической деятельности Роспотребнадзора, осуществляющий функцию Государственной коллекции возбудителей особо опасных бактериальных инфекций I - II групп патогенности.
Штаммы холерных вибрионов, выделенные от людей, из объектов окружающей среды, идентифицированные в лабораториях Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности и в Центрах индикации и диагностики опасных инфекционных болезней, направляют в Референс-центр по мониторингу за холерой.
Срок доставки эпидемически значимых культур - не более 5 суток, остальные культуры доставляются не позднее одного месяца. Передачу и транспортирование осуществляют в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
7. Порядок организации и проведения лабораторной диагностики холеры для лабораторий федерального уровня
7.1. Порядок организации и проведения лабораторной диагностики холеры для Референс-центра по мониторингу за холерой
7.1.1. Требования к лабораториям Референс-центра по мониторингу за холерой
Наличие разрешительных и регламентирующих работу документов
Учреждение, на базе которого функционирует Референс-центр по мониторингу за холерой должно иметь лицензию на деятельность, связанную с использованием возбудителей I - II групп патогенности (опасности).
Лаборатории Референс-центра по мониторингу за холерой должны иметь санитарно-эпидемиологические заключения о возможности проведения работ с микроорганизмами I - II групп патогенности (опасности) в соответствии с действующими санитарными правилами о порядке выдачи санитарно-эпидемиологического заключения о возможности проведения работ с возбудителями инфекционных заболеваний человека I - IV групп патогенности (опасности).
Лаборатории Референс-центра по мониторингу за холерой должны быть аккредитованы на техническую компетентность в установленном порядке в соответствии с действующей законодательной базой Российской Федерации.
Учет, хранение, передача и транспортирование выделенных подозрительных культур холерных вибрионов должны осуществляться в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
Утилизация отходов должна осуществляться в соответствии с действующими санитарными правилами по санитарно-эпидемиологическим требованиям к обращению с медицинскими отходами.
Проведение исследований на всех этапах: отбор проб, их хранение, доставка в лабораторию, регистрация, порядок исследования, выдача
результатов, взаимодействие с учреждениями Роспотребнадзора должны соответствовать требованиям действующих нормативных и распорядительных документов.
Требования к специалистам и персоналу, участвующим в выполнении исследований на холеру
Исследования на холеру могут выполнять специалисты не моложе 18 лет с высшим и средним медицинским, биологическим образованием, окончившие курсы первичной специализации по ООИ по специальности «Бактериология», имеющие допуск к работе с ПБА I - II групп на основании приказа руководителя учреждения.
Инженерно-технический персонал, дезинфекторы и санитарки проходят специальную подготовку по месту работы в соответствии с должностными обязанностями.
Специалисты, осуществляющие деятельность, связанную с использованием возбудителей инфекционных заболеваний, должны повышать квалификацию не реже одного раза в 5 лет и иметь сертификат специалиста.
Необходимый уровень подготовки специалистов с высшим медицинским (биологическим) образованием и средним медицинским образованием, повышение их квалификации по лабораторной диагностике холеры представлен в прилож. 1.
Требования к обеспечению безопасности работы персонала
Каждая лаборатория должна иметь пакет документов, определяющих режим безопасной работы сотрудников с учетом характера работ, особенностей технологии, свойств микроорганизмов. Документы должны быть согласованы с комиссией по контролю соблюдения требований биологической безопасности, специалистами по охране труда, противопожарным мероприятиям и утверждены руководителем учреждения. Результаты проверок знаний правил техники безопасности персонала при проведении работ фиксируются в специальном журнале.
Все сотрудники должны выполнять требования по обеспечению безопасности работы с материалом, подозрительным или зараженным возбудителями инфекционных болезней I - II групп патогенности (опасности) в соответствии с действующими нормативными документами.
Порядок организации внутреннего контроля качества лабораторных исследований
Контроль качества диагностических исследований на холеру в лабораториях Референс-центра по мониторингу за холерой включает:
· контроль качества питательных сред, диагностических препаратов и тест-систем, эталонных штаммов, дисков с антибактериальными препаратами, дистиллированной воды, дезинфицирующих средств, химических реактивов;
· контроль эффективности мембранных фильтров;
· своевременную поверку средств измерений, аттестацию испытательного оборудования;
· контроль качества стерильности фильтровальных установок, лабораторной посуды;
· контроль качества стерилизации паровых и суховоздушных стерилизаторов;
· контроль температурного режима работы холодильников и термостатов;
· контроль работы бактерицидных ламп;
· проверку состояния воздуха производственных помещений и боксов, температурного режима, влажности;
· проверку санитарного состояния помещений, включая условия уборки, дезинфекции, контроля смывов с поверхностей и оборудования.
Результаты контроля фиксируют в специальных журналах.
Правила ведения документации
Ведение лабораторной документации, включая регистрационные и рабочие журналы, осуществляют в соответствии с требованиями действующих нормативно-методических документов.
Требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру
Для проведения диагностических исследований на холеру в лабораториях должны быть в наличии:
· питательные среды, зарегистрированные в установленном порядке и экспериментальные серии (прилож. 3, 8);
· диагностические препараты, тест-системы, антибактериальные препараты, зарегистрированные в установленном порядке и экспериментальные серии (прилож. 4, 7, 8);
· химические реактивы (прилож. 5);
· приборы, оборудование, расходные материалы (прилож. 6).
7.1.2. Номенклатура и объем исследований
Лаборатории Референс-центра по мониторингу за холерой:
· проводят полную идентификацию и изучение биологических, молекулярно-биологических, биохимических свойств возбудителей холеры, в т.ч. культур с атипичными свойствами и вновь выявленных холерных вибрионов, явившихся причиной эпидемической вспышки;
· определяют чувствительность холерных вибрионов к антибактериальным препаратам, изучают механизмы резистентности;
· проводят серологическое обследование больных холерой, вибриононосителей и других контингентов населения - по эпидпоказаниям;
· проводят исследование клинического материала и проб окружающей среды - по эпидпоказаниям.
7.1.3. Организация и обеспечение диагностической деятельности при мониторинге за холерой
Материалом для исследования служат культуры холерных вибрионов, в т.ч. культуры с атипичными свойствами, выделенные в лабораториях территориального и регионального уровней; вновь выявленные холерные вибрионы, явившиеся причиной вспышки; клинический материал, сыворотки крови больных холерой, вибриононосителей и других контингентов - по эпидпоказаниям.
При исследовании культур возбудителей холеры, в том числе культур с атипичными свойствами и вновь выявленных холерных вибрионов, явившихся причиной вспышки, используют биологические и современные высокотехнологичные методы бактериологического, иммуносерологического и молекулярно-генетического анализа, а также серологические методы при исследовании сывороток крови больных холерой, вибриононосителей и других контингентов населения, обследуемых по эпидемическим показаниям.
Порядок исследования клинического материала, проб из объектов окружающей среды на холеру соответствует п. 5.2.3.
Идентификация поступивших культур осуществляется по полной схеме:
· изучение морфологии микробных клеток;
· определение подвижности выделенной культуры в препарате висячей или раздавленной капли с последующим просмотром препаратов под микроскопом с фазово-контрастным устройством;
· определение наличия индофенолоксидазы;
· исследование методом флюоресцирующих антител;
· определение типа расщепления глюкозы в среде Хью-Лейфсона;
· определение способности ферментировать углеводы и многоатомные спирты;
· определение декарбоксилазной и дигидролазной активности по отношению к отдельным аминокислотам (лизин, аргинин, орнитин);
· постановка развернутой реакции агглютинации с холерными агглютинирующими сыворотками O1, Инаба, Огава, RO и реакции слайд-агглютинации с холерной сывороткой O139 серогруппы;
· определение биовара холерных вибрионов O1 серогруппы (определение чувствительности к диагностическим бактериофагам классическому и эльтор, постановка гемагглютинации с куриными эритроцитами, определение чувствительности к 50 ед./мл полимиксина В, постановка реакции Фогес-Проскауэра);
· определение эпидемической значимости культуры комплексным методом: по гемолитической активности в пробе Грейга, чувствительности к холерным эльтор ctx+ и ctx- фагам (кроме холерных вибрионов O139 серогруппы), в ПЦР на наличие генов ctxА и tcpA, по определению холерогенности на модели кроликов-сосунков, по результатам реакции объёмной аггломерации с использованием полимерного иммуноглобулинового антилипазного диагностикума (РАО);
· определение чувствительности к антибиотикам (диско-диффузионным методом, методом серийных разведений в агаре и бульоне);
· постановка дополнительных тестов, определяющих принадлежность к роду Vibrio и виду Vibrio cholerae или другим видам патогенных вибрионов (определение протеолитических свойств; выявление Анастатической активности; определение образования индола; определение образования сероводорода; выявление способности к биолюминисценции; определение галофильности вибрионов; определение способности вибрионов к росту при различных температурах; определение образования нитратредуктазы; определение образования β-галактазидазы).
Расширенная характеристика культур с помощью молекулярно-биологических методов: по генам, ассоциированным с вирулентностью, проведение секвинирования, рестрикции, ген-амплификации, VNTR-типирование.
При идентификации культур холерных вибрионов с атипичными свойствами использование дополнительных серологических, иммунологических, биохимических и других методов для подтверждения принадлежности культур к роду Vibrio и виду Vibrio cholerae:
· ПЦР с использованием дополнительных специфических праймеров;
· реакции агглютинации с кроличьими холерными агглютинирующими сыворотками;
· реакции слайд-агглютинации с использованием моноклональных антител;
· реакции преципитации в геле;
· адсорбции агглютининов по Кастеллани;
· реакции агглютинации с убитыми кипячением культурами
Применение серологических методов исследования в соответствии с действующими нормативными документами. В сыворотках больных холерой, вибриононосителей и других контингентов населения, обследуемых по эпидпоказаниям, выявляют агглютинины, вибриоцидные антитела.
При определении агглютининов в сыворотке крови ставят:
· реакцию агглютинации с живыми культурами холерных вибрионов, выделенных от больных (вибриононосителей) в очаге в макро- или микрообъеме.
При определении вибриоцидных антител в сыворотке крови ставят:
· реакцию вибриоцидных антител (РВА) на основе чашечного метода (Finkelstein);
· РВА на основе ферментации углеводов.
Возможно применение препаратов, предназначенных для серологической диагностики.
7.1.4. Порядок взаимодействия лабораторий Референс-центра по мониторингу за холерой с учреждениями Роспотребнадзора
Информация о выделенных и/или идентифицированных культурах холерного вибриона передается в соответствии с действующими нормативными документами и направляется в Центр верификации диагностической деятельности Роспотребнадзора, осуществляющий функцию Государственной коллекции возбудителей особо опасных бактериальных инфекций I - II групп патогенности.
Культуры холерного вибриона, идентифицированные в лабораториях Референс-центра по мониторингу за холерой, передают в Национальный Центр верификации диагностической деятельности Роспотребнадзора, осуществляющий функцию Государственной коллекции возбудителей особо опасных бактериальных инфекций I - II групп патогенности.
Передачу и транспортирование осуществляют в соответствии с действующими санитарными правилами по порядку учета, хранения, передачи и транспортирования микроорганизмов I - IV групп патогенности.
7.2. Порядок и организация лабораторной диагностики холеры Национального Центра верификации диагностической деятельности
7.2.1. Требования к лабораториям Национального Центра верификации диагностической деятельности
Наличие разрешительных и регламентирующих работу документов, требования к специалистам и персоналу, участвующим в выполнении исследований на холеру, требования к обеспечению безопасности работы персонала, порядок организации внутреннего контроля лабораторных исследований, правила ведения документации и требования к материальным ресурсам, необходимым для выполнения диагностических исследований на холеру, аналогичны п. 7.1.1.
7.2.2. Номенклатура и объем исследований
Лаборатории Национального Центра верификации диагностической деятельности проводят:
· верификацию результатов диагностики холеры и идентификации культур, полученных из Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности, Центров индикации и диагностики опасных инфекционных болезней Роспотребнадзора, Референс-центра по мониторингу за холерой;
· выполняют диагностические исследования материала от больных холерой и умерших от этого заболевания - по эпидпоказаниям;
· осуществляют хранение коллекционных штаммов, охраноспособное и авторское депонирование.
7.2.3. Организация и обеспечение диагностической деятельности
Порядок исследования клинического материала, проб из объектов окружающей среды на холеру соответствует п. 5.2.3.
Идентификацию культур осуществляют по полной схеме, дополнительно проводят:
· секвенирование фрагментов генов 16S - 23S рДНК и других видоспецифичных локусов;
· определение генотипов штаммов холерных вибрионов.
На основании результатов расширенной характеристики штаммов холерных вибрионов составляют паспорта на штаммы, хранящиеся в Национальном Центре верификации диагностической деятельности, осуществляющем функции Государственной коллекции.
7.2.4. Порядок взаимодействия лабораторий Национального Центра верификации диагностической деятельности с учреждениями Роспотребнадзора
Национальный Центр верификации диагностической деятельности Роспотребнадзора направляет результаты проведенных исследований в Региональные центры по мониторингу за возбудителями инфекционных болезней I - II групп патогенности, Центры индикации и диагностики возбудителей опасных инфекционных болезней, Референс-центр по мониторингу за холерой.
Приложение 1
|
№ п/п |
Перечень бактериологических лабораторий с учетом уровней |
Уровни подготовки |
|||||||
|
профессиональная переподготовка в противочумных учреждениях (не менее 500 ч) |
повышение квалификации по ООИ (72 - 500 ч) |
другие виды подготовки (семинары по лабораторной диагностике холеры) |
рабочие места в лаборатории или отделе особо опасных инфекций |
||||||
|
врачи |
лаборанты |
врачи |
лаборанты |
врачи |
лаборанты |
врачи |
лаборанты |
||
|
Территориальный уровень |
|||||||||
|
1 |
ЛПУ |
- |
- |
± |
± |
+ |
+ |
+ |
+ |
|
2 |
Филиалы ФБУЗ ЦГиЭ |
- |
- |
± |
± |
+ |
+ |
+ |
+ |
|
3 |
ФБУЗ ЦГиЭ без лаборатории ООЧ |
- |
- |
± |
± |
+ |
+ |
+ |
+ |
|
4 |
ФБУЗ ЦГиЭ с лабораториями ООЧ |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
Региональный уровень |
|||||||||
|
5 |
Региональные центры по мониторингу II - IV групп патогенности |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
6 |
Региональные центры по мониторингу I - II групп патогенности |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
7 |
Центры индикации и диагностики |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
Федеральный уровень |
|||||||||
|
8 |
Референс-центр по мониторингу за холерой |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
9 |
Национальный Центр верификации |
+ |
+ |
+ |
+ |
± |
± |
- |
- |
|
«+» Обязательный уровень подготовки. «-» Подготовка для такого уровня не требуется. «±» Подготовка для такого уровня рекомендуется |
|||||||||
Приложение 2
Требования к профессиональным навыкам специалистов, осуществляющих лабораторную диагностику холеры
1. Требования к знаниям и умениям специалистов лечебно-профилактических учреждений, выполняющих бактериологические исследования на холеру
1.1. Врачи-бактериологи и биологи должны знать:
· основные положения эпидемиологического надзора за холерой, в том числе в части, касающейся обследования больных на холеру;
· нормативные документы, регламентирующие проведение исследований на холеру;
· требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителями III - IV групп патогенности, а также требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителем холеры;
· этапы подготовительной работы (подготовка питательных сред, диагностических препаратов, реактивов);
· требования к доставке клинического материала, регистрации, его хранению, уничтожению;
· порядок исследования материала в условиях односменной и круглосуточной работы лаборатории;
· порядок исследования материала в зависимости от времени отбора и доставки его в лабораторию;
· этапы лабораторного исследования на холеру;
· методы ускоренной диагностики холеры;
· культуральные, морфологические, иммуносерологические и биохимические свойства холерных вибрионов;
· сроки выдачи предварительного положительного результата исследования;
· правила и сроки передачи выделенных (подозрительных) культур.
1.2. Врачи-бактериологи и биологи должны уметь выполнять диагностическое исследование клинического материала на холеру:
· отбирать колонии со щелочного агара и среды TCBS с характерным для вибрионов ростом;
· выполнять микроскопию мазков, окрашенных по Граму, на всех этапах исследования;
· определять индофенолоксидазу;
· ставить с подозрительными на холерный вибрион колониями реакцию слайд-агглютинации с холерными сыворотками O1, Огава, Инаба, RO и O139 и учитывать результаты;
· выполнять микроскопию и оценку результатов мазков, обработанных флюоресцирующими иммуноглобулинами (МФА);
· выполнять реакцию иммобилизации вибрионов (РИВ) под влиянием специфических холерных сывороток;
· вести необходимую документацию.
1.3. Лаборанты, медицинские лабораторные техники и медицинские технологи должны знать:
· правила работы с материалом, подозрительным на зараженность возбудителями III - IV групп патогенности;
· этапы подготовительной работы (подготовку посуды, питательных сред, диагностических препаратов, реактивов;
· этапы лабораторного исследования на холеру;
· культуральные, морфологические свойства холерных вибрионов, отношение вибрионов к углеводам в полиуглеводных средах.
1.4. Лаборанты, медицинские лабораторные техники и медицинские технологи должны уметь:
· готовить к работе необходимые питательные среды (прилож. 3);
· готовить ингредиенты для окраски мазков по Граму;
· готовить разведения сывороток для постановки реакции слайд-агглютинации и иммунофлюоресценции;
· выполнять первичные посевы исследуемого материала и пересевы со сред обогащения;
· готовить мазки, фиксировать их, окрашивать по Граму, а также флюоресцирующими иммуноглобулинами;
· ставить пробу на индофенолоксидазу;
· проводить с подозрительными на холерный вибрион колониями реакцию слайд-агглютинации с холерными сыворотками O1, Огава, Инаба, RO и O139;
· ставить реакцию иммобилизации с холерными сыворотками;
· готовить отработанный материал для автоклавирования.
2. Требования к знаниям и умениям специалистов ФБУЗ «ЦГиЭ» и их филиалов, выполняющих бактериологические исследования на холеру
2.1. Врачи-бактериологи и биологи должны знать:
· основные положения эпидемиологического надзора за холерой, в т.ч. в части, касающейся сроков, объёмов и контингентов, подлежащих обследованию на холеру, сроков, объёмов и вида исследуемых проб из объектов окружающей среды;
· нормативные документы, регламентирующие проведение исследований на холеру;
· требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителями III - IV групп патогенности, а также требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителем холеры;
· этапы подготовительной работы (подготовка питательных сред, диагностических препаратов, реактивов);
· требования к доставке клинического материала и проб из объектов внешней среды, регистрации, хранению, уничтожению;
· порядок исследования материала в условиях односменной и круглосуточной работы лаборатории;
· порядок исследования материала в зависимости от времени отбора и доставки его в лабораторию;
· этапы лабораторного исследования на холеру;
· методы ускоренной диагностики холеры;
· культуральные, морфологические, иммуносерологические и биохимические свойства холерных вибрионов;
· сроки выдачи предварительного положительного результата исследования;
· правила и сроки передачи выделенных (подозрительных) культур.
2.2. Врачи-бактериологи и биологи должны уметь выполнять диагностическое исследование клинического материала на холеру:
· отбирать колонии со щелочного агара и среды TCBS с характерным для вибрионов ростом;
· выполнять микроскопию мазков, окрашенных по Граму, на всех этапах исследования;
· определять индофенолоксидазу;
· ставить с подозрительными на холерный вибрион колониями реакцию слайд-агглютинации с холерными сыворотками O1, Огава, Инаба, RО и O139;
· выполнять микроскопию и оценку результатов мазков, обработанных флюоресцирующими иммуноглобулинами (МФА);
· выполнять реакцию иммобилизации вибрионов (РИВ) под влиянием специфических холерных сывороток;
· вести необходимую документацию.
2.3. Лаборанты, медицинские лабораторные техники и медицинские технологи должны знать:
· правила работы с материалом, подозрительным на зараженность возбудителями III - IV групп патогенности;
· этапы подготовительной работы (подготовку посуды, питательных сред, диагностических препаратов, реактивов;
· этапы лабораторного исследования на холеру;
· культуральные, морфологические свойства холерных вибрионов, отношение вибрионов к углеводам в полиуглеводных средах.
2.4. Лаборанты, медицинские лабораторные техники и медицинские технологи должны уметь:
· осуществлять отбор проб воды из поверхностных водоёмов, сточных вод и других объектов окружающей среды;
· готовить к работе необходимые питательные среды (прилож. 3);
· готовить ингредиенты для окраски мазков по Граму;
· готовить разведения сывороток для постановки реакции слайд-агглютинации и иммунофлюоресценции (при наличии люминесцентного микроскопа);
· выполнять первичные посевы исследуемого материала и пересевы со сред обогащения;
· готовить мазки, фиксировать их, окрашивать по Граму, а также флюоресцирующими иммуноглобулинами;
· ставить пробу на индофенолоксидазу;
· проводить с подозрительными на холерный вибрион колониями реакцию слайд-агглютинации с холерными сыворотками O1, Огава, Инаба, RO и O139;
· ставить реакцию иммобилизации с холерными сыворотками;
· готовить отработанный материал для автоклавирования.
3. Требования к знаниям и умениям специалистов лабораторий ООИ ФБУЗ «ЦГиЭ», выполняющих бактериологические исследования на холеру
3.1. Врачи-бактериологи и биологи должны знать:
· основные положения эпидемиологического надзора за холерой, в том числе в части, касающейся обследования больных на холеру;
· нормативные документы, регламентирующие проведение исследований на холеру;
· требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителями II - IV групп патогенности, а также требования биологической безопасности при работе с материалом, подозрительным на зараженность возбудителем холеры;
· этапы подготовительной работы (подготовка питательных сред, диагностических препаратов, реактивов);
· требования к доставке клинического материала, регистрации, его хранению, уничтожению;
· порядок исследования материала в условиях односменной и круглосуточной работы лаборатории;
· порядок исследования материала в зависимости от времени отбора и доставки его в лабораторию;
· этапы лабораторного исследования на холеру;
· методы ускоренной диагностики холеры;
· культуральные, морфологические, иммуносерологические и биохимические свойства холерных вибрионов;
· сроки выдачи предварительного положительного результата исследования;
· правила и сроки передачи выделенных (подозрительных) культур;
· методы контроля качества питательных сред и ингибиторов посторонней микрофлоры;
· методы определения чувствительности к диагностическим фагам классическому и эльтор, холерным эльтор фагам ctx+ и ctx-;
· методы оценки эпидемической значимости холерных вибрионов;
· методы определения антибиотикочувствительности холерных вибрионов.
3.2. Врачи-бактериологи и биологи должны уметь выполнять диагностическое исследование материала на холеру:
· проводить исследование материала от больных и умерших с подозрением на холеру, от лиц, подлежащих бактериологическому обследованию на холеру, проб воды из стационарных и других точек отбора и других объектов окружающей среды, предусмотренных действующими санитарными правилами;
· идентифицировать выделенные культуры холерных вибрионов O1 и O139 серогрупп по сокращенной и полной схеме с определением эпидзначимости холерных вибрионов по наличию генов ctxА и tcpA, гемолитической активности и чувствительности к фагам ctx+ и ctx-;
· определять антибиотикочувствительность выделенных культур;
· устанавливать таксономическую принадлежность холерных вибрионов не О1/не O139 серогрупп и других представителей рода Vibrio и семейства Vibrionaceae;
· вести необходимую документацию.
3.3. Лаборанты, медицинские лабораторные техники и медицинские технологи должны знать:
· правила работы с материалом, подозрительным на зараженность возбудителями III - IV групп патогенности;
· этапы подготовительной работы (подготовку посуды, питательных сред, диагностических препаратов, реактивов;
· этапы лабораторного исследования на холеру;
· культуральные, морфологические и антигенные свойства холерных вибрионов, отношение вибрионов к углеводам в полиуглеводных средах;
· методы полной и сокращенной идентификации холерных вибрионов O1 и O139 серогрупп;
· методы идентификации культур холерных вибрионов не O1/не O139 серогрупп и других представителей рода Vibrio и семейства Vibrionaceae;
· методы определения качества питательных сред и ингибиторов роста посторонней микрофлоры.
3.4. Лаборанты, медицинские лабораторные техники и медицинские технологи должны уметь:
· готовить к работе необходимые питательные среды (прилож. 3);
· готовить ингредиенты для окраски мазков по Граму;
· готовить разведения сывороток для постановки реакции слайд-агглютинации и иммунофлюоресценции (при наличии люминесцентного микроскопа);
· выполнять первичные посевы исследуемого материала и пересевы со сред обогащения;
· готовить мазки, фиксировать их, окрашивать по Граму, а также флюоресцирующими иммуноглобулинами;
· ставить пробу на индофенолоксидазу;
· проводить с подозрительными на холерный вибрион колониями реакцию слайд-агглютинации и объемную реакцию агглютинации с холерными сыворотками O1, Огава, Инаба, RO и O139;
· ставить реакцию иммобилизации с холерными сыворотками;
· готовить отработанный материал для автоклавирования.
4. Требования к знаниям и умениям специалистов Региональных центров по мониторингу за возбудителями инфекционных болезней I - II групп патогенности, Центров индикации и диагностики возбудителей опасных инфекционных болезней, Референс-центра по мониторингу за холерой и Национального Центра верификации диагностической деятельности, выполняющих бактериологические исследования на холеру
4.1. Врачи-бактериологи и биологи должны знать:
· основные положения эпидемиологического надзора за холерой;
· вопросы организации лабораторных исследований на холеру;
· требования биологической безопасности при работе с зараженным и подозрительным на заражение микроорганизмами II группы патогенности материалом;
· таксономию и классификацию представителей семейства Vibrionaceae;
· морфологические, культуральные, биохимические свойства холерных вибрионов;
· серологические методы изучения свойств холерных вибрионов;
· определение чувствительности к диагностическим фагам классическому и эльтор, холерным фагам эльтор ctx+ и ctx-;
· методы определения эпидемической значимости холерных вибрионов;
· определение чувствительности к антибиотикам, химиопрепаратам и дезинфектантам;
· этапы лабораторного исследования на холеру, сроки выдачи ответов, правила и сроки передачи выделенных культур;
· требования к доставке материала, его хранению, регистрации, уничтожению, подготовке к передаче и транспортированию;
· этапы подготовительной работы (подготовку питательных сред для выделения и идентификации холерных вибрионов, диагностических препаратов, реактивов);
· методы серологической диагностики холеры у людей;
· критерии оценки качества питательных сред, используемых для диагностики холеры, ингибиторов посторонней микрофлоры;
· нормативные документы, используемые при проведении лабораторных исследований на холеру.
4.2. Врачи-бактериологи и биологи должны уметь:
· провести полное исследование по схеме лабораторной диагностики холеры материала от больных и умерших с подозрением на холеру, проб из объектов окружающей среды;
· идентифицировать выделенные культуры холерных вибрионов O1 и O139 серогрупп по сокращенной и полной схеме;
· определить эпидемическую значимость культур;
· определить чувствительность к антибиотикам выделенных культур;
· провести серологическую диагностику материала от больных холерой, вибриононосителей и других контингентов - по эпидпоказаниям;
· установить таксономическую принадлежность холерных вибрионов не O1/не O139 серогрупп и других представителей рода Vibrio и семейства Vibrionaceae;
· осуществлять контроль качества питательных сред и ингибиторов посторонней микрофлоры;
· вести необходимую документацию.
4.3. Лаборанты, медицинские лабораторные техники и медицинские технологи должны знать:
· морфологические, культуральные и основные биохимические свойства холерных вибрионов;
· этапы лабораторного исследования на холеру;
· методы полной и сокращенной идентификации холерных вибрионов O1 и O139 серогрупп;
· методы идентификации культур холерных вибрионов не O1/не O139 серогрупп и других представителей рода Vibrio и семейства Vibrionaceae;
· методы серологической диагностики холеры;
· правила работы с материалом, зараженным или подозрительным та заражение возбудителем холеры;
· этапы подготовительной работы (подготовка посуды, красок, питательных сред для выделения и идентификации холерных вибрионов, диагностических препаратов, реактивов);
· методы определения качества питательных сред и ингибиторов посторонней микрофлоры.
4.4. Лаборанты, медицинские лабораторные техники и медицинские технологи должны уметь:
· приготовить или подготовить к работе питательные среды для выделения и идентификации холерных вибрионов (прилож. 3);
· приготовить основные ингредиенты для окраски мазков по Граму;
· приготовить реактивы для постановки пробы на оксидазу, выявления образования ацетилметилкарбинола, индола, сероводорода, нитратредуктазы, β-галактозидазы;
· подготовить разведения сывороток для постановки слайд- и развернутой реакции агглютинации и иммунофлуоресценции;
· произвести первичные посевы и пересевы поступившего материала;
· сделать мазки, зафиксировать их и окрасить;
· поставить пробу на индофенолоксидазу;
· поставить слайд- и развернутую реакцию агглютинации с холерными сыворотками;
· поставить реакцию иммобилизации с холерными сыворотками;
· провести определение качества питательных сред и теллурита калия;
· подготовить отработанный материал для автоклавирования;
· участвовать:
![]() в
идентификации выделенной культуры по полной и сокращенной схеме;
в
идентификации выделенной культуры по полной и сокращенной схеме;
![]() в
определении эпидемической значимости выделенной культуры по регламентированным
для этих лабораторий тестам;
в
определении эпидемической значимости выделенной культуры по регламентированным
для этих лабораторий тестам;
![]() в
определении антибиотикочувствительности выделенных культур;
в
определении антибиотикочувствительности выделенных культур;
![]() в
исследовании сывороток крови больных холерой и вибриононосителей в системе
серологических реакций.
в
исследовании сывороток крови больных холерой и вибриононосителей в системе
серологических реакций.