Федеральная служба по надзору в сфере защиты прав
потребителей
и благополучия человека
Сборник
методических документов, необходимых
для обеспечения применения
Федерального закона от 12 июня 2008 г. № 88-ФЗ
«Технический регламент на молоко
и молочную продукцию»
Часть 3
В сборник включены методические документы, содержащие правила и методы исследований (испытаний) и измерений, а также правила отбора образцов для проведения исследований (испытаний) и измерений, в соответствии с постановлением Главного государственного санитарного врача Российской Федерации Г.Г. Онищенко от 08.12.2008 № 67.
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств
левомицетина (Хлорамфеникола,
Хлормицетина) в продуктах животного
происхождения методом высокоэффективной
жидкостной хроматографии и
иммуноферментного анализа
Методические
указания
МУК 4.1.1912-04
1. Разработаны: ГУ НИИ питания РАМН (В.А. Тутельян, С.А. Хотимченко, С.А. Шевелева, В.К. Кирничная, Т.В. Киселева, Н.Г. Орлова, Н.Р. Ефимочкина, Н.В. Барбер), Московским государственным университетом им. М.В. Ломоносова (А.М. Егоров, А.Ю. Колосова, Ж.В. Самсонова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Минздрава России.
3. Утверждены Главным государственным санитарным врачом Российской Федерации, Первым заместителем Министра здравоохранения Российской Федерации Г.Г. Онищенко 6 марта 2004 г.
4. Введены в действие 1 мая 2004 г.
5. Введены впервые.
|
УТВЕРЖДАЮ Главный государственный санитарный врач Российской Федерации, Первый заместитель Министра здравоохранения Российской Федерации Г.Г. Онищенко 6 марта 2004 г. Дата введения: 1 мая 2004 г.
|
4.3. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение
остаточных количеств левомицетина
(Хлорамфеникола, Хлормицетина) в продуктах
животного происхождения методом
высокоэффективной жидкостной хроматографии
и иммуноферментного анализа
Методические указания
МУК 4.1.1912-04
1. Назначение и область применения
Настоящие методические указания предназначены для учреждений госсанэпидслужбы Минздрава РФ и других ведомств, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов в соответствии с СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов».
Методические указания распространяются на методы с различным целевым назначением (арбитраж, скрининг). Два метода определения остаточных количеств левомицетина (хлорамфеникола, хлормицетина) в продуктах животного происхождения:
I - высокоэффективной жидкостной хроматографии (ВЭЖХ);
II - иммуноферментного анализа (ИФА).
2. Общие положения
Среди ряда веществ, которые могут контаминировать продовольственное сырье и пищевые продукты, важное место занимают ветеринарные препараты, используемые как для лечения животных, так и в качестве стимуляторов роста. Сильнодействующими лекарственными препаратами, используемыми в ветеринарии, остаются антибиотики. Известно большое число антибиотиков, обладающих различными свойствами, механизмом и спектром действия, распределением в организме животных, характером метаболизма и т.д.
Систематическое поступление в организм человека антибиотиков с продуктами питания крайне вредно, поскольку они могут оказывать нежелательные эффекты, чаще всего в виде возникновения аллергических реакций, дисбактериозов, подавлять активность некоторых ферментов, изменять микрофлору кишечника, способствовать распространению устойчивых форм микроорганизмов и т.д. Следует учитывать возможность отрицательного влияния антибиотиков в сырье для пищевой промышленности на проведение ряда технологических процессов в переработке мяса, рыбы, молока (в частности, при получении кисломолочных продуктов) и других продуктов. Кроме того, наличие антибиотиков может затруднять бактериологические исследования качества продуктов животного происхождения.
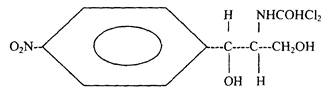
Хлорамфеникол (далее - ХАФ) является антибиотиком широкого спектра действия, обладающим высокой активностью в отношении бактерий и риккетсий. В отличие от многих антибиотиков ХАФ обладает довольно простым химическим строением.
Формула хлорамфеникола
|
|
М.в. 323,13 |
Хлорамфеникол малорастворим в воде, но хорошо в спирте. Установлено, что ХАФ медленно выводится из организма животных и сравнительно долго сохраняет свою активность при хранении продуктов.
В настоящее время для определения ХАФ в продуктах питания применяют ряд методов, в их числе микробиологические методы, которые являются сравнительно простыми и дешевыми, однако отличаются недостаточной специфичностью и воспроизводимостью результатов.
Для арбитражных исследований вводятся хроматографические методы, в частности ВЭЖХ, позволяющий раздельно определять как ХАФ, так и его метаболиты.
Количественный метод определения ХАФ при помощи высокоэффективной жидкостной хроматографии в сельскохозяйственных продуктах, отличается низким пределом обнаружения (0,01 мг/кг), хорошей воспроизводимостью (относительное стандартное отклонение 0,15 - 0,21) и надежностью.
Для скрининговых целей в мире широко применяют методы иммунохимического анализа, обеспечивающие высокую чувствительность, специфичность и точность. Для контроля пищевой продукции предпочтение отдается методам твердофазного иммуноферментного анализа, которые являются высокочувствительными (предел обнаружения - 0,00008 мг/кг).
Методические указания предназначены для учреждений госсанэпидслужбы Минздрава РФ и других ведомств, осуществляющих контроль качества и безопасности продовольственного сырья и пищевых продуктов. Согласно СанПиН 2.3.2.1078-01 содержание левомицетина в продуктах животного происхождения не допускается.
3. Отбор и подготовка проб
Отбор и подготовка проб аналогичен для обоих методов исследования.
Отбор продуктов питания осуществляется в соответствии с требованиями ГОСТов на исследуемые продукты: ГОСТ 7269-79 «Мясо», ГОСТ 7202.0-74 «Мясо птицы». ГОСТ 3622-68 «Молоко и молочные продукты».
Отобранные образцы продуктов герметично упаковывают в полиэтиленовые мешки, стеклянные банки с притертыми крышками или укладывают в коробки. Образцы доставляют в лабораторию для анализа сразу же после отбора проб или, в случае необходимости, хранят на холоде, а для скоропортящихся продуктов осуществляют замораживание -4 - -10 °С, используя для этой цели холодильники или соответствующие приспособления.
К исследованию скоропортящихся образцов следует приступать в день их доставки в лабораторию. При отсутствии такой возможности образцы должны хранить при указанной выше температуре не более двух недель со времени отбора среднего образца.
4. Определение остаточных количеств левомицетина (Хлорамфеникола, Хлормицетина) в продуктах животного происхождения методом высокоэффективной жидкостной хроматографии
4.1. Принцип метода
Метод основан на извлечении хлорамфеникола экстракцией этилацетатом, последовательной промывке экстракта разбавленным раствором щелочи и кислоты, обезжиривании петролейным эфиром и хроматографическом разделении с помощью высокоэффективной жидкостной хроматографии в обращенно-фазном варианте.
4.2. Аппаратура, материалы, реактивы
|
Жидкостный хроматограф с УФ детектором, длина волны 278 нм, любой марки |
|
|
Колонка с обращенной фазой (ODS, С18) длина 25 см, диаметр 4,6 мм, диаметр сорбента 5 мкм |
|
|
Гомогенизатор тканей |
ГОСТ 15906 |
|
Центрифуга настольная или аналогичная |
ТУ 5.375-4261 |
|
Ротационный испаритель с ловушкой |
ТУ 25-11-917 |
|
Азот, поверочный нулевой газ |
|
|
Весы технические |
ГОСТ 19491 |
|
Весы аналитические |
ГОСТ 24104-88Е |
|
Цилиндры мерные, объемом 50 и 100 см3 |
|
|
Колбы плоскодонные на 50 и 100 см3 с НШ № 14,5 |
ТУ 48-52 |
|
Колбы мерные на 25, 50 и 100 см3 |
|
|
Пипетки 1,0, 2,0, 5 и 10 см3 |
|
|
Колбы для упаривания с круглым или коническим дном на 50 и 100 см3 с НШ № 14,5 |
|
|
Воронка делительная на 100 см3 |
ГОСТ 2536 |
|
Натрий серно-кислый, безводный |
|
|
Этилацетат, хч |
ГОСТ 5.1070 |
|
Натрий хлористый, насыщенный раствор в воде |
|
|
Гидроокись натрия, хч |
|
|
10 %-ный раствор щелочи (NaOH, КОН) |
|
|
Уксусная кислота |
|
|
10 %-ный раствор уксусной кислоты |
|
|
Серная кислота |
|
|
Калий фосфорно-кислый однозамещенный 0,025 М раствор КН2РO4 |
ТУ 6-09-5324-87 |
|
Ацетонитрил |
ТУ 6-09-3534 |
|
Петролейный эфир, фракция 40 - 70 °С |
|
|
Метанол (спирт метиловый) |
|
|
Дециламин, импорт. |
|
|
Вода дистиллированная |
|
|
Левомицетина сукцинат растворимый |
|
4.3. Требования техники безопасности при проведении испытаний
Помещение, в котором проводится определение хлорамфеникола, должно быть оборудовано приточно-вытяжной вентиляцией. Все операции анализа необходимо проводить в вытяжном шкафу с использованием индивидуальных средств защиты.
4.4. Подготовка к испытанию
4.4.1. Приготовление растворов
Взвешивают 25 мг левомицетина, помещают в мерную колбу на 25 см3 и растворяют в метаноле, концентрация левомицетина 1 мг/мл. В мерную колбу на 25 см3 помещают 0,25 см3 полученного раствора и разбавляют метанолом до метки. Концентрация левомицетина в стандартном растворе 10 нг/мкл.
4.5. Проведение испытания методом ВЭЖХ
4.5.1. Подготовка образца для определения левомицетина в молоке
Смешивают 25 см3 молока с 12 г безводного сульфата натрия и экстрагируют (3 раза по 15 см3 этилацетата). Полученную смесь центрифугируют 15 мин со скоростью 4000 об./мин и декантируют. Этилацетатный слой промывают последовательно 5 см3 насыщенного раствора NaCl с добавлением в него 0,2 см3 10 % NaOH; 5 см3 насыщенного раствора NaCl с добавлением 0,2 см3 10 % СН3СООН; 5 см3 насыщенного раствора NaCl. Органический слой отбирают и упаривают на ротационном испарителе (при 50 °С) до возможно минимального объема, отдувают азотом до исчезновения запаха органических растворителей, добавляют 3 см3 смеси ацетонитрил-вода (1:4) и экстрагируют 3 раза по 5 см3 петролейным эфиром. Петролейный эфир отбрасывают и извлекают левомицетин экстракцией этилацетатом (3 раза по 5 см3). Этилацетатный слой упаривают досуха, растворяют в 0,1 см3 метанола.
4.5.2. Подготовка образца для определения левомицетина в мясе
Гомогенизируют 10 г мяса с 15 см3 фосфатного буфера (0,025 М КН2РO4 + 0,025 М Na2HPO4) pH = 6,88 и экстрагируют 3 раза по 30 см3 этилацетата. Полученную взвесь центрифугируют 15 мин при 4000 об./мин и декантируют этилацетатный слой, промывают последовательно 5 см3 насыщенного раствора NaCl с добавлением 0,2 мл 10 %-ного NaOH; 5 мл насыщенного раствора NaCl с добавлением 0,2 мл 10 %-ного СН3СООН и 5 см3 насыщенного раствора NaCl. Органический слой отбирают и упаривают на ротационном испарителе (при 50 °С) до возможно минимального объема, отдувают азотом до исчезновения запаха органических растворителей, добавляют 3 см3 смеси ацетонитрил-вода (1:4) и экстрагируют 3 раза по 5 см3 петролейного эфира, петролейный эфир отбрасывают и извлекают левомицетин экстракцией этилацетатом (3 раза по 5 см3). Этилацетатный слой упаривают досуха, растворяют в 0,1 см3 метанола.
4.5.3. Подготовка образца для определения левомицетина в яйцах
Перетирают 10 г гомогената яйца с 5 г Na2SO4 приливают 40 см3 этилацетата и 5 см3 1Н H2SO4 перемешивают и центрифугируют 5 - 10 мин при 4000 об./мин, этилацетатный слой декантируют, водную часть экстрагируют последовательно 30 и 20 см3 этилацетата, при необходимости применяя центрифугирование для расслоения. Объединенные этилацетатные слои промывают последовательно 10 см3 2-процентного раствора Nа2СО3 насыщенного NaCl; 10 см3 насыщенного раствором NaCl.
4.6. Условия хроматографирования (ВЭЖХ)
В жидкостной хроматограф с колонкой (Ультрасфер ODS, С18) 5 мкм (250×4,6 мм), УФ детектором при λ = 278 нм, используя элюент ацетонитрил-вода-дециламин (40:60:0,1), вводят 5 мкл стандартного раствора (10 нг/мкл) левомицетина. В тех же условиях вводят метанольный экстракт образца (молока, мяса, яиц).
4.7. Подтверждение наличия левомицетина в образцах
Для подтверждения наличия левомицетина к 50 мкл метанольного экстракта приливают 50 мкл 10 %-ного раствора КОН и нагревают 20 мин при 70 °С, 10 мкл полученного раствора вводят в тех же условиях в колонку жидкостного хроматографа. На полученной хроматограмме пик с временем удерживания левомицетина отсутствует. Это подтверждает наличие левомицетина в образце.
4.8. Обработка результатов
4.8.1. За окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до второго десятичного знака.
Метрологические характеристики метода определения хлорамфеникола в продуктах питания животного происхождения (молоке, мясе, яйцах)
|
Статистический параметр |
Соединение - хлорамфеникол |
|
Нижний предел определения, мг/кг |
0,01 |
|
Интервал надежного определения, мг/кг |
0,01 - 10,0 |
|
Среднее значение открываемости (показатель правильности), % |
95,5 |
|
Допустимое расхождение между результатами двух параллельных определений хлорамфеникола, полученными в одной лаборатории в одной серии измерений (сходимость), при Р = 0,95 %, не должно превышать, % |
7,0 |
|
Допустимое расхождение между результатами двух параллельных определений хлорамфеникола, выполненных в двух разных лабораториях (воспроизводимость), при Р = 0,95 % не должно превышать по отношению к среднему, % |
10,0 |
4.8.2. Если расхождение результатов двух параллельных определений (сходимость и воспроизводимость) превышает требования по п. 4.8.1, то повторно проводят два новых параллельных определения.
5. Определение хлорамфеникола (левомицетина) в продуктах животного происхождения (молоке, мясе, яйцах) методом иммуноферментного анализа
5.1. Принцип метода ИФА
В основу метода количественного определения ХАФ в продуктах питания положен принцип твердофазного конкурентного ИФА на полистироловых планшетах. Принцип метода основан на конкуренции свободного ХАФ из измеряемой пробы и ХАФ, предварительно иммобилизованного на твердой фазе в составе белкового конъюгата, за центры связывания специфичных к ХАФ антител. После отделения несвязавшихся реагентов количество антител, прореагировавших с иммобилизованным антигеном, определяют с помощью антивидовых антител, меченых пероксидазой хрена. Количество связавшегося с антителами конъюгата вторичных антител выявляют с помощью субстрат-хромогенной смеси. Количество определяемого антибиотика, содержащегося в исследуемом образце, обратно пропорционально регистрируемой оптической плотности продукта ферментативной реакции.
Пределы обнаружения метода - 0,000012 - 0,00008 мг/кг.
5.2. Аппаратура, материалы, реактивы
|
Фотометр планшетный вертикального сканирования, с фильтрами, соответствующими длине волны 492 или 450 нм «Униплан», «Пикон», «Мультискан» или иного типа с теми же характеристиками |
|
|
Дозаторы пипеточные автоматические с переменным объемом 0,002 - 0,02 см3, 0,02 - 0,2 см3, 0,1 - 1 см3 одноканальные «Ленпипет», «Термолабсистемс» или иные тех же объемов |
|
|
Дозаторы пипеточные автоматические 8-канальные с переменным объемом 0,05 - 0,3 см3 «Ленпипет», «Термолабсистемс» или иные тех же объемов |
|
|
Наконечники для автоматических пипеток объемом 0,3 и 1,0 см3 однократного применения |
|
|
Анализатор, потенциометрический, погрешность измерений pH ± 0,01 или pH-метр или другие марки с аналогичными характеристиками |
|
|
Весы аналитические 120 г/0,001 мг |
|
|
Весы лабораторные общего назначения, 2 класса точности, до 200 г/0,1 г |
|
|
Термостат, позволяющий поддерживать рабочую температуру 37 °С с отклонением от заданной ± 1 °С, не более |
ТУ 64-1-1382-72 |
|
Гомогенизатор лабораторный перистальтический типа «Стомайкер», «Микс-2» или других наименований |
|
|
Аквадистиллятор, обеспечивающий качество дистиллированной воды |
|
|
Холодильник бытовой электрический |
|
|
Стаканы химические и колбы мерные, вместимостью 25, 50, 200 и 500 см3 |
|
|
Часы механические сигнальные |
|
|
Центрифуга настольная со скоростью не менее 4000 об./мин (3000 g) или иного типа |
ТУ 5.375-4261 |
|
Цилиндры мерные, вместимостью 25 см3 |
|
|
Шейкер лабораторный для пробирок типа «Вортекс» |
|
|
Микроиспаритель лабораторный одноканальный моделей ПЭ-2300, «Мини-Вак» или других аналогичного назначения |
|
|
Насос (компрессор) мембранный РКадет, РКадмирал или иных моделей аналогичного назначения |
|
|
Аппарат универсальный для встряхивания |
ТУ 64-1-2451-78 |
|
Набор реагентов для количественного определения хлорамфеникола (левомицетина) методом иммуноферментного анализа типа «ИФА-ХАФ» (производства ЗАО «НВО Иммунотех») или другие с аналогичными характеристиками |
|
|
Набор реагентов для количественного определения хлорамфеникола (левомицетина) типа «Ридаскрин Левомицетин» (производства «Р-Биофарм АГ») или другие с аналогичными характеристиками |
|
|
Калий железистосинеродистый (желтая кровяная соль), хч |
|
|
Цинка сульфат, хч |
|
|
Этилацетат, хч |
ГОСТ 5.1070 |
|
Хлороформ технический |
ГОСТ 2-15-76-72 |
|
Изооктан, хч |
|
5.3. Характеристика наборов для иммуноферментного определения левомицетина (хлорамфеникола)
5.3.1. Состав набора ИФА-ХАФ:
|
• планшет 96-луночный полистироловый, покрытый конъюгатом ХАФ-овальбумин |
1 шт.; |
|
• раствор ХАФ в метаноле концентрацией 1 мг/см3 |
1 фл.; |
|
• антитела против ХАФ в 1 %-ном растворе сахарозы, лиофилизированные |
1 фл.; |
|
• конъюгат вторичных антител с пероксидазой из корня хрена |
1 фл.; |
|
• фосфатно-солевой буфер, приготовленный на основе одно- и двухзамещенного фосфата калия с добавлением твин-20, pH 7,0 ± 0,5, концентрированный |
2 фл.; |
|
• буфер для анализа образцов молока, приготовленный с добавлением казеина и азида натрия, концентрированный - буфер 1 |
1 фл.; |
|
• субстратный буфер, приготовленный на основе лимонной кислоты, натриевой соли лимонной кислоты и перекиси водорода, pH 4,9 ± 0,3, концентрированный |
1 фл.; |
|
• о-фенилендиамин (хромоген), по 6 мг |
1 табл.; |
|
• серная кислота (стоп-реагент), 25 % |
1 фл. |
5.3.2. Состав набора «Ридаскрин Левомицетин»
Микротитровальный планшет на 96 лунок (12 стрипов по 8 лунок), сенсибилизированных антителами «захвата» - 1 шт.
Комплект стандартных растворов левомицетина со следующими концентрациями: 0; 0,5; 1,5; 4,5; 13,5; 40,5 нг/см3 буферном растворе по 1,3 мл - 6 шт.
Конъюгат левомицетина с пероксидазой - 0,7 см3.
Антитела к левомицетину - 0,7 см3.
Субстрат, содержит пероксид карбамида - 7 см3.
Хромоген, содержит тетраметилбензидин - 7 см3.
Стоп-реагент, содержит 1 N серную кислоту - 14 см3.
Буфер 1, для разбавления стандартных растворов левомицетина, конъюгата, антител, растворов образцов и буфера 2 - 100 см3.
Буфер 2, для разбавления стандартных образцов при анализе молока - 1 см3.
Наборы рассчитаны на проведение анализа в 2-х повторностях 41 исследуемых образцов и 6 калибровочных проб (всего 96 определений на один планшет).
5.3.3. Аналитические характеристики наборов
5.3.3.1. Набор ИФА-ХАФ
Специфичность. Использование высоко аффинных антител к ХАФ обеспечивает высокую специфичность анализа. Процент перекрестной реакции с сукцинатом ХАФ составляет 25 %, с дезацилированным ХАФ, являющимся одним из метаболитов антибиотика, - менее 1 %, с антибиотиками других групп - менее 1 %.
Чувствительность. Минимальная концентрация ХАФ, определяемая с помощью набора, составляет 0,00008 мг/кг (дм3).
Воспроизводимость. Коэффициент вариации результатов определений концентраций ХАФ с помощью набора не превышает 12 %.
Тест на открытие. Процент открытия составляет 70 - 130 %.
Линейность. Линейность составляет 90 - 110 %.
Диапазон определяемых концентраций 0,0001 - 0,1мг/кг (дм3).
Проверка набора. При параллельном определении концентрации хлорамфеникола в продуктах питания животного происхождения с помощью набора ИФА-ХАФ и метода ВЭЖХ коэффициент корреляции составляет 0,975.
5.3.3.2. Набор «Ридаскрин Левомицетин»
Чувствительность (пределы обнаружения) - 0,000012 - 0,00005 мг/кг(дм3).
Извлекаемость - > 80 %.
Перекрестная чувствительность: левомицетин - 100 %, левомицетин основной - 0,5 %, тиамфеникол - менее 0,05 %. Нет чувствительности к тетрациклинам, гентамицину, ампициллину и флорфениколу.
5.4. Требования техники безопасности при проведении испытаний
Все компоненты наборов, за исключением о-фенилендиамина, в используемых концентрациях не токсичны. О-Фенилендиамин обладает канцерогенным действием. Поэтому в случае попадания веществ на кожные или слизистые покровы следует немедленно тщательно смыть его большим количеством воды. Стоп-реагент содержит в своем составе серную кислоту. Следует избегать контакта стоп-реагента с кожей.
5.5. Проведение испытаний с применением набора ИФА-ХАФ
Все разведения реагентов и расчеты представлены для проведения анализа на 1 планшете.
Построение калибровочной кривой необходимо проводить для каждого планшета.
5.5.1. Приготовление реагентов
5.5.1.1. Приготовление фосфатно-солевого буфера, содержащего детергент (ФСБТ)
Содержимое двух флаконов с фосфатно-солевым буферным раствором количественно перенести в стакан и довести общий объем раствора до 400 см3 дистиллированной водой. Полученный буфер может храниться закрытым в течение 5 дней при температуре не выше 2 - 8 °С.
5.5.1.2. Приготовление буфера 1
Содержимое флакона с концентратом буфера количественно перенести в стакан и довести общий объем раствора до 50 см3 ФСБТ. Полученный буфер может храниться в течение 5 дней при температуре 2 - 8 °С.
5.5.1.3. Приготовление образцов для анализа
Молоко. Пробу молока развести перед анализом в 100 раз буфером 1.
Мясо. Встряхивают 3 г измельченной ткани (фарша) с 6 см3 этил-ацетата в течение 5 мин, затем центрифугируют в течение 10 мин. Упаривают досуха 1 см3 верхней фазы. Осадок перемешивают с 3 см3 ФСБТ и центрифугируют при 3000 g в течение 5 мин. Супернатант отбирают и разводят в 50 раз ФСБТ.
Яйца. Взвешивают по 3 г смешанного (гомогенизированного) содержимого яйца в реакционную посуду и проводят дальнейшую пробоподготовку, как описано для образцов мяса.
5.5.1.4. Приготовление калибровочных проб (КП)
Калибровочные пробы готовятся заново при каждом определении.
Молоко. Калибровочные пробы готовятся из стандартного раствора ХАФ в метаноле (1 мг/см3) по следующей схеме.
1. Приготовить 5 см3 раствора ХАФ в ФСБТ с концентрацией 0,01 мг/см3 (5 см3 раствора содержат 0,05 см3 стандартного раствора ХАФ в метаноле).
2. Приготовить 1 см3 калибровочной пробы 6 (КП 6) в буфере 1 с концентрацией 100 нг/см3 (1 см3 раствора содержит 0,01 см3 раствора, приготовленного на стадии 1).
3. Последующие калибровочные пробы готовят по схеме из КП 6 с использованием буфера 1:
|
№№ |
Концентрация ХАФ, нг/см3 |
Общий объем калибровочной пробы, см3 |
Объем КП 6, содержащийся в соответствующей калибровочной пробе, см3 |
|
КП 1 |
0 |
1,0 |
0 |
|
КП 2 |
0,1 |
0,5 |
0,1 см3 из КП 3 |
|
КП 3 |
0,5 |
1,0 |
0,005 |
|
КП 4 |
2 |
1,0 |
0,02 |
|
КП 5 |
10 |
1,0 |
0,1 |
Мясо (яйца). Калибровочные пробы готовятся из стандартного раствора ХАФ в метаноле (1 мг/см3) по вышеприведенной схеме. На всех стадиях используется буфер ФСБТ.
5.5.1.5. Приготовление рабочего раствора антител
Рабочий раствор антител готовится непосредственно перед использованием.
Содержимое одного флакона с лиофилизированными антителами растворить в 6 см3 ФСБТ. Полученный раствор хранению не подлежит.
5.5.1.6. Приготовление рабочего раствора конъюгата
Рабочий раствор конъюгата готовится непосредственно перед использованием.
Содержимое одного флакона с конъюгатом количественно перенести в стакан и довести общий объем до 15 см3 ФСБТ - при анализе образцов молока и до 30 см3 - при анализе образцов мяса и яиц. Полученный раствор хранению не подлежит.
5.5.1.7. Приготовление субстратно-хромогенной смеси
Субстратно-хромогенную смесь готовят непосредственно перед использованием.
Для приготовления раствора применять только химически чистую посуду.
В 11,25 см3 дистиллированной воды растворить 1 таблетку о-фенилендиамина, тщательно перемешивая и избегая попаданий света. К полученному раствору количественно добавить 1,25 см3 концентрата субстратного буферного раствора. Субстратно-хромогенная смесь, подготовленная к работе, хранению не подлежит.
5.5.2. Процедура анализа
Внесение реагентов следует проводить согласно схеме:
|
|
1 |
2 |
3 |
4 |
|
12 |
|
A |
КП 1 |
КП 1 |
П 3 |
П 3 |
|
П |
|
B |
КП 2 |
КП 2 |
П 4 |
П 4 |
|
П |
|
C |
КП 3 |
КП 3 |
П 5 |
П 5 |
|
П |
|
D |
КП 4 |
КП 4 |
П 6 |
П 6 |
|
П |
|
E |
КП 5 |
КП 5 |
П 7 |
П 7 |
|
П |
|
F |
КП 6 |
КП 6 |
П 8 |
П 8 |
|
П |
|
G |
П 1 |
П 1 |
П 9 |
П 9 |
|
П |
|
H |
П 2 |
П 2 |
П 10 |
П 10 |
|
П |
5.5.2.1. В два ряда лунок планшета внести калибровочные пробы (КП), приготовленные по п. 5.5.1.4, по 0,05 см3, начиная с минимальной концентрации. Рекомендуется не вносить калибровочные пробы в крайние ряды планшета во избежание влияния краевого эффекта. При разнице более 0,1 единицы оптической плотности в результатах параллельных проб на крайних рядах учитывать результат крайнего ряда не следует.
В оставшиеся лунки внести в дубликатах исследуемые образцы в объеме 0,05 см3.
Процедуру внесения образцов следует выполнять как можно быстрее. Вся операция не должна превышать 12 - 15 мин.
5.5.2.2. Во все лунки планшета внести по 0,05 см3 рабочего раствора антител, приготовленного по п. 5.5.1.5. Антитела вносить в лунки планшета в той же последовательности, что и калибровочные пробы и исследуемые образцы.
5.5.2.3. Плотно закрыть планшет крышкой и выдержать при температуре 37 °С в течение 1,5 ч в термостате.
5.5.2.4. Содержимое лунок удалить стряхиванием. Затем провести отмывку. Для этого в каждую лунку планшета внести по 0,35 см3 промывочного буферного раствора, оставить на 1 - 2 мин, а затем удалить содержимое лунок стряхиванием. Процедуру повторить 4 раза. После этого тщательно удалить остатки влаги из лунок, несколько раз вытряхнув планшет о марлевую салфетку или фильтровальную бумагу.
5.5.2.5. Во все лунки планшета внести по 0,1 см3 рабочего раствора конъюгата, приготовленного по п. 5.5.1.6.
5.5.2.6. Плотно закрыть планшет крышкой и выдержать при температуре 37 °С в течение 1 ч в термостате.
5.5.2.7. Содержимое лунок удалить стряхиванием. Затем провести отмывку. Для этого в каждую лунку планшета внести по 0,35 см3 промывочного буферного раствора, оставить на 1 - 2 мин, а затем удалить содержимое лунок стряхиванием. Процедуру повторить 5 раз. После этого тщательно удалить остатки влаги из лунок, несколько раз вытряхнув планшет о марлевую салфетку или фильтровальную бумагу.
5.5.2.8. Во все лунки планшета внести по 0,1 см3 раствора субстратно-хромогенной смеси и выдержать планшет при комнатной температуре 18 - 25 °С в темном месте в течение 30 - 35 мин при анализе образцов молока и 7 - 10 мин - при анализе образцов мяса или яиц.
5.5.2.9. Внести во все лунки планшета по 0,35 см3 стоп-реагента (раствора серной кислоты).
5.5.2.10. Измерить оптическую плотность в лунках планшета при длине волны 490 нм. Окраска планшета стабильна в течение 1 ч в темноте.
5.5.3. Учет результатов
Построить калибровочную кривую зависимости оптической плотности от концентрации ХАФ в калибровочных пробах (следует использовать логарифмический масштаб для оси абсцисс). Соединить кривой (по лекалу) полученные точки. Образец калибровочной кривой приведен ниже.
Рассчитать средние арифметические значения показателей оптической плотности испытуемых образцов и по калибровочной кривой определить в них концентрацию ХАФ, учитывая фактор разбавления, который равен 100, для всех образцов.
5.5.4. Условия хранения и эксплуатации набора
Набор реагентов ИФА-ХАФ должен храниться при температуре 2 - 8 °С в течение всего срока годности. Допускается хранение набора при температуре до 25 °С не более 5 суток. Срок годности набора - 12 мес. Компоненты набора перед использованием необходимо выдержать при комнатной температуре 18 - 25 °С не менее 30 мин. Раствор антител, конъюгата и субстратно-хромогенная смесь хранению не подлежат. Промывочный буферный раствор может храниться после разведения при температуре 2 - 8 °С в течение 5 дней. При вскрытии и растворении лиофилизированных компонентов набора необходимо следить, чтобы на пробках не осталось сухого вещества.
5.6. Проведение испытаний с применением набора «Ридаскрин Левомицетин»
5.6.1. Подготовка проб
Образцы, предназначенные для анализа, должны храниться в холодильнике, в темном месте.
5.6.1.1. Молоко
Пробу молока объемом 5 см3 охладить до 8 °С, перенести в стеклянную центрифужную пробирку, центрифугировать при 4 - 12 °С в течение 15 мин при 3000 g. Удалить верхний слой жира и перенести аликвоту обезжиренного молока в новую чистую пробирку. Для анализа использовать 0,05 см3 раствора на 1 лунку планшета. Фактор разбавления - 1. Предел обнаружения - 0,00005 мг/кг. Предел количественного обнаружения - 0,00015 мг/кг.
Примечание: для приготовления стандартных растворов для измерения проб молока использовать буфер 2.
5.6.1.2. Исследования сухого молока
Приготовить растворы:
• осадителя 1 - 0,36 М раствор ферроцианида (II) калия × 3 Н2O - 1,52 г растворить в 10 см3 дистиллированной воды;
• осадителя 2 - 1,04 М раствор сульфата цинка × 7 Н2O - (2,99 г растворить в 10 см3 дистиллированной воды).
Взвесить в центрифужной стеклянной пробирке 2 г сухого молока, добавить 10 см3 дистиллированной воды и встряхивать пробирку до растворения пробы. Добавить в пробирку по 1 см3 осадителя 1 и осадителя 2. Пробы тщательно перемешать на вортексе, и центрифугировать при 4 - 12 °С в течение 10 мин при 3000 g. Перед центрифугированием пробы охладить до 8 °С, перенести 3,6 см3 супернатанта (что соответствует 0,6 г сухого молока) в чистую пробирку. Добавить в пробирку 6 см3 этилацетата и экстрагировать встряхиванием в течение 10 мин. Центрифугировать при комнатной температуре (20 - 25 °С) в течение 10 мин при 3000 g.
Перенести 4 см3 эфирного экстракта (соответствует 0,4 г сухого молока) в новую чистую пробирку и испарить экстракт досуха при 60 °С в слабом токе азота. Растворить сухой остаток в 0,4 см3 буфера I и тщательно перемешать на вортексе. Для анализа используют 0,05 см3 раствора на 1 лунку планшета.
|
Фактор разбавления |
1 |
|
Предел обнаружения |
0,00005 мг/кг |
|
Предел количественного определения |
0,00015 мг/кг |
5.6.1.3. Мясо
Гомогенизировать пробу массой не менее 100 г в гомогенизаторе. Взвесить в стеклянной центрифужной пробирке 3 г гомогената, смешать с 3 см3 дистиллированной воды и добавить 6 см3 этилацетата. Интенсивно встряхивать пробирку по оси «вверх-вниз» в течение 10 мин. Центрифугировать при комнатной температуре (20 - 25 °С) в течение 10 мин при 3000 g.
Перенести 4 см3 эфирного экстракта (соответствует 2 г пробы) в новую чистую пробирку и испарить экстракт досуха на микроиспарителе при 60 °С в слабом токе азота. Растворить сухой остаток в 1 см3 смеси изооктана с хлороформом в соотношении 2:3 и тщательно перемешать на вортексе. Добавить к раствору 0,5 см3 буфера 1 и интенсивно перемешивать на вортексе в течение 1 мин. Центрифугировать при комнатной температуре (20 - 25 °С) в течение 10 мин при 3000 g или более высоком ускорении.
Для анализа использовать 0,05 см3 раствора (водный верхний слой*) на 1 лунку планшета.
|
Фактор разбавления |
0,1 |
|
Предел обнаружения |
0,0000125 мг/кг |
|
Предел количественного обнаружения |
0,0000375 мг/кг |
__________
* В случае образования пены или геля в межфазовой зоне при недостаточном объеме водной фазы поместить пробирку на 5 мин в водяную баню при температуре 80 °С и затем еще раз центрифугировать
5.6.1.4. Яйца
Гомогенизировать пробу массой не менее 100 г смешанного содержимого яйца в гомогенизаторе. Взвесить в стеклянной центрифужной пробирке 2 г гомогената, смешать с 12 см3 этилацетата. Интенсивно встряхивать пробирку по оси «вверх-вниз» в течение 10 мин. Центрифугировать при комнатной температуре (20 - 25 °С) в течение 10 мин при 3000 g.
Перенести 6 см3 эфирного экстракта (соответствует 1 г пробы) в новую чистую пробирку и испарить экстракт досуха при 60 °С в слабом токе азота. Растворить сухой остаток в 1 см3 смеси изооктана с хлороформом в соотношении 2:3 и тщательно перемешать на вортексе.
Добавить к раствору 1 см3 буфера 1 и интенсивно перемешивать на вортексе в течение одной минуты. Центрифугировать при комнатной температуре (20 - 25 °С) в течение 10 мин при 3000 g или более высоком ускорении.
Для анализа использовать 0,05 см3 раствора (водный верхний слой*) на лунку планшета.
|
Фактор разбавления |
1 |
|
Предел обнаружения |
0,00005 мг/кг |
|
Предел количественного определения |
0,00015 мг/кг |
__________
* В случае образования пены или геля в межфазовой зоне при недостаточном объеме водной фазы поместить пробирку на 5 мин в водяную баню при температуре 80 °С и затем еще раз центрифугировать
5.6.2. Ход анализа
5.6.2.1. Предварительная подготовка
Перед использованием набора довести температуру всех реагентов до комнатной температуры (20 - 25 °С). Немедленно после использования охладить все оставшиеся реагенты до температуры 2 - 8 °С.
В процессе выполнения анализа не допускать высыхания лунок планшета.
На всех стадиях инкубации избегать воздействия прямого солнечного света. При инкубации планшета закрыть его непрозрачным экраном.
5.6.2.2. Приготовление раствора конъюгата
Перед разбавлением концентрированного раствора конъюгата осторожно встряхнуть содержимое флакона. Для приготовления рабочего раствора конъюгата разбавить концентрат конъюгата буферным раствором 1, имеющимся в комплекте набора, в отношении 1:11 (например, смешать 0,2 см3 концентрата конъюгата с 2 мл буфера - данного разведения достаточно для 4-х стрипов по 8 лунок).
5.6.2.3. Приготовление раствора антител
Перед разбавлением концентрата антител осторожно встряхнуть содержимое флакона. Для приготовления рабочего раствора антител разбавить концентрат буферным раствором 1, имеющимся в комплекте набора, в отношении 1:11 (например, смешать 0,2 см3 концентрата антител с 2 см3 буфера 1 - данного разведения достаточно для 4-х стрипов).
5.6.2.4. Приготовление буферного раствора 2 (только для проб молока)
Для приготовления готового буферного раствора 2, использующегося при исследовании проб молока, разбавить концентрат буфера 2 в 9 см3 буферного раствора 1 и энергично перемешать с помощью встряхивателя типа «вортекс», периодически подогревая раствор до 40 °С. Мутность раствора не влияет на результат определения, однако осадок на дне флакона после перемешивания должен равномерно распределяться в объеме раствора.
5.6.2.5. Подготовка микротитровального планшета
Перед выполнением анализа из планшета следует извлечь необходимое количество стрипов.
Остальные стрипы следует тщательно упаковать в фольгированный пакет вместе с осушителем, закрыть застежку пакета и поместить на хранение при температуре 2 - 8 °С.
5.6.2.6. Приготовление стандартных растворов
Для приготовления рабочих стандартных растворов левомицетина концентрированные растворы, входящие в состав набора, следует разбавить буфером 1 (или буфером 2) в указанной пропорции. Для разбавления использовать только стеклянную посуду.
После разбавления тщательно перемешивать готовые растворы.
Для каждой серии исследований следует готовить свежие стандартные растворы.
Стандарт 1:0,05 см3 концентрата 1 + 0,45 см3 буферного раствора 1* 0 нг/дм3
Стандарт 2:0,05 см3 концентрата 2 + 0,45 см3 буферного раствора 1* 50 нг/дм3
Стандарт 3:0,05 см3 концентрата 3 + 0,45 см3 буферного раствора 1* 150 нг/дм3
Стандарт 4:0,05 см3 концентрата 4 + 0,45 см3 буферного раствора 1* 450 нг/дм3
Стандарт 5:0,05 см3 концентрата 5 + 0,45 см3 буферного раствора 1* 1350 нг/дм3
Стандарт 6:0,05 см3 концентрата 6 + 0,45 см3 буферного раствора 1* 4050 нг/дм3
_________
* При исследовании образцов молока для разведения стандартов использовать буферный раствор 2
5.6.3. Процедура анализа
Вставить в рамку планшета стрипы (лунки) в количестве, необходимом для выполнения всех запланированных определений в двух повторностях. Записать координаты лунок, предназначенных для стандартных растворов и подготовленных исследуемых растворов. Пример формы записи приведен на рис. 1.
Рис. 1. Пример формы записи координат лунок перед
выполнением анализа (С - стандарты, П - пробы).
5.6.3.1. Добавить по 0,05 см3 стандартных растворов и растворов исследуемых образцов в соответствующие пары лунок.
5.6.3.2. Добавить по 0,05 см3 разбавленного раствора конъюгата в каждую лунку.
5.6.3.3. Добавить в каждую лунку по 0,05 см3 готового разбавленного раствора антител. Перемешать вручную, избегая попадания смеси в соседние лунки, и оставить на инкубацию в течение 2 ч при комнатной температуре (20 - 25 °С).
5.6.3.4. Вылить жидкость из лунок, перевернуть рамку планшета и выбить капли жидкости, оставшиеся в лунках, путем энергичного троекратного постукивания рамки с лунками по столу, накрытому фильтровальной бумагой. Наполнить лунки 0,25 см3 дистиллированной воды и снова вылить воду. Выбить капли воды, как описано выше. Повторить процедуру промывки лунок водой еще два раза.
5.6.3.5. Добавить по 0,05 см3 раствора субстрата и по 0,05 см3 раствора хромогена в каждую лунку. Перемешать вручную, соблюдая осторожность, и инкубировать при комнатной температуре (20 - 25 °С) в течение 30 мин в темноте.
5.6.3.6. Добавить в каждую лунку по 0,1 см3 раствора стоп-реагента и хорошо перемешать вручную. В течение 60 мин после добавления стоп-реагента измерить оптическую плотность в каждой лунке при 450 нм (нулевое считывание по воздуху).
5.6.4. Определение количества левомицетина в исследованных пробах
Средние значения оптической плотности, измеренной в лунках со стандартными и исследуемыми растворами, делятся на среднее значение оптической плотности, измеренной в лунках с первым (нулевым) стандартом, результат умножается на 100. Таким образом, результат измерения оптической плотности выражается в процентах от оптической плотности лунки с нулевым стандартом, то есть:
![]()
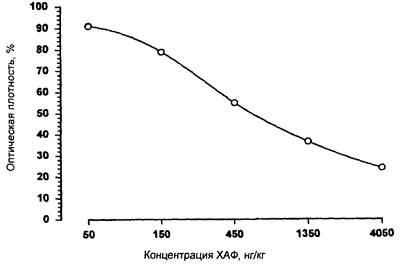
По величинам относительного поглощения, вычисленным для стандартных растворов, и соответствующим значениям концентрации левомицетина в нг/кг строится калибровочная кривая в полулогарифмической системе координат. Калибровочная кривая должна быть почти линейна в диапазоне 50 - 1350 нг/кг (см. рис. 2).
Рис. 2. Калибровочная кривая, полученная для набора
реагентов «Ридаскрин Левомицетин».
Концентрация левомицетина в растворах исследуемых образцов в нг/кг (или нг/дм3) определяется по калибровочной кривой соответственно относительному поглощению, измеренному и вычисленному для этих растворов.
Для того чтобы вычислить концентрацию левомицетина в исследуемой исходной пробе, величину концентрации левомицетина, полученную по калибровочной кривой, следует умножить на соответствующий фактор разбавления (см. п. 5.5.1.1 - 5.5.1.4). Результат исследования выражают в мг/кг или мг/дм3.
При выполнении пробоподготовки по п.п. 5.5.1.3 и 5.5.1.4 холостые пробы могут показывать положительный результат на уровне 2-й стандартной пробы. При расчете концентрации левомицетина в исследуемых пробах рекомендуется учитывать фоновый сигнал с помощью постановки холостого опыта. Для этого в каждой серии анализов необходимо выполнять испарение 4 см3 чистого этилацетата и далее следовать процедуре, описанной в п. 5.5.3. Измеренный фоновый сигнал далее следует вычитать на стадии обработки результатов
5.7. Обработка результатов
5.7.1. 3а окончательный результат измерения принимают среднее арифметическое результатов двух параллельных определений. Окончательный результат округляют до второго десятичного знака.
Метрологические характеристики иммуноферментного метода определения хлорамфеникола в продуктах питания животного происхождения (молоке, мясе, яйцах)
|
Статистический параметр |
Соединение - хлорамфеникол |
|
Нижний предел определения, мг/кг |
0,00008 |
|
Интервал надежного определения, мг/кг |
0,0001 - 10,0 |
|
Среднее значение открываемости (показатель правильности), % |
105 (70 - 140) |
|
Допустимое расхождение между результатами двух параллельных определений хлорамфеникола, полученными в одной лаборатории в одной серии измерений (сходимость), при Р = 0,95 %, не должно превышать, % |
8,0 |
|
Допустимое расхождение между результатами двух параллельных определений хлорамфеникола, выполненных в двух разных лабораториях (воспроизводимость), при Р = 0,95 % не должно превышать по отношению к среднему, % |
10,0 |
5.7.2. Если расхождение результатов двух параллельных определений (сходимость и воспроизводимость) превышает требования по п. 5.6.1, то повторно проводят два новых параллельных определения.
Содержание