ФЕДЕРАЛЬНАЯ СЛУЖБА ПО
ГИДРОМЕТЕОРОЛОГИИ И
МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ (РОСГИДРОМЕТ)
|
РУКОВОДЯЩИЙ ДОКУМЕНТ |
РД 52.24.669-2005 |
УНИФИЦИРОВАННЫЕ МЕТОДЫ
БИОТЕСТИРОВАНИЯ ДЛЯ ОБНАРУЖЕНИЯ
ТОКСИЧЕСКОГО ЗАГРЯЗНЕНИЯ ПОВЕРХНОСТНЫХ
ВОД СУШИ С ИСПОЛЬЗОВАНИЕМ
МИКРОЗООПЛАНКТОНА
Предисловие
1 РАЗРАБОТАН ГУ «ГХИ» Федеральной службы по гидрометеорологии и мониторингу окружающей среды (Росгидромет)
2 РАЗРАБОТЧИКИ А.М. Никаноров, чл.-корр. РАН, руководитель разработки; Е.Н. Бакаева, д-р биол. наук; Н.А. Игнатова.
3 УТВЕРЖДЕН Заместителем Руководителя Росгидромета 13.12.2005 г.
4 ЗАРЕГИСТРИРОВАН ГУ ЦКБ ГМП за номером РД 52.24.669-2005 от 28.12.2005 г.
5 ВВЕДЕН ВПЕРВЫЕ
СОДЕРЖАНИЕ
Введение
Перечень загрязняющих веществ, поступающих в водные объекты от сосредоточенных и рассеянных источников загрязнения в районах с опасными уровнями загрязнения поверхностных вод суши чрезвычайно широк. Он включает в себя различные минеральные и органические вещества во всех возможных формах миграции. Для выявления в водном объекте зон наибольшего загрязнения, определения количественных характеристик их перемещения и т.п. необходим отбор и анализ значительного количества проб поверхностных и сточных вод, а также донных отложений.
В списках наиболее опасных и часто встречающихся в районах интенсивного антропогенного воздействия загрязняющих веществ тяжелые металлы встречаются практически всегда. Причем это характерно не только для металлообрабатывающих, гальванических производств. Мощным источником поступления тяжелых металлов в поверхностные воды являются технологические процессы, связанные со сжиганием угля, автомобильный транспорт, предприятия добывающих отраслей и т.д.
Повышенный интерес природоохранных органов к этому виду загрязнений обусловлен такими важными геоэкологическими свойствами многих из тяжелых металлов как высокая токсичность, канцерогенность, способность к бионакоплению и т.п.
В водной среде металлы присутствуют в трех формах: взвешенные частицы, коллоидные частицы и растворенные соединения. Последние представлены свободными ионами и растворимыми комплексными соединениями с органическими (гуминовые и фульвокислоты) и неорганическими (галогениды, сульфаты, фосфаты, карбонаты) лигандами. Значительная часть тяжелых металлов в поверхностных водах находится во взвешенном состоянии. В районах с интенсивным антропогенным воздействием взвешенные вещества являются, зачастую, основной формой миграции тяжелых металлов. Этот факт необходимо учитывать при гидрохимических исследованиях загрязненности водных объектов с интенсивным уровнем антропогенного воздействия. Реализуется это одновременным определением содержания тяжелых металлов как растворенных в воде, так и сорбированных на взвесях.
Наиболее важным, как при изучении природных процессов, так и при разработке вопросов охраны окружающей среды является определение подвижных форм тяжелых металлов, способных при определенных условиях переходить в растворенное состояние из взвешенных веществ и донных отложений. Решение этой проблемы возможно при использовании надежного химико-аналитического определения загрязняющих ингредиентов во взвешенном состоянии.
Современные химико-аналитические методы характеризуются достаточно высокими показателями времени анализа, трудозатрат, стоимости. Значительное повышение эффективности использования таких методов при решении задач обнаружения опасных уровней загрязнения поверхностных вод суши, особенно таких, как оперативное расследование аварийных ситуаций, может дать сочетание этих методов с простыми методами предварительного выявления незагрязненных проб. Как известно, при любой схеме отбора значительная часть проб воды соответствует незагрязненным участкам водного объекта или незагрязненным объектам. Их можно исключить из трудоемкой, дорогостоящей процедуры химико-аналитического определения в том случае, если есть уверенность отсутствия в них загрязняющих веществ. Реализовать процедуру выявления чистых проб можно с помощью несложных методов биологического тестирования острой токсичности воды исследуемых проб. Целесообразность такого подхода становится еще более очевидной, если учесть тот факт, что биологическое тестирование степени загрязнения природных вод в последние годы стало обязательным во всех развитых странах. Особенно это справедливо для обнаружения и оценки опасных уровней загрязнения поверхностных вод суши, которые могут возникать либо в результате длительного хронического загрязнения, либо в результате аварийного загрязнения водных объектов.
Решение поставленной задачи достигается путем использования биотестов, реагирующих на наличие токсического компонента как в растворенной, так и во взвешенной форме веществ, содержащихся в исследуемой пробе воды с последующим определением подвижных форм тяжелых металлов, как наиболее приоритетных загрязняющих веществ.
РУКОВОДЯЩИЙ ДОКУМЕНТ
|
УНИФИЦИРОВАННЫЕ МЕТОДЫ БИОТЕСТИРОВАНИЯ ДЛЯ
ОБНАРУЖЕНИЯ ТОКСИЧЕСКОГО ЗАГРЯЗНЕНИЯ |
Дата введения - 2006-07-01
1 Область применения
Настоящий руководящий документ устанавливает требования к порядку проведения и оценке токсического загрязнения поверхностных вод суши (ПВС) методами биотестирования с использованием в качестве тест-объектов представителей микрозоопланктона.
Настоящий документ предназначен для организаций наблюдательной сети Федеральной службы по гидрометеорологии и мониторингу окружающей среды (Росгидромета), осуществляющих организацию и проведение наблюдений за загрязнением ПВС в составе Государственной службы наблюдений за состоянием окружающей природной среды (ГСН) России.
Руководящий документ может быть использован в качестве методического пособия специалистами и практическими работниками природоохранных учреждений, осуществляющих наблюдения за загрязнением природной среды, а также для оценки токсического загрязнения поверхностных вод.
2 Нормативные ссылки
В настоящем руководящем документе использованы ссылки на следующие нормативные документы:
ГОСТ 17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения.
ГОСТ 17.1.5.04-81 Охрана природы. Гидросфера. Приборы и устройства для отбора, первичной обработки и хранения проб природных вод. Общие технические условия
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 19179-73 Гидрология суши. Термины и определения
ГОСТ 27065-86 Качество вод. Термины и определения
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
РД 52.24.309-92 Методические указания. Охрана природы. Гидросфера. Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Роскомгидромета
Р 52.24.566-94 Рекомендации. Методы токсикологической оценки загрязнения пресноводных экосистем
РД 52.24.635-2002 Методические указания. Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования.
3 Термины и определения, обозначения
В настоящем руководящем документе использованы следующие термины и определения:
3.1 анализ проб воды: Определение физических, физико-химических, химических, биологических, токсических свойств и состава воды [1].
3.2 биотестирование (биологическое тестирование): Оценка качества объектов окружающей среды (воды и др.) по ответным реакциям живых организмов, являющихся тест-объектами (РД 52.24.635).
3.3 биотест: Совокупность приемов получения информации о токсичности воды (донных отложений) для гидробионтов на основе регистрации реакций тест-объекта (Р 52.24.566).
3.4 водный объект: Сосредоточение вод на поверхности суши в формах ее рельефа, либо в недрах, имеющее границы, объем и черты водного режима [2].
3.5 диапазон реагирования: Интервал значений концентраций эталонного токсиканта, в пределах которого результат биотестирования является надежным.
3.6 загрязнение воды водоемов и водотоков: Процесс изменения состава и свойств воды водоемов и водотоков под влиянием поступающих в воду загрязняющих веществ, микроорганизмов, тепла, приводящих к ухудшению качества воды (РД 52.24.309).
3.7 загрязнение токсическое: Загрязнение воды водоемов и водотоков токсичными веществами.
3.8 качество воды: Характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования (ГОСТ 17.1.1.01).
3.9 контроль качества воды: Проверка соответствия показателей качества воды установленным нормам и требованиям (ГОСТ 27065).
3.10 критерий токсичности: Значение показателя токсичности, на основании которого судят о наличии токсического действия (Р 52.24.566).
3.11 метрологическая характеристика метода: Характеристика чувствительности метода, определяемая для тест-объекта по LC50 при воздействии эталонного токсиканта (медь (II) сернокислая, калий двухромовокислый).
3.12 нормы качества воды: Установленные значения показателей качества воды для конкретных видов водопользования (ГОСТ 27065).
3.13 острое токсическое действие (острая токсичность): Воздействие, вызывающее быструю ответную реакцию тест-объекта. Острое токсическое действие чаще всего определяют по тест-реакции «гибель» или «выживаемость» в условиях кратковременного биотестирования. При использовании коловраток и других организмов микрозоопланктона длительность воздействия составляет от 6 до 24 ч.
3.14 показатель токсичности: Признак тест-объекта, используемый для оценки токсичности воды (Р 52.24.566).
3.15 поверхностные воды: Воды, находящиеся на поверхности суши в виде различных водных объектов (ГОСТ 19179).
3.16 природные воды: Воды Земли с содержащимися в них твердыми, жидкими и газообразными веществами (ГОСТ 19179).
3.17 проба воды: Количество воды, предназначенное для исследования.
3.18 пункт наблюдений за загрязнением поверхностных вод суши ГСН Росгидромета: Место на водоеме или водотоке, где проводят комплекс работ для получения данных о качестве воды или донных отложений (РД 52.24.635).
3.19 результат биотестирования: Конечный вывод о токсичности водной среды, установленный в ходе биотестирования.
3.20 створ пункта наблюдений за загрязнением поверхностных вод суши ГСН Росгидромета: Условное поперечное сечение водоема или водотока, в котором производят комплекс работ для получения данных о показателях состава и свойств воды (РД 52.24.635).
3.21 тест-объект: Организм, который используют при биотестировании, например, инфузории, дафнии (Р 52.24.566).
3.22 токсикология водная: Наука о токсичности водной среды, в том числе природной или сточной воды для гидробионтов [3].
3.23 токсичность воды: Свойство воды (донных отложений) вызывать патологические изменения или гибель организмов, обусловленные присутствием в ней токсичных веществ (Р 52.24.566).
3.24 токсикологический эксперимент: Эксперимент, в ходе которого оценивают влияние на тест-объект испытываемой воды или химического соединения. Состоит из двух серий: опыт (с воздействием воды или химического соединения) и контроль, в ходе которого оценивают влияние дехлорированной водопроводной воды или воды из фонового створа, но проводимого в тех же условиях (Р 52.24.566).
3.25 точка отбора проб: Точно зафиксированное местоположение отбора пробы воды или донных отложений (РД 52.24.635).
3.26 условно чистый участок водного объекта: Обычно это фоновый створ.
3.27 фоновый створ: Створ, расположенный на расстоянии не менее 1 км выше источника загрязнения (Р 52.24.566).
3.28 хроническое токсическое действие (хроническая токсичность): Воздействие, вызывающее ответную реакцию тест-объекта, проявляющуюся в течение относительно длительного периода времени. Хроническое токсическое действие измеряют по тест-показателям «выживаемость», «плодовитость», «изменение роста» и другим реакциям при длительном биотестировании (Р 52.24.566).
3.29 чувствительность тест-объекта: Нижняя граница диапазона действия эталонного токсиканта, при которой обнаруживают параметры его токсичности на тест-объект.
3.30 экспозиция: Период, в течение которого организм находится под воздействием исследуемого фактора, в частности химического вещества. В зависимости от экспозиции различают острое или хроническое токсическое действие (РД 52.24.635).
3.31 эталонный токсикант: Токсическое вещество, используемое для проверки чувствительности биотеста или тест-объекта (РД 52.24.566).
3.32 LC50: Концентрация токсиканта, приводящая к гибели 50 % взятой для эксперимента выборки.
4 Общие положения
4.1 В данном руководящем документе устанавливают требования к унификации методов биотестирования с использованием представителей микрозоопланктона для оценки токсического загрязнения поверхностных вод. Обоснование использования представителей микрозоопланктона на основе критериев выбора видов - индикаторов изложены в приложении А.
4.2 Для унификации методов биотестирования необходимо тщательное соблюдение всех этапов биотеста (см. раздел 6) и использование особенностей жизненного цикла тест-объектов согласно Р 52.24.566.
4.3 Биотестирование поверхностных вод суши проводят в режимных наблюдениях и для решения оперативных задач с целью проверки соответствия качества вод отдельных проб установленным нормам. В режимных наблюдениях на основе систематических данных биотестирования оценивают токсикологическое состояние водных объектов или их участков. В ходе решения оперативных задач оценивают токсичность отдельных проб воды с целью выяснения чрезвычайных экологических ситуаций.
4.4 Вода фонового (контрольного) створа не должна оказывать токсического, хронического и тем более острого токсического действия на тест-объекты, используемые для биотестирования [4].
4.5 В ходе биотестирования устанавливают отсутствие или наличие токсического (острого, подострого, хронического) действия испытываемой (опытной) пробы для биологических объектов, без идентификации загрязняющих веществ и их количественных характеристик согласно рекомендациям Р 52.24.566.
4.6 Биотестирование основано на определении показателей токсичности испытываемой (опытной) пробы воды, отобранной в зоне влияния источника загрязнения и их отличий от контрольной пробы, отобранной на условно чистом участке водного объекта.
4.7 Биотестирование токсичности поверхностных вод суши позволяет:
- оценить токсичность пробы воды;
- оценить влияние источников загрязнения на состояние водной составляющей водного объекта;
- оценить в целом уровень токсического загрязнения экосистемы водного объекта;
- оценить эколого-токсикологическое состояние водного объекта в комплексе с методами биоиндикационных и физико-химических исследований.
4.8 Объективную оценку токсического загрязнения получают путем:
- использования набора биотестов с различными тест-объектами, желательно, представителями разного трофического и систематического уровня, например, микроводоросли, дафнии, рыбы, инфузории, коловратки и т.д.;
- использования набора биотестов на основе различных тест-реакций одного тест-объекта, например, пищевая активность, гибель, плодовитость коловраток, или, например, фотосинтез, концентрация хлорофилла, интенсивность прироста микроводорослей.
Наиболее точную оценку получают по комплексу показателей гибели и плодовитости тест-объекта в зависимости от экспозиции [5].
5 Основные принципы биотестирования поверхностных вод суши
Методы биотестирования природных вод имеют ряд общих принципов с методами биотестирования сточных вод, однако имеют и существенные особенности:
- все процедуры и технологические приемы биотестирования должны быть более жесткими по сравнению с таковыми для сточных вод из-за относительно низких концентраций загрязняющих веществ;
- необходимость четких стандартных условий и процедуры биотестирования в связи с относительно низкими концентрациями загрязняющих веществ и влиянием естественных физико-химических параметров водной среды;
- использование двух контрольных серий (на дехлорированной водопроводной воде исследуемого региона и на воде фонового створа);
- обязательное наличие данных о параметрах гидрохимического режима водного объекта и использование испытываемой воды без их изменения (например, температуры, рН);
- биотестирование проводят на нефильтрованной воде, при наличии взвешенных частиц - на нефильтрованной и фильтрованной;
- преимущественное использование методов непрерывного биотестирования (без постановки отдельных экспериментов по установлению острого и хронического токсического действия, т.е. отсутствие острого токсического действия в кратковременном опыте позволяет продолжить тот же опыт без замены среды и популяций тест-объектов в длительный эксперимент по определению хронического токсического действия).
6 Основные этапы методов биотестирования
6.1 Основные для всех методов биотестирования, этапы и порядок их соблюдения для получения надежной информации [2] включают четыре этапа: предварительный, общий, специализированный и заключительный.
6.2 На предварительном этапе используют методику в соответствии с областью ее применения.
6.3 На общем этапе получают для биотестирования пробы воды из исследуемого (опытного) и контрольного (фонового) створов, включая регламентацию способов отбора, хранения и подготовки проб для биотестирования.
6.4 На специализированном этапе устанавливают следующее:
6.4.1 Стандартные условия содержания маточной культуры тест-объекта на основе требований к тест-объектам. Требования к тест-объектам включают:
- полное название вида и точное указание его систематической принадлежности (результаты биотестирования на одном виде не распространяются на другие виды, чувствительность к токсическому воздействию у разных видов существенно отличаются);
- морфо-функциональные и возрастные показатели;
- способы получения;
- физико-химические условия, режим кормления содержания маточной культуры тест-объекта.
6.4.2 Пригодность тест-объекта к биологическому анализу. В биотестировании используют синхронизированные культуры. Способы синхронизации представителей микрозоопланктона приведены в рекомендациях Р 52.24.566 и [5].
6.4.3 Требования к чувствительности и точности методики биотестирования. Параметры чувствительности (порог чувствительности и диапазон реагирования) и точности (сходимость и воспроизводимость результатов) устанавливают в ходе токсикологических экспериментов.
Порог чувствительности и диапазон реагирования тест-объекта определяется экспериментально с помощью эталонного токсиканта по величине того параметра, который принят за критерий токсичности в биотесте. Например, при биотестировании острого токсического действия диапазон реагирования тест-объектов устанавливают по интервалу концентраций бихромата калия, в пределах которого находится LC50.
Порог чувствительности представляет собой нижнюю границу диапазона реагирования.
Характеристика точности биотеста - гарантируемые значения показателей точности методики, выполняемой при всех допускаемых вариациях влияющих факторов и характеризующих точность любого результата биотестирования, который может быть получен по данной методике при ее строгом соблюдении. Нормы точности устанавливают в ходе токсикологических экспериментов, проводимых в одной (сходимости) или нескольких лабораториях (воспроизводимости).
6.4.4 Требования к процедуре выполнения методики биотестирования, включающие:
- требования к числу повторностей, емкостям для биотестирования, объему воды и плотности посадки тест-объектов, соблюдение оптимальных условий жизнедеятельности тест-объектов (температура, концентрация растворенного кислорода, жесткость воды, рН), содержанию взвешенных веществ в испытываемой воде, и др.;
- требования к регламентации факторов, влияющих на точность результатов. Указание допустимых колебаний значений факторов среды и условий выполнения биотеста, соблюдение которых позволяет считать результаты правильными. Допустимый количественный диапазон колебаний факторов среды и условий биотестирования устанавливают по данным литературы и исследованиям разработчиков методик о биологических особенностях гидробионтов, используемых в качестве тест-объектов.
6.4.5 Требования к регистрации тест-показателей. Учет тест-показателей проводят визуально или с помощью приборов. Особенно важным является соблюдение срока экспозиции и временного интервала учета тест-показателей.
6.4.6 Требования к контрольной серии. Для анализа результатов биотестирования необходимо выбрать один из двух используемых контролей (вода из условно чистого фонового участка, профильтрованная через планктонный газ высоких номеров, и дехлорированная водопроводная вода местного региона) согласно Р 52.24.566.
6.5 На заключительном этапе проводят следующее:
6.5.1 Оценивают результаты биотестирования, включающие либо статистическую обработку, либо оценку по шкалам токсичности согласно Р 52.24.566 и [5].
6.5.2 Определяют способ выражения результатов - словесное выражение степени токсического действия от острого до хронического.
6.5.3 Устанавливают требования к документации, представляемой по результатам биотестирования, обеспечивающей возможность контроля качества информации.
7 Требования к порядку проведения и оценке результатов биотестирования
7.1 Формирование сети пунктов и программ наблюдений
7.1.1 Выбор пунктов, створов для отбора проб и подготовку программ осуществляют УГМС и согласуют их с ГХИ в соответствии с положениями методических указаний РД 52.24.309. Периодичность и сроки наблюдений должны быть также совмещены с таковыми для гидробиологических наблюдений, которые проводят согласно методическим указаниям РД 52.24.309.
7.2 Отбор, хранение и подготовка проб для биотестирования
7.2.1 Пробы природной воды отбирают в соответствии с требованиями ГОСТ 17.1.5.05 и ГОСТ Р 51592, используя приборы и устройства, предусмотренные ГОСТ 17.1.5.04.
7.2.2 Хранение и подготовку проб для биотестирования проводят согласно рекомендациям Р 52.24.566.
7.3 Оценка результатов токсического загрязнения
7.3.1 В зависимости от задач исследования и используемых биотестов оценку результатов токсического загрязнения оценивают по-разному.
7.3.2 Токсическое загрязнение поверхностных вод суши методами биотестирования проводят экспертным путем и характеризуют следующим образом:
- «острое» и «хроническое токсическое действие»;
- «острое», «подострое» и «хроническое токсическое действие» для биотестов на микрозоопланктоне, выявляемое при биотестировании (Р 52.24.566).
7.3.3 В случае высокой токсичности в качестве признака для ранжирования токсичности используют коэффициент разбавления: величина разбавления, устраняющая токсичность согласно рекомендациям Р 52.24.566.
7.3.4 В случае нерезко выраженной токсичности необходима статистическая доказательность результатов биотестирования. Биометрическую обработку результатов биотестирования проводят с помощью приемов, применяемых в водной токсикологии. Алгоритм расчета статистической обработки результатов биотестирования приведен в приложении Б.
7.4 Представление результатов биотестирования
Результаты биотестирования поверхностных вод суши представляют по форме согласно рекомендациям Р 52.24.566, включающих следующие материалы:
- характеристику пробы отобранной воды и условия отбора;
- результаты биотестирования пробы поверхностных вод суши по каждому из использованных биотестов;
- общее заключение о токсичности пробы поверхностных вод суши по набору биотестов.
7.5 Метрологические характеристики методов биотестирования
Метрологическая характеристика методов биотестирования включает чувствительность тест-объектов к эталонному токсиканту, сходимость и воспроизводимость процедуры биотестирования. Чувствительность тест-объекта к токсиканту зависит от используемого тест-показателя [5].
Пример проверки чувствительности популяции тест-объекта коловратки (представитель микрозоопланктона) приведен в приложении В.
7.6 Требования безопасности, охраны окружающей среды
7.6.1 При выполнении работ следует соблюдать общие требования к технике безопасности работ на водных объектах и в химических лабораториях.
7.6.2 Особых требований по экологической безопасности не предъявляется.
7.7 Требования к квалификации специалиста
К выполнению экспериментальных работ методами биотестирования допускаются лица, имеющие биологическое, экологическое образование, знакомые с основами водной токсикологии, методами полевых и лабораторных гидробиологических исследований.
Оценка результатов биотестирования является экспертной. Получить надежную биологическую информацию позволят базовые знания специалиста-гидробиолога, способного поддерживать культуру тест-объекта в лаборатории или получать ее из природных водных объектов, корректно провести токсикологический эксперимент и проанализировать данные и сопоставить результаты биотестирования с результатами гидробиологического и гидрохимического исследований.
Приложение А
(справочное)
Обоснование
использования представителей микрозоопланктона в биотестировании
на основе критериев выбора видов-индикаторов
А.1 Биоиндикаторами могут служить представители всех царств живой природы. Важнейшая задача биотестирования - выявление и оценка надежности биоиндикаторов, разработка критериев их использования в мониторинге загрязнения окружающей среды.
Представители микрозоопланктона (инфузории и коловратки) отвечают следующим требованиям индикационных видов беспозвоночных животных, используемых в биологическом мониторинге водной среды:
- по своей экологии заметно подвергаются воздействию тех факторов среды, на которые ориентирован мониторинг;
- занимают функционально значимое место в экосистеме всех регионов;
- широко распространены во всех областях, в том числе и в континентальной;
- заметно реагируют на изменение среды колебаниями численности.
А.2 Использование инфузорий (т. Ciliata) в биотестировании определяется следующим: инфузории проявляют высокую чувствительность к загрязняющим веществам, поступающим в водные экосистемы со сточными водами. При этом они наиболее чувствительны к тяжелым металлам, к токсикантам органической природы:
- благодаря сочетанию в инфузориях признаков клетки и организма на них можно получать как клеточные, так и организменные реакции на токсическое воздействие;
- возможность культивирования в широком диапазоне температур позволяет использовать инфузорий для экспериментальных исследований в любое время года;
- короткий жизненный цикл, быстрота размножения позволяют проследить реакцию на токсическое воздействие в относительно короткий срок в целом ряду поколений;
- возможность получения большого количества генетически однородного материала от одной особи благодаря особенностям размножения.
А.3 Представители класса коловраток (кл. Rotatoria) соответствуют большинству критериев видов-индикаторов:
- способны накапливать загрязняющее вещество и не погибать под действием реально встречающихся концентраций;
- легко доступны в природе ввиду массовости видов;
- имеют приемлемые размеры;
- легко культивируются в лабораторных условиях;
- ряд видов устойчив к солоноватой воде;
- достаточно легко определяются до вида (кроме бделлоид);
- образ жизни ряда видов хорошо изучен;
- имеют короткий жизненный цикл развития;
- цикл развития гетерогенных коловраток заканчивается откладкой покоящихся яиц, что позволяет постоянно иметь культуру животных, а также дает возможность получения синхронной культуры коловраток [5].
Одна из стадий жизненного цикла коловраток - период покоя, переживаемый коловратками, обладающих гетерогонией, в виде покоящихся яиц, представляет несомненный интерес. Использование покоящихся яиц коловраток может служить для унификации процесса биотестирования. Воспроизводимость и сопоставимость результатов биотестирования - одно из условий методов токсикологической оценки качества воды с помощью живых организмов, которое выполнимо при использовании для экспериментов по токсичности синхронных культур. Последние представляют собой полученные в одинаковых условиях и находящиеся в одинаковом физиологическом состоянии одновозрастные особи (тест-объекты). Для получения синхронной культуры в качестве альтернативного варианта чистым культурам беспозвоночных можно использовать покоящиеся яйца. Так, воспроизводимость в экспериментах при использовании тест-культур из покоящихся яиц коловраток оказалась в три раза выше, чем на дафниях. Использование покоящихся яиц коловраток и в биотестировании в настоящее время стало возможным благодаря изучению сложного цикла размножения коловраток, позволившего разработать способы получения, хранения и выклева покоящихся яиц.
Таким образом, коловратки как класс представляют интерес и являются перспективными биоиндикаторами для оценки токсического загрязнения поверхностных вод методами биотестирования.
Подробная характеристика видов Brachionus calyciflorus (кл. Rotatoria) и Paramecium caudatum (т. Ciliata), используемых в биотестировании, условия их получения, содержания маточной культуры, процедура биотестирования изложены в рекомендациях Р 52.24.566.
Приложение Б
(рекомендуемое)
Алгоритм статистической обработки результатов биотестирования
Б.1 В зависимости от цели биотестирования оценку результатов биотестирования проводят различными способами.
Для быстрого расчета оценки токсичности используют шкалы степени токсического действия испытываемой воды. Критерии, разработанные на основе проведенных ранее исследований и литературных данных, приведены в рекомендациях Р 52.24.566.
Если оценку результатов биотестирования проводят более детально, то рассчитывают достоверность отклонения от контроля исследуемого показателя.
Б.2 Алгоритм расчета достоверности отклонений тест-показателя от контроля.
Определение достоверности отклонений от контроля осуществляют методами вариационной статистики. Для удобства расчетов составляют таблицу Б.1.
При этом вычисляют по формулам:
1) среднее арифметическое значение показателя
![]() (Б.1)
(Б.1)
где Vi - отдельные значения показателя;
n - количество повторностей;
2) среднее квадратическое отклонение
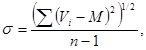 (Б.2)
(Б.2)
3) ошибку среднего арифметического
![]() (Б.3)
(Б.3)
4) доверительный интервал
D = tst · m, (Б.4)
где tst - табличная величина критерия Стьюдента, степень свободы (n - 1);
5) критерий достоверности разности
![]() (Б.5)
(Б.5)
где Мk и Моп - сравниваемые средние величины в контроле и опыте;
![]() и
и ![]() - квадраты ошибок в контроле и опыте;
- квадраты ошибок в контроле и опыте;
tst - табличное значение критерия Стьюдента, степень свободы (nк + nоп-2) (таблица Б.2).
Если рассчитанное значение td больше или равно значению стандартного критерия Стьюдента (td ³ tst), то отклонение результатов биотестирования от контроля достоверно. И тогда можно сделать вывод о том, что испытываемая вода оказывает токсическое действие.
Таблица Б.1 - Форма записи, расчетов и статистической обработки результатов биотестирования
|
Повторности |
Vi |
М |
Vi - M |
(Vi - M)2 |
s |
М |
m2 |
D |
M ± D |
td |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
контроль |
1 |
||||||||||
|
2 |
|||||||||||
|
3 |
|||||||||||
|
опыт |
1 |
||||||||||
|
2 |
|||||||||||
|
3 |
Таблица Б.2 - Критические значения критериев Стьюдента tst при уровне значимости 0,05
|
tst |
Степень свободы |
tst |
|
|
1 |
12,71 |
6 |
2,45 |
|
2 |
4,30 |
7 |
2,37 |
|
3 |
3,18 |
8 |
2,31 |
|
4 |
2,78 |
9 |
2,26 |
|
5 |
2,57 |
10 |
2,23 |
Приложение В
(справочное)
Установление чувствительности популяции тест-объекта и значения метрологических характеристик методов
В.1 Чувствительность популяции тест-объекта проверяют по интенсивности реагирования к эталонному токсиканту 1) медь (II) сернокислая или 2) калий двухромовокислый. Показателем чувствительности служит LC50 за 24 ч экспозиции, т.е. концентрация эталонного токсиканта, в которой гибнет 50 % взятой в опыт популяции.
В практике токсикологических исследований показано, что к гибели 50 % взятой в эксперимент выборки популяции тест-объектов (LC50) приводит не одна концентрация эталонного токсиканта, а диапазон концентраций.
Так, например, для тест-объекта коловратки Brachionus calyciflorus этот диапазон составляет от 0,009 до 0,029 мг/л меди (II) сернокислой и от 0,075 до 0,250 мг/л калия двухромовокислого.
LC50 определяют графическим методом. В ходе эксперимента учитывают погибших особей. Гибель выражают в процентах. Процентные значения переводят в пробитные значения согласно таблице В.1. Соответствующие концентрации эталонного токсиканта выражают в логарифмических значениях.
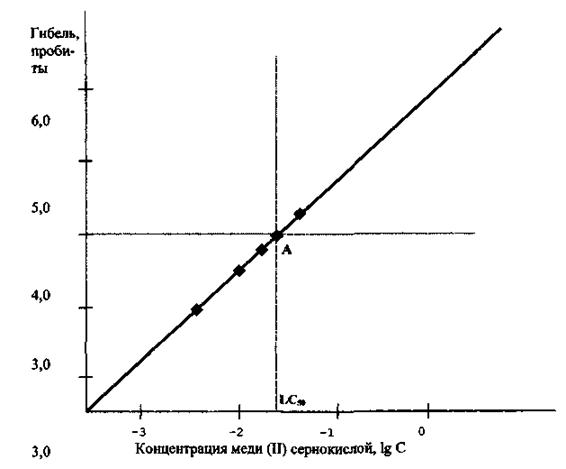
На основе пробитных значений и концентраций эталонного токсиканта, выраженных в десятичных логарифмах, строят график в виде прямой линии. На графике на оси ординат находят точку пробитного значения 5,0 и от нее параллельно оси абсцисс проводят линию до пересечения с линией графика, построенного по результатам эксперимента с различными концентрациями эталонного токсиканта. Получают точку А - пересечение прямой и координаты пробитного значения 5,0 (см. рисунок В.1). Точка пересечения опущенного перпендикуляра и оси абсцисс определяет значение LC50 - Значение последней соответствует концентрации эталонного токсиканта, при которой гибнет 50 % взятой в опыт популяции.
В случае, когда полученная по графику концентрация эталонного токсиканта (LC50) выходит за пределы указанных выше диапазонов, то для биотестирования следует взять другую популяцию. В противном случае результаты биотестирования будут некорректными.
Таблица В.1 - Таблица перевода гибели выборки тест-объектов, выраженной в процентах, в пробитные значения
|
0,0 |
1,0 |
2,0 |
3,0 |
4,0 |
5,0 |
6,0 |
7,0 |
8,0 |
9,0 |
|
|
0 |
- |
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,44 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3,77 |
3,85 |
3,87 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,22 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,81 |
4,82 |
4,84 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,30 |
5,33 |
5,36 |
5,38 |
5,41 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5,81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,88 |
7,05 |
7,32 |
Рисунок В.1 - Графический расчет LC50
Например, для нахождения LC50 для популяции брахионуса проводят эксперимент по исследованию нескольких концентраций меди (II) сернокислой: 0,005; 0,010; 0,015; 0,030 мг/л. По результатам опыта составляют таблицу В.2.
Таблица В.2 - Результаты эксперимента по определению LC50 популяции Brachionus calyciflorus
|
Гибель |
|||
|
мг/л |
lg C |
% |
Пробиты |
|
0,005 |
- 2,3 |
10 |
3,72 |
|
0,010 |
- 2,0 |
30 |
4,48 |
|
0,015 |
- 1,8 |
45 |
4,87 |
|
0,030 |
- 1,5 |
60 |
5,25 |
По значениям таблицы В.2 строят график (рисунок В.1). Точка пересечения опущенного из точки А перпендикуляра и оси абсцисс определяет значение LC50. В данном случае значение LC50 составляет - 1,7lgС, что соответствует 0,020 мг/л концентрации меди (II) сернокислой. Полученная по графику концентрация меди (II) сернокислой (LC50) укладывается в границы указанного выше диапазона концентраций (от 0,009 до 0,029 мг/л). Следовательно, эта популяция брахионуса пригодна для проведения токсикологического анализа.
В.2 Метрологическая характеристика методов биотестирования с использованием микрозоопланктона
В.2.1 В результате исследований отклика тест-объектов на эталонный токсикант по показателю гибели установлены следующие значения метрологических характеристик биотестов:
- с использованием коловраток: при воздействии калия двухромовокислого за 24 ч экспозиции диапазон концентраций для Brachionus calyciflorus составляет от 0,025 до 1,0 мг/л, внутрилабораторная прецизионность - 25 %;
- с использованием инфузорий: при воздействии калия двухромовокислого за 24 ч экспозиции диапазон концентраций для Paramecium caudatum составляет от 0,075 до 2,50 мг/л, внутрилабораторная прецизионность составляет 25 %.
В.2.2 В результате исследований отклика тест-объектов на эталонный токсикант по показателю размножения установлены следующие значения метрологических характеристик биотестов:
- с использованием коловраток: при воздействии калия двухромовокислого за 24 ч экспозиции диапазон концентраций для Brachionus calyciflorus составляет от менее 0,001 до 0,001 мг/л, внутрилабораторная прецизионность - 25 %;
- с использованием инфузорий: при воздействии калия двухромовокислого за 24 ч экспозиции диапазон концентраций для Paramecium caudatum составляет от 0,001 до 1,0 мг/л, внутрилабораторная прецизионность - 25 %.
Библиография
[1] Зенин А.А., Белоусова Н.В. Гидрохимический словарь. - Л.: Гидрометеоиздат, 1988. - 240 с.
[2] Водный кодекс Российской Федерации. В ред. Федерального закона от 23.12.2003, № 186-ФЗ.
[4] Правила охраны поверхностных вод (типовые положения). - М.: Госкомприрода СССР, 1991.