РД 52.24.412-95
РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МЕТОДИКА ВЫПОЛНЕНИЯ
ИЗМЕРЕНИЙ МАССОВОЙ КОНЦЕНТРАЦИИ
ГЕКСАХЛОРБЕНЗОЛА, АЛЬФА-, БЕТА- И ГАММА-ГХЦГ,
ДИКОФОЛА, ДИГИДРОГЕПТАХЛОРА, 4,4'-ДДТ, 4,4'-ДДЕ, 4,4'-
ДДД, ТРИФЛУРАЛИНА В ВОДАХ
ГАЗОХРОМАТОГРАФИЧЕСКИМ МЕТОДОМ
Ростов-на-Дону
Предисловие
1. РАЗРАБОТАН Гидрохимическим институтом
2. РАЗРАБОТЧИКИ Ю.Я. Винников, канд. хим. наук (руководитель разработки); Г.И. Ганин, канд. хим. наук; Е.В. Федорова
3. УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Начальником ГУЭМЗ Росгидромета Цатуровым Ю.С. 17.04.95 г.
4. ОДОБРЕН Секцией по методам химического и радиологического мониторинга природной среды ЦКПМ Росгидромета 11.04.95 г., протокол № 2.
5. СВИДЕТЕЛЬСТВО ОБ АТТЕСТАЦИИ МВИ Выдано Гидрохимическим институтом в 1995 г. № 66
6. ЗАРЕГИСТРИРОВАН в 1995 г. № 412
7. ВЗАМЕН РД 52.24.66-88
Введение
Галогенорганические инсектициды и гербициды широко применяются в агрохимической практике для борьбы с насекомыми-вредителями и сорной растительностью, что обуславливает поступление этих пестицидов в водные объекты с ливневым стоком с сельхозугодий и через атмосферу.
Из-за значительных объемов применения и свойств ряд галогенорганических пестицидов - альфа-ГХЦГ (альфа-изомер гексахлорциклогексана), гамма-ГХЦГ (гамма-изомер гексахлорциклогексана, линдан, гамматокс), 4,4'-ДДТ (п,п'-ДДТ, дикофан, аэротокс), 4,4'-ДДЕ (п,п-ДДЕ), 4,4'-ДДД (п,п-ДДД, ротан, ТДЕ), дикофол (акарин, кельтан, хлорэтанол), трифлуралин (олитреф, трефлан) - включен в приоритетный перечень пестицидов, подлежащих контролю в поверхностных водах суши.
Методика предназначена для определения приоритетных галогенорганических пестицидов - хлорорганических (альфа- и гамма-ГХЦГ, дикофола, 4,4'-ДДТ, 4,4'-ДДЕ, 4,4'-ДДД) и трифлуралина в поверхностных водах суши и очищенных сточных водах. В случае необходимости методика предусматривает, кроме того, количественное определение гексахлорбензола (ГХБ, гексадина) и дигидрогептахлора (бета-дигидрогептахлора, дилора), не включенных в приоритетный перечень, но распространенных и встречающихся в поверхностных водах пестицидов, а также приоритетного для почв бета-изомера ГХЦГ.
Предельно допустимые в поверхностных водах суши концентрации определяемых по настоящей методике пестицидов приведены в таблице 1.
Газохроматографическому определению пестицидов мешают некоторые соединения, не разрушающиеся при обработке экстракта концентрированной серной кислотой и имеющие времена удерживания, близкие к таковым для определяемых пестицидов. К таким соединениям относятся полихлорбифенилы (ПХБ), хлорированные парафины, галоваксы (полихлорнафталины), токсафены, тиодан, эфиры фталевой кислоты и некоторые другие. С целью более точной идентификации пестицидов в случае присутствия в экстрактах таких соединений проводят обработку экстракта спиртовой щелочью (щелочное дегидрохлорирование).
Таблица 1 - Предельно допустимые концентрации галогенорганических пестицидов в поверхностных водах суши
|
ПДК, мкг/дм3 |
||
|
хозяйственно-питьевых |
рыбохозяйственных |
|
|
Гексахлорбензол |
1 |
не установлена |
|
Альфа-ГХЦГ |
20 |
отсутствие |
|
Бета-ГХЦГ |
20 |
отсутствие |
|
Гамма-ГХЦГ |
4 |
отсутствие |
|
Дигидрогептахлор |
40 |
0,5 |
|
Трифлуралин |
20 |
0,3 |
|
4,4'-ДДЕ |
2 |
отсутствие |
|
4,4'-ДДД |
2 |
отсутствие |
|
4,4'-ДДТ |
2 |
отсутствие |
|
Дикофол |
20 |
отсутствие |
Мешающее влияние сероорганических веществ, сероводорода и элементарной серы, если это необходимо, устраняют обработкой экстрактов активированной медью или раствором сульфата тетрабутиламмония в присутствии изопропилового спирта и сульфита натрия.
При использовании по варианту 2 (однократное экстрагирование проб воды н-гексаном объемом 2,5 см3) настоящий РД может применяться совместно с вариантом 2 РД 52.24.485-95 «Методические указания. Методика выполнения измерений массовой концентрации хлорпирифоса в поверхностных водах суши газохроматографическим методом» в целях определения в одной пробе воды хлорпирифоса, хлорорганических пестицидов и трифлуралина.
РД 52.24.412-95
РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ МАССОВОЙ КОНЦЕНТРАЦИИ ГЕКСАХЛОРБЕНЗОЛА, АЛЬФА-, БЕТА- И ГАММА-ГХЦГ, ДИКОФОЛА, ДИГИДРОГЕПТАХЛОРА, 4,4'-ДДТ, 4,4'-ДДЕ, 4,4'-ДДД, ТРИФЛУРАЛИНА В ВОДАХ ГАЗОХРОМАТОГРАФИЧЕСКИМ МЕТОДОМ
Дата введения 01.07.95 г.
1. Назначение и область применения методики
Настоящий руководящий документ устанавливает газохроматографическую методику выполнения измерений массовой концентрации ГХБ, альфа-, бета- и гамма-ГХЦГ, дикофола, дигидрогептахлора, 4,4'-ДДТ, 4,4'-ДДЕ, 4,4'-ДДД и трифлуралина в пробах поверхностных вод суши и очищенных сточных вод в диапазоне 0,002 - 0,050 мкг/дм3 для ГХБ, альфа-ГХЦГ и гамма-ГХЦГ, 0,005 - 0,150 мкг/дм3 для трифлуралина, дигидрогептахлора, 4,4'-ДДЕ, 0,010 - 0,300 мкг/дм3 для бета-ГХЦГ и 4,4'-ДДД, 0,020 - 0,500 мкг/дм3 для 4,4'-ДДТ и дикофола. При анализе проб воды с массовой концентрацией определяемых пестицидов, превышающей верхний предел указанных выше соответствующих диапазонов, необходимо разбавление экстракта, подлежащего хроматографированию.
2. Нормы погрешности и значения характеристик погрешности измерения
В соответствии с ГОСТ 27384 нормы погрешности при выполнении измерений галогенорганических пестицидов в природных водах составляют для ГХБ ± 50 %; для гамма-ГХЦГ в диапазоне массовых концентраций от 0,08 до 1 мкг/дм3 минус 65 - плюс 100 %, от 1,0 до 10 мкг/дм3 ± 50 %, свыше 10 мкг/дм3 ± 25 %; для 4,4'-ДДТ и дикофола в диапазоне массовых концентраций от 0,2 до 1 мкг/дм3 включительно минус 65 - плюс 100 %.
Для массовых концентраций гамма-ГХЦГ менее 0,08 мкг/дм3 и для массовых концентраций дикофола и 4,4'-ДДТ менее 0,2 мкг/дм, а также для альфа-ГХЦГ, бета-ГХЦГ, трифлуралина, 4,4'-ДДЕ, 4,4'-ДДД и дигидрогептахлора нормы погрешности не установлены.
Установленные для настоящей методики значения характеристик погрешностей и их составляющих приведены в таблицах 2 и 3.
Таблица 2 - Значения характеристик погрешности и ее составляющих при определении галогенорганических пестицидов по варианту 1 методики (P = 0,95)
|
Диапазон измеряемых концентраций C, мкг/дм3 |
Характеристики составляющих погрешности, мкг/дм3 |
Характеристика погрешности, мкг/дм3, D |
||
|
случайной,
s( |
систематической Dc |
|||
|
ГХБ |
0,0020 - 0,0500 |
4 · 10-4 + 0,056 C |
3 · 10-4 + 0,045 C |
8 · 10-4 + 0,11 C |
|
Альфа-ГХЦГ |
0,0020 - 0,0500 |
4 · 10-4 + 0,087 C |
3 · 10-4 + 0,069 C |
8 · 10-4 + 0,17 C |
|
Бета-ГХЦГ |
0,010 - 0,300 |
0,001 + 0,056 C |
0,001 + 0,045 C |
0,003 + 0,11 C |
|
Гамма-ГХЦГ |
0,0020 - 0,0500 |
4 · 10-4 + 0,090 C |
3 · 10-4 + 0,072 C |
8 · 10-4 + 0,18 C |
|
Дигидрогептахлор |
0,0050 - 0,150 |
3 · 10-4 + 0,061 C |
3 · 10-4 + 0,049 C |
7 · 10-4 + 0,12 C |
|
4,4'-ДДЕ |
0,0050 - 0,150 |
0,001 + 0,047 C |
8 · 10-4 + 0,037 C |
0,002 + 0,093 C |
|
4,4'-ДДД |
0,010 - 0,300 |
6 · 10-4 + 0,11 C |
5 · 10-4 + 0,085 C |
0,001 + 0,22 C |
|
4,4'-ДДТ |
0,020 - 0,500 |
0,005 + 0,048 C |
0,004 + 0,038 C |
0,010 + 0,096 C |
|
Дикофол |
0,020 - 0,500 |
0,003 + 0,045 C |
0,002 + 0,036 C |
0,005 + 0,090 C |
|
Трифлуралин |
0,0050 - 0,150 |
8 · 10-4 + 0,074 C |
6 · 10-4 + 0,059 C |
0,0016 + 0,15 C |
Таблица 3 - Значения характеристик погрешности и ее составляющих при определении галогенорганических пестицидов по варианту 2 методики (P = 0,95)
|
Диапазон измеряемых концентраций C, мкг/дм3 |
Характеристики составляющих погрешности, мкг/дм3 |
Характеристика погрешности, мкг/дм3, D |
||
|
случайной,
s( |
систематической Dc |
|||
|
ГХБ |
0,0020 - 0,0500 |
4 · 10-4 + 0,044 C |
3 · 10-4 + 0,035 C |
8 · 10-4 + 0,089 C |
|
Альфа-ГХЦГ |
0,0020 - 0,0500 |
6 · 10-4 + 0,10 C |
4 · 10-4 + 0,081 C |
0,0011 + 0,20 C |
|
Бета-ГХЦГ |
0,010 - 0,300 |
0,002 + 0,049 C |
0,001 + 0,040 C |
0,003 + 0,089 C |
|
Гамма-ГХЦГ |
0,0020 - 0,0500 |
5 · 10-4 + 0,079 C |
4 · 10-4 + 0,063 C |
0,0010 + 0,16 C |
|
Дигидрогептахлор |
0,0050 - 0,150 |
0,0012 + 0,020 C |
0,00104 + 0,016 C |
0,0024 + 0,041 C |
|
4,4'-ДДЕ |
0,0050 - 0,150 |
0,001 + 0,036 C |
8 · 10-4 + 0,029 C |
0,0019 + 0,072 C |
|
4,4'-ДДД |
0,010 - 0,300 |
0,003 + 0,019 G |
0,002 + 0,015 C |
0,005 + 0,039 C |
|
4,4'-ДДТ |
0,020 - 0,200 |
0,001 + 0,092 C |
0,001 + 0,073 C |
0,003 + 0,18 C |
|
св. 0,200 - 0,500 |
0,019 |
0,015 |
0,038 |
|
|
Дикофол |
0,020 - 0,500 |
0,001 + 0,060 C |
0,001 + 0,048 C |
0,003 + 0,12 C |
|
Трифлуралин |
0,0050 - 0,0500 |
0,15 C |
0,12 C |
1 · 10-4 + 0,29 C |
|
св. 0,0500 - 0,150 |
0,0074 |
0,0059 |
0,015 |
|
При выполнении измерений массовой концентрации пестицидов свыше 0,050 мкг/дм3 для ГХБ, альфа- и гамма-ГХЦГ, свыше 0,150 мкг/дм3 для трифлуралина, дигидрогептахлора, 4,4'-ДДЕ, свыше 0,300 мкг/дм3 для бета-ГХЦГ и 4,4'-ДДД, свыше 0,500 мкг/дм3 для 4,4'-ДДТ и дикофола погрешности измерения для соответствующих пестицидов не превышают значений, рассчитанных по приведенным в таблицах 2 и 3 зависимостям.
3. Метод измерения
Определение основано на извлечении пестицидов из воды экстрагированием н-гексаном, очистке экстракта концентрированной серной кислотой и количественном их определении методом газожидкостной хроматографии с детектором по захвату электронов.
Методика представлена в двух вариантах. По варианту 1 извлечение пестицидов из пробы воды осуществляют с помощью двукратной экстракции н-гексаном (2 · 20 см3); по варианту 2 - с помощью микроэкстракции, т.е. однократной экстракции н-гексаном объемом 2,0 - 2,5 см3.
Вариант 2 более экспрессен и менее трудоемок, но требует более высокой квалификации аналитика.
Идентификацию определяемых пестицидов проводят по временам удерживания. Последние для некоторых из пестицидов могут быть слишком близкими или вовсе совпадать при разделении на одной фазе. Поэтому для каждой серии однотипных проб следует устанавливать однозначность идентификации разделением на колонках с фазами различной полярности, например, SE-30 и ХЕ-60 или OV-17 и ХЕ-60.
Количественный расчет содержания определяемых пестицидов проводят по высотам их хроматографических пиков на хроматограммах стандартного раствора и экстракта пробы воды.
4. Средства измерений, вспомогательные устройства, реактивы, материалы
4.1. Средства измерений, вспомогательные устройства
4.1.1. Хроматограф газовый типа Цвет-550 или другого типа с детектором по захвату электронов (ДПР, ИРД и др. типа) - 1
4.1.2. Весы аналитические 2 класса точности по ГОСТ 24104 или другого типа, равноценные по точности - 1
4.1.3. Весы технические лабораторные 4 класса точности с пределом взвешивания 200 г - 1
4.1.4. Микрошприц МШ-1 ОМ, ТУ 2-833-106 - 1
4.1.5. Дозатор пипеточный П1 с объемом дозы 0,5 см3, ТУ 64-1-3329 - 1
4.1.6. Муфельная печь с регулируемым нагревом любого типа - 1
4.1.7. Шкаф сушильный любого типа - 1
4.1.8. Микрокомпрессор аквариумный любого типа - 1
4.1.9. Насос вакуумный ВН-494 или аналогичного типа - 1
4.1.10. Центрифуга настольная ОПн-3 с ротором-крестовиной или аналогичного типа со скоростью вращения до 3000 об/мин - 1
4.1.11. Мешалка магнитная ММ-3 или аналогичного типа - 1
4.1.12. Плитка электрическая с закрытой спиралью с регулируемым нагревом - 1
4.1.13. Баня водяная любого типа - 1
4.1.14. Испаритель ротационный ИР-1М, ТУ 25-11-917 - 1
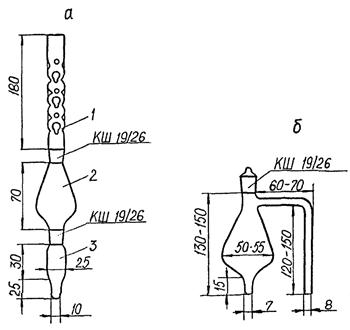
или аппарат для концентрирования экстрактов (аппарат Кудерна-Даниша, см. рисунок 1а), - 6
или колбы с Г-образным отводом вместимостью 100 см3, (см. рисунок 1б) - 6
4.1.15. Колонки хроматографические стеклянные длиной 2 м с внутренним диаметром 3 мм - 2
4.1.16. Колбы мерные, ГОСТ 1770, вместимостью: 50 см3 - 35
100 см3 - 10
4.1.17. Пипетки градуированные не ниже 2 класса точности, ГОСТ 29227, вместимостью:
1 см3 - 5
2 см3 - 5
5 см3 - 5
4.1.18. Цилиндры мерные, ГОСТ 1770, вместимостью: 10 см3 - 5
25 см3 - 2
100 см3 - 1
1000 см3 - 1
4.1.19. Пробирки градуированные с притертыми пробками исполнения 2, ГОСТ 1770, вместимостью
10 см3 - 8
4.1.20. Колбы конические с притертыми пробками, ГОСТ 25336, вместимостью:
25 см3 - 6
50 см3 или 100 см3 - 6
4.1.21. Воронки делительные, ГОСТ 25336, вместимостью:
25 см3 - 1
100 см3 - 6
250 см3 - 6
500 см3 - 1
1000 см3 - 6
4.1.22. Воронки лабораторные, ГОСТ 25336, диаметром 40 - 60 мм - 6
4.1.23. Химические стаканы, ГОСТ 25336, вместимостью: 50 см3 - 6
1000 см3 - 6
4.1.24. Пробки стеклянные с конусным шлифом с соединительным краном, ОСТ 25-79 - 6
4.1.25. Холодильник с прямой трубкой со шлифом ХПТ-ХШ, ГОСТ 25336 - 6
4.1.26. Стеклянный бюкс или стаканчик для взвешивания с притертой крышкой вместимостью 50 см3, ГОСТ 25336 - 1
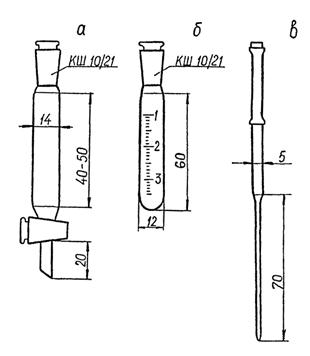
4.1.27. Воронки делительные, вместимостью 10 см3 по ГОСТ 25336 или см. рисунок 2а - 6
4.1.28. Пробирки градуированные с притертыми пробками вместимостью 5 см3 по ГОСТ 1770 или см. рисунок 2б - 12
4.1.29. Пипетка для отбора гексановых микроэкстрактов (рисунок 2в) - 1
4.1.30. Сменные капилляры к пипеткам для отбора микроэкстрактов к дозатору пипеточному (рисунок 2в) - 18
4.1.31. Эксикатор, ГОСТ 25336 - 1
4.1.32. Склянка для очистки газов, СПТ, ГОСТ 25336 - 1
а - аппарат Кудерна-Даниша (1 - дефлегматор, 2 - средняя часть аппарата, 3 - пробирка для сбора концентрата);
б - колба с Г-образным отводом
Рисунок 1 - Устройства для концентрирования экстрактов
4.2. Реактивы и материалы
4.2.1. Стандартные образцы или препараты альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, дигидрогептахлора, дикофола, 4,4'-ДДЕ, 4,4'-ДДД, 4,4'-ДДТ, гексахлорбензола, трифлуралина с содержанием основного вещества не менее 95 %
4.2.2. Хроматон N-AW-DMCS (N-AW-HMDS, N-Super) или Инертон AW-DMCS (фракция 0,16 - 0,20 мм) с 5 % нанесенной неподвижной фазы SE-30 или с 3 % OV-17
4.2.3. Хроматон N-AW-DMCS (N-AW-HMDS, N-Super) или Инертон AW-DMCS (фракция 0,16 - 0,20 мм) с 5 % нанесенной неподвижной фазы ХЕ-60
4.2.4. н-Гексан, ч., ТУ 6-09-3375, перегнанный
4.2.5. Ацетон, ч.д.а., ГОСТ 2603, свежеперегнанный или ацетон, ос.ч., ТУ 6-09-3513
4.2.6. Спирт этиловый ректификованный, ГОСТ 18300
4.2.7. Кислота серная, х.ч., концентрированная, ГОСТ 4204
4.2.8. Кислота азотная, х.ч., ГОСТ 4461
4.2.9. Спирт изопропиловый, х.ч., ТУ 6-09-402
4.2.7. Сульфат натрия безводный, ч.д.а., ГОСТ 4166
4.2.8. Гидроксид натрия, ч.д.а., ГОСТ 4328
4.2.9. Бумага индикаторная универсальная, ТУ 6-09-1181
4.2.10. Сульфит натрия безводный, ч.д.а., ГОСТ 195
4.2.11. Гидрокарбонат натрия, х.ч., ГОСТ 4201
4.2.12. Гидроксид калия, х.ч., ГОСТ 4328
4.2.13. Тетрабутиламмония сульфат, ч., 15 % водный раствор, ТУ 6-09-05-719
4.2.14. Медь металлическая электролитическая ГОСТ 859 или оксид меди, ч. или ч.д.а.
4.2.15. Азот газообразный особой чистоты, МРТУ 6-02-375, или азот нулевой поверочный, ТУ 6-21-39 - 1 баллон
4.2.16. Уголь активный БАУ, ГОСТ 6217
4.2.17. Стеклоткань или стекловата, ГОСТ 10146, промытая ацетоном и н-гексаном
4.2.18. Вата медицинская, ГОСТ 5556, промытая н-гексаном
4.2.19. Вода дистиллированная, ГОСТ 6709
4.2.20. Трубка Ф-4Д электроизоляционная фторопластовая с внутренним диаметром 4 - 5 мм
4.2.21. Трубка из силиконовой резины с внутренним диаметром 5 - 6 мм
а - делительная воронка вместимостью 10 см;
б - пробирка с притертой пробкой для сбора микроэкстрактов;
в - пипетка со сменными капиллярами для сбора микроэкстрактов
Рисунок 2 - Нестандартное оборудование для работы с микроэкстрактами
5. Отбор и хранение проб
Отбор проб воды осуществляют в соответствии с ГОСТ 17.1.5.05 с помощью стеклянного батометра. Из батометра пробу без фильтрования переносят в стеклянные бутыли вместимостью 1 дм3 и закрывают притертыми стеклянными или обернутыми тефлоновой пленкой или алюминиевой фольгой корковыми пробками. Применение полиэтиленовой посуды, резиновых и полиэтиленовых пробок не допускается.
Пробы воды хранят не более 10 сут. при температуре 5 - 7 °C.
Гексановые экстракты хранят только в стеклянной посуде с притертыми пробками в темноте при температуре 5 - 7 °C. Срок хранения неочищенных экстрактов - не более 10 сут., очищенных - до 3 мес.
6. Подготовка к выполнению измерений
6.1. Приготовление растворов и реактивов
6.1.1. Дистиллированная вода, очищенная н-гексаном
Очищают, экстрагируя 1 дм3 дистиллированной воды в делительной воронке 10 см3 н-гексана и отбрасывая гексановый экстракт.
6.1.2. Сульфат натрия безводный
Перед использованием сульфат натрия прокаливают в муфельной печи при температуре 350 - 400 °C в течение 8 ч. Прокаленный сульфат натрия хранят в эксикаторе.
6.1.3. Сульфат натрия, водный раствор
Растворяют 130 г безводного сульфата натрия в дистиллированной воде и доводят объем раствора до 1 дм3. Приготовленный раствор очищают, экстрагируя его 20 см3 н-гексана.
6.1.4. Гидрокарбонат натрия, 0,5 % водный раствор
В 200 см3 дистиллированной воды растворяют 1 г гидрокарбоната натрия. Приготовленный раствор очищают, экстрагируя его 10 см3 н-гексана.
6.1.5. Тетрабутиламмоний сульфат (ТБА), водный раствор
Раствор ТБА готовят непосредственно перед употреблением. Для этого к 11 см3 15 %-ного водного раствора ТБА (4.2.13) приливают 38 см3 дистиллированной воды и добавляют 12,5 г сернистокислого натрия. Приготовленный раствор ТБА очищают трехкратной экстракцией н-гексаном объемами по 10 см3.
6.1.6. Кислота серная, 1 % водный раствор
Раствор готовят, приливая 1,1 см3 концентрированной серной кислоты в 200 см3 дистиллированной воды, очищенной н-гексаном.
6.1.7. Кислота азотная, водный раствор 6 моль/дм3
Раствор готовят, приливая 50 см3 концентрированной азотной кислоты при помешивании к 150 см3 дистиллированной воды.
6.1.8. Медь металлическая, опилки или крупка
Опилки получают, обрабатывая слиток меди напильником или ножовкой по металлу. Изменяя силу нажима на напильник или ножовку, добиваются того, чтобы размер крупинок меди составлял 0,2 - 0,5 мм. Предназначенные для получения медных опилок напильник или полотно ножовки должны быть обезжирены промывкой последовательно ацетоном и н-гексаном.
Медная крупка нужного размера может быть получена восстановлением в токе водорода при температуре 300 °C отсеянного оксида меди.
Полученные медные опилки или медную крупку помещают в бюкс и активируют их обработкой раствором азотной кислоты (6.1.7) в течение 20 - 30 с. После этого опилки или крупку промывают дистиллированной водой 4 - 5 раз и затем 5 - 6 раз ацетоном. После ацетона медные опилки или крупку промывают 3 - 4 раза н-гексаном. Хранят активированные медные опилки или крупку в бюксе под слоем н-гексана 2 суток, после чего необходимо провести повторное активирование. Наиболее целесообразно активировать такое количество меди, которое необходимо на 1 день работы.
6.2. Приготовление стандартных растворов гексахлорбензола, альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, дигидрогептахлора, дикофола, 4,4'-ДДЕ, 4,4'-ДДД, 4,4'-ДДТ, трифлуралина
Стандартные растворы пестицидов готовят из стандартных образцов или препаратов пестицидов.
В случае использования стандартных образцов пестицидов производят разбавление исходных растворов в соответствии с инструкцией по их применению.
Стандартные растворы пестицидов готовят, используя в качестве растворителей н-гексан и ацетон. Растворы в н-гексане используют для приготовления стандартных образцов сравнения при хроматографировании (7.5), растворы в ацетоне - в качестве добавок в пробы природной воды при определении коэффициентов пересчета (7.6) и при внутрилабораторном контроле.
6.2.1. Основные стандартные растворы
Перед проведением операций по приготовлению растворов пестицидов весовым методом необходимо препараты пестицидов и н-гексан выдержать в течение двух часов в рабочем помещении.
На аналитических весах отвешивают 0,005 или 0,010 г пестицида, количественно переносят навеску в мерную колбу вместимостью 50 или 100 см3 соответственно взятой навеске, растворяют в небольшом количестве н-гексана и доводят объем до метки н-гексаном спустя 2 - 3 ч после растворения пестицида. Полученному раствору приписывают концентрацию 100 мкг/см3.
Процедура приготовления основного стандартного раствора одинакова для всех пестицидов. В качестве основных стандартных растворов могут быть применены стандартные образцы пестицидов (ГСО) концентрацией 100 мкг/см3.
Растворы хранят в холодильнике не более 6 мес.
6.2.2. Промежуточные стандартные растворы 1
В мерную колбу вместимостью 50 см3 пипеткой отбирают 5 см3 основного стандартного раствора или стандартного образца пестицида и доводят объем до метки на колбе н-гексаном. Полученному раствору приписывают концентрацию 10 мкг/см3.
Процедура приготовления промежуточного стандартного раствора 1 одинакова для всех пестицидов.
Растворы хранят в холодильнике не более 3 мес.
6.2.3. Промежуточные стандартные растворы 2
В мерную колбу вместимостью 50 см3 пипеткой отбирают 1,25 см3 промежуточного стандартного раствора 1 и доводят объем до метки на колбе н-гексаном. Полученному раствору приписывают концентрацию 0,25 мкг/см3.
Процедура приготовления промежуточного стандартного раствора 2 одинакова для всех пестицидов.
Растворы хранят в холодильнике не более 3 мес.
6.2.4. Рабочие стандартные растворы смеси пестицидов
Растворы смеси пестицидов, дозируемые в хроматограф, готовят из промежуточных стандартных растворов пестицидов в мерных колбах вместимостью 50 см3, отмеряя пипетками в колбу объемы растворов, указанные в таблицах 4 - 5. Объем смеси до 50 см3 доводят н-гексаном. Приписываемое каждому пестициду значение его концентрации в смеси указано в таблицах 4 - 5.
Таблица 4 - Рабочие стандартные растворы пестицидов (смесь 1)
|
Состав раствора |
Используемый раствор пестицида |
Объем раствора, вносимый в мерную колбу, см3 |
Концентрация пестицида в смеси, мкг/см3 |
|
|
1 |
Гексахлорбензол |
промежуточный 2 |
0,4 |
0,002 |
|
Альфа-ГХЦГ |
промежуточный 2 |
0,4 |
0,002 |
|
|
Бета-ГХЦГ |
промежуточный 2 |
2,0 |
0,010 |
|
|
Гамма-ГХЦГ |
промежуточный 2 |
0,4 |
0,002 |
|
|
Дигидрогептахлор |
промежуточный 2 |
1,0 |
0,005 |
|
|
Трифлуралин |
промежуточный 2 |
1,0 |
0,005 |
|
|
4,4'-ДДЕ |
промежуточный 2 |
1,0 |
0,005 |
|
|
4,4'-ДДД |
промежуточный 2 |
2,0 |
0,010 |
|
|
4,4'-ДДТ |
промежуточный 2 |
4,0 |
0,020 |
|
|
Дикофол |
промежуточный 2 |
4,0 |
0,020 |
|
|
2 |
Гексахлорбензол |
промежуточный 2 |
1,0 |
0,005 |
|
Альфа-ГХЦГ |
промежуточный 2 |
1,0 |
0,005 |
|
|
Бета-ГХЦГ |
промежуточный 2 |
5,0 |
0,025 |
|
|
Гамма-ГХЦГ |
промежуточный 2 |
1,0 |
0,005 |
|
|
Дигидрогептахлор |
промежуточный 2 |
2,4 |
0,012 |
|
|
Трифлуралин |
промежуточный 2 |
2,4 |
0,012 |
|
|
4,4'-ДДЕ |
промежуточный 2 |
2,4 |
0,012 |
|
|
4,4'-ДДД |
промежуточный 2 |
5,0 |
0,025 |
|
|
4,4'-ДДТ |
промежуточный 1 |
0,25 |
0,050 |
|
|
Дикофол |
промежуточный 1 |
0,25 |
0,050 |
|
|
3 |
Гексахлорбензол |
промежуточный 2 |
2,0 |
0,010 |
|
Альфа-ГХЦГ |
промежуточный 2 |
2,0 |
0,010 |
|
|
Бета-ГХЦГ |
промежуточный 2 |
0,25 |
0,050 |
|
|
Гамма-ГХЦГ |
промежуточный 2 |
2,0 |
0,010 |
|
|
Дигидрогептахлор |
промежуточный 2 |
5,0 |
0,025 |
|
|
Трифлуралин |
промежуточный 2 |
5,0 |
0,025 |
|
|
4,4'-ДДЕ |
промежуточный 2 |
5,0 |
0,025 |
|
|
4,4'-ДДД |
промежуточный 2 |
0,25 |
0,050 |
|
|
4,4'-ДДТ |
промежуточный 2 |
0,5 |
0,10 |
|
|
Дикофол |
промежуточный 1 |
0,5 |
0,10 |
|
|
4 |
Гексахлорбензол |
промежуточный 2 |
4,0 |
0,020 |
|
Альфа-ГХЦГ |
промежуточный 2 |
4,0 |
0,020 |
|
|
Бета-ГХЦГ |
промежуточный 1 |
0,5 |
0,10 |
|
|
Гамма-ГХЦГ |
промежуточный 2 |
4,0 |
0,020 |
|
|
Дигидрогептахлор |
промежуточный 1 |
0,25 |
0,050 |
|
|
Трифлуралин |
промежуточный 1 |
0,25 |
0,050 |
|
|
4,4'-ДДЕ |
промежуточный 1 |
0,25 |
0,050 |
|
|
4,4'-ДДД |
промежуточный 1 |
0,5 |
0,10 |
|
|
4,4'-ДДТ |
промежуточный 1 |
1,0 |
0,20 |
|
|
Дикофол |
промежуточный 1 |
1,0 |
0,20 |
|
|
5 |
Гексахлорбензол |
промежуточный 1 |
0,25 |
0,050 |
|
Альфа-ГХЦГ |
промежуточный 1 |
0,25 |
0,050 |
|
|
Бета-ГХЦГ |
промежуточный 1 |
1,5 |
0,30 |
|
|
Гамма-ГХЦГ |
промежуточный 1 |
0,25 |
0,050 |
|
|
Дигидрогептахлор |
промежуточный 1 |
0,75 |
0,150 |
|
|
Трифлуралин |
промежуточный 1 |
0,75 |
0,150 |
|
|
4,4'-ДДЕ |
промежуточный 1 |
0,75 |
0,150 |
|
|
4,4'-ДДД |
промежуточный 1 |
1,5 |
0,30 |
|
|
4,4'-ДДТ |
промежуточный 1 |
2,5 |
0,50 |
|
|
Дикофол |
промежуточный 1 |
2,5 |
0,50 |
Таблица 5 - Рабочие стандартные растворы пестицидов (смесь 2)
|
Состав раствора |
Используемый раствор пестицида |
Объем раствора, вносимый в мерную колбу, см3 |
Концентрация пестицида в смеси, мкг/см3 |
|
|
1 |
Альфа-ГХЦГ |
промежуточный 2 |
0,4 |
0,002 |
|
Гамма-ГХЦГ |
промежуточный 2 |
0,4 |
0,002 |
|
|
Дигидрогептахлор |
промежуточный 2 |
1,0 |
0,005 |
|
|
2 |
Альфа-ГХЦГ |
промежуточный 2 |
1,0 |
0,005 |
|
Гамма-ГХЦГ |
промежуточный 2 |
1,0 |
0,005 |
|
|
Дигидрогептахлор |
промежуточный 2 |
2,4 |
0,012 |
|
|
3 |
Альфа-ГХЦГ |
промежуточный 2 |
2,0 |
0,010 |
|
Гамма-ГХЦГ |
промежуточный 2 |
2,0 |
0,010 |
|
|
Дигидрогептахлор |
промежуточный 2 |
5,0 |
0,025 |
|
|
4 |
Альфа-ГХЦГ |
промежуточный 2 |
4,0 |
0,020 |
|
Гамма-ГХЦГ |
промежуточный 2 |
4,0 |
0,020 |
|
|
Дигидрогептахлор |
промежуточный 1 |
0,25 |
0,050 |
|
|
5 |
Альфа-ГХЦГ |
промежуточный 1 |
0,25 |
0,050 |
|
Гамма-ГХЦГ |
промежуточный 1 |
0,25 |
0,050 |
|
|
Дигидрогептахлор |
промежуточный 1 |
0,75 |
0,150 |
Рабочие стандартные растворы смесей пестицидов хранят в холодильнике не более 3 мес.
6.2.5. Стандартные растворы пестицидов в ацетоне
При определении коэффициентов пересчета (7.6) или в целях внутреннего контроля для внесения добавки стандартного раствора смеси пестицидов в пробу воды основные и промежуточные стандартные растворы пестицидов, а также рабочие стандартные растворы их смесей, готовят аналогично описанному выше (6.2.1 - 6.2.4), используя в качестве растворителя ацетон (марка ос.ч.). В этом случае дозируемый в хроматограф стандартный раствор смеси пестицидов в н-гексане готовят следующим образом.
В мерный цилиндр с притертой пробкой вместимостью 10 см3 вносят пипеткой 1 см3 н-гексана и 1 см3 стандартного раствора смеси пестицидов в ацетоне и перемешивают содержимое цилиндра, не переворачивая его. Затем добавляют в цилиндр очищенную н-гексаном дистиллированную воду до общего объема смеси 10 см3, закрывают цилиндр пробкой и перемешивают смесь встряхиванием в течение 0,5 - 1,0 мин. Дают смеси расслоиться и используют верхний гексановый слой в качестве стандартного раствора смеси пестицидов в н-гексане. Полученную смесь хранят в холодильнике не более 5 сут.
Условия и сроки хранения растворов пестицидов в ацетоне аналогичны таковым для растворов в н-гексане (6.2.1 - 6.2.4).
6.3. Подготовка хроматографических колонок
Стеклянные хроматографические колонки внутренним диаметром 3 мм и длиной 2 м промывают последовательно ацетоном и н-гексаном, сушат при температуре 110 - 120 °C в сушильном шкафу и заполняют одну колонку носителем с неподвижной фазой SE-30 или OV-17 (4.2.2), другую колонку - носителем с фазой ХЕ-60 (4.2.3).
Для заполнения хроматографической колонки один ее конец, который в дальнейшем будет подсоединяться к детектору, закрывают тампоном из промытого ацетоном и н-гексаном стекловолокна и присоединяют к вакуумному насосу через мелкую капроновую сетку. Затем включают насос и заполняют колонку носителем с фазой, добавляя последний небольшими порциями и постукивая колонку палочкой с резиновым концом при постоянно работающем насосе, следя за тем, чтобы носитель заполнял колонку равномерно, без разрывов.
Заполненную колонку закрывают тампоном из промытой стеклоткани и помещают в термостат колонок хроматографа, подсоединив к испарителю, но не подсоединяя к детектору. Кондиционирование колонки целесообразно проводить следующим образом. Установив расход азота через колонку 40 - 50 см3/мин, выдерживают колонку при температуре 60 - 70 °C в течение 20 - 30 мин. Затем поднимают температуру термостата колонок со скоростью 2 - 3 град/мин до температуры 230 °C и при этой температуре кондиционируют колонку в течение 8 - 10 ч.
6.4. Подготовка хроматографов
Подготовку хроматографов проводят в соответствии с инструкцией по их эксплуатации. После кондиционирования колонок их подсоединяют также и к детекторам, устанавливают расход газа-носителя (азота) через колонки 30 - 40 см3/мин и проверяют герметичность соединений.
Устанавливают необходимый режим работы хроматографов (7.5). После выхода приборов на рабочие режимы вводят несколько раз по 4 - 5 мм3 рабочих стандартных растворов смесей пестицидов (6.2.4) и проверяют эффективность хроматографирования последних.
6.5. Подготовка оборудования для микроэкстракции
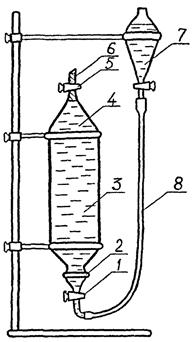
6.5.1. Устройство для микроэкстракции
Микроэкстракцию (однократное извлечение пестицидов из пробы воды 2,5 см3 н-гексана) производят с помощью устройства, представленного на рисунок 3. Для наиболее полного отделения малых количеств экстракта последний вытесняют вверх, добавляя после разделения слоев в основную делительную воронку (поз. 3, рисунок 3) необходимое количество воды из вспомогательной делительной воронки (поз. 7, рисунок 3).
Для сборки устройства надевают на горло основной делительной воронки проволочное кольцо с усиками (поз. 2, рисунок 3), с помощью которого пружинками или резиновыми кольцами осуществляется фиксация пробки-крана (4.1.24; поз. 1, рисунок 3), и соединяют пробку-кран и вспомогательную воронку фторопластовой трубкой, изогнутой соответственно пробке-крану. Соединение фторопластовой трубки со стеклом осуществляется встык с помощью отрезков силиконовой трубки длиной 15 - 20 мм. Соединение и разъем должны быть выполнимы без усилий во избежание поломки стеклянных элементов устройства.
6.5.2. Подготовка пипетки для отбора микроэкстрактов
Пипетка для отбора микроэкстрактов представляет собой отрезок трубки из силиконовой резины диаметром 5 - 6 мм, который с одного конца закрыт отрезком стеклянной палочки длиной 5 - 6 мм (рисунок 2в). С другого конца в отрезок трубки вставляют сменные капилляры (4.1.30).
После отбора микроэкстракта одной пробы в пипетке меняют использованный капилляр на другой, чистый, и после этого пипеткой осуществляют отбор микроэкстракта другой пробы.
6.6. Подготовка дозатора пипеточного
На наконечник дозатора (4.1.5) вместо полиэтиленовой насадки одевают отрезок силиконовой трубки длиной 15 мм. В свободный конец отрезка трубки вставляют такой же капилляр, как и в пипетку для отбора микроэкстрактов.
6.7. Приготовление фильтра для очистки воздуха
Используемый для упаривания экстрактов воздух (7.2.4, 7.3.2, 7.4) необходимо очищать, пропуская через фильтр с активным углем. В качестве фильтра применяют склянку для очистки газов (4.1.32). Входной отросток склянки заполняют медицинской ватой и наполняют склянку активным углем. При этом выходную часть склянки наполняют активным углем так, чтобы его уровень не доходил до выходного отростка, примерно, на 2 см. Оставшуюся незаполненной углем выходную часть склянки заполняют медицинской ватой. После этого входной отросток склянки соединяют с аквариумным микрокомпрессором, а выходящий из выходного отростка очищенный воздух используют для упаривания экстрактов.
7. Выполнение измерений
7.1. Холостое измерение
Холостое измерение проводят перед анализом проб воды с целью проверки чистоты применяемых реактивов и материалов.
Для выполнения холостого измерения берут 0,8 - 1,0 дм3 дистиллированной воды, очищенной н-гексаном (6.1.1), тот же объем растворителя, который расходуется на экстракцию одной пробы воды, и проводят последовательно все операции анализа в зависимости от выбранного варианта методики (см. 7.2.1 - 7.2.4 или 7.3.1 - 7.3.2, а также 7.4).
Если пики на хроматограмме холостого опыта совпадают по временам удерживания хотя бы с одним пиком какого-либо из определяемых пестицидов, то необходимо путем постадийного исследования установить какой из реактивов загрязнен и провести его очистку или заменить этим же реактивом, но из другой партии.
7.2. Выполнение измерений по варианту 1
7.2.1. Экстракционное извлечение пестицидов
Нефильтрованную пробу воды объемом 0,8 - 1,0 дм3 переносят из транспортной тары в делительную воронку вместимостью 1 дм3. Дважды ополаскивают транспортную тару объемами по 10 см3 ацетоном и переносят смывы в делительную воронку. Добавляют в делительную воронку 20 см3 н-гексана и выполняют экстрагирование, встряхивая пробу 3 мин и затем ожидая расслоения смеси 15 - 30 мин. Затем водную фазу переносят в химический стакан, а гексановый экстракт - в колбу с притертой пробкой. Пробу воды возвращают в делительную воронку и еще раз экстрагируют н-гексаном объемом 20 см3. Пробу воды после расслоения отбрасывают, а гексановый экстракт объединяют с первым экстрактом.
К объединенному гексановому экстракту при непрерывном помешивании добавляют безводный сульфат натрия в количестве 2 - 5 г (в зависимости от степени эмульгированности экстракта) и затем фильтруют экстракт через слой безводного сульфата натрия (примерно, 3 - 4 г), помещенного в воронку на подложку из обезжиренной ваты и предварительно смоченного н-гексаном до появления первой капли.
1 - пробка-кран, 2 - кольцо для фиксации пробки-крана, 3 - делительная воронка, 4 - водный слой, 5 - сливной кран, 6 - гексановый экстракт, 7 - вспомогательная воронка, 8 - фторопластовая трубка, 9 - штатив
Рисунок 3 - Схема устройства для микроэкстракции
Делительную воронку ополаскивают внутри н-гексаном объемом 8 - 10 см3, переносят эту порцию н-гексана из делительной воронки в колбу, в которой был объединенный экстракт, обмывают ею стенки колбы и находящийся в колбе сульфат натрия и также фильтруют через слой сульфата натрия в воронке. Колбу и находящийся в ней сульфат еще раз ополаскивают 8 - 10 см3 н-гексана, который затем фильтруют через ту же воронку с сульфатом натрия.
Весь фильтрат (экстракты и промывные порции н-гексана) собирают в аппарат Кудерна-Даниша (4.1.14). Если экстракт необходимо оставить на хранение, то фильтрат собирают в колбу с притертой пробкой.
7.2.2. Предварительное концентрирование
К аппарату Кудерна-Даниша, содержащему полученный по 7.2.1 гексановый экстракт, подсоединяют дефлегматор и помещают аппарат на водяную баню при температуре 90 - 95 °C так, чтобы уровень воды в бане доходил до середины шлифа пробирки для концентрата. Необходимо следить, чтобы дефлегматор не охлаждался и кипение не прекращалось (при необходимости - защитить среднюю часть аппарата асбестовым экраном).
Экстракт упаривают в этих условиях до объема, примерно, 0,5 см3. Удаление растворителя длится 10 - 20 мин. Затем аппарат извлекают из водяной бани и охлаждают на воздухе. Дефлегматор и среднюю часть аппарата обмывают изнутри 2 - 3 см3 н-гексана и отсоединяют пробирку с концентратом. Общий объем концентрата должен составлять 4 - 5 см3.
Если фильтрат гексанового экстракта собирали в колбу с притертой пробкой (7.2.1), то после перенесения содержимого колбы в аппарат Кудерна-Даниша колбу ополаскивают дважды н-гексаном объемами по 2 - 3 см3, промывные порции н-гексана также помещают в аппарат Кудерна-Даниша и после этого осуществляют концентрирование.
Вместо аппарата Кудерна-Даниша концентрирование экстрактов можно проводить в колбах с Г-образным отводом (4.1.14) на водяной бане с температурой 75 - 80 °C или с помощью ротационного испарителя (температура бани около 35 °C).
Сконцентрированный по 7.2.2 экстракт количественно переносят в делительную воронку вместимостью 10 см3, приливают пипеткой 1 см3 концентрированной серной кислоты, несколько раз аккуратно переворачивают делительную воронку и дают смеси расслоиться. Обработку экстракта серной кислотой повторяют, меняя последнюю до тех пор, пока слой кислоты не будет оставаться бесцветным.
Всю кислоту, пошедшую на обработку экстракта собирают в пробирку вместимостью 10 см3 для последующего определения трифлуралина (7.4).
Обработанный серной кислотой экстракт промывают последовательно 2 - 3 см3 дистиллированной воды, очищенной н-гексаном, 1 - 2 раза по 2 - 3 см3 0,5 % раствором гидрокарбоната натрия (6.1.4) до отсутствия кислой реакции по универсальной индикаторной бумаге и снова 2 раза дистиллированной водой.
7.2.4. Окончательное концентрирование экстрактов
Очищенный по 7.2.3 экстракт переносят в градуированную пробирку вместимостью 10 см3. Делительную воронку, в которой осуществляли очистку экстракта (7.2.3), обмывают изнутри дважды н-гексаном объемами по 0,5 см3 и промывные порции н-гексана объединяют с экстрактом в пробирке. Содержащийся в пробирке экстракт упаривают до объема, примерно, 1,5 см3 струей азота или воздуха (воздух очищают с помощью фильтра, см. 6.7). Затем в пробирку доливают 7 - 8 см3 дистиллированной воды, очищенной н-гексаном, доводят объем экстракта точно до 1,5 см3 дальнейшим упариванием струей азота (воздуха) или добавлением по каплям н-гексана и хроматографируют по 7.5 аликвоту объемом 5 - 6 мм3 или закрывают пробирку притертой пробкой и оставляют на хранение.
7.3. Выполнение измерений по варианту 2
7.3.1. Микроэкстракционное извлечение пестицидов
В основную делительную воронку установки для микроэкстракции (рисунок 3) вместимостью 1 дм3 с помощью мерного цилиндра помещают нефильтрованную пробу воды объемом 0,8 - 1,0 дм3, 80 - 100 см3 раствора сульфата натрия (6.1.3) и 2,0 - 2,5 см3 н-гексана. Закрывают делительную воронку пришлифованной пробкой-краном, закрепляют пробку-кран с помощью пружинок или резиновых колец и энергично экстрагируют пробу в течение 3 мин, затем основную делительную воронку помещают в штатив установки сливным отростком вверх. После расслоения фаз (через 15 - 30 мин) соединяют пробку-кран с уравнительной трубкой, подсоединенной другим концом к сливному отростку вспомогательной делительной воронки, и вытесняют экстракт вместе с эмульсией через сливной кран основной делительной воронки в ее сливной отросток. Экстракт вместе с эмульсией отбирают пипеткой-капельницей (рисунок 2в), переносят в градуированную пробирку вместимостью 5 см3, закрывают пробирку пришлифованной пробкой и центрифугируют в течение 5 мин при 3000 об/мин.
В случае, если после центрифугирования значительная часть гексанового экстракта находится в виде эмульсии, осторожно круговыми движениями перемешивают экстракт с помощью пипетки опустив в экстракт капилляр. Налипшую на кончик капилляра гелеобразную массу удаляют из пробирки и, в случае необходимости, повторяют центрифугирование.
В делительную воронку вместимостью 10 см3 с помощью дозатора пипеточного (6.6) помещают 1,5 см3 экстракта, полученного по 7.3.1. Туда же приливают 1 см3 концентрированной серной кислоты и осторожно встряхивают делительную воронку несколько раз. Дают слоям разделиться и удаляют из делительной воронки серную кислоту. Если слой серной кислоты окрашен, обработку повторяют. Все порции серной кислоты, пошедшие на очистку экстракта, собирают в пробирку с притертой пробкой вместимостью 10 см3 для дальнейшего определения трифлуралина (7.4).
Обработанный серной кислотой экстракт промывают 2 см3 дистиллированной воды, очищенной н-гексаном, затем 1 - 2 раза (до отсутствия кислой реакции по универсальной индикаторной бумаге) 0,5 % раствором гидрокарбоната натрия порциями по 2 см3 и после этого 2 раза дистиллированной водой объемами по 2 см3.
Отмытый экстракт из делительной воронки с частью воды переносят в градуированную пробирку с притертой пробкой вместимостью 5 см3. Делительную воронку 2 раза обмывают внутри н-гексаном объемами по 0,3 - 0,5 см3 и промывные порции н-гексана объединяют с экстрактом в пробирке. Объем очищенного экстракта доводят до 1,5 см3, упаривая струей азота или очищенного через фильтр (6.7) воздуха или добавляя по каплям н-гексан. После этого аликвоту экстракта объемом 5 - 6 мм3 хроматографируют по 7.5 или закрывают пробирку притертой пробкой и оставляют на хранение.
В делительную воронку вместимостью 100 или 250 см3 вносят такой объем очищенной н-гексаном дистиллированной воды, который в 30 раз превышает объем пошедшей на очистку экстракта серной кислоты (7.2.4 или 7.3.2). Туда же количественно переносят объединенные порции использованной на очистку экстрактов серной кислоты (5.2.3 или 5.3.2) и перемешивают содержимое делительной воронки. Затем вносят в нее пипеткой 1,5 см3 н-гексана и энергично встряхивают в течение 5 мин. Дают смеси отстояться и отбрасывают водный слой.
Гексановый экстракт переносят в делительную воронку вместимостью 10 см3. Делительную воронку, в которой осуществляли экстрагирование трифлуралина, обмывают изнутри дважды н-гексаном объемами по 0,5 - 1,0 см3 и промывные порции н-гексана объединяют с экстрактом в делительной воронке вместимостью 10 см3. Экстракт промывают очищенной н-гексаном дистиллированной водой, 0,5 % раствором гидрокарбоната натрия, еще дистиллированной водой, переносят в пробирку с притертой пробкой вместимостью 5 см3 и доводят до объема 1,5 см3 так, как это описано в 7.3.2. После этих операций экстракт готов для хроматографирования. Хроматографируют аликвоту объемом 5 - 6 мм3 или закрывают пробирку притертой пробкой и оставляют на хранение.
7.5. Хроматографирование экстрактов
Хроматографирование экстракта каждой пробы осуществляют на двух хроматографах, один из которых снабжен колонкой с неподвижной фазой SE-30 или OV-17, а другой - колонкой с фазой ХЕ-60.
На хроматографе, снабженном колонкой с фазой ХЕ-60, записывают хроматограмму стандартного раствора смеси 1 (6.2.4). На фазе SE-30 или OV-17 плохо разделяются ГХБ, бета-ГХЦГ и гамма-ГХЦГ, а также дикофол и дигидрогептахлор. Поэтому для лучшей идентификации определяемых пестицидов на хроматографе, снабженном колонкой с фазой SE-30 или OV-17, записывают последовательно хроматограммы стандартных растворов, как смеси 1, так и смеси 2.
В испарители обоих хроматографов вводят по 5 - 6 мм3 соответствующих стандартных растворов и определяют времена удерживания хроматографических пиков пестицидов. Этот параметр необходимо проверять ежедневно перед началом определения после выхода приборов на рабочий режим.
Затем в испарители обоих хроматографов вводят по 5 - 6 мм3 экстракта одной пробы, приготовленного по 7.2.4 или 7.3.2. Трифлуралин определяют, хроматографируя на обоих хроматографах по 5 - 6 мм3 экстракта одной пробы, приготовленного по 7.4. Пестициды идентифицируют, сравнивая времена удерживания на хроматограммах пробы с временами удерживания, установленными при хроматографировании стандартных растворов на колонках с соответствующими неподвижными фазами.
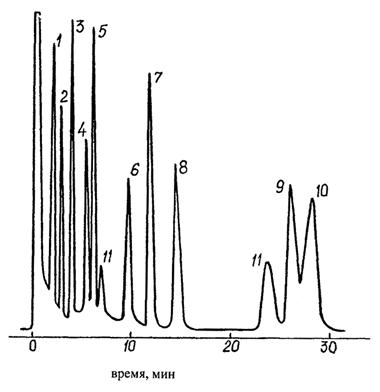
Примеры хроматограмм представлены на рисунках 4 и 5.
Условия хроматографирования следует устанавливать для каждого конкретного хроматографа свои, исходя из приведенных ниже:
- температура испарителя - 220 - 230 °C;
- температура колонки - 190 - 210 °C;
- температура детектора - 270 - 280 °C;
- расход азота через колонку - 30 - 40 см3/мин;
- расход азота на поддув детектора - в соответствии с инструкцией по его эксплуатации;
- скорость диаграммной ленты - 240 мм/ч;
- рабочий предел измерений на усилителе - в зависимости от определяемых концентраций;
- объемы вводимых в хроматограф аликвот стандартного раствора и пробы должны быть одинаковы.
Пестицид считается идентифицированным только в том случае, если соответствующий ему пик имеет место на хроматограммах, полученных как на колонке с фазой ХЕ-60, так и на колонке с фазой SE-30 или OV-17. Если, например, на хроматограмме, полученной на колонке с фазой ХЕ-60, имеется пик, соответствующий по времени удерживания 4,4'-ДДЕ, а на хроматограмме, полученной на колонке с фазой SE-30 или OV-17, пик, соответствующий 4,4'-ДДЕ, отсутствует (или в случае обратной ситуации), то делается вывод об отсутствии в пробе воды этого вещества.
При хроматографировании экстрактов проб природной воды необходимо выполнять условие, чтобы концентрации в них пестицидов находилась в пределах аттестованных диапазонов их концентраций (таблицы 2, 3). Если содержание пестицидов в экстракте превышает верхний предел аттестованных диапазонов концентраций, экстракты, полученные по 7.2.4, 7.3.2 и 7.4, разбавляют в соответствующее число раз н-гексаном.
7.6. Определение коэффициентов пересчета
В процессе проведения анализа происходят некоторые потери пестицидов. Поэтому во избежание получения заниженных результатов в формулу, по которой рассчитывают содержание того или иного пестицида, вводят коэффициент, учитывающий потери этого пестицида в ходе определения (8.1).
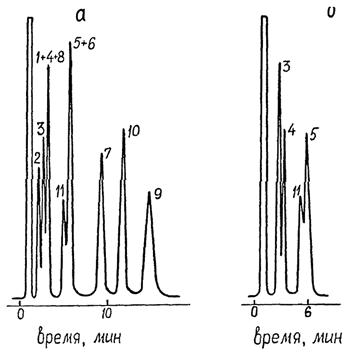
1 - гексахлорбензол, 2 - трифлуралин, 3 - альфа-ГХЦГ, 4 - гамма-ГХЦГ, 5 - дигидрогептахлор, 6 - дикофол, 7 - 4,4'-ДДЕ, 8 - бета-ГХЦГ, 9 - 4,4'-ДДД, 10 - 4,4'-ДДТ, 11 - пики хроматографической системы
Рисунок 4 - Хроматограмма стандартного раствора смеси 1 пестицидов на колонке с неподвижной фазой ХЕ-60
1 - гексахлорбензол, 2 - трифлуралин, 3 - альфа-ГХЦГ, 4 - гамма-ГХЦГ, 5 - дигидрогептахлор, 6 - дикофол, 7 - 4,4'-ДДЕ, 8 - бета-ГХЦГ, 9 - 4,4'-ДДД, 10 - 4,4'-ДДТ, 11 - пики хроматографической системы
Рисунок 5 - Хроматограммы стандартных растворов смеси 1 (а) и смеси 2 (б) пестицидов на колонке с неподвижной фазой SE-30
Величины коэффициентов потерь в той или иной степени зависят от варианта определения (7.2.1 - 7.2.4 или 7.3.1 - 7.3.2), от применяемого оборудования для концентрирования экстрактов, а также от состава анализируемой воды. Поэтому коэффициенты пересчета необходимо определять в каждой лаборатории для различных типов вод и оборудования для концентрирования экстрактов, используя тот вариант определения, который применяется в данной лаборатории. Для определения коэффициентов пересчета анализируют две пробы природной воды данного типа объемом по 0,8 дм3, в одну из которых внесена добавка стандартного раствора смеси 1 в ацетоне (6.2.4) объемом 1 см3. Анализ проводят по 7.2.1 - 7.2.4 или 7.3.1 - 7.3.2 и 7.4 в зависимости от того, какой вариант определения будет применяться. Анализ проб с добавками и без добавок осуществляют в 4 - 5 повторностях. С водой иного типа анализ проводят вновь.
Коэффициенты пересчета для каждого пестицида находят по формулам, приведенным в 8.2.
Значения коэффициентов пересчета (К), полученные при метрологической аттестации настоящей методики, приведены в таблице 6.
Таблица 6 - Ориентировочные коэффициенты пересчета
|
Величины коэффициентов пересчета при определении |
||
|
по варианту 1 |
по варианту 2 |
|
|
Гексахлорбензол |
1,22 |
1,20 |
|
Альфа-ГХЦГ |
1,38 |
1,38 |
|
Бета-ГХЦГ |
1,59 |
1,67 |
|
Гамма-ГХЦГ |
1,38 |
1,38 |
|
Дигидрогептахлор |
1,25 |
1,29 |
|
Трифлуралин |
1,16 |
1,18 |
|
4,4'-ДДЕ |
1,15 |
1,16 |
|
4,4'-ДДД |
1,15 |
1,11 |
|
4,4'-ДДТ |
1,15 |
1,13 |
|
Дикофол |
1,40 |
1,35 |
7.7. Устранение мешающих влияний
Использование для очистки экстрактов концентрированной серной кислоты позволяет устранить мешающее влияние большого количества соэкстрагирующихся веществ, в том числе метафоса, фосфамида и др.
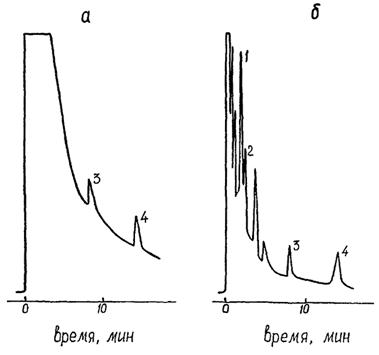
Если при хроматографировании экстракта по 7.5 наблюдается значительная перегрузка начальной части хроматограммы в области выхода пиков альфа- и гамма-ГХЦГ (рисунок 6), осуществляют дополнительную очистку экстракта от элементарной серы и (или) содержащих серу соединений.
1 - альфа-ГХЦГ, 2 - гамма-ГХЦГ, 3 - 4,4'-ДДЕ, 4 - 4,4'-ДДТ
Рисунок 6 - Хроматограммы экстракта из природной воды, содержащей сероводород, до (а) и после (б) ее обработки активированной медью
Очистка от элементарной серы и содержащих серу соединений с помощью ТБА в присутствии сульфита натрия. С помощью дозатора (6.6) очищенный серной кислотой экстракт в количестве 1 см3 вносят в делительную воронку вместимостью 10 см3. Затем в делительную воронку добавляют пипеткой 1 см3 изопропилового спирта и 1 см3 раствора ТБА (6.1.5). Содержимое воронки встряхивают в течение 1 мин.
Если при этом сульфит натрия, содержащийся в растворе ТБА, не выпадает в осадок, то его добавляют к смеси в делительной воронке порциями примерно по 100 мг до тех пор, пока добавленная порция не выпадет в осадок. После этого к содержимому в делительной воронке добавляют 5 см3 дистиллированной воды, очищенной н-гексаном, встряхивают и нижний водный слой отделяют, сливая его в химический стакан вместимостью 50 см3. Гексановый экстракт фильтруют через предварительно смоченный н-гексаном сульфат натрия (2 - 3 г) в градуированную пробирку с притертой пробкой вместимостью 10 см3. Слой сульфата натрия промывают 1,0 - 1,5 см3 н-гексана. Водный слой возвращают в делительную воронку и экстрагируют еще раз 3 см3 н-гексана. После этого водный слой отбрасывают, а гексановый экстракт фильтруют через ту же порцию сульфата натрия. Слой сульфата натрия промывают 1,0 - 1,5 см3 н-гексана. Очищенный экстракт концентрируют под струей азота или воздуха до 1 см3 и хроматографируют.
Очистка от элементарной серы и содержащих серу соединений активированной медью. С помощью дозатора (6.6) 1 см3 очищенного серной кислотой экстракта вносят в градуированную пробирку с притертой пробкой вместимостью 5 см3 и добавляют туда небольшое количество (на кончике скальпеля) активированной меди (6.1.8). Закрывают пробирку пробкой и оставляют на 15 - 20 мин, периодически встряхивая пробирку, но не переворачивая.
Если вся добавленная порция меди покрылась черным налетом, добавляют в пробирку с экстрактом еще порцию меди и вновь оставляют, периодически встряхивая пробирку (если сплошное почернение медных опилок или крупки происходит ранее, чем через 15 - 20 мин, то новую порцию добавляют, не ожидая истечения этого времени). Медь добавляют до тех пор, пока очередная ее порция через 15 - 20 мин после добавления не останется без изменений или только немного потемнеет (экстракт при этом зачастую мутнеет от образующегося сульфида меди).
По завершении процесса очистки экстракта в пробирку приливают 2 - 3 см3 дистиллированной воды, очищенной н-гексаном, закрывают пробирку пробкой и центрифугируют в течение 0,5 - 1 мин при 3000 об/мин. Объем доводят до 1 см3 н-гексаном и хроматографируют.
Щелочное дегидрохлорирование. В пробах воды наряду с определяемыми пестицидами могут присутствовать ПХБ, галоваксы, терфенилы и подобные группы соединений. Это проявляется, как правило, в регистрации на хроматограмме большого количества пиков, по временам удерживания зачастую совпадающих с пиками определяемых пестицидов, а также пиков с временами удерживания большими, чем время удерживания 4,4'-ДДТ. В таких случаях экстракты подвергают щелочному дегидрохлорированию.
Для щелочного дегидрохлорирования 1 см3 гексанового экстракта, очищенного серной кислотой (7.2.4 или 7.3.2) и, если необходимо, от сернистых соединений (см. выше) помещают в плоскодонную коническую колбу со шлифом вместимостью 25 см3, добавляют 0,4 - 0,5 г плавленного гидроксида калия (4 - 5 гранул) и 2 см3 этилового спирта. К колбе подсоединяют обратный холодильник и помещают ее на нагретую до температуры 50 - 55 °C магнитную мешалку. Содержимое колбы нагревают, перемешивая при этой температуре в течение 30 мин с момента растворения гранул гидроксида калия. В качестве перемешивающего элемента используют активатор из железного стержня, запаянного в стеклянную трубку длиной 10 - 20 мм и диаметром 3 - 5 мм.
После окончания нагревания колбу вместе с холодильником приподнимают над магнитной мешалкой. Через 5 - 10 мин колбу отсоединяют от холодильника и промывают 3 - 5 см3 н-гексана из пипетки внутреннюю часть холодильника и внешнюю часть его шлифа, собирая промывную порцию н-гексана в реакционную колбу. Содержимое колбы переносят в делительную воронку вместимостью 25 см3, колбу ополаскивают 2 см3 н-гексана, смывая его в ту же делительную воронку. Туда же добавляют 10 см3 дистиллированной воды, очищенной н-гексаном и перемешивают, переворачивая делительную воронку. После разделения слоев нижний водно-спиртовый слой сливают в исходную (реакционную) колбу, а гексановый экстракт в другую делительную воронку. Водно-спиртовый слой возвращают в первую делительную воронку и повторно экстрагируют 2 - 3 см3 н-гексана. Объединенный гексановый экстракт во второй делительной воронке промывают дважды 1 % раствором серной кислоты объемами по 2 см3, а затем очищенной н-гексаном дистиллированной водой и 0,5 % раствором гидрокабоната натрия до отсутствия кислой реакции по универсальной индикаторной бумаге и опять дистиллированной водой. Полученный таким образом гексановый экстракт сушат фильтрованием через 2 - 3 г безводного сульфата натрия, упаривают струей азота или воздуха при комнатной температуре до объема 1 см3 и хроматографируют.
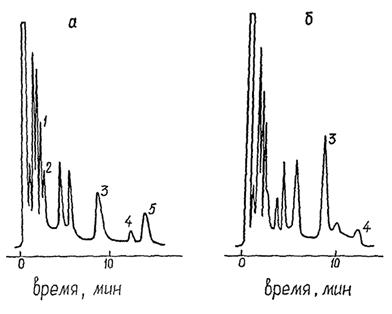
Пример хроматограмм экстракта пробы воды до и после дегидрохлорирования представлен на рисунке 7.
Щелочное дегидрохлорирование осуществляют с идентификационными целями. В процессе дегидрохлорирования от молекул ГХЦГ, 4,4'-ДДТ, 4,4'-ДДД, дигидрогептахлора отщепляются молекулы НСl. Это приводит к тому, что после дегидрохлорирования аналитические сигналы (пики), соответствующие альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, 4,4'-ДДТ, 4,4'-ДДД, дигидрогептахлору, на хроматограмме исчезают. При этом пик 4,4'-ДДЭ в той или иной степени возрастает за счет образования этого соединения из 4,4'-ДДТ.
Если же в пробе воды присутствуют галоваксы, ПХБ, терфенилы, молекулы которых в условиях щелочного дегидрохлорирования не изменяются, и пики этих соединений на хроматограммах совпадают с пиками определяемых пестицидов, то после дегидрохлорирования аналитические сигналы, отвечающие альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, 4,4'-ДДТ, 4,4'-ДДД или дигидрогептахлору, останутся неизменными или несколько уменьшенными. Таким образом, идентификацию того пестицида (альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, 4,4'-ДДТ, 4,4'-ДДД или дигидрогептахлора), пик которого на хроматограмме после дегидрохлорирования экстракта остался, следует считать недостоверным.
1 - альфа-ГХЦГ, 2 - гамма-ГХЦГ, 3 - 4,4'-ДДЕ, 4 - компонент ПХБ, 5 - 4,4'-ДДТ
Рисунок 7 - Хроматограммы экстракта из природной воды до (а) и после (б) щелочного дегидрохлорирования
8. Вычисление результатов измерений
8.1. Вычисление результатов измерений массовой концентрации галогенорганических пестицидов
Массовую концентрацию ГХБ, альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, дигидрогептахлора, дикофола, трифлуралина определяют по хроматограмме, полученной на колонке с неподвижной фазой ХЕ-60; 4,4'-ДДД и 4,4'-ДДТ - по хроматограмме, полученной на колонке с фазой SE-30, а массовая концентрация 4,4'-ДДЭ может быть определена по любой хроматограмме.
Если анализ проб воды осуществляли по варианту 1, то массовую концентрацию каждого пестицида рассчитывают по формуле (1)
если же анализ осуществляли по варианту 2, то массовую концентрацию каждого пестицида рассчитывают по формуле (2):
где Cx - концентрация пестицида в анализируемой пробе, мкг/дм3;
Cст - концентрация пестицида в стандартном растворе смеси пестицидов, мкг/см3;
hx - высота пика определяемого пестицида на хроматограмме экстракта из пробы воды, мм;
hст - высота пика определяемого пестицида на хроматограмме стандартного раствора смеси пестицидов, мм;
V1 - объем экстракта после концентрирования (7.2.4), если определение проводили по варианту 1, или объем н-гексана, взятый для микроэкстракции, если определение проводили по варианту 2, см3;
V2 - объем пробы воды, взятый для анализа, дм;
a - величина, учитывающая потери экстракта, получаемого по 7.3.1, равная 0,4 см3 при окружающей температуре до 25 °C и 0,5 см3 при температуре свыше 25 °C;
K - коэффициент, учитывающий потери данного пестицида в процессе анализа.
В случае проведения дополнительной очистки экстрактов от элементарной серы и содержащих серу соединений с помощью ТБА (7.7) содержание ГХБ, альфа-ГХЦГ, бета-ГХЦГ, гамма-ГХЦГ, трифлуралина, дигидрогептахлора, дикофола находят умножением C на 1,25, а содержание 4,4'-ДДТ, 4,4'-ДДЕ и 4,4'-ДДД - умножением C на 1,11. При очистке экстрактов от содержащих серу соединений с помощью активированной меди (7.7) корректировку величины C не проводят.
Если та или иная часть аттестованного диапазона концентраций какого-либо пестицида (таблицы 2 - 3) попадает в диапазон нелинейного детектирования, то для этой части диапазона концентраций пестицида строят градуировочный график.
Результат измерения в документах, предусматривающих его использование, представляют в виде:
Сх ± D, мкг/дм3 (Р = 0,95), (3)
где D - характеристика погрешности измерения для данной массовой концентрации конкретного соединения (таблицы 2, 3).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
8.2. Вычисление коэффициентов пересчета
Коэффициент пересчета (K) того или иного пестицида вычисляют по формуле
где Сд - добавка данного пестицида к пробе воды, мкг/дм3;
Cпр - концентрация данного пестицида в пробе воды с добавкой (среднее из 4 - 5 определений), мкг/дм3;
C - концентрация данного пестицида в пробе воды без добавки (среднее из 4 - 5 определений), мкг/дм3.
Если анализ проб осуществляли по варианту 1, то величины Cпр и C в формуле (4) находят по формуле (5)
Спр или ![]() (5)
(5)
или, если анализ осуществляли по варианту 2, - по формуле (6)
Cпр или
![]() (6)
(6)
где значения символов те же, что и в формулах (1) и (2), приведенных в 8.1.
9. Контроль погрешности измерений
Оперативный контроль погрешности проводят с использованием метода добавок. Периодичность контроля - не менее одной контрольной на 15 - 20 рабочих проб за период, в течение которого условия проведения анализа неизменны.
Для выполнения контроля измеряют концентрацию каждого пестицида в пробе без добавки (C) и в пробе с известной добавкой (Cпр). Добавка (Cд) к пробе должна составлять не более 100 % от содержания конкретного пестицида в пробе. При отсутствии пестицида в пробе добавка должна быть равна удвоенной минимально определяемой концентрации. Пробу с добавкой анализируют одновременно с рабочими пробами.
Результат контроля признают удовлетворительным, если:
|Cпр - С - Cд| £ Кп (7)
Норматив контроля (Кп) рассчитывают по формуле:
![]() (Р
= 0,95), (8)
(Р
= 0,95), (8)
где Dс и ![]() - характеристики систематической и
случайной составляющих погрешности измерения
концентрации конкретного пестицида в пробе без добавки С (таблицы 2, 3).
- характеристики систематической и
случайной составляющих погрешности измерения
концентрации конкретного пестицида в пробе без добавки С (таблицы 2, 3).
Если в исходной пробе определяемый пестицид не обнаружен, то погрешность рассчитывают для концентрации добавки.
При превышении норматива повторяют измерения с использованием другой пробы. При повторном превышении норматива выясняют причины, приводящие к неудовлетворительным результатам, и устраняют их.
10. Требования безопасности
10.1. При выполнении измерений массовой концентрации галогенорганических пестицидов в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в «Правилах по технике безопасности при производстве наблюдений и работ на сети Госкомгидромета», Л., Гидрометеоиздат, 1983, или в «Типовой инструкции по технике безопасности для гидрохимических лабораторий служб Роскомвода», М., 1995.
10.2. По степени воздействия на организм вредные вещества, используемые при выполнении определений, относятся к 1, 2, 3, 4 классам опасности по ГОСТ 12.1.007.
10.3. Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
10.4. Определение следует проводить при наличии вытяжной вентиляции. Оператор, выполняющий определение, должен быть проинструктирован о специфических мерах предосторожности при работе с галогенорганическими пестицидами.
10.5. Оператор, выполняющий измерения на хроматографе должен знать правила безопасности при работе с электрооборудованием, сжатыми и горючими газами.
11. Требования к квалификации операторов
Анализ проб на содержание галогенорганических пестицидов должен выполняться квалифицированным химиком-аналитиком, прошедшим соответствующую подготовку, знающим основы газовой хроматографии, владеющим техникой экстрагирования, очистки растворителей и хроматографирования.
12. Затраты времени на проведение анализа
Для проведения анализа серии из 6 проб воды по варианту 1 требуется:
- на подготовку посуды - 1,5 чел.-ч;
- на приготовление реактивов, материалов и растворов - 1,5 чел.-ч;
- на проведение определения и вычисления - 18 чел.-ч.
Для проведения анализа серии из 6 проб воды по варианту 2 требуется:
- на подготовку посуды - 1,5 чел.-ч;
- на приготовление реактивов, материалов и растворов - 1,5 чел.-ч;
- на проведение определения и вычисления - 14 чел.-ч.
ФЕДЕРАЛЬНАЯ СЛУЖБА ПО ГИДРОМЕТЕОРОЛОГИИ И МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ
ГИДРОХИМИЧЕСКИЙ ИНСТИТУТ
СВИДЕТЕЛЬСТВО №
66
об аттестации МВИ
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ массовой концентрации гексахлорбензола, альфа-, бета- и гамма-ГХЦГ, дикофола, дигидрогептахлора, 4,4'-ДДТ, 4,4'-ДДЕ, 4,4'-ДДД, трифлуралина в водах газохроматографическим методом.
ОСНОВАНА на извлечении пестицидов из воды экстрагированием н-гексаном, очистке экстракта концентрированной серной кислотой и количественном их определении методом газожидкостной хроматографии с детектором по захвату электронов.
РАЗРАБОТАНА Гидрохимическим институтом.
РЕГЛАМЕНТИРОВАНА в РД 52.24.412-95.
АТТЕСТОВАНА в соответствии с ГОСТ Р 8.563 (ГОСТ 8.010).
АТТЕСТАЦИЯ проведена Гидрохимическим институтом на основании результатов экспериментальных исследований в 1992 г. и метрологической экспертизы материалов в 1995 г.
В результате аттестации МВИ установлено:
1. МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Значения характеристик погрешности и ее составляющих представлены в таблицах 1 и 2
Таблица 1 - Значения характеристик погрешности и ее составляющих при определении галогенорганических пестицидов по варианту 1 методики (Р = 0,95)
|
Пестицид |
Диапазон измеряемых концентраций С, мкг/дм3 |
Характеристики составляющих погрешности, мкг/дм3 |
Характеристика погрешности, мкг/дм3, D |
|
|
случайной,
|
систематической Dc |
|||
|
ГХБ |
0,0020 - 0,0500 |
4 · 10-4 + 0,056 C |
3 · 10-4 + 0,045 C |
8 · 10-4 + 0,11 C |
|
Альфа-ГХЦГ |
0,0020 - 0,0500 |
4 · 10-4 + 0,087 C |
3 · 10-4 + 0,069 C |
8 · 10-4 + 0,17 C |
|
Бета-ГХЦГ |
0,010 - 0,300 |
0,001 + 0,056 C |
0,001 + 0,045 C |
0,003 + 0,11 C |
|
Гамма-ГХЦГ |
0,0020 - 0,0500 |
4 · 10-4 + 0,090 C |
3 · 10-4 + 0,072 C |
8 · 10-4 + 0,18 C |
|
Дигидрогептахлор |
0,0050 - 0,150 |
3 · 10-4 + 0,061 C |
3 · 10-4 + 0,049 C |
7 · 10-4 + 0,12 C |
|
4,4'-ДДЕ |
0,0050 - 0,150 |
0,001 + 0,047 C |
8 · 10-4 + 0,037 C |
0,002 + 0,093 C |
|
4,4'-ДДД |
0,010 - 0,300 |
6 · 10-4 + 0,11 C |
5 · 10-4 + 0,085 C |
0,001 + 0,22 C |
|
4,4'-ДДТ |
0,020 - 0,500 |
0,005 + 0,048 C |
0,004 + 0,038 C |
0,010 + 0,096 C |
|
Дикофол |
0,020 - 0,500 |
0,003 + 0,045 C |
0,002 + 0,036 C |
0,005 + 0,090 C |
|
Трифлуралин |
0,0050 - 0,150 |
8 · 10-4 + 0,074 С |
6 · 10-4 + 0,059 C |
0,0016 + 0,15 C |
Таблица 2 - Значения характеристик погрешности и ее составляющих при определении галогенорганических пестицидов по варианту 2 методики (Р = 0,95)
|
Пестицид |
Диапазон измеряемых концентраций C, мкг/дм3 |
Характеристики составляющих погрешности, мкг/дм3 |
Характеристика погрешности, мкг/дм3, D |
|
|
случайной,
|
систематической Dc |
|||
|
ГХБ |
0,0020 - 0,0500 |
4 · 10-4 + 0,044 C |
3 · 10-4 + 0,035 C |
8 · 10-4 + 0,089 C |
|
Альфа-ГХЦГ |
0,0020 - 0,0500 |
6 · 10-4 + 0,10 C |
4 · 10-4 + 0,081 C |
0,0011 + 0,20 C |
|
Бета-ГХЦГ |
0,010 - 0,300 |
0,002 + 0,049 C |
0,001 + 0,040 C |
0,003 + 0,089 C |
|
Гамма-ГХЦГ |
0,0020 - 0,0500 |
5 · 10-4 + 0,079 C |
4 · 10-4 + 0,063 C |
0,0010 + 0,16 C |
|
Дигидрогептахлор |
0,0050 - 0,150 |
0,0012 + 0,020 C |
0,00104 + 0,016 C |
0,0024 + 0,041 C |
|
4,4'-ДДЕ |
0,0050 - 0,150 |
0,001 + 0,036 C |
8 · 10-4 + 0,029 C |
0,0019 + 0,072 C |
|
4,4'-ДДД |
0,010 - 0,300 |
0,003 + 0,019 C |
0,002 + 0,015 C |
0,005 + 0,039 C |
|
4,4'-ДДТ |
0,020 - 0,200 |
0,001 + 0,092 C |
0,001 + 0,073 C |
0,003 + 0,18 C |
|
св. 0,200 - 0,500 |
0,019 |
0,015 |
0,038 |
|
|
Дикофол |
0,020 - 0,500 |
0,001 + 0,060 C |
0,001 + 0,048 C |
0,003 + 0,12 C |
|
Трифлуралин |
0,0050 - 0,0500 |
0,15 C |
0,12 C |
1 · 10-4 + 0,29 C |
|
св. 0,0500 - 0,150 |
0,0074 |
0,0059 |
0,015 |
|
2. Оперативный контроль погрешности измерений проводят в соответствии с разделом 9 РД 52.24.412-95.
3. Дата выдачи свидетельства март 1995 г.
Главный метролог ГУ ГХИ А.А. Назарова
СОДЕРЖАНИЕ