РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МЕТОДИКА ВЫПОЛНЕНИЯ
ИЗМЕРЕНИЙ МАССОВОЙ КОНЦЕНТРАЦИИ ОБЩЕГО АЗОТА
В ВОДАХ ФОТОМЕТРИЧЕСКИМ МЕТОДОМ
ПОСЛЕ ОКИСЛЕНИЯ ПЕРСУЛЬФАТОМ КАЛИЯ
Ростов-на-Дону
Предисловие
1 РАЗРАБОТАН Гидрохимическим институтом
2 РАЗРАБОТЧИКИ Л.В. Боева, канд. хим. наук (руководитель разработки), Г.А. Крятова
3 УТВЕРЖДЕН И ВВЕДЕН В ДЕЙСТВИЕ Начальником ГУЭМЗ Росгидромета Цатуровым Ю.С. 17.04.95 г.
4 ОДОБРЕН Секцией по методам химического и радиологического мониторинга природной среды ЦКПМ Росгидромета 11.04.95 г.,
5 СВИДЕТЕЛЬСТВО ОБ АТТЕСТАЦИИ МВИ Выдано Гидрохимическим институтом в 1995 г. № 13
6 ЗАРЕГИСТРИРОВАН ЦКБ ГМП в 1995 г. № 364
7 ВЗАМЕН РД 52.24.13-84
Введение
Азот - один из основных биогенных элементов, являющихся незаменимыми составными частями тканей любого живого организма.
В природных водах азот присутствует в виде двух основных групп - азота неорганических соединений и азота, входящего в состав органических веществ. В воде также имеется растворенный молекулярный азот, однако, количество его незначительно.
Неорганические соединения азота - нитриты, нитраты и ионы аммония - присутствуют в водах главным образом в растворенном виде. Органические азотсодержащие вещества в значительной степени могут находится в виде взвешенных и коллоидных форм. Состав органических соединений азота, присутствующих в водах, весьма разнообразен (простые и сложные белки, аминокислоты, амины, амиды, мочевина и др.).
Содержание общего азота в незагрязненных природных водах зависит от степени трофии водоема. В олиготрофных водоемах концентрация азота составляет 0,3 - 0,7 мг/дм3 , мезотрофных 0,7 - 1,3 мг/дм3 , эвтрофных 0,8 - 2,0 мг/дм3 .
Источниками поступления азота в природные воды являются: разложение клеток отмерших организмов, прижизненные выделения гидробионтов, атмосферные осадки, фиксация из воздуха в результате жизнедеятельности азотфиксирующих бактерий. Значительное количество азота может попадать в водоемы с бытовыми, сельскохозяйственными и промышленными сточными водами.
Понижение содержания соединений азота в водоемах связано, в основном, с потреблением их водными растениями. Некоторую роль в этом процессе играет денитрификация, т.е. перевод связанного азота в свободное состояние.
Содержание азота в природных водах является одним из показателей санитарного состояния водоема. Значительное повышение концентрации азота приводит к эвтрофикации водного объекта и ухудшению качества воды. Состав и соотношение минеральных и органических форм азота указывает на направление и интенсивность биологических и биохимических процессов, протекающих в водоеме, в том числе процессов самоочищения. Эта информация может быть использована не только для оценки качества воды, но при решении других вопросов, например, в установлении взаимосвязи между процессами жизнедеятельности водных организмов и химическим составом воды.
РД 52.24.364-95
РУКОВОДЯЩИЙ ДОКУМЕНТ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ. МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ МАССОВОЙ КОНЦЕНТРАЦИИ ОБЩЕГО АЗОТА В ВОДАХ ФОТОМЕТРИЧЕСКИМ МЕТОДОМ ПОСЛЕ ОКИСЛЕНИЯ ПЕРСУЛЬФАТОМ КАЛИЯ
Дата введения 01.07.95 г.
1 Назначение и область применения методики
Настоящий руководящий документ устанавливает фотометрическую методику выполнения измерений массовой концентрации общего азота в пробах природных и очищенных сточных вод в диапазоне 0,05 - 10,0 мг/дм3. При анализе проб воды с массовой концентрацией азота, превышающей 10,0 мг/дм3, необходимо соответствующее разбавление пробы водой, не содержащей соединений азота.
2 Нормы погрешности и значения характеристик погрешности измерения
В соответствии с ГОСТ 27384 нормы погрешности при выполнении измерений общего азота в природных водах в диапазоне массовых концентраций 0,1 - 0,5 мг/дм3 составляют ± 25 %, свыше 0,5 мг/дм3 - ± 10 %. Для сточных вод норма погрешности в диапазоне массовых концентраций 0,5 - 5,0 мг/дм3 составляет ± 25 %, от 5,0 до 50 мг/дм3 - ± 15 %, свыше 50 мг/дм3 - ± 10 %.
Установленные для настоящей методики значения характеристик погрешности и ее составляющих приведены в таблице 1.
При выполнении измерений общего азота в пробах с массовой концентрацией свыше 10,0 мг/дм3 после соответствующего разбавления погрешность измерения не превышает величины D ´ n, где D - погрешность измерения концентрации общего азота в разбавленной пробе; n - степень разбавления.
Таблица 1 - Значения характеристик погрешности и ее составляющих (Р = 0,95)
|
Характеристики составляющих погрешности, мг/дм3 |
Характеристика погрешности, мг/дм3, D |
||
|
случайной, |
систематической Dc |
||
|
0,05 - 10,00 |
0,01 + 0,04 °С |
0,01 + 0,02 °С |
0,02 + 0,07 °С |
3 Метод измерения
Определение общего азота основано на окислении азотсодержащих соединений персульфатом калия при нагревании в щелочной среде в результате чего азот, содержащийся в органических и неорганических соединениях, превращается в нитраты. Далее нитраты восстанавливаются с помощью кадмиевого редуктора до нитритов, а последние определяются по цветной реакции с реактивом Грисса фотометрическим методом.
Органический азот определяется по разности между общим содержанием азота и содержанием неорганических форм (нитратов, нитритов, ионов аммония).
Степень превращения органического азота в нитраты в основном составляет 90 - 100 %, за исключением соединений, содержащих азо- или гидразогруппы (-N = N-; -N = N). Степень окисления их до нитратов не превышает 40 %, а остальная часть превращается в свободный азот.
Мешающих влияний при фотометрическом определении общего азота с персульфатным окислением не обнаружено.
4 Средства измерений, вспомогательные устройства, реактивы, материалы
4.1 Средства измерений, вспомогательные устройства
4.1.1 Фотоэлектроколориметр типа КФК-2, КФК-2мп (КФК-3) по ТУ 3.3.1766, ТУ 3.3.1860 или спектрофотометр типа СФ-46 (СФ-26).
4.1.2 Весы аналитические 2 класса точности по ГОСТ 24104.
4.1.3 Весы технические лабораторные 4 класса точности по ГОСТ 24104 с пределом взвешивания 200 г, 500 г.
4.1.4 рН-метр типа рН-150, рН-155 по ТУ 25-7410.003, ТУ 25-7416.0171 или иономер типа Анион-210, Анион-214.
4.1.5 Шкаф сушильный общелабораторного назначения по ГОСТ 13474.
4.1.6 Насос вакуумный любого типа.
4.1.7 Плитка электрическая с закрытой спиралью и регулируемой мощностью нагрева по ГОСТ 14919.
4.1.8 Баня водно-глицериновая.
4.1.9 Термометр по ГОСТ 29224 с диапазоном 0 - 150 °С - 1
4.1.10 Колбы мерные не ниже 2 класса точности по ГОСТ 1770 вместимостью: 100 см3 - 8
4.1.11 Пипетки градуированные не ниже 2 класса точности по ГОСТ 29227 вместимостью: 2 см3 - 4
5 см3 - 2
10 см3 - 2
4.1.12 Пипетки с одной отметкой не ниже 2 класса точности по ГОСТ 29169 вместимостью: 5 см3 - 2
10 см3 - 1
20 см3 - 1
25 см3 - 1
4.1.13 Цилиндры мерные по ГОСТ 1770 вместимостью: 25 см3 - 2
100 см3 - 2
250 см3 - 1
500 см3 - 1
1000 см3 - 1
4.1.14 Колбы конические или плоскодонные по ГОСТ 25336 вместимостью 50 - 100 см3 - 7
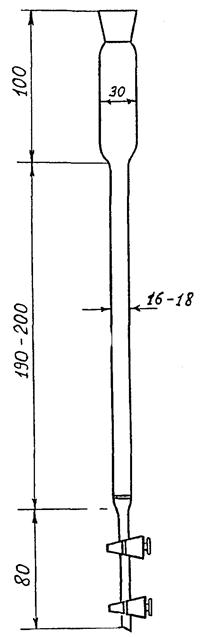
4.1.15 Редуктор (рисунок 1) - 1
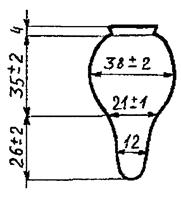
4.1.16 Пробирки типа П1 или П2 по ГОСТ 25336 высотой 200 мм, диаметром 21 мм с пробками-холодильниками (рисунок 2) - 7
4.1.17 Воронки лабораторные по ГОСТ 25336 диаметром 5 - 6 см - 2
4.1.18 Стаканы химические по ГОСТ 25336 вместимостью: 100 см3 - 2
250 см3 - 1
500 см3 - 1
1000 см3 - 1
Рисунок 1 - Редуктор
Рисунок 2 - Пробка-холодильник
4.1.19 Стаканчики для взвешивания (бюксы) по ГОСТ 25336 - 3
4.1.20 Колонки стеклянные ионообменные с краном и пористой пластиной высотой 50 - 70 см или бюретки с прямым краном вместимостью 50 см3 с прокладкой из стеклоткани или стекловаты - 2
4.1.21 Склянка с тубусом по ГОСТ 25336 вместимостью 2 - 3 дм3 - 1
4.1.22 Колба с тубусом (колба Бунзена) по ГОСТ 25336 - 1
4.1.23 Воронка фильтрующая с пористой пластиной (пор 160) по ГОСТ 25336 - 1
4.1.24 Палочка стеклянная - 1
4.1.25 Эксикатор по ГОСТ 25336 - 1
4.1.26 Чашка фарфоровая по ГОСТ 9147 диаметром 12 см - 1
4.1.27 Шпатель пластмассовый - 1
4.1.28 Устройство для фильтрования проб с использованием мембранных или бумажных фильтров.
Допускается использование других типов средств измерений, посуды и вспомогательного оборудования, в том числе импортных, с характеристиками не хуже, чем у приведенных в 4.1.
4.2 Реактивы и материалы
4.2.1 Мочевина по ГОСТ 6691, ч.д.а.
4.2.2 Д,L-лейцин по ТУ 6-09-1170, ч.
4.2.3 Калий надсернокислый (калия персульфат) по ГОСТ 4146, х.ч. или ч.д.а., перекристаллизованный.
4.2.4 Хлорид аммония по ГОСТ 3773, ч.д.а.
4.2.5 Натрия гидроксид по ГОСТ 4328, х.ч. (допустимо ч.д.а.) или калия гидроксид по ГОСТ 24363, ч.д.а.
4.2.6 Серная кислота по ГОСТ 4204, ч.д.а.
4.2.7 Соляная кислота по ГОСТ 3118, ч.д.а.
4.2.8 Уксусная кислота (ледяная) по ГОСТ 61, ч.д.а.
4.2.9 Реактив Грисса по ТУ 6-09-3569, ч.д.а. или кислота сульфаниловая по ГОСТ 5821, ч.д.а. и 1-нафтиламин по ГОСТ 8827, ч.д.а.
4.2.10 Вода дистиллированная по ГОСТ 6769.
4.2.11 Вода деионированная (получение см. 6.1.12).
4.2.12 Глицерин по ГОСТ 6259, ч.
4.2.13 Фильтры мембранные «Владипор МФА-МА», 0,45 мкм, по ТУ 6-05-1903 или другого типа, равноценные по характеристикам или фильтры бумажные обеззоленные «синяя лента» по ТУ 6-09-1678.
4.2.14 Фильтры бумажные обеззоленные «белая лента» по ТУ 6-09-1678.
4.2.15 Катионит сильнокислотный КУ-2 по ГОСТ 20298, или КРС-5п-Т40 по ТУ 6-09-10-829 или другой, равноценный по характеристикам.
4.2.16 Анионит сильноосновной АВ-17 или АРА-4п по ТУ 6-09-10-723 или другой, равноценный по характеристикам.
4.2.17 Универсальная индикаторная бумага по ТУ 6-09-1181. Допускается использование реактивов, изготовленных по другой нормативно-технической документации, в том числе импортных, с квалификацией не ниже указанной в 4.2.
4.3 Дополнительное оборудование и реактивы для подготовки кадмиевого редуктора
4.3.1 Источник постоянного тока любого типа, позволяющий получить напряжение на ячейке 3 В при величине тока не менее 2 А.
4.3.2 Вольтметр постоянного тока по ГОСТ 8711, позволяющий измерить напряжение 3 В.
4.3.3 Амперметр постоянного тока по ГОСТ 8711, позволяющий измерить ток 1 - 2 А.
4.3.4 Колбы мерные по ГОСТ 1770 вместимостью 250 см3 и 1 дм3.
4.3.5 Пипетка градуированная по ГОСТ 20292 вместимостью 1 см3.
4.3.6 Сосуд стеклянный или пластмассовый вместимостью 2 - 3 дм3, диаметром не менее 15 см.
4.3.7 Свинцовая пластинка площадью 80 - 100 см2.
4.3.8 Кадмий металлический по ТУ 6-09-3095, сплавленный в виде палочки.
4.3.9 Сульфат кадмия по ГОСТ 4456, ч.д.а.
4.2.10 Калия нитрат по ГОСТ 4217, ч.д.а.
4.3.11 Нитрит натрия по ГОСТ 4197, ч.д.а.
4.3.12 Сульфат меди пентагидрат по ГОСТ 4165, ч.д.а.
5 Отбор и хранение проб
Отбор проб производят в соответствии с ГОСТ 17.1.5.05 в склянки вместимостью 0,25 - 0,5 дм3. Устройство для отбора проб и склянки трижды ополаскивают отбираемой водой. Отобранную пробу фильтруют через мембранный фильтр с размером пор 0,45 мкм. Мембранные фильтры перед употреблением очищают двух- трехкратным кипячением в течение 15 - 20 минут в 100 см3 деионированной воды. Чистые фильтры хранят в плотно закрытом бюксе. При отсутствии мембранных фильтров допустимо использовать бумажные обеззоленные фильтры «синяя лента». При фильтровании через любой фильтр первую порцию фильтра следует отбросить. В связи с тем, что соединения азота биохимически неустойчивы, пробу следует анализировать в течение суток. Длительное хранение возможно при замораживании пробы. Пробы, законсервированные серной кислотой (1 см3 раствора H2SO4 (1:1) на 1 дм3 воды), можно хранить 3 - 5 дней в прохладном месте.
6. Подготовка к выполнению измерений
6.1 Приготовление растворов и реактивов
6.1.1 Раствор персульфата калия
4 г персульфата калия (перекристаллизованного при необходимости) растворяют в 100 см теплой (t° = 40 - 45 °С) деионированной воды. Раствор хранят не более недели в темной склянке в прохладном месте (но не в холодильнике).
Перекристаллизация персульфата калия. 70 г соли растворяют в 350 см3 нагретой до температуры 65 °С деионированной воды. При необходимости быстро фильтруют через неплотный обеззоленный бумажный фильтр. Охлаждают в бане со льдом. Выпавшие кристаллы фильтруют через стеклянный фильтр под вакуумом и высушивают в вакуум-эксикаторе или обычном эксикаторе над концентрированной серной кислотой. Хранят высушенный препарат в плотно закрытой склянке из темного стекла.
6.1.2 Раствор гидроксида натрия или калия, 1,5 моль/дм3
15 г гидроксида натрия или 21 г гидроксида калия растворяют в 250 см3 деионированной воды. Хранят в полиэтиленовой посуде.
6.1.3 Раствор хлорида аммония, 5 г/дм3
5 г хлорида аммония растворяют в 1 дм3 дистиллированной воды. Раствор устойчив в течение 6 мес.
6.1.4 Раствор реактива Грисса
Приготовление из готового препарата. В бюксе взвешивают на технических весах 10 г сухого, растертого в ступке до однородной массы реактива Грисса и растворяют его в 100 см3 12 % раствора уксусной кислоты. Раствор фильтруют через бумажный фильтр. Хранят в склянке из темного стекла с притертой или полиэтиленовой пробкой в холодильнике не более недели. При комнатной температуре допустимо хранение не более 2 суток.
Приготовление из 1-нафтиламина и сульфаниловой кислоты.
Раствор сульфаниловой кислоты. Взвешивают на технических весах 2,0 г сульфаниловой кислоты и растворяют её в 300 см3 12 % раствора уксусной кислоты. Для ускорения растворения смесь можно слегка подогреть в горячей воде. Раствор устойчив в течение нескольких месяцев при хранении в темном месте.
Раствор 1-нафтиламина. В бюксе взвешивают 0,1 г 1-нафтиламина, растворяют его в нескольких каплях ледяной уксусной кислоты, добавляют 150 см3 12 % раствора уксусной кислоты и перемешивают. Раствор фильтруют и хранят в темной склянке в прохладном месте не более месяца.
Раствор реактива Грисса готовят, смешивая равные объемы растворов сульфаниловой кислоты и 1-нафтиламина. Раствор используют в день приготовления.
6.1.5 Раствор уксусной кислоты, 12 %
К 440 см3 дистиллированной воды приливают 60 см3 ледяной уксусной кислоты и перемешивают. Хранят в склянке с притертой пробкой.
6.1.6 Раствор серной кислоты, 0,05 моль/дм3
2,8 см3 концентрированной серной кислоты растворяют в 1 дм3 дистиллированной воды.
6.1.7 Раствор серной кислоты, 0,025 моль/дм3
К 250 см3 серной кислоты 0,05 моль/дм3 добавляют 250 см3 дистиллированной воды и перемешивают.
6.1.8 Раствор гидрооксида натрия, 1 моль/дм3
40 г гидрооксида натрия растворяют в 1 дм3 дистиллированной воды.
6.1.9 Раствор соляной кислоты, 1 моль/дм3
84 см3 концентрированной соляной кислоты растворяют в 920 см3 дистиллированной воды
6.1.10 Подготовка колонки с катионитом к работе
Сухую смолу выдерживают в дистиллированной воде в течение суток, помещают в ионообменную колонку на высоту около 50 см, следя за равномерным распределением смолы в колонке. После этого смолу «тренируют» пропуская последовательно по 100 см3 раствора соляной кислоты, дистиллированной воды, раствора гидроксида натрия и вновь дистиллированной воды. Скорость пропускания растворов примерно 1 - 2 капли в секунду цикл обработки смолы повторяют 8 - 10 раз. После этого пропускают 100 см3 раствора соляной кислоты и промывают смолу дистиллированной водой до pH 6 по универсальной индикаторной бумаге.
Регенерацию катионита осуществляют, пропуская через колонку 100 см3 раствора соляной кислоты 1 моль/дм3 и затем промывая ее дистиллированной водой.
6.1.11 Подготовка колонки с анионитом к работе
Сухую смолу выдерживают в дистиллированной воде в течение суток, помещают в ионообменную колонку на высоту около 50 см, следя за равномерным распределением смолы в колонке. После этого смолу «тренируют», пропуская последовательно по 100 см3 раствора гидроксида натрия, дистиллированной воды, раствора соляной кислоты и вновь дистиллированной воды. Скорость пропускания растворов примерно 1 - 2 капли в секунду. Цикл обработки смолы повторяют 8 - 10 раз. Заканчивают обработку смолы раствором гидроксида натрия и промывают дистиллированной водой до pH 7 по универсальной бумаге.
Регенерацию анионита осуществляют, пропуская через колонку 100 см3 раствора гидроксида натрия 1 моль/дм3 и затем промывая ее дистиллированной водой.
6.1.12 Получение депонированной воды
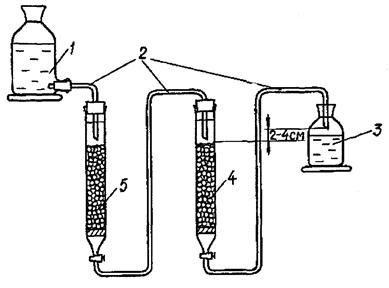
Для получения деионированной воды собирают установку, схема которой изображена на рисунке 3.
1 - склянка с дистиллированной водой; 2 - пластиковые соединительные трубки; 3 - склянка с деионированной водой; 4 - колонка с катионитом; 5 - колонка с анионитом.
Рисунок 3 - Схема установки для деионирования воды
Колонки примерно на 1/2 высоты заполняют дистиллированной водой и добавляют в них катионит или анионит, так, чтобы не оставалось воздушных пузырьков. По мере необходимости избыток воды сливают из колонки. После заполнения колонок их соединяют, как показано на схеме. Для получения деионированной воды дистиллированную воду пропускают через колонку с анионитом, а затем катионитом со скоростью 1 - 2 капли в секунду.
6.1.13 Водно-глицериновая смесь
1 часть глицерина смешивают с 2 частями дистиллированной воды.
6.2 Подготовка водно-глицериновой бани
В качестве бани может использоваться любой металлический сосуд высотой около 20 см с плотно закрывающейся крышкой. В крышке вырезают отверстия для установки пробирок и термометра. Диаметр отверстий должен как можно более точно соответствовать диаметру пробирок для предотвращения значительного испарения воды из бани. Пробирки установленные в бане, должны выступать над крышкой не более, чем на 2 см.
Количество отверстий зависит от диаметра бани, но их должно быть не менее 7. На дно бани следует положить металлическую сетку или подставку с отверстиями произвольного размера. Если стенки сосуда тонкие, для уменьшения теплообмена снаружи его следует покрыть слоем асбеста. Баня заполняется водно-глицериновой смесью на высоту 14 - 16 см и устанавливается на электроплитку мощностью 0,8 - 1 кВт.
Температура бани после закипания должна быть 103 - 104 °С. Если температура ниже требуемой величины, в смесь следует добавить глицерин, в противном случае - разбавить водой. В процессе кипения за счет небольшого испарения воды температура бани может повышаться на 1 - 2 °С. Перед выполнением анализа следующей серии в баню следует добавить дистиллированную воду до первоначального уровня и проверить температуру кипения.
Для нагревания пробирок вместо водно-глицериновой бани может использоваться термостат, позволяющий установить необходимую температуру и обеспечить равномерное нагревание жидкости в пробирках.
6.3 Подготовка кадмиевого редуктора
6.3.1 Раствор сульфата меди
10 г сульфата меди растворяют в 0,5 дм3 дистиллированной воды.
6.3.2 Раствор сульфата кадмия
400 г сульфата кадмия растворяют в 1 дм3 дистиллированной воды и доводят pH полученного раствора до 2 по универсальной индикаторной бумаге с помощью серной кислоты.
6.3.3 Раствор соляной кислоты, 0,05 моль/дм3
4,4 см3 концентрированной соляной кислоты приливают к 1 дм3 дистиллированной воды и перемешивают.
6.3.4 Раствор нитрата калия с концентрацией азота 250 мг/дм3
Взвешивают на аналитических весах 0,4510 г нитрата калия, высушенного предварительно при 110 °С, количественно переносят его в мерную колбу вместимостью 250 см3 и растворяют в дистиллированной воде.
Раствор хранят в темной, плотно закрытой склянке не более 6 мес.
6.3.5 Раствор нитрита натрия с концентрацией азота 250 мг/дм3
Взвешивают на аналитических весах 0,3079 г нитрита натрия, высушенного предварительно при 105 °С, количественно переносят его в мерную колбу вместимостью 250 см3 и растворяют в дистиллированной воде. Объем раствора доводят до метки на колбе и перемешивают. Раствор хранят в темной, плотно закрытой склянке при 3 - 5 °С не более 1 мес.
6.3.6 Получение мелкокристаллического кадмия электролитическим путем
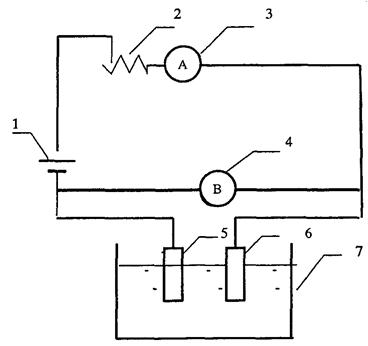
Для проведения электролиза собирают установку по схеме, приведенной на рисунке 4.
Высота электролита в сосуде должна быть не менее 12 см, расстояние между электродами не менее 8 - 10 см, напряжение на ячейке устанавливают 3 В при силе тока в цепи 1,2 - 1,8 А. Сила тока регулируется глубиной погружения кадмиевой палочки. Во избежание замыкания электроды не должны касаться дна и стенок электролизера.
Образующиеся в процессе электролиза кристаллы собирают пластмассовым шпателем непосредственно с катода. Не следует допускать, чтобы кристаллы скапливались на дне сосуда. Для предотвращения окисления кристаллы кадмия хранят под водой.
1 - источник постоянного тока; 2 - переменное сопротивление; 3 - амперметр; 4 - вольтметр; 5 - анод (кадмиевая палочка, помещенная в мешочек из марли или неплотной ткани); 6 - катод (свинцовая пластина); 7 - сосуд с раствором сульфата кадмия.
Рисунок 4 - Схема установки для получения кадмия электролизом
Дальнейшему измельчению кадмий подвергать не следует.
Вместо свинцового катода можно взять кадмиевую палочку. В этом случае следует обязательно поставить стеклянную пластину между электродами, т.к. образующиеся на катоде кристаллы вытягиваются по направлению к аноду. Выход кадмия близок к теоретическому и составляет около 2 г/А·ч.
Вместо электролитического кадмия можно использовать также кадмиевые опилки, полученные измельчением кадмиевой палочки грубым напильником или пилой с крупными зубьями. Размер опилок должен быть около 1 мм.
6.3.7 Омеднение кадмия
120 г измельченного кадмия помещают в стакан вместимостью 1 дм3, промывают 300 см3 раствора соляной кислоты 0,05 моль/дм3, затем дистиллированной водой и заливают 500 см3 раствора сульфата меди. Перемешивают до обесцвечивания раствора сульфата меди. После омеднения кадмий следует тщательно отмыть дистиллированной водой от мелких частиц, не осаждающихся в течение 2 - 3 с после интенсивного перемешивания кристаллов омедненного кадмия в стакане с водой.
6.3.8 Подготовка кадмиевого редуктора
Омедненный кадмий переносят в редуктор, заполненный дистиллированной водой, следя за тем, чтобы он равномерно распределялся по колонке, без пустот и воздушных пузырьков.
После заполнения редуктора омедненным кадмием необходимо пропустить через редуктор 1,0 - 2,0 дм3 стабилизирующего раствора с содержанием нитратного азота 0,2 мг/дм3. Для его приготовления в мерную колбу вместимостью 1 дм3 помещают 0,8 см3 раствора нитрата калия с концентрацией азота 250 мг/дм3, добавляют 20 см3 раствора хлорида аммония, доводят дистиллированной водой до метки и перемешивают.
Для каждого вновь подготовленного редуктора следует установить оптимальную скорость пропускания пробы. Для этого берут по 100 см3 стабилизирующего раствора и пропускают его через редуктор с различной скоростью (в интервале от 8 до 14 см3/мин). Первые 60 - 65 см3 раствора, прошедшего через редуктор отбрасывают, последующие 25 см3 отбирают в коническую колбу, добавляют 1,5 см3 реактива Грисса и через 40 мин измеряют оптическую плотность. Оптимальной является скорость, при которой оптическая плотность раствора максимальна.
Для определения степени восстановления редуктора следует сравнить оптическую плотность раствора, полученного при пропускании его через редуктор с оптимальной скоростью, с оптической плотностью раствора с концентрацией нитритного азота 0,2 мг/дм3 к 25 см3 которого добавлено 1,5 см3 реактива Грисса. Для приготовления раствора с концентрацией нитритного азота 0,2 мг/дм3 0,8 см3 раствора нитрита натрия с концентрацией азота 250 мг/дм3 помещают в мерную колбу вместимостью 1 дм3, доводят до метки дистиллированной водой и перемешивают.
При необходимости следует провести определение холостой пробы и ввести поправку на содержание нитратов в дистиллированной воде.
Степень восстановления (%) равна A(NO3-)/A(NO2-) ´ 100, где A(NO3-) и A(NO2-) - оптические плотности стандартных растворов нитрата и нитрита, за вычетом поглощения холостой пробы. Удовлетворительным считается редуктор, у которого степень восстановления превышает 90 %.
При падении степени восстановления редуктора следует кадмий из колонки перенести в стакан и промыть 300 см3 раствора соляной кислоты с концентрацией 0,05 моль/дм3, затем отмыть кадмий от мелких частиц (как это описано выше) дистиллированной водой. Промывание кадмия следует проводить до тех пор, пока вода над ним после взбалтывания не останется совершенно прозрачной.
Отмытый кадмий загружают в редуктор и вновь проверяют степень восстановления. Если указанная процедура не приведет к повышению степени восстановления, колонку следует заполнить свежей порцией омедненного кадмия.
Продолжительность работы кадмиевого редуктора зависит от состава анализируемой воды и может достигать нескольких сотен проб.
6.4 Приготовление градуировочного раствора
Градуировочный раствор, аттестованный по процедуре приготовления, готовят из мочевины и D,L-лейцина.
Погрешность, обусловленная процедурой приготовления градуировочного раствора, не превышают 1,5 % относительно приписанного значения массовой концентрации общего азота.
6.4.1 Раствор мочевины, 500 мг/дм3 азота
0,1077 г мочевины, предварительно высушенной в течение 1 ч при 105 °С, растворяют в деионированной воде, переносят в мерную колбу вместимостью 100 см3, доводят до метки деионированной водой и перемешивают.
6.4.2 Раствор мочевины, 100 мг/дм3 азота
20 см3 раствора мочевины с концентрацией 500 мг/дм3 помещают в мерную колбу вместимостью 100 см3, доводят объем до метки деионированной водой и перемешивают.
6.4.3 Раствор D,L-лейцина, 100 мг/дм3 азота
0,0944 г D,L-лейцина растворяют в 5 см3 раствора гидроксида натрия или калия 1,5 моль/дм3, переносят в мерную колбу вместимостью 100 см3, доводят объем до метки деионированной водой и перемешивают.
Растворы мочевины и D,L-лейцина хранят в темных склянках с пришлифованными пробками в течение 1 мес при комнатной температуре и до 3 мес в холодильнике.
6.4.4 Градуировочный раствор
5,0 см раствора D,L-лейцина и 5,0 см3 раствора мочевины с концентрацией 100 мг/дм3 помещают в мерную колбу вместимостью 100 см3, доводят до метки деионированной водой и перемешивают.
Массовая концентрация общего азота в градуировочном растворе равна 10,0 мг/дм3. Раствор используют в день приготовления.
6.5 Установление градуировочной зависимости
В пробирки, дважды промытые деионированной водой, помещают 0; 0,5; 1,0; 1,5; 2,0; 2,5; 3,0 см3 градуировочного раствора и доводят объем пробы в каждой пробирке до 10 см3 деионированной водой. Содержание общего азота в пробах составит соответственно 0; 0,005; 0,010; 0,015; 0,020; 0,025 и 0,030 мг. Далее выполняют все операции, описанные в разделе 8.
Градуировочную зависимость устанавливают в координатах: содержание азота в пробе, мг - оптическая плотность графически или рассчитывают методом наименьших квадратов.
Градуировочную зависимость устанавливают не реже 1 раза в квартал и, в обязательном порядке, при использовании новой партии персульфата калия и реактива Грисса, либо замене измерительного прибора.
7 Условия выполнения измерений
В помещении, где выполняют измерения общего азота, не следует проводить работы, связанные с применением растворов аммиака и других летучих соединений азота.
8 Выполнение измерений
Пробирки для сжигания и пробки-холодильники дважды промывают деионированной водой и помещают в них аликвоту (2 - 25 см3) пробы воды, содержащую не более 0,030 мг азота. Рекомендуемый объем аликвоты при различной концентрации азота приведен в таблице 2.
Таблица 2 - Рекомендуемый объем пробы воды для фотометрического измерения общего азота
|
0,05 - 0,3 |
0,3 - 0,5 |
0,5 - 2,0 |
2,0 - 5,0 |
5,0 - 10,0 |
|
|
Объем пробы, см3 |
25 |
20 |
10 |
5 |
2 |
Добавляют 3 см3 раствора персульфата калия и 1,5 см3 раствора гидроксида натрия или калия. Закрывают пробирки пробками-холодильниками, заполненными дистиллированной водой, и немедленно помещают в кипящую водно-глицериновую баню. Одновременно с каждой серией проб проводят анализ холостой пробы. Для этого в пробирку помещают 3 см3 раствора персульфата калия и 1,5 см3 раствор гидроксида натрия или калия и также ставят в баню. Уровень жидкости в бане должен быть выше уровня жидкости в пробирках не менее чем на 2 см. Температура бани, измеренная через 15 мин после установки в нее пробирок, должна быть 104 ± 1 °С.
Через 40 - 45 мин (не более) пробирки вынимают из бани и охлаждают. Содержимое каждой пробирки количественно переносят в стакан вместимостью 100 см3, предварительно сполоснув пробки-холодильники небольшим количеством дистиллированной воды, доводят pH пробы до 7 - 8 раствором серной кислоты 0,05 моль/дм3 с помощью pH-метра. При отсутствии pH-метра допустимо использование универсальной индикаторной бумаги. При анализе сильно минерализованных проб образуются обильные осадки гидроксидов металлов, не растворяющихся при доведении pH до величины 7 - 8. В таком случае необходимо подкислить пробу до pH 2 - 3, а затем нейтрализовать раствором щелочи.
Количественно переносят раствор в мерную колбу, вместимостью 100 см3, добавляют 2 см3 раствора хлорида аммония, доводят до метки дистиллированной водой, перемешивают и пропускают через кадмиевый редуктор с оптимальной скоростью добавляя пробу порциями по 20 - 25 см3. Первые 60 - 65 см3 пробы, прошедшие через редуктор, отбрасывают, следующую порцию раствора (25 см3) отбирают в цилиндр вместимостью 25 см3. Предварительно цилиндр ополаскивают тем же раствором.
Из цилиндра переносят раствор в сухую коническую или плоскодонную колбу, немедленно добавляют 1,5 см3 раствора реактива Грисса и перемешивают. Через 40 минут измеряют оптическую плотность на фотоэлектроколориметре с зеленым светофильтром или спектрофотометре при длине волны 520 нм в кюветах длиной 1 см против дистиллированной воды. Оптическую плотность холостого опыта вычитают из оптической плотности проб.
После пропускания каждой серии проб колонку следует промыть 20 см3 раствора серной кислоты 0,025 моль/дм3, затем дистиллированной водой (80 - 100 см3).
Если при минерализации проб образуется белый осадок, не растворяющийся при подкислении, после нейтрализации пробу фильтруют через беззольный фильтр, предварительно промытый дистиллированной водой, в мерную колбу вместимостью 100 см3, стаканчик и фильтр промывают дистиллированной водой, собирая промывные воды в ту же мерную колбу, добавляют 2 см3 хлористого аммония, доводят объем до метки водой и далее проводят определение как описано выше.
При анализе сильнозагрязненных вод (ХПК > 50 мг/дм3) следует добавить в пробу 5 см3 раствора персульфата калия и 2 см3 раствора щелочи. Аналогично выполняют анализ холостой пробы.
9 Вычисление результатов измерений
Массовую концентрацию общего азота в анализируемой пробе воды рассчитывают по формуле:
![]() (1)
(1)
где Cx - массовая концентрация общего азота в анализируемой воде, мг/дм3;
а - содержание общего азота в пробе, найденное по градуировочной зависимости, мг;
V - объем пробы, взятый для анализа, см3.
Результат измерения в документах, предусматривающих его использование, представляют в виде:
Cx ± D, мг/дм3 (Р = 0,95), (2)
где D - характеристика погрешности измерения для данной массовой концентрации общего азота (таблица 1).
Численные значения результата измерения должны оканчиваться цифрой того же разряда, что и значения характеристики погрешности.
10 Контроль погрешности измерений
Оперативный контроль погрешности проводят по воспроизводимости результатов определения общего азота в повторных рабочих пробах воды. Периодичность контроля - не менее одной контрольной на 15 - 20 рабочих проб за период, в течение которого условия проведения анализа неизменны.
Для проведения контроля выполняют измерение общего азота в основной и контрольной пробе. Интервал между анализом основной и контрольной пробы должен составлять от 1 до 3 дней.
Результат контроля признают удовлетворительным, если расхождение результатов основного (Cx1) и контрольного (Сx2) измерения не превышает норматива контроля (Кв):
Норматив контроля рассчитывают по формуле:
где ![]() - характеристика случайной составляющей
погрешности для массовой концентрации общего азота, рассчитанной по формуле (Cx1 + Сx2)/2 (таблица
1).
- характеристика случайной составляющей
погрешности для массовой концентрации общего азота, рассчитанной по формуле (Cx1 + Сx2)/2 (таблица
1).
При превышении норматива проводят повторное определение общего азота в контрольной пробе. При повторном превышении норматива выясняют причины, приводящие к неудовлетворительным результатам и устраняют их.
11 Требования безопасности
11.1 При выполнении измерений массовой концентрации общего азота в пробах природных и очищенных сточных вод соблюдают требования безопасности, установленные в «Правилах по технике безопасности при производстве наблюдений и работ на сети Госкомгидромета», Л., Гидрометеоиздат, 1983, или в «Типовой инструкции по технике безопасности для гидрохимических лабораторий служб Роскомвода», М., 1995.
11.2 По степени воздействия на организм вредные вещества, используемые при выполнении определений, относятся к 1, 2, 3 классам опасности по ГОСТ 12.1.007.
11.3 Содержание используемых вредных веществ в воздухе рабочей зоны не должно превышать установленных предельно допустимых концентраций в соответствии с ГОСТ 12.1.005.
12 Требования к квалификации операторов
К выполнению измерений и обработке их результатов допускаются лица со средним профессиональным образованием, имеющие стаж работы в лаборатории не менее 6 месяцев, освоившие методику анализа.
13 Затраты времени на проведение анализа
На подготовительные работы требуется:
- на подготовку и регенерацию ионообменных колонок для получения деионированной воды в год - 24 чел.-ч;
- на подготовку и регенерацию кадмиевого редуктора в год - 16 чел.-ч при объеме работ до 300 проб за год и 20 чел.-ч - более 300 проб;
- на приготовление растворов и реактивов в год - 25 чел.-ч;
- на установление градуировочной зависимости - 3,6 чел.-ч.
На выполнение определения общего азота требуется:
- в единичной пробе - 2,0 чел.-ч.;
- в серии из 10 проб - 5,5 чел.-ч.
Затраты времени на подготовку посуды включены в затраты времени на проведение анализа.
ФЕДЕРАЛЬНАЯ СЛУЖБА РОССИИ ПО ГИДРОМЕТЕОРОЛОГИИ И МОНИТОРИНГУ ОКРУЖАЮЩЕЙ СРЕДЫ
ГИДРОХИМИЧЕСКИЙ ИНСТИТУТ
СВИДЕТЕЛЬСТВО № 13
об аттестации МВИ
МЕТОДИКА ВЫПОЛНЕНИЯ ИЗМЕРЕНИЙ массовой концентрации общего азота в водах фотометрическим методом после окисления персульфатом калия.
ОСНОВАНА на окислении азотсодержащих соединений персульфатом калия при нагревании в щелочной среде в результате чего азот, содержащийся в органических и неорганических соединениях, превращается в нитраты. Далее нитраты восстанавливаются с помощью кадмиевого редуктора до нитритов, а последние определяются по цветной реакции с реактивом Грисса фотометрическим методом.
РАЗРАБОТАНА Гидрохимическим институтом.
РЕГЛАМЕНТИРОВАНА в РД 52.24.364-95.
АТТЕСТОВАНА в соответствии с ГОСТ Р 8.563 (ГОСТ 8.010).
АТТЕСТАЦИЯ проведена Гидрохимическим институтом на основании результатов экспериментальных исследований в 1984 г., и метрологической экспертизы материалов в 1995 г.
В результате аттестации МВИ установлено:
1. МВИ соответствует предъявляемым к ней метрологическим требованиям и обладает следующими основными метрологическими характеристиками:
Значения характеристик погрешности и ее составляющих (Р = 0,95)
|
Характеристики составляющих погрешности, мг/дм3 |
Характеристика погрешности, мг/дм3, D |
||
|
случайной, |
систематической Dc |
||
|
0,05 - 10,00 |
0,01 + 0,04 °С |
0,01 + 0,02 °С |
0,02 + 0,07 °С |
2. Оперативный контроль погрешности измерений проводят в соответствии с разделом 10 РД 52.24.364-95.
3. Дата выдачи свидетельства февраль 1995 г.
Главный метролог ГУ ГХИ А.А. Назарова
СОДЕРЖАНИЕ