Государственное санитарно-эпидемиологическое нормирование
Российской Федерации
4.2.
МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И
МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация контроля и методы
выявления бактерий Listeria
monocytogenes
в пищевых продуктах
Методические указания
МУК 4.2.1122-02
Минздрав России
Москва 2002
Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах: Методические указания. - М.: Федеральный центр Госсанэпиднадзора Минздрава России, 2002.
1. Разработаны: Федеральным центром Госсанэпиднадзора Минздрава России (Л.Г. Подунова, Э.Ф. Опочинский, Н.С. Кривопалова), ГУ Научно-исследовательским институтом питания Российской Академии медицинских наук (В.А. Тутельян, С.А. Шевелева, И.Б. Кунаева, Н.Р. Ефимочкина), Департаментом Госсанэпиднадзора Минздрава России (Н.Н. Иванова), Научно-исследовательским институтом эпидемиологии и микробиологии им. Н.Ф. Гамалеи РАМН (И.С. Тартаковский, С.А. Ермолаева, Т.С. Карпова), Центральным научно-исследовательским институтом эпидемиологии МЗ РФ (Б.Л. Черкасский), Центром Госсанэпиднадзора в г. Москве (Н.Я. Салова, В.П. Голованова), Центром Госсанэпиднадзора в Тульской области (Т.А. Попова), Всероссийским научно-исследовательским институтом мясной промышленности (Ю.Г. Костенко), Координационным микробиологическим центром рыбной промышленности ГИПРОРЫБФЛОТа (Л.Б. Мухина, Е.Ю. Дмитриева), Всероссийским научно-исследовательским институтом ветеринарной вирусологии и микробиологии (В.М. Котляров).
2. Утверждены Главным государственным санитарным врачом Российской Федерации - Первым заместителем министра здравоохранения Российской Федерации Г.Г. Онищенко 22.04.02.
3. Введены впервые.
СОДЕРЖАНИЕ
УТВЕРЖДАЮ
Главный государственный санитарный
врач Российской Федерации – Первый
заместитель Министра здравоохранения
Российской Федерации
Г.Г. Онищенко
22 апреля 2002 г.
МУК 4.2.1122-02
Дата введения: 1 июня 2002 г.
4.2. МЕТОДЫ КОНТРОЛЯ. БИОЛОГИЧЕСКИЕ И МИКРОБИОЛОГИЧЕСКИЕ ФАКТОРЫ
Организация контроля и методы выявления бактерий Listeria monocytogenes в пищевых продуктах
Методические указания
1. Общие положения и область применения
1.1. Настоящие методические указания устанавливают основные принципы организации контроля и методику проведения лабораторных исследований пищевых продуктов по выявлению в них бактерий Listeria monocytogenes.
При контроле пищевых продуктов на загрязненность патогенными микроорганизмами в СанПиН 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов» предусматривается новый микробиологический показатель «Listeria monocytogenes - не допускаются» в 25 г продуктов массового назначения и в 50 - 100 г для продуктов детского и специализированного питания.
Проведение контроля на Listeria monocytogenes позволит получить реальную картину ситуации в Российской Федерации, оценить степень загрязненности пищевой продукции и дать оценку эффективности принимаемых мер в целях обеспечения ее безопасности в плане новых и вновь возникающих возбудителей инфекций с пищевым путем передачи для здоровья и жизни человека.
1.2. Методические указания предназначены для применения в лабораториях учреждений государственной санитарно-эпидемиологической службы Российской Федерации, осуществляющих контроль за качеством продовольственного сырья и пищевых продуктов, в т.ч. импортируемых в Российскую Федерацию, гигиеническую оценку и выдачу санитарно-эпидемиологических заключений, а также бактериологическую диагностику заболеваний с пищевым путем передачи; в лабораториях других организаций, аккредитованных в установленном порядке на право проведения контроля безопасности пищевой продукции и продовольственного сырья; в организациях, независимо от форм собственности, осуществляющих производственный контроль продовольственного сырья и пищевых продуктов в процессе промышленного производства и выпуска продукции.
1.3. Методические указания являются обязательными при контроле пищевых продуктов в ходе проведения противоэпидемических мероприятий при возникновении вспышек, а также в порядке осуществления санитарно-эпидемиологического надзора.
1.4. Организация проведения контроля пищевых продуктов на Listeria monocytogenes.
Лабораторный контроль за отсутствием Listeria monocytogenes в пищевых продуктах, где нормируется этот показатель, проводится:
· в порядке надзора за соблюдением установленных требований в области обеспечения качества и безопасности пищевых продуктов в ходе проверок изготовления и оборота пищевой продукции, оказания услуг в сфере торговли и общественного питания;
· при экспертизе продукции и подтверждении соответствия требованиям нормативных документов для целей гигиенической оценки и выдачи санитарно-эпидемиологических заключений;
· при контроле за безопасностью продукции изготовителем (производственный контроль);
· в ходе проведения противоэпидемических мероприятий и при эпидрасследовании заболеваний.
1.5. При проведении контроля безопасности по показателю Listeria monocytogenes согласно Положению о государственной санитарно-эпидемиологической службе, утвержденному постановлением Правительства Российской Федерации от 24 июля 2000 г. № 554, должен осуществляться периодический отбор образцов пищевой продукции.
1.5.1. Порядок контроля и кратность исследований должны устанавливаться в соответствии с методическими и инструктивными документами, утвержденными или согласованными в установленном порядке органами государственной санитарно-эпидемиологической службы Российской Федерации, при этом необходимо учитывать специфику производства, степень его эпидзначимости, материально-техническое оснащение и т.п.
Особого внимания должны заслуживать предприятия, вырабатывающие продукты детского питания, детские молочные кухни, пищеблоки детских лечебно-профилактических учреждений, стационаров для онкологических, гематологических больных, домов ребенка, родильных домов, домов престарелых и инвалидов и т.п.
При проведении текущего надзора рекомендуемая минимальная периодичность выборочного лабораторного контроля пищевой продукции массового потребления - 1 раз в квартал; для детского и диетического питания - 2 раза.
1.5.2. При производственном контроле организация и периодичность лабораторных исследований продукции по показателю Listeria monocytogenes должна устанавливаться изготовителем продукции в соответствии с действующими санитарными правилами и согласовываться с учреждениями государственной санитарно-эпидемиологической службы по месту расположения предприятия-изготовителя.
1.5.3. Контроль пищевых продуктов по показателю Listeria monocytogenes с целью гигиенической оценки для выдачи санитарно-эпидемиологических заключений и подтверждения соответствия установленным требованиям при проведении экспертизы осуществляется в уполномоченных лабораториях центров Госсанэпиднадзора или других организаций, аккредитованных в установленном порядке.
1.6. В пищевых продуктах, предназначенных для непосредственного употребления в пищу, в отношении которых отсутствуют микробиологические нормативы или данные о возможности выделения Listeria monocytogenes, контроль Listeria monocytogenes не проводится, однако в случае заболеваний людей и/или нарушений в области обеспечения качества и безопасности пищевых продуктов образцы таких продуктов должны быть направлены на лабораторное исследование.
1.7. Организация лабораторных исследований на Listeria monocytogenes.
Допускается организация лабораторных исследований путем их поэтапного выполнения в лабораториях учреждений госсанэпидслужбы различных уровней. При отсутствии возможности идентификации выделенных культур последние могут быть переданы в лаборатории, располагающие соответствующей материально-технической базой и квалифицированным персоналом, для выдачи окончательного результата.
2. Сущность метода
Методические указания содержат описание метода выявления бактерий Listeria monocytogenes, основанного на высеве определенного количества продукта в жидкие селективные среды, инкубировании посевов, выявлении в этих посевах бактерий, способных расти и образовывать типичные колонии на агаризованных дифференциально-диагностических средах. Принадлежность выделенных культур к Listeria monocytogenes определяется по биохимическим, морфологическим и другим свойствам.
Метод выявления L. monocytogenes в пищевых продуктах основан на применении специальных селективных и дифференциально-диагностических сред. Селективность сред по отношению к сопутствующей микрофлоре обеспечивается включением в их состав хлорида лития, акрифлавина, циклогексимида, налидиксиновой кислоты, полимиксина или других антибиотиков. Внесение эскулина и цитрата аммония железа позволяет подтверждать наличие листерий по почернению среды за счет гидролиза эскулина в присутствии ионов Fe+. Подтверждающие тесты родовой и видовой идентификации включают окраску по Граму, определение подвижности выделенных на агаризованных средах типичных по физиологическим и морфологическим признакам культур, их способности восстанавливать нитраты до нитритов, сбраживать рамнозу, ксилозу и маннит, способности к гидролизу лецитина на ГРМ-среде с активированным углем, а также определение наличия В-гемолиза на кровяном агаре и дифференциацию L. monocytogenes от других гемолизирующих листерий в САМР-тесте с контрольными штаммами Stafphylocjccus aureus и Rhodococcus equi.
При необходимости для выявления L. monocytogenes в пищевых продуктах проводится постановка реакции нарастания титра фага (РНФ).
Предлагаемый метод обнаружения L. monocytogenes, гармонизированный с Международным стандартом ISO 11290-111996, предусматривает определение наличия или отсутствия L. monocytogenes в нормируемой массе продукта в соответствии с нормативами СанПиН 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов», выраженными в альтернативной форме и основанными на существующей системе отбора образцов и оценки результатов анализа по двухклассной системе.
Методические указания также содержат описание методики кондуктометрического определения L. monocytogenes в пищевых продуктах с использованием микробиологического анализатора «Бак Трак». Метод кондуктометрического анализа основан на регистрации изменений импеданса - сопротивления питательной среды, которые происходят в процессе роста и метаболической активности микроорганизмов.
3. Аппаратура, материалы, лабораторная посуда, реактивы и питательные среды
3.1. Аппаратура и инструментарий |
|
|
НД (ГОСТ, ТУ) |
|
|
Анализатор потенциометрический, погрешность измерений рН ±0,01 |
|
|
Шкаф сушильный стерилизационный ШСС-80П или других марок, позволяющий поддерживать температуру (160±5) °С |
ТУ 64-1-28-70-76 |
|
Термостат, позволяющий поддерживать рабочую температуру 37 °С с отклонением от заданной ±1 °С |
ТУ 64-1-1382-72 |
|
Баня водяная с подогревом |
|
|
Весы лабораторные общего назначения, 2 и 4 класса точности, с наибольшим пределом взвешивания 200 г |
|
|
Микроскоп биологический МБИ-1, МБИ-2, МБИ-3, МБР-1, МБР-3, МБС |
ГОСТ 8284-78 |
|
Стерилизаторы паровые медицинские или аналогичные |
|
|
Дистиллятор, обеспечивающий качество дистиллированной воды в соответствии с |
|
|
Гомогенизатор перистальтического типа «Стомайкер» или других наименований |
|
|
Облучатель бактерицидный настенный ОБН-150 или других видов |
ТУ 16-535-84 |
|
Холодильник бытовой электрический |
|
|
Пинцет медицинский |
|
|
Ножницы медицинские |
ГОСТ 21239-89 |
|
Скальпель хирургический, 15 см |
|
|
Штативы для пробирок |
|
|
Часы механические сигнальные |
|
|
Электроплитка |
|
3.2. Лабораторная посуда и материалы |
|
|
Бумага фильтровальная лабораторная |
|
|
Бутылки стеклянные для химических реактивов |
|
|
Кастрюли эмалированные |
|
|
Марля медицинская |
ГОСТ 9412-77 |
|
Колбы плоскодонные конические или круглые разной вместимости |
|
|
Воронки стеклянные |
|
|
Вата медицинская гигроскопическая |
|
|
Пипетки вместимостью 1, 2, 5 и 10 см3 |
|
|
Полистироловые планшеты U-образные |
|
|
Пробирки Уленгута (поплавки) |
|
|
Пробирки типов П1, П2 |
|
|
Стекла предметные для микропрепаратов |
|
|
Спиртовки лабораторные стеклянные |
|
|
Ступка фарфоровая с пестиком |
|
|
Термометр ртутный с диапазоном измерения от 0 до 100 °С (цена деления шкалы 1 °С) |
|
|
Чашки биологические (Петри) |
|
3.3. Реактивы и питательные среды |
|
|
НД (ФС, ТУ), фирма-изготовитель |
|
|
3.3.1. Реактивы, компоненты сред |
|
|
Агар микробиологический |
ГОСТ 17206-84 |
|
Вода дистиллированная |
|
|
D-глюкоза, ч. |
|
|
D-лактоза, 1-водная |
ТУ 6-09-22-98-79 |
|
Маннит |
|
|
Ксилоза |
|
|
Рамноза |
|
|
Калия гидроокись |
|
|
Калий фосфорнокислый однозамещенный, ч. |
|
|
Калий фосфорнокислый двузамещенный 3-водный |
|
|
Кислота соляная, х.ч. |
|
|
Литий хлористый, ч. или х.ч., или ч.д.а. |
|
|
Масло иммерсионное для микроскопии |
ГОСТ 31739-78 |
|
Набор реактивов для окраски по Граму |
|
|
Натрий-аммоний фосфорнокислый двузамещенный, 4-водный, ч. или х.ч. |
|
|
Натрия гидроокись, ч.д.а. |
|
|
Натрий лимоннокислый, 5,5-водный, ч.д.а. |
ГОСТ 22280-75 |
|
Натрий хлористый, ч. или х.ч., или ч.д.а. |
|
|
Пара-диметиламидобензальдегид, ч. |
ТУ 6-09-3272-77 |
|
Пептон сухой ферментативный для бактериологических целей |
|
|
Полимиксин «М» или «В» сульфат по 500000 ед. (медпрепарат) |
|
|
Спирт этиловый ректификованный технический |
|
|
Спирт этиловый ректификованный |
|
|
Железа аммонийного цитрат |
|
|
Феноловый красный |
ГОСТ 5853-51 |
|
Фенолфталеин |
ГОСТ 5850-72 |
|
Фуксин основной |
ТУ 6-09-4119-75 |
|
Хлороформ технический |
ГОСТ 2-15-76-72 |
|
Уксусная кислота |
|
|
Сульфаниловая кислота |
|
|
А-нафтол |
|
|
Цинк порошкообразный |
|
|
Эскулин |
|
|
Экстракт дрожжевой сухой |
|
|
Лития хлорид |
|
|
Уголь активированный |
Р.72.270.3 |
|
Желток куриного яйца |
|
|
Крахмал |
|
|
Налидиксовая кислота |
Lab M, HiMedia |
|
Акрифлавина гидрохлорид (трипафлавин) |
Lab M, HiMedia |
|
Цефтазидим |
|
|
Циклогексимид |
|
|
Тест-штаммы Listeria monocytogenes, Listeria ivanovii, Listeria innocua, Staphylococus aureus, Rhodococcus equi, типичные по культуральным, морфологическим и биохимическим свойствам |
|
|
3.3.2. Среды питательные |
|
|
3.3.2.1. Для культивирования изолятов |
|
|
Триптозный ГРМ-агар и ГРМ-бульон |
ФС42-3377-97 (ГНЦ ПМ) |
|
Среда ГРМ № 1 |
ВФС 42-2988-97 (ГНЦПН) |
|
Питательный бульон и питательный агар |
ТУ 10-02-02-789-176-94 |
|
Триптон-соевый агар с дрожжевым экстрактом (TSYEA) |
HiMedia M1214 |
|
Триптон-соевый бульон с дрожжевым экстрактом (TSYEB) |
HiMedia M1263 |
|
3.3.2.2. Среды селективного обогащения |
|
|
Бульон Фрейзера (Fraser Broth) |
BioMerieux 42046 |
|
Бульон Фрейзера половинной концентрации (Half Fraser Broth) |
BioMerieux 42048 |
|
Fraser Broth Base, Fraser Supplement, Fraser Selective Supplement |
HiMedia М1327, FD 141, FE1251 |
|
Бульон для обогащения Listeria Enrichment Broth |
Merch 1.10549, HiMedia М569 |
|
Бульон вторичного обогащения для листерий - Fraser Secondary Enrichment Broth Base |
HiMedia М1 083 |
|
Селективный бульон для листерий - Listeria Selective Broth Base |
HiMedia М889 |
|
Среды Pre-Media 403А и BiMedia 401А, 402А, 403А |
Lab M |
|
3.3.2.3. Дифференциально-диагностические селективные среды |
|
|
PALCAM - Listeria Selective Agar Base с селективной добавкой 1.12122 |
Merck 1.1 1755 |
|
PALCAM-агар - селективная среда для выделения листерий |
BioMerieux 43559 |
|
Агар для идентификации листерий - Listeria Identification Agar Base (PALCAM) |
HiMedia М1 064 |
|
Oxford-агар - селективная среда для выделения листерий |
BioMerieux 43 560 |
|
Listeria Oxford Medium Base и Oxford Listeria Supplement |
HiMedia M1 145, FD 071 |
|
Среды Гисса с маннитом, ксилозой, рамнозой |
ФС (ЦНИИВС им. И.И. Мечникова, НИИ питательных сред) |
|
Среда для определения подвижности листерий (Listeria motility medium) |
HiMedia M 1215 |
|
SIM-агар (сероводород-индол-подвижность) |
Difco |
|
Blood Agar Base - основа кровяного агара |
HiMedia М073 |
|
Тест-системы биохимические для видовой идентификации API Listeria |
BioMerieux |
Допускается использование других коммерческих питательных сред и диагностических препаратов аналогичного назначения для проведения исследований в соответствии с данным документом. При их применении следует руководствоваться рекомендациями изготовителя.
Питательные среды и биологические препараты импортного производства должны иметь международный сертификат качества ИСО 9000 или EN 29000. Питательные среды и препараты отечественного производства должны вырабатываться по нормативной документации, утвержденной в установленном порядке.
4. Подготовка к анализу
4.1. Приготовление растворов и реактивов
|
По ГОСТ 26669 |
|
|
4.1.2. Изотонический (0,85 %-ный водный) раствор хлорида натрия |
По ГОСТ 26669 |
|
4.1.3. Растворы и реактивы для постановки реакции нитратредукции |
По ГОСТ 10444.8- 99 |
|
4.1.4. Приготовление растворов и реактивов для окраски препаратов по Граму |
По ГОСТ 10444.1 или в соответствии с инструкцией по применению |
|
4.1.5. Раствор перекиси водорода для определения каталазы 3 %-ный |
По ГОСТ 30425 |
4.2. Приготовление питательных сред
Среды промышленного изготовления, поименованные в п. 3.3.2, готовятся согласно прописям на этикетке или в соответствии с рекомендациями фирмы.
Допускается применение сред лабораторного приготовления по п.п. 4.2.1 - 4.2.10.
Приготовление питательных сред Рre-Media 403А и BiMedia 401А, 402А, 403А для определения листерий проводят в соответствии с МУК 4.2.590-96 «Бактериологические исследования с использованием микробиологического экспресс-анализатора «Бак Трак 4100».
4.2.1. Питательный агар с 1 % глюкозы и питательный бульон с 1 % глюкозы (МПА с 1 % глюкозы, МПБ с 1 % глюкозы) готовят в соответствии с ГОСТ 10444.1.
4.2.2. Триптон-соевый бульон с дрожжевым экстрактом (ТSYЕВ) / Триптон-соевый агар с дрожжевым экстрактом (ТSYЕА).
Состав среды (г/л): ферментативный гидролизат казеина - 17,0; пептон соевый - 3,0; натрий хлористый - 5,0; фосфат калия однозамещенный - 2,5; глюкоза - 2,5; дрожжевой экстракт - 6,0; агар микробиологический (для ТSYЕА) - 15,0.
Компоненты растворяют в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН 7,3±0,2 и автоклавируют при 121 °С в течение 15 мин.
4.2.3. Среды селективного обогащения типа бульона Фрейзера.
Приготовление основы среды (г/л): ферментативный гидролизат казеина - 5,0; пептон - 5,0; мясной экстракт - 5,0; дрожжевой экстракт - 5,0; натрий хлористый - 20,0; калия дигидрофосфат - 1,35; натрия гидрофосфат - 12,0; эскулин - 1,0; литий хлористый - 3,0; железа аммонийного цитрат - 0,25 - растворяют в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН 7,2±0,2 и автоклавируют при 121 °С 15 мин.
Перед употреблением в основу среды вносят асептически раствор селективных компонентов следующего состава:
4.2.3.1. Для приготовления среды типа бульона Фрейзера первичного обогащения*: налидиксовой кислоты - 10 мг, акрифлавина гидрохлорид - 12,5 мг растворить в 10 см3 стерильного 0,2N гидроксида натрия.
* Допускается при приготовлении среды типа бульона Фрейзера первичного обогащения готовить основу среды без добавления эскулина и цитрата железа аммонийного.
4.2.3.2. Для приготовления среды типа бульона Фрейзера вторичного обогащения: налидиксовой кислоты - 20 мг, акрифлавина гидрохлорид - 25 мг растворить в 10 см3 стерильного 0,2N гидроксида натрия.
Готовые среды разливают в стерильные колбы или пробирки и хранят в защищенных от света условиях при температуре не выше 8 °С.
4.2.4. PALCAM-агар (полимиксин-акрифлавин-лития хлорид-цефтазидим-эскулин-маннитол - агар) - селективная дифференциально-диагностическая среда для выделения листерий.
Приготовление основы среды (г/л): пептон мясной ферментативный - 23,0; дрожжевой экстракт - 3,0; крахмал - 1,0; натрия хлорид - 5,0; эскулин - 0,8; лития хлорид - 15,0; железа аммония цитрат - 0,5; глюкоза - 0,5; маннит - 10,0; феноловый красный - 0,08; агар -15,0 - растворяют в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН 7,0±0,2 и автоклавируют при 121 °С 15 мин.
К стерильной расплавленной основе среды добавляют асептически раствор селективных компонентов следующего состава: акрифлавин - 0,005; полимиксин «В» - 100000 ед.; цефтазидим - 0,02 в 10 см3 стерильной дистиллированной воды.
Готовую среду разливают в стерильные чашки Петри и хранят в защищенных от света условиях при температуре не выше 8 °С.
4.2.5. Селективная дифференциально-диагностическая среда для выделения листерий типа Оксфорд-агара.
Приготовление основы среды (г/л): пептон мясной ферментативный - 23,0; крахмал кукурузный - 1,0; натрия хлорид - 15,0; эскулин - 1,0; лития хлорид - 15,0; железа аммония цитрат - 0,5; глюкоза - 0,5; агар - 15,0 растворяют в 1000 см3 дистиллированной воды, тщательно перемешивают, устанавливают рН 7,0±0,2 и автоклавируют при 121 °С 15 мин.
К стерильной расплавленной основе среды добавляют асептически раствор селективных компонентов следующего состава: акрифлавина гидрохлорид - 0,005; циклогексимид - 0,4, колистина сульфат* - 0,02, цефатетан* - 0,002, фосфомицин* - 0,01 мг в 10 см3 50 %-ного этилового спирта.
Готовую среду разливают в стерильные чашки Петри и хранят в защищенных от света условиях при температуре не выше 8 °С.
Допускается замена комплекса перечисленных антибиотиков на полимиксин в количестве 500000 ед. на 1 л.
4.2.6. Кровяной агар.
К растопленному и охлажденному до 45 - 50 °С питательному агару с 1 % глюкозы (п. 4.2.1) добавляют 5 % по объему дефибринированной крови животных. Разливают в чашки Петри диаметром 90 мм по 15 см3 среды и подсушивают при 37 °С.
Засев производят в теплые чашки.
4.2.7. Питательный агар с эритроцитами барана. Дефибринированную или стабилизированную цитратом кровь барана центрифугируют в асептических условиях 30 мин при 900 об/мин. Надосадочную жидкость сливают. Осадок суспендируют в стерильном физиологическом растворе до первоначального объема, добавляют в количестве 5 % по объему к растопленному и охлажденному до 45 - 50 °С питательному агару (п. 4.2.1). Разливают в чашки Петри по 10 см3, подсушивают при 37 °С. Чашки используют для посева теплыми.
4.2.8. Среда для определения подвижности: 20 г гидролизата казеина ферментативного, 6 г пептона мясного ферментативного и 5 г агара растворяют в 1000 см3 дистиллированной воды, устанавливают рН 7,3±0,2, разливают в пробирки по 5 - 7 см3 и автоклавируют при 121 °С 15 мин.
4.2.9. Среды Гисса по ГОСТ 10444.1 с маннитом, рамнозой, ксилозой. 10 г пептона ферментативного и 5 г натрия хлористого растворяют в 1000 см3 дистиллированной воды и добавляют 10 г соответствующего углевода. Устанавливают рН 7,1±0,1, вносят 10 мл индикатора Андреде (также возможно использование индикатора бромкрезолового пурпурного, «ВР» и др.), разливают в пробирки и стерилизуют при 112 °С в течение 20 мин.
4.2.10. Среда для определения лецитиназной активности листерий.
К среде ГРМ № 1 перед стерилизацией добавляют активированный уголь, растертый до порошкообразного состояния, до концентрации 0,5 % (вес/объем). Желток куриного яйца разводят в 150 мл физиологического раствора и добавляют 5 % по объему к стерилизованному и охлажденному до 40 - 50 °С питательному агару. Разливают в чашки Петри по 20 см3 и подсушивают при 37 °С. Аналогично готовят среду с добавлением желтка, но без добавления активированного угля.
5. Отбор и подготовка проб пищевых продуктов для анализа
5.1. Общие положения по отбору и подготовке проб
Отбор и подготовку проб продукции производят в соответствии с ГОСТ 26668-85 «Методы отбора проб для микробиологических анализов», ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов», МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов», ГОСТ Р 51446 (ИСО 7218-96), а также в соответствии с действующими ГОСТ и НД на конкретные виды продуктов.
Масса или объем отбираемых проб должны быть достаточными для проведения исследования и минимально вдвое превышать аналитический образец. Из точечных проб составляют навеску массой 25±0,1 г (50 - 100 г - для продуктов детского, лечебного и специализированного питания).
От продукции в потребительской таре в мелкой фасовке пробы отбирают в количестве одной или нескольких единиц в зависимости от массы или объема потребительской тары, с тем чтобы количество было достаточным для проведения анализа.
От продукции в транспортной или потребительской таре больших размеров или неупакованной пробы отбирают из разных мест с различной глубины, включая поверхность.
Для микробиологических анализов пробы отбирают до взятия проб на физико-химические и органолептические анализы стерильным инструментом в стерильную посуду. При этом от образца отбирают несколько точечных проб из разных мест, которые измельчают и перемешивают, из них составляют навеску 25 г.
Замороженные продукты предварительно размораживают до температуры внутри продукта 0 - (-1) °С; продукты, содержащие жиры (сливочное масло, мороженое) нагревают до температуры 40 - 45 °С и перемешивают.
Отобранные образцы перемешивают и измельчают или доводят до однородной консистенции по ГОСТ 26669, из измельченной суспензии составляют навеску необходимой массы.
При посевах высококислотных или щелочных (с рН < 6 или > 7,5) жидких и твердых продуктов для предотвращения снижения рН питательных сред на 0,5 и более, рН продукта перед посевом доводят до (7,0±0,2) по ГОСТ Р 50480.
5.2. Отбор и подготовка проб молока, молочных продуктов, сыров, мороженого
Отбор и подготовку проб продуктов проводят согласно ГОСТ 3622-68 «Молоко и молочные продукты. Отбор и подготовка их к испытанию» и 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
Кисломолочные продукты, сыр, творог, творожные изделия и пастообразные продукты тщательно измельчают с помощью гомогенизаторов перистальтического типа или ножевых и подвергают нейтрализации, масло сливочное и мороженое растапливают до сметанообразной консистенции.
5.3. Отбор и подготовка проб мяса, мясных полуфабрикатов, мяса птицы и птицепродуктов, колбасных изделий и других мясопродуктов
Отбор и подготовку проб мяса, субпродуктов, мясных полуфабрикатов, колбасных изделий и других мясных продуктов проводят по ГОСТ 21237 «Мясо. Методы бактериологического анализа», ГОСТ 4288 «Изделия кулинарные и полуфабрикаты из рубленного мяса», ГОСТ 9958, ГОСТ 9792 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц».
Массу навески отбирают в соответствии с п. 6.1.
Отбор и подготовку проб мяса птицы, субпродуктов и птичьих полуфабрикатов проводят по ГОСТ Р 50396.0 «Мясо птицы, субпродукты и полуфабрикаты птичьи. Методы отбора проб и подготовка к микробиологическим исследованиям».
5.4. Отбор и подготовка проб плодоовощной продукции
Отбор и подготовку к анализу проб плодоовощной продукции проводят согласно ГОСТ 26668, ГОСТ 26669, ГОСТ 26313 «Продукты переработки плодов и овощей. Правила приемки, методы отбора проб», кроме подготовки к анализу проб поверхностно контаминированных и пюреобразных продуктов. Для поверхностно-контаминированной и быстрозамороженной плодоовощной продукции подготовку проводят согласно «Инструкции по микробиологическому контролю быстрозамороженной плодоовощной продукции» (МЗ СССР 29.09.89, прил. 1, п. 1.3). Для анализа поверхностно-контаминированной продукции готовят суспензию добавлением к навеске массой (100±30) г, отобранной из трех единиц тары или фасовки, 0,1 %-ного пептонно-солевого раствора в количестве, равном массе навески. При этом 1 см3 полученной суспензии оценивают как 1 г (см3) продукта.
Из измельченных плодов, овощей, полуфабрикатов и пюреобразных и жидких отбирают раздельно навески массой по (100±30) г из трех единиц тары или фасовки и готовят объединенную пробу массой в соответствии с п. 6.1.
5.5. Отбор и подготовка проб рыбы, нерыбных объектов промысла и продуктов, вырабатываемых из них
Отбор и подготовку проб проводят согласно «Инструкции по санитарно-микробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных» № 5319-91 от 22.02.91 и ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний».
Отбор проб свежей, охлажденной и мороженой рыбы проводят от 2 точечных образцов, мышечная ткань в которых составляет не менее 25 г по ГОСТ 7631-85. Из каждой точечной пробы стерильным инструментом вырезают спинные мышцы с кожей, перемешивают и отвешивают 25 г, затем измельчают с помощью гомогенизаторов перистальтического типа или ножевых и гомогенизируют в 225 см3 среды накопления.
5.6. Продукты детского, лечебного питания и их компоненты
Отбор и подготовку проб продуктов детского, лечебного питания и их компонентов проводят согласно МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов».
Отобранные пробы продуктов перед исследованием тщательно перемешивают, кисломолочные продукты нейтрализуют (на 10 см3/г исследуемого продукта или его первого разведения для сухих кисломолочных продуктов, напитка или закваски добавляют 1,0 см3 стерильного раствора двууглекислого натрия с массовой концентрацией 100 г/см3). Сыр, творог, творожные изделия и пастообразные продукты тщательно измельчают и нейтрализуют. Топленое масло или молочный жир расплавляют при температуре 40 - 45 °С и перемешивают до получения однородной эмульсии.
6. Проведение анализа
6.1. Подготовленную в соответствии с п. 5. навеску исследуемого продукта (гомогената, смыва с поверхности) в количестве 25 г (см3) вносят в одну из сред для первичного обогащения в количестве 225 см3 (по п.п. 3.3.2.2, 4.2.3.1). При необходимости анализа других масс продукта их посев проводят в среду также в соотношении 1:9 по объему.
Посевы термостатируют при 37 °С в течение (24±2) ч. При росте листерий на средах предобогащения, содержащих эскулин и цитрат железа аммонийного, наблюдается почернение среды за счет гидролиза гликозида эскулина до глюкозы и эскулетина. Эскулетин реагирует с ионами железа, образуя комплекс черного или оливкового цвета. На других средах почернения не отмечается.
6.2. После термостатирования продукта в среде для первичного обогащения 0,1 см3 суспензии пересевают в 10 см3 одной из жидких сред для вторичного обогащения по п.п. 3.3.2.2, 4.2.3.2. Посевы термостатируют при температуре (37±1) °С в течение 48 ч. В средах с эскулином отмечают почернение как признак возможного присутствия бактерий рода Listeria.
6.3. Из пробирок после термостатирования, независимо от наличия или отсутствия признаков роста, и в т.ч. почернения, делают пересев по 0,1 см3 на поверхность двух чашек Петри с одной из агаризованных дифференциально-диагностических сред по п.п. 3.3.2.3, 4.2.4, 4.2.5. Посевной материал растирают стерильным шпателем. Допускается проводить пересев петлей штрихом. Чашки со средами предварительно подсушивают.
Посевы термостатируют при температуре (37±1) °С в течение 24 - 48 ч.
6.4. Проведение анализа без этапа вторичного обогащения. При посеве продуктов с низким исходным уровнем микробной контаминации и при отсутствии признаков роста в жидкой среде (помутнение, почернение и др.) допускается проводить пересев на чашки с агаризованными дифференциально-диагностическими средами сразу после этапа первичного обогащения по п. 6.2.
6.5. При отсутствии роста на чашках с дифференциально-дианостическими средами типа Оксфордского агара и PALCAM-агара анализ прекращают и дают заключение об отсутствии L. monocytogenes в исследованной пробе продукта.
6.6. При обнаружении характерного роста на чашках отбирают 3 - 5 колоний для их дальнейшего изучения.
На средах типа PALCAM-агара через 24 ч инкубирования листерии формируют мелкие, серовато-зеленые или оливково-зеленые колонии с черным ореолом, диаметром 0,5 - 1,0 мм, иногда с черным центром. Через 48 ч колонии диаметром 1,0 - 2,0 мм приобретают зеленую окраску с углубленными центрами, окруженными черным ореолом. Кокковая микрофлора (бактерии родов Staphilococcus, Enterococcus) образует желтые колонии за счет ферментации маннита.
На Оксфордском агаре (Oxford agar) листерии, выращенные в течение 24 ч, мелкие (1 мм), сероватые, окруженные черным ореолом. Через 48 ч - более темные, около 2 мм в диаметре, с черным ореолом и углубленным центром.
При появлении сплошного роста листерии производят пересев бактериологической петлей из зон наибольшего почернения среды штрихами на 2 - 3 чашки Петри с селективной дифференциально-диагностической питательной средой (Оксфордский или PALKAM-агар) для получения изолированных колоний. Посевы термостатируют аналогично п. 6.3.
6.7. Отобранные характерные колонии, подозрительные на принадлежность к Listeria monocytogenes, пересевают на среды: МПА с 1 % глюкозы (п. 4.2.1), триптон-соевый агар с дрожжевым экстрактом (TSYEA) по п. 3.3.2.1 или 4.2.2 для получения изолированных колоний, которые подвергают дальнейшему изучению.
Посевы термостатируют при температуре 30 °С в течение 24 ч.
6.8. Идентификация выделенных культур. Для определения принадлежности выделенных микроорганизмов к роду Listeria полученные на средах культивирования чистые культуры микроскопируют по Граму, определяют наличие у них каталазы, подвижность при двух температурах инкубирования - 22 и 37 °С, способность к ферментации маннита и ставят реакцию нитрат-редукции.
6.8.1. Окраска по Граму. Бактерии рода Listeria являются грамположительными тонкими короткими палочками, спор не образуют.
6.8.2. Каталазную активность культур определяют в соответствии с ГОСТ 30425 по способности каталазы разлагать перекись водорода с выделением пузырьков газа. Реакцию ставят с охлажденной до комнатной температуры суточной культурой на стерильном предметном стекле. Изолированную колонию, взятую с поверхности питательной среды, растирают на стекле и пипеткой наносят каплю 3 %-ного раствора перекиси водорода. Если через 30 - 60 с на стекле появляются пузырьки газа, то считают результаты реакции положительными. Параллельно ставят контрольную пробу.
Бактерии рода Listeria являются каталазоположительными.
6.8.3. Подвижность культур определяют посевом уколом в среды по п. 3.3.2.3 и 4.2.8 и инкубированием при двух температурах - 25 и 37 °С в течение 48 - 72 ч.
Бактерии рода Listeria подвижны при 20 - 25 °С (образуют характерный рост вокруг линии укола, похожий на зонтик) и неподвижны (или слабоподвижны) при 35 - 37 °С.
6.8.4. Для определения способности сбраживать углеводы культуры пересевают на пестрый ряд в среды Гисса по п.п. 3.3.2.3 или 4.2.9. Посевы термостатируют 7 дней при 37 °С, наличие ферментативной активности в отношении углеводов определяют по изменению окраски сред за счет образования кислоты.
Большинство бактерий рода Listeria не утилизируют маннит (за исключением L. graui и L. graui subsp.murraui).
6.8.5. Постановку реакции нитрат-редукции проводят по ГОСТ 10444.8-88. Бактерии рода Listeria не восстанавливают нитраты до нитритов (за исключением L. graui и L. graui subsp.murraui).
Обнаружение в посевах грамположительных коротких тонких палочек, каталазоположительных, не восстанавливающих нитраты до нитритов, не утилизирующих маннит, подвижных при 25 °С и неподвижных при 37 °С, указывает на принадлежность выделенных на дифференциально-диагностических средах культур с характерной морфологией к роду Listeria.
Для подтверждения принадлежности выделенных листерий к виду L. monocytogenes определяют способность к ферментации рамнозы, ксилозы, наличие лецитиназной и бета-гемолитической активности и проводят постановку КАМП-теста (САМР-test). Дифференцирующие признаки видов рода Listeria указаны в табл. 1.
Для видовой дифференциации выделенных культур листерий допускается использовать биохимические тест-системы API Listeria фирмы «Bio Merieux». При их применении следует руководствоваться рекомендациями изготовителя.
|
L. monocytogenes |
L. ivanovii |
L. seeligeri |
L. innocua |
L. graui |
L. welshimeri |
|
|
Ферментация: |
||||||
|
· маннита |
- |
- |
- |
- |
+ |
- |
|
· ксилозы |
- |
+ |
+ |
- |
- |
+ |
|
· рамнозы |
+ |
- |
- |
+/- |
+/- |
+/- |
|
Бета-гемолиз |
+ |
+ |
+ |
- |
- |
- |
|
КАМП-тест (САМР-test). Усиление гемолиза около штриха: |
||||||
|
· Phodococcus equi |
- |
+ |
- |
- |
- |
- |
|
· Staphilococcus aureus |
+ |
- |
+ |
- |
- |
- |
|
Лецитиназная активность: |
||||||
|
· на среде с активированным углем |
+ |
+ |
- |
- |
- |
- |
|
· на среде без угля |
- |
+ |
- |
- |
- |
- |
6.8.6. Наличие способности ферментировать рамнозу и ксилозу - определяют аналогично п. 6.8.4. Бактерии L. monocytogenes утилизируют рамнозу с образованием кислоты и не утилизируют ксилозу.
6.8.7. Бета-гемолитическую активность исследуемых культур определяют по образованию зон просветления за счет растворения эритроцитов вокруг колоний при посеве на поверхность кровяного агара, приготовленного с добавлением стерильной дефибринированной крови барана или кролика. Посевы на кровяном агаре (п.п. 3.3.2.3, 4.2.6) термостатируют при 37 °С в течение 24 ч.
Listeria monocytogenes обладают β-гемолитической активностью (образуют узкие четкие зоны просветления вокруг колоний).
6.8.8. Постановку КАМП-теста проводят для дифференциации L. monocytogenes от других видов листерий, обладающих гемолитической активностью.
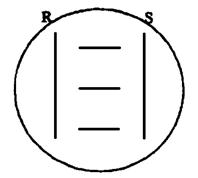
Для проведения теста 2 - 3-суточные культуры гемолитических штаммов Staphilococcus aureus и Phodococcus equi засевают на кровяной агар с эритроцитами барана двумя параллельными штрихами на расстоянии 5,0 - 5,5 см, как показано на рис. 1.
Между вертикальными штрихами St. aureus и Ph. equi засевают параллельными штрихами исследуемые культуры листерий на расстоянии друг от друга не менее 1 см и от вертикальных штрихов - 0,5 см. В качестве контрольных используют тест-штаммы L. monocytogenes и L. ivanovii. Инкубацию проводят 24 ч при 37 °С. Отмечают форму и размеры зон гемолиза около вертикальных штрихов роста стафилококка и родококка.
Listeria monocytogenes дает расширение зоны гемолиза около штриха St. aureus (положительный КАМП-тест) и имеет отсутствие изменений зоны гемолиза рядом со штрихом Ph. equi (отрицательный КАМП-тест).
Рис. 1.
S - посев Staphilococcus aureus; R - посев Phodococcus equi.
6.8.9. Для определения лецитиназной активности дно двух чашек Петри со средой ГРМ № 1, содержащих: 1 чашка - желток куриного яйца и активированный уголь, 2 чашка - желток куриного яйца без активированного угля - делят на несколько секторов или квадратов, исследуемые культуры и контрольные штаммы листерий пересевают параллельно короткими штрихами на соответствующие секторы чашек, содержащих и не содержащих уголь. Инкубируют 48 ч при 37 °С. Чашки просматривают в проходящем свете и определяют наличие активности в присутствии и в отсутствии активированного угля, сравнивая с контрольными высевами музейных штаммов. Listeria ivanovii дает плотную зону помутнения шириной 3 - 6 мм независимо от присутствия активированного угля. Listeria monocytogenes дает аналогичную зону помутнения в присутствии активированного угля и не дает при отсутствии угля. Другие виды листерий не дают зоны помутнения.
6.9. Учет результатов. Результат оценивают по каждой исследованной пробе отдельно. В образце продукта констатируют присутствие Listeria monocytogenes, если при посеве на селективные среды выделены короткие неспорообразующие грамположительные палочки, каталазоположительные, подвижные при 25 °С и неподвижные при 37 °С, утилизирующие эскулин, сбраживающие с образованием кислоты рамнозу и не сбраживающие маннит и ксилозу, не восстанавливающие нитраты до нитритов, обладающие бета-гемолитической активностью, дающие положительную реакцию в КАМП-тесте со Staphilococcus aureus и отрицательную - с Phodococcus equi, проявляющие лецитиназную активность на среде ГРМ № 1 с добавлением желтка куриного яйца и в присутствии активированного угля.
Результаты выявления Listeria monocytogenes в определенной навеске продукта записывают: «Listeria monocytogenes обнаружены в 25 г (см3) (в 50 - 100 г - для продуктов детского, лечебного и специализированного питания) продукта» или «Listeria monocytogenes не обнаружены в 25 г (см3) (в 50 - 100 г - для продуктов детского, лечебного и специального питания) продукта».
Результат оценивают по каждой пробе отдельно.
7. Проведение исследования с использованием кондуктометрического анализатора «Бак Трак»
7.1. Предварительное обогащение - 1 этап
Для предварительного обогащения используется среда Pre-Меdia 403А.
Необходимое количество продукта, в котором регламентируется отсутствие L. monocytogenes, смешивают со средой Pre-Меdia 403А в соотношении 1/10, затем образец гомогенизируют и инкубируют в течение 24 ч.
7.2. Обогащение - 2 этап
Для обогащения используют одну из сред BiMedia 401А, BiMedia 402А, BiMedia 403А.
Среду BiMedia 403А (401А, 402А) оставляют уравновеситься при комнатной температуре в течение 12 ч. Устанавливают температуру 37 °С на приборе «Бак Трак».
В основном меню программы «Бак Трак» устанавливают следующие параметры.
Параметры для инкубаторного блока (Adjust parameters)
Время исследований (Duration) 36 ч
Масштаб измерений (Scale)
М-параметр 0 - 20 %
Е-параметр 0 - 80 %
Время задержки (Dе1ау) 1 ч
Пороговые значения (Thresholds)
М-параметр 5 %
Е-параметр 15 %
Проводить учет результатов по Е-параметру
Пороговое значение по времени (Time limit) 30 ч
Добавляют в каждую измерительную ячейку по 10 см3 среды BiMedia и вносят по 0,1 см3 предобогащенного образца, тщательно перемешивают содержимое, вращая ячейку между ладонями (не переворачивая).
Для контроля среды используют одну измерительную ячейку с 10 см3 среды BiMedia (без инокулята).
Выбирают в основном меню программы ЗАПУСК ИЗМЕРЕНИЙ (Start measurement) и начинают измерения.
После того как каждая позиция в блоке будет отмаркирована как свободная на экране монитора, измерительные ячейки помещают в прибор «Бак Трак». Измерение начинается автоматически через 1 ч после загрузки ячеек в прибор. Рост микроорганизмов и время определения изменения импеданса (IDT) записываются автоматически.
Учет результатов.
Образец загрязнен листериями, если изменение импеданса превышает 15 %-ное пороговое значение по Е-параметру в течение 30 ч.
Подтверждение Listeria-позитивных образцов. В случае положительного ответа на листерии проводится подтверждение роста и идентификация до L. monocytogenes с высевом на селективные питательные среды в соответствии с п.п. 6.3 - 6.8. Высев производится непосредственно из измерительной ячейки.
Выросшие культуры подвергают идентификации по п. 6.8.
Учет результатов и выдача ответа по п. 6.9.
8. Выявление Listeria monocytogenes в реакции нарастания титра фага (РНФ)
РНФ может быть использована в качестве дополнительного метода для обнаружения L. monocytogenes в пищевых продуктах (при проведении противоэпидемических мероприятий и при эпидрасследовании).
Реакция нарастания титра фага - быстрый специфический метод обнаружения листерии, обеспечивающий выявление возбудителя в исследуемом материале без выделения культуры.
РНФ основана на свойстве индикаторного бактериофага строго специфично размножаться в клетках гомологичного микроба. Размножение бактериофага сопровождается увеличением количества его частиц и повышением титра.
8.1. В реакции применяют листериозные бактериофаги L2А и L4А. Штаммы L. monocytogenes I (9-127) и II (9-72) серогрупп. Питательные среды, содержащие 0,5 % глюкозы: мясопептонный бульон, 1,5 %-ный и 0,7 %-ный мясопептонный агар.
8.2. При постановке РНФ с пробами пищевых продуктов отвешивают 25 г исследуемого материала, измельчают, помещают в колбу емкостью 1000 см3 и добавляют 250 см3 МПБ. Смесь в течение 5 - 10 мин встряхивают, затем 9 см3 переносят в бактериологическую пробирку № 1 (опыт).
8.3. Бактериофаги используют в рабочем разведении (10000 фаговых корпускул в 1 см3). Для этого их растворяют в МПБ до исходного объема, указанного на этикетке ампулы, а затем на МПБ отдельными пипетками делают пять последовательных десятикратных разведений (в последнем разведении титр бактериофага составит 1∙104).
Смесь фагов готовят путем смешивания равных объемов фага L2А и L4А в рабочем разведении.
8.4. Для контроля титра бактериофага, который ставят один на группу анализов, проводимых одновременно, в пробирку № 2 (контроль) вносят 9 см3 МПБ.
8.5. В пробирки № 1 и 2 вносят по 1 см3 смеси фага в рабочем разведении (рис. 2) и выдерживают их в течение 16 - 24 ч при комнатной температуре, после чего в пробирки добавляют по 1 см3 хлороформа. Содержимое тщательно встряхивают и оставляют при комнатной температуре на 30 - 40 мин. Хлороформ оседает на дно, надосадочную жидкость подвергают дальнейшим исследованиям.
8.6. При использовании смеси фагов из опытной и контрольной пробирок (№ 1 и 2) берут по 0,2 см3 и переносят по 0,1 см3 в две пробирки, содержащие по 0,9 см3 МПБ (один ряд для обнаружения фага L2А, а другой - L4А), а затем из каждой пробирки готовят еще одно десятикратное разведение.
8.7. Готовят взвесь штаммов I и II серогруппы по стандарту мутности 10 ед. путем разведения суточной агаровой культуры в физиологическом растворе. Во все пробирки с разведенным материалом добавляют по 0,1 см3 взвеси, штамма 1 серогруппы для выявления фага L2А или штамма II серогруппы для обнаружения фага L4А.
Содержимое пробирок засевают методом агаровых слоев по Грациа. Для этого накануне дня исследования в бактериологические чашки Петри разливают по 10 см3 1,5 %-ного МПА; МПА можно разлить в чашки Петри и в день исследования, но в этом случае поверхность агара необходимо предварительно подсушить в течение 40 - 50 мин при 37 °С или 2 ч при комнатной температуре. Для второго слоя используют расплавленный и охлажденный до 48 - 50 °С 0,7 %-ный МПА, который следует использовать в течение часа, так как позже он приобретает гелеобразную консистенцию и непригоден для исследования.
Рис. 2. Схема постановки РНФ для обнаружения листерий.
Затем в пробирки пипеткой вносят по 2,5 - 3 см3 расплавленного и охлажденного до 48 - 50 °С 0,7 %-ного МПА. Содержимое быстро и тщательно перемешивают вращением пробирки между ладонями и выливают в чашку Петри. Смесь легким покачиванием чашки равномерно распределяют вторым слоем на поверхности 1,5 %-ного МПА. Чашки оставляют на ровном месте на 20 - 30 мин (до застывания 0,7 %-ного МПА), затем переворачивают и инкубируют при комнатной температуре.
8.8. Учет реакции проводят через 16 - 24 ч инкубирования посевов. В опытных пробах и контроле титра фага подсчитывают число негативных колоний во всех чашках. Негативные колонии - округлые, хорошо заметные на фоне бактериального роста, прозрачные участки, образующиеся в результате лизиса бактерий.
При учете результатов сравнивают количество негативных колоний на чашках соответствующих разведений.
8.9. Результаты реакции оценивают по увеличению титра бактериофага (количества негативных колоний):
· увеличение количества негативных колоний в опытной пробе по отношению к контролю в 5 и более раз (хотя бы по одному из разведений) оценивается как положительный результат, менее чем в 5 раз - отрицательный;
· сплошной лизис или лизис с островками оценивается как положительный результат.
8.10. При получении положительного результата РНФ дают заключение, что в исследуемом материале (пробе) обнаружены бактерии рода Listeria.
9. Биологические исследования
Биологические исследования (постановку биопроб на мышах) выделенных культур и их серологическую диагностику в реакции агглютинации проводят в ходе противоэпидемических мероприятий и при эпидрасследовании заболеваний в соответствии с методическими рекомендациями «Лабораторная диагностика листериоза животных и людей, меры борьбы и профилактики». М., 1987 (утв. 04.09.86) [16].
10. Требования безопасности
Исследования пищевых продуктов на наличие Listeria monocytogenes проводят в соответствии с СанПиН 1.2.731-99 «Безопасность работы с микроорганизмами III - IV групп патогенности и гельминтами».
Библиографический список
1. Федеральный закон «О санитарно-эпидемиологическом благополучии населения» от 30 марта 1999 г. № 52-ФЗ.
2. Положение о государственной санитарно-эпидемиологической службе Российской Федерации, утвержденное постановлением Правительства Российской Федерации от 24 июля 2000 г. № 554.
3. Положение о государственном санитарно-эпидемиологическом нормировании, утвержденное постановлением Правительства Российской Федерации от 24 июля 2000 г. № 554.
4. СанПиН 2.3.2.1078-01 «Гигиенические требования к безопасности и пищевой ценности пищевых продуктов».
5. ГОСТ 26668-85 «Продукты пищевые и вкусовые. Методы отбора проб для микробиологических исследований».
6. ГОСТ 26669-85 «Продукты пищевые и вкусовые. Подготовка проб для микробиологических анализов».
7. ГОСТ 26670-91 «Продукты пищевые. Методы культивирования микроорганизмов».
8. ГОСТ 10444.1-84 «Консервы. Приготовление растворов, красок, индикаторов, питательных сред, применяемых в микробиологическом анализе».
9. ГОСТ 9225-84 «Молоко и молочные продукты. Методы микробиологического анализа».
10. ГОСТ 9792-73 «Колбасные изделия и продукты из свинины, баранины, говядины и мяса других видов убойных животных и птиц. Правила приемки и методы отбора проб».
11. ГОСТ 9958-81 «Изделия колбасные и продукты из мяса. Методы бактериологического анализа».
12. ГОСТ 21237-75 «Мясо. Методы микробиологического анализа».
13. ГОСТ 4288-76 «Изделия кулинарные и полуфабрикаты из рубленого мяса. Правила приемки и методы испытания».
14. ГОСТ 7631-85 «Рыба, морские млекопитающие, морские беспозвоночные и продукты их переработки. Правила приемки, органолептические методы оценки качества, методы отбора проб для лабораторных испытаний».
15. МУК 4.2.590-96 «Бактериологические исследования с использованием микробиологического экспресс-анализатора «Бак Трак 4100» / Минздрав России. М., 1997.
16. Методические рекомендации «Лабораторная диагностика листериоза животных и людей, меры борьбы и профилактики», (утв. Минздравом СССР 04.09.86).
17. «Инструкция по санитарно-микробиологическому контролю тушек, мяса птицы, птицепродуктов, яиц и яйцепродуктов на птицеводческих и птицеперерабатывающих предприятиях», (утв. Главветупром; согл. зам. Главного государственного санитарного врача СССР 30.08.90).
18. СанПиН 2.3.4.050-96 «Производство и реализация рыбной продукции».
19. СанПиН 2.3.4.545-96 «Производство хлеба, хлебобулочных и кондитерских изделий».
20. СанПиН 2.3.4.551-96 «Производство молока и молочных продуктов».
21. СанПиН 42-123-4423-87 «Нормативы и методы микробиологического контроля продуктов детского питания, изготовленных на молочных кухнях системы здравоохранения».
22. СанПиН 1.2.731-99 «Безопасность работы с микроорганизмами III-IV групп патогенности и гельминтами».
23. СанПиН 2.3.6.1066-01 «Санитарно-эпидемиологические требования к организации торговли и обороту в них продовольственного сырья и пищевых продуктов».
24. «Инструкция по порядку и периодичности контроля за содержанием микробиологических и химических загрязнителей в молоке и молочных продуктах на предприятиях молочной промышленности» (утв. Минсельхозпродом России, согл. Госкомсанэпид-надзором России 28.12.95).
25. «Санитарные правила для предприятий пищеконцентратной промышленности» (утв. Минздравом СССР 01.03.76).
26. «Ветеринарно-санитарные правила для предприятий (цехов) переработки птицы и производства яйцепродуктов» (утв. Минздравом СССР 6.03.87).
27. «Инструкция по порядку и периодичности контроля за содержанием микробиологических и химических загрязнителей в мясе, птице, яйцах и продуктах их переработки» (утв. Минсельхозпромом России; согл. Минздравом России 27.06.00).
28. «Инструкция по микробиологическому контролю производства мороженого» (утв. ТК 186 по стандартизации (молоко и молочные продукты); согл. зам. Главного государственного санитарного врача России 10.03.93).
29. «Инструкция по санитарно-бактериологическому контролю производства маргарина и майонеза на предприятиях маргариновой промышленности» (утв. Госагропромом СССР 21.11.88).
30. «Порядок санитарно-микробиологического контроля при производстве мяса и мясных продуктов» (утв. Минсельхозпромом России 15.12.95).
31. «Инструкция по микробиологическому контролю производства высокостойких безалкогольных напитков. ИК 10-5031536-105-91» (утв. Госагропромом СССР; согл. Минздравом СССР 28.06.91).
32. «Инструкция по микробиологическому контролю быстрозамороженной плодоовощной продукции» (утв. Госагропромом СССР; согл. Минздравом СССР 29.09.89).
33. МУК 4.2.577-96 «Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов».