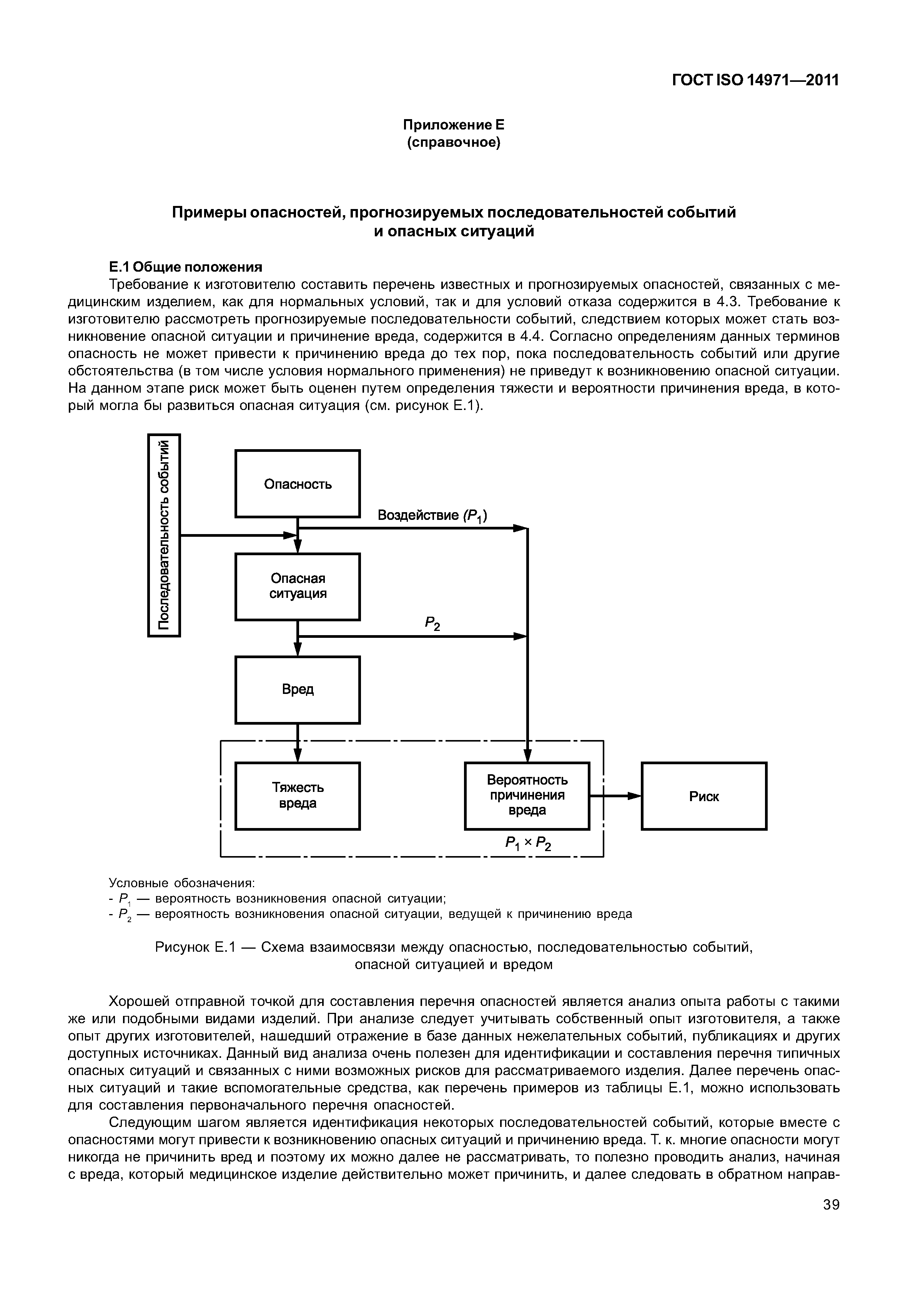
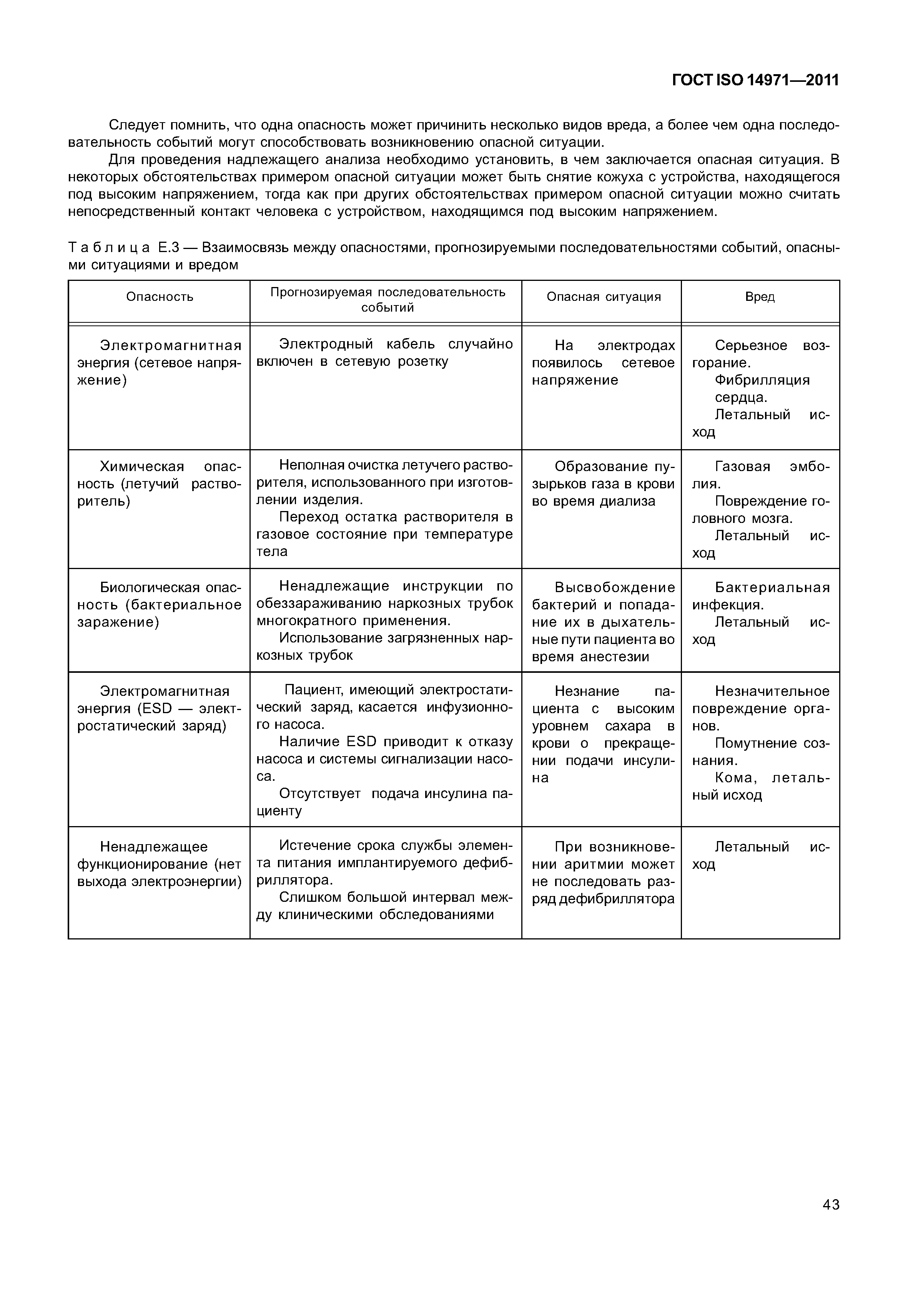
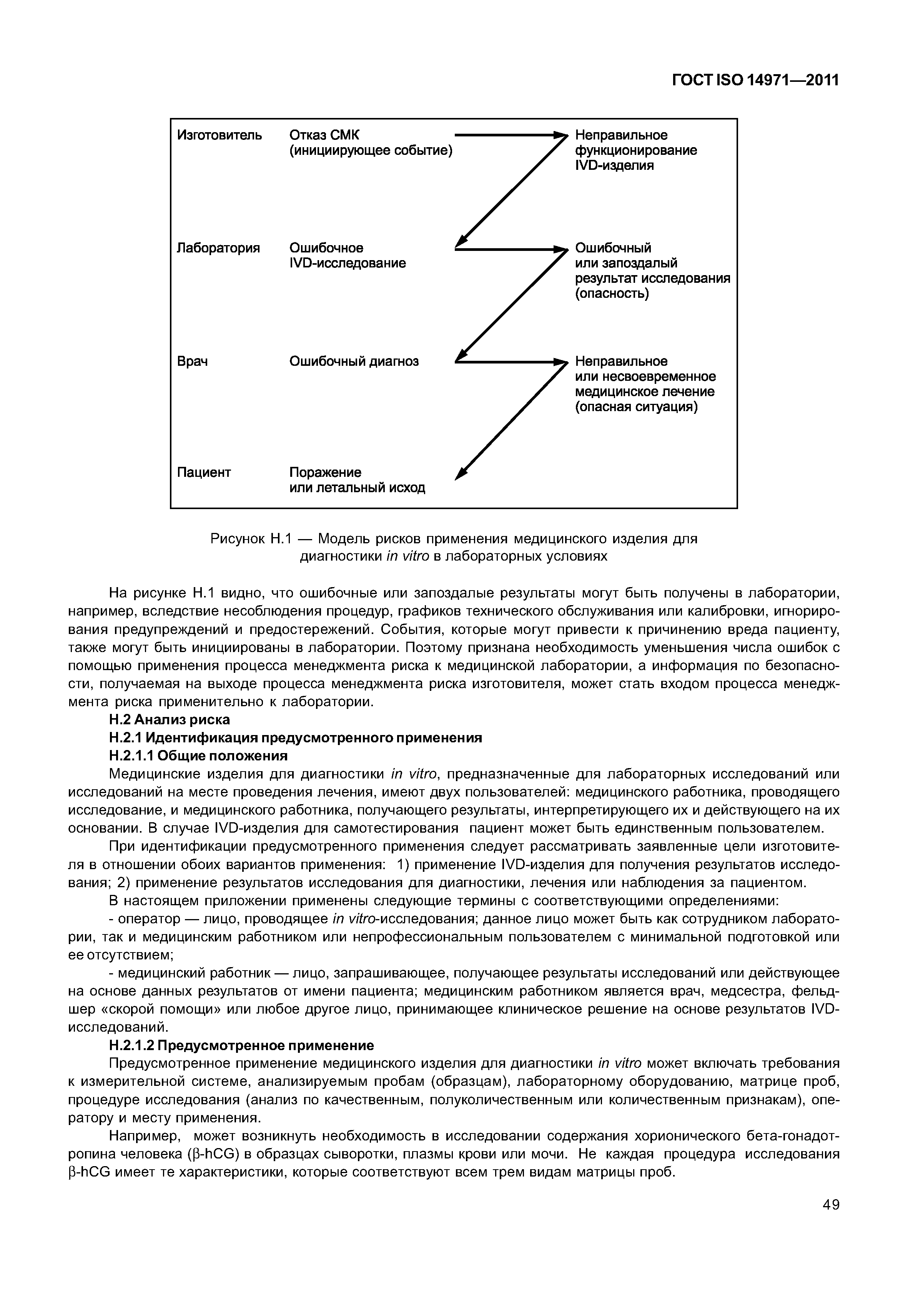
ГОСТ ISO 14971-2011
Изделия медицинские. Применение менеджмента риска к медицинским изделиям
| Обозначение: | ГОСТ ISO 14971-2011 |
| Обозначение англ: | 14971-2011 |
| Статус: | Введен впервые |
| Название рус.: | Изделия медицинские. Применение менеджмента риска к медицинским изделиям |
| Название англ.: | Medical devices. Application of risk management to medical devices |
| Дата добавления в базу: | 01.10.2014 |
| Дата актуализации: | 01.01.2021 |
| Дата введения: | 01.01.2013 |
| Область применения: | Стандарт устанавливает для изготовителя процесс определения опасностей, связанных с медицинскими изделиями, включая изделия для диагностики in vitro, и процедуры определения, оценивания, управления рисками и мониторинга результативности данного управления. Требования стандарта применимы ко всем стадиям жизненного цикла медицинских изделий. Стандарт не может быть использован для принятия клинических решений. Стандарт не устанавливает уровни допустимого риска. Стандарт не требует наличия у изготовителя системы менеджмента качества, однако менеджмент риска может быть составной частью системы менеджмента качества. |
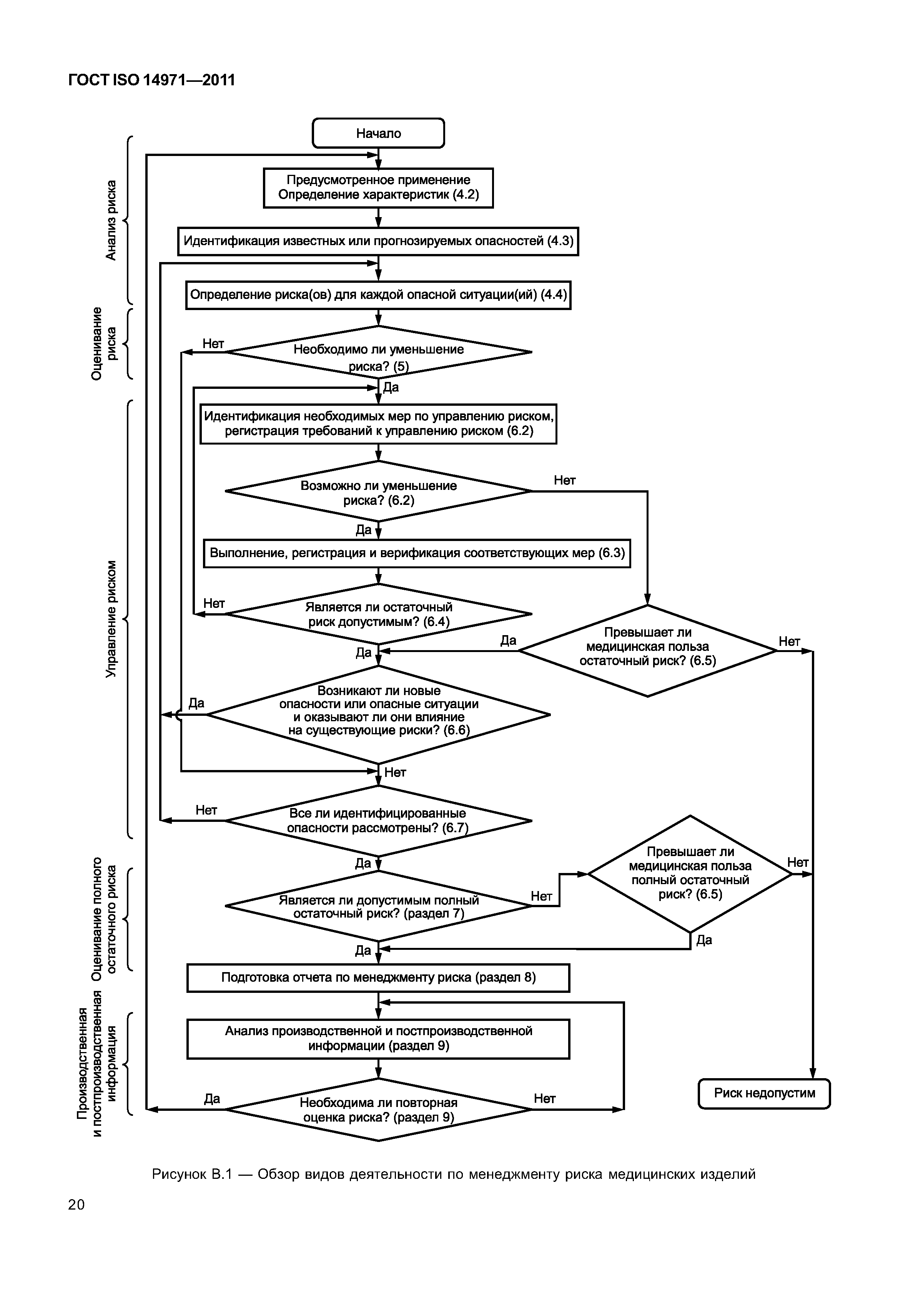
| Оглавление: | 1 Область применения 2 Термины и определения 3 Общие требования к менеджменту риска 3.1 Процесс менеджмента риска 3.2 Ответственность высшего руководства 3.3 Квалификация персонала 3.4 План менеджмента риска 3.5 Файл менеджмента риска 4 Анализ риска 4.1 Процесс анализа риска 4.2 Предусмотренное применение и определение характеристик, относящихся к безопасности медицинского изделия 4.3 Идентификация опасностей 4.4 Определение риска(ов) для каждой опасной ситуации 5 Оценивание риска 6 Управление риском 6.1 Уменьшение риска 6.2 Анализ возможностей управления риском 6.3 Выполнение мер по управлению риском 6.4 Оценивание остаточного риска 6.5 Анализ соотношения риск/польза 6.6 Риски, возникающие вследствие выполнения мер по управлению риском 6.7 Полнота управления риском 7 Оценивание допустимости совокупного остаточного риска 8 Отчет по менеджменту риска 9 Производственная и постпроизводственная информация Приложение А (справочное) Обоснование требований Приложение В (справочное) Обзор процесса менеджмента риска медицинских изделий Приложение С (справочное) Вопросы, на которые необходимо ответить для определения характеристик медицинского изделия, влияющих на безопасность его применения Приложение D (справочное) Концепции риска, применимые медицинским изделиям Приложение Е (справочное) Примеры опасностей, прогнозируемых последовательностей событий и опасных ситуаций Приложение F (справочное) План менеджмента риска Приложение G (справочное) Информация о методах анализа риска Приложение Н (справочное) Руководство по менеджменту риска медицинских изделий для диагностики in vitro Приложение I (справочное) Руководящие указания по процессу анализа риска в отношении биологических опасностей Приложение J (справочное) Информация по безопасности и остаточному риску Библиография |
| Разработан: | ФГУП ВНИИНМАШ |
| Утверждён: | 29.11.2011 Межгосударственный Совет по стандартизации, метрологии и сертификации (Inter-Governmental Council on Standardization, Metrology, and Certification 40) 13.12.2011 Федеральное агентство по техническому регулированию и метрологии (1261-ст) |
| Издан: | Стандартинформ (2013 г. ) |
| Расположен в: |