4.2. Методы контроля. Биологические и микробиологические факторы
Методические указания МУК 4.2.2314-08
Методы санитарно-паразитологического анализа воды
(утв. руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом РФ Г.Г. Онищенко 18 января 2008 г.)
Дата введения: с момента утверждения
1. Разработаны: Институтом медицинской паразитологии тропической медицины им. Е. И. Марциновского ММА им. И. М. Сеченова (H. А. Романенко), А. И. Чернышенко, Г. И. Новосильцев, Е. Н. Морозов, Н. А. Турбабина); ФГУЗ «Федеральный центр гигиены и эпидемиологии» Роспотребнадзора (А. И. Верещагин, И. В. Братина, Т. Н. Цыбина, Т. Г. Сыскова, М. В. Зароченцев); кафедрой паразитологии, паразитарных и тропических болезней ММА им. И. М. Сеченова (В. П. Сергиев, Р. К. Мирзоева, М. В. Гузеева); ФГУЗ «Центр гигиены и эпидемиологии в г. Москве» (Н. И. Тимошенко); ГНЦ РФ Физико-энергетический институт (Б. И. Фурсов, Г. С. Жданов); ФГУЗ «Центр гигиены и эпидемиологии в г. Челябинске» (Б. Е. Рабинович); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (Т. М. Гузеева, 3. С. Середа); ГУ НИИ экологии человека и гигиены окружающей среды им. А. Н. Сысина РАМН (Ю. А. Рахманин, Р. И. Михайлова, А. Е. Недачин); ФГУП НИИ физических проблем им. Ф. В. Лукина (С. М. Кузьмин, Е. С. Кузьмин, С. М. Безручко); Тюменским НИИ КИП (Т. Ф. Степанова); ООО «СтайЛаб» (А. В. Галкин); РМАПО Минсоцразвития России (А. Е. Беляев); РАГС при Президенте РФ (В. В. Гутенев); Курским Госуниверситетом (Н. С. Малышева, С. С. Пёхова, Н. А. Плёхова, Е. Л. Дмитриева); ФГУЗ «Центр гигиены и эпидемиологии в Белгородской области» (В. В. Евдокимов, В. И. Евдокимов).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию при Федеральной службе по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 6 декабря 2007 г. № 3).
3. Утверждены и введены в действие Главным государственным санитарным врачом Российской Федерации, Руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека Г. Г. Онищенко 18 января 2008 г.
4. Введены взамен МУК 4.2.964-00 «Санитарно-паразитологическое исследование воды хозяйственного и питьевого использования»
Содержание
1. Область применения
1.1. Методические указания устанавливают методы лабораторного паразитологического контроля безопасности питьевой воды по нормируемым показателям СанПиН 2.1.4.1074-01 "Питьевая вода. Гигиенические требования к качеству воды централизованных систем питьевого водоснабжения. Контроль качества", СанПиН 2.1.4.1116-02 "Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества", СанПиН 2.1.2.1188-03 "Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества".
1.2. Настоящие методические указания являются обязательными для контроля питьевой воды по показателям паразитарной безопасности при проведении государственного санитарно-эпидемиологического надзора (контроля) в учреждениях Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека и лабораториях других организаций, аккредитованных в установленном порядке.
Допускается применение любого из указанных в настоящих МУК методов по выбору исполнителя.
Допускается использование аналогов оборудования, приборов, реагентов и материалов, указанных в настоящих МУК, разрешенных к применению в установленном порядке.
2. Отбор, хранение и транспортирование проб
2.1. Общие требования к отбору проб питьевой воды
Отбор проб воды на объектах надзора проводится в соответствии с действующими нормативно-методическими документами (СанПиН, ГОСТ, МУК) и настоящими методическими указаниями.
Для отбора проб воды используют специально предназначенную для этих целей одноразовую посуду или емкости многократного применения. Многоразовая посуда (емкости) должна быть изготовлена из материалов, выдерживающих обработку кипячением.
При исследовании воды из распределительной сети отбор проб производится из крана с предварительным спуском воды не менее 3 - 5 мин, с применением гибких шлангов, водораспределительных сеток, насадок. При отборе проб воды с концентрированием осадка на мембранных или порошковых фильтрах применяют насадки аппаратов напорного фильтрования, напор воды при этом регулируют с таким расчетом, чтобы он был достаточным для фильтрации через мембранные фильтры (МФАСП или ATM).
При исследовании воды на объектах транспорта (водном, воздушном, железнодорожном) отбор проб воды производится на выходе из гидротехнических сооружений, осуществляющих водоснабжение данных транспортных средств.
Из открытых (поверхностных) водоемов, плавательных бассейнов пробы отбирают с поверхности, с различных глубин объемом 25 - 50 л, емкостями 1,5 - 2,0 л с интервалом 2 - 3 мин.
Забор проб воды с объекта (точки пробозабора) проводят несколькими способами:
1) отбор воды с каждой точки пробозабора обследуемого объекта по 25 - 50 л непосредственно в большие закрывающиеся емкости (фляги, бутыли, канистры и т. п.) и соответственно доставкой этих объемов воды для исследования в лабораторию;
2) отбор воды (по 25 - 50 л с каждой точки) с последующим концентрированием проб с применением химреактивов (коагулянтов) непосредственно на обследуемом объекте и доставкой на исследование в лабораторию уменьшенного в 10 и более раз объема (осадок с надосадочной жидкостью);
3) отбор проб воды с помощью фильтровальных приборов на объектах водозабора и доставкой на исследование в лабораторию концентрированного осадка на мембранных или порошковых фильтрах.
2.2. Хранение и транспортирование проб
В лабораторию доставляют маркированные емкости с пробами исследуемой воды или осадок с надосадочной жидкостью после применения коагулянтов, или концентрированный осадок на фильтрах (мембранных или порошковых).
Фильтры, через которые проводилось фильтрование исходной воды с помощью фильтровальных приборов непосредственно на объекте надзора, помещают в широкогорлый флакон или стеклянную банку, добавляют исходной (исследуемой) воды с таким расчетом, чтобы вода покрывала поверхность фильтра, закрывают флакон или банку завинчивающейся или притертой крышкой и доставляют в лабораторию. При использовании фильтровальных приборов с порошковым фильтром в лабораторию доставляют концентрат пробы в пластиковой емкости, входящей в состав прибора.
Емкости с пробами воды, мембранными фильтрами с концентрированным осадком или с порошковым концентратом маркируют с указанием даты и номера пробы, количества мембранных фильтров с одной точки пробоотбора. Маркированные пробы в лабораторию транспортируют для дальнейшего исследования с сопроводительным актом отбора проб воды, где указывается место отбора (населенный пункт, водный объект и т. п.), дата, время забора, количество точек пробоотбора, номера проб, количество воды или количество фильтров и другая информация.
Пробы воды должны быть доставлены в лабораторию в течение 24 ч после отбора. Пробы, не прошедшие предварительную обработку, хранят при комнатной температуре 15 - 20 °С не более двух суток. Концентрированные пробы можно хранить в холодильнике при температуре 2 - 4 °С в течение не более трех суток.
3. Оборудование, расходные материалы, реактивы
3.1. Фильтровальное оборудование*
Приборы мембранного фильтрования:
1) вакуумные фильтровальные установки типа ПВФ-142, ПВФ-35, ПВФ-47;
2) напорного фильтрования типа ПНФ, УППВ.
Приборы порошкового фильтрования:
1) напорного фильтрования - типа ПробоКонг и его модификации;
2) отборник флотанта фильтрующий типа "ОФФ-25".
___________________
* Допускается применение аналогичных приборов отечественных и зарубежных производителей, разрешенных к применению в установленном порядке.
3.2. Вспомогательное оборудование и расходные материалы
Лабораторная центрифуга типа ОПН-3, ОПН-8, ЦЛС-31М, ОС-6М со сменным ротором или другие марки с аналогичными параметрами, обеспечивающие 1500 - 3000 об./мин, позволяющие центрифугировать пробы воды в центрифужных пробирках объемом от 10 мл.
Низкотемпературный холодильный шкаф или холодильник бытовой, поддерживающий температуру 2 - 6°С.
Термостат, поддерживающий рабочую температуру 37 °С и обеспечивающий градиент температуры в камере ± 1°С.
Весы лабораторные механические равноплечие (аптекарские) с наибольшим пределом взвешивания 1 000 г, с допустимой погрешностью не более 0,1 г с разновесами или электронные с наибольшим пределом взвешивания 200 г, с допустимой погрешностью не более 0,01 г.
Ареометры с пределами измерения от 1,000 до 1,400 кг/м3.
Дистиллятор, обеспечивающий качество дистиллированной воды не ниже ГОСТа 6709-72.
Шкаф сушильный, стерилизационный, обеспечивающий температуру до 180 °С.
Световые микроскопы отечественные типа МИКМЕД-2 (вариант 2) и других фирм, оснащенные окулярами с увеличением 10× (дополнительно могут быть 7× и 5×), объективами 10×, 40×, 100×. Окуляр-микрометр и объект-микрометр.
Мембранные фильтры для фильтрования воды на основе ацетатов целлюлозы типа МФАС-СПА с размерами пор от 1,5 до 3,0 мкм, МФАС-СПА-4 с размерами пор от 2,5 до 4,5 мкм или прозрачные аналитические трековые мембраны ATM на основе полиэтилентерефталата с размерами пор от 1,0 до 5,0 и более мкм. Диаметр фильтровальных дисков 25, 35, 47, 70 и до 142 мкм, в зависимости от диаметра фритты фильтродержателя используемого фильтровального оборудования.
Предфильтры - капроновая сетка с ячейками 60 - 70 мкм.
Емкости для отбора проб воды из нейтрального материала, пригодные для обеззараживания (широкогорлые стеклянные или пластиковые флаконы емкостью 100 - 500 мл с притертым или завинчивающимися крышками, металлические или пластиковые канистры емкостью 10 - 25 л, стеклянные бутыли, фляги молочные металлические, эмалированные бидоны и др.).
Дозаторы пипеточные полуавтоматические с наконечниками.
Лабораторный вортекс, лабораторный ротатор.
Лабораторная посуда стеклянная одноразового или многоразового использования (химические стаканы, колбы, чашки Петри, цилиндры измерительные, пробирки центрифужные градуированные, микропробирки полипропиленовые, стеклянные палочки, стекла предметные, стекла покровные, пипетки стеклянные или разовые и т. п.).
Инструментарий металлический: пинцеты для работы с мембранными фильтрами, ножницы, иглы препаровальные, шпатели.
Лотки эмалированные, металлические, эмалированные кастрюли, ведра.
Горелки газовые или спиртовки.
Штативы лабораторные для пробирок и микропробирок.
Часы песочные на 3 - 5 мин, часы сигнальные или электронный таймер.
Кисти акварельные широкие (мягкие или полужесткие).
4. Методы концентрирования проб питьевой воды
Концентрация больших объемов воды (50 л и более) на объектах позволяет пробу воды, предназначенную для доставки в лабораторию на исследование, уменьшить до 0,5 - 1,0 л.
Концентрирование больших объемов воды применимо также непосредственно в лабораториях, что позволяет не только уменьшить объемы исследуемых проб воды, но и хранить пробы перед исследованием в холодильнике до 3-х суток (п. 2.2).
Все пробы воды, которые сконцентрированы с применением химических реактивов (коагулянтов), исследуются после предварительной фильтрации через мембранные фильтры.
4.1. Концентрирование проб воды с применением химических веществ
4.1.1. Концентрирование пробы воды гидрокарбонатом кальция
К 10 л пробы добавить 100 мл 1 моль/л CaCl2, затем 100 мл 1 моль/л NaHCO3. Встряхнуть емкость для перемешивания.
Добавить 100 мл 1 моль/л NaOH. Встряхнуть емкость для перемешивания.
Дать отстояться не менее 2 ч.
После осаждения хлопьев осторожно удалить из емкости надосадочную жидкость, оставив 4 - 5 см жидкости над осадком (даже если осадок невидим).
В осадок с надосадочной жидкостью добавить 100 - 200 мл 10%-й сульфаминовой кислоты (NH2SO3H) для полного растворения хлопьев.
Хорошо перемешать содержимое емкости и перелить в центрифужные флаконы объемом 1 000 мл или 500 мл, пронумерованные в соответствии с номером пробы.
Вода во флаконах должна иметь рН = 6 ± 0,5, чтобы не было повторного образования хлопьев. При несоответствии рН осторожно отрегулировать раствором 1 моль/л NaOH.
Центрифугировать флаконы 10 мин при 1500 - 2000 об./мин.
Сразу после центрифугирования осторожно удалить (слить) надосадочную жидкость или отсосать лабораторным вакуумным насосом с давлением не более 0,2 бар.
Энергично перемешать оставшуюся жидкость, ресуспендируя осадок, и перенести его в градуированную центрифужную пробирку объемом 50 мл.
Довести объем в ней до 50 мл фильтрованной дистиллированной водой (сполоснуть центрифужный флакон дистиллированной водой и перенести в 50 мл центрифужную пробирку).
Центрифугировать пробирки 15 мин при 2000 - 2500 об./мин.
Записать объем осадка сразу после центрифугирования.
Удалить надосадочную жидкость или отсосать пипетками, оставив 1 см над осадком.
Добавить дистиллированную воду в центрифужную пробирку, доведя объем до 5 мл.
Размешать осадок механическим встряхиванием в течение 10 - 15 с.
4.1.2. Концентрирование пробы воды сульфатом железа (FeSO4·7H2O)
На 10 л добавить 20 мл 1 моль/л раствор FeSO4·7H2O, перемешать механически в течение 5 мин. Довести значение рН до 9,0 ± 0,2, добавив в емкость 2 мл 1 моль/л раствора NaOH.
Оставить отстаиваться на ночь (12 - 18 ч) при комнатной температуре. Затем осторожно удалить надосадочную жидкость, оставив над осадком 4 - 5 см жидкости.
Перелить содержимое канистры в центрифужные флаконы объемом 1 000 мл или 500 мл (сполоснуть канистру 10%-й щавелевой кислотой (100 - 150 мл) до полного растворения осадка сульфата железа и вылить раствор в центрифужный флакон).
Центрифугировать 10 мин при 1500 - 2000 об./мин.
Осторожно удалить надосадочную жидкость или отсосать пипетками, оставив над осадком (даже если осадок невидим) 1 см жидкости.
Центрифугировать 10 мин при 1500 - 2000 об./мин. Осторожно удалить надосадочную жидкость или отсосать пипетками, оставив 1 см над осадком.
Измерить лакмусовой бумагой рН концентрированного осадка и, если необходимо, отрегулировать до рН 7,2 - 7,4.
Перенести суспензию в градуированные центрифужные пробирки объемом 50 мл.
Довести объем в пробирках до 50 мл дистиллированной водой.
Центрифугировать 15 мин при 1500 об./мин.
Записать объем осадка сразу после центрифугирования.
Осторожно удалить надосадочную жидкость или отсосать пипетками, оставив над осадком 1 см жидкости. Если нет видимого осадка, необходимо очень осторожно аспирировать надосадочную жидкость, не касаясь кончиком пипетки стенок и дна пробирки, чтобы избежать засасывания паразитарных объектов (цист и ооцист простейших).
Добавить в центрифужные пробирки дистиллированной воды, доведя объем до 10 мл.
Размешать осадок механическим встряхиванием в течение 10 - 15 с.
Недостаток метода:
1) на месте забора проб воды необходимо иметь дополнительное оборудование - центрифугу;
2) длительность отстаивания воды после добавления химических веществ (полдня и более), что не всегда возможно при ограниченности времени, отведенного на отбор проб.
4.2. Концентрирование осадка питьевой воды на мембранных и порошковых фильтрах
Применяемые для фильтрования мембранные фильтры МФАС СПА или прозрачные ATM укладывают на фильтродержатель (фритту) прибора вакуумного или напорного фильтрования и фильтруют через них исследуемую пробу воды в соответствии с инструкцией к прибору (п. 3.1).
По мере замедления процесса фильтрации из-за загрязнения фильтра его заменяют новым, использованный фильтр с осадком снимают пинцетом с фильтродержателя прибора и помещают в емкости для хранения и доставки в лабораторию в соответствии с п. 2.2. Использование в приборах предфильтров перед поступлением исследуемой воды на мембранный фильтр уменьшает вероятность их загрязнения крупными частицами.
В условиях лаборатории производится смыв осадка с мембранных фильтров в день отбора (фильтрования) и доставки проб. Исследование концентрированного смыва с мембранных фильтров проводится в лаборатории в соответствии с методиками в день доставки или не позднее 3-х суток с момента отбора проб, при условии хранения смыва в стеклянных емкостях в соответствии с п. 2.2.
Порошковая фильтрация осуществляется на приборах типа ПробоКонг и проводится в соответствии с инструкцией к прибору. Объем профильтрованной воды измеряют водосчетчиком, давление фильтрации - манометром. Фильтрование происходит через намывной порошковый фильтр гидробиологический (ПФГ), формируемый на опорной сетке потоком исследуемой воды. В качестве сменного корпуса фильтра применяют пластиковую бутылку, в которую после окончания фильтрации смывают слой порошкового фильтра с задержанными патогенами и транспортируют в лабораторию для дальнейшего исследования.
Метод обеспечивает возможность быстрого концентрирования больших (до 1000 л) объемов питьевой воды до 100 - 500 мл концентрата для дальнейшего исследования, простоту отделения паразитарных объектов от фильтрующего материала в процессе флотации, исключает необходимость отбора и транспортирования в лабораторию больших (≥50 л) объемов питьевой воды.
5. Методы исследования проб питьевой воды
Пробы воды после пробоподготовки (фильтрации) и получения концентрированных смывов осадка исследуются санитарно-паразитологическими, серологическими, молекулярно-биологическими методами для выявления возбудителей паразитарных болезней (яиц гельминтов и патогенных кишечных простейших).
Санитарно-паразитологические методы применяются при исследовании на яйца, личинки гельминтов и патогенных кишечных простейших (цист лямблий и ооцист криптоспоридий) (п. 5.1).
Серологические методы применяются для обнаружения антигена к специфическим антителам патогенных простейших (цисты лямблий и ооцисты криптоспоридий) в комплексе АГ+АТ (п. 5.2).
Молекулярно-биологическими методами (ПЦР) определяют специфические нуклеиновые кислоты ДНК или РНК паразитарного агента (цисты лямблий и ооцисты криптоспоридий) или его генетической мутации (п. 5.3).
Яйца и личинки гельминтов можно выявить только саниатрно-паразитологическими методами.
Для выявления патогенных кишечных простейших (цист лямблий и ооцист криптоспоридий) можно применить любой из вышеперечисленных методов. Наиболее чувствительным является серологический метод иммуномагнитной сепарации с иммунофлуоресцентным мечением, который позволяет выявить цисты лямблий и ооцисты криптоспоридий даже при незначительной их концентрации в воде.
5.1. Методы санитарно-паразитологического исследования проб питьевой воды и их концентратов
5.1.1. Метод порошковой фильтрации
Оборудование: отборник флотанта фильтрующий "ОФФ-25" в комплекте, центрифуга с качающимся ротором с прозрачными пластиковыми или стеклянными центрифужными стаканчиками объемом 100 - 150 мл.
Расходные материалы: аналитические трековые мембраны (ATM) с диаметром диска 25 мм.
Реактивы и красители: раствор Люголя, красители или флуорохромы, флуоресцентно-меченые антитела, промывочные и фиксирующие растворы, флотирующая жидкость.
Порядок приготовления препарата для микроскопического исследования:
• взбалтывают смыв в бутылке и разливают по центрифужным стаканчикам, доливают дистиллированной воды до верха стаканчика;
• центрифугируют в качающемся роторе со скоростью 1000 - 1500 об./мин, 10 мин;
• удаляют надосадочную жидкость;
Примечание 1
Целесообразно провести предварительное отстаивание концентрата с целью уменьшения объема осадка. Для этого взбалтывают смыв ПробоКонга и дают ему отстояться 10 мин для оседания крупной фракции. Надосадочную жидкость помещают в центрифужные пробирки. Полученный осадок также можно исследовать методом иммуномагнитной сепарации (п. 5.2) или ПЦР (п. 5.3).
• к осадку (примерно 20 мл без предварительного отстаивания) приливают флотирующую жидкость, объем которой должен в 5 раз превышать объем осадка (примерно 100 мл);
• осадок тщательно взбалтывают стеклянной палочкой и отмечают на стенке пробирки маркером уровень жидкости;
• наслаивают сверху 5 - 10 мм дистиллированной воды или применяемого физиологического раствора;
Примечание 2
Наслоение воды или физраствора предотвращает прилипание зерен к стенкам пробирки и возможное последующее загрязнение ими препарата для микроскопирования, а также испарение воды из флотирующей жидкости с выпадением кристалликов соли на объектах, приводящим к их "потоплению".
Не рекомендуется наслаивать водопроводную воду, т. к. ионы кальция и магния, содержащиеся в ней, образуют нерастворимые сульфаты при контакте с флотирующей жидкостью на основе сульфата цинка, что приводит к помутнению флотанта и возможной забивке микропористой мембраны.
• центрифугируют со скоростью 1500 - 2000 об./мин. 10 мин, при этом паразитарные агенты всплывают, а частицы порошкового фильтра оседают;
Примечание 3
Стаканчики в роторе должны быть установлены в предназначенные для них ячейки, недопустимо устанавливать их в ячейки или стаканчики большего диаметра так, чтобы они могли раскачиваться (совершать прецессию) во время центрифугирования, что приводит к перемешиванию границы слоев растворов.
Не рекомендуется останавливать центрифугу тормозом.
• с помощью отборника флотанта фильтрующего ОФФ-25 (по прилагаемой инструкции) отбирают флотант на прозрачную трековую мембрану, промывают ее дистиллированной водой от флотирующей жидкости, обрабатывают красителями или флуоресцирующими антителами;
Примечание 4
При отсутствии ОФФ-25 флотант можно отсосать пипеткой и перенести в центрифужную пробирку, разбавить не менее чем в 5 раз дистиллированной водой, центрифугировать 5 мин при 1500 об./мин, надосадочную жидкость удалить, из осадка готовить препараты для микроскопирования или исследовать его методом иммуномагнитной сепарации или ПЦР.
• на чистое предметное стекло наносят палочкой для иммерсионных жидкостей каплю глицерина и размазывают боковой поверхностью этой палочки на участке под фильтр;
• извлекают из ОФФ-25 мембрану пинцетом (согласно инструкции), касаются ее нижней стороной фильтровальной бумаги для удаления возможных капель воды и укладывают, постепенно опуская ее, начиная с края, на подготовленное предметное стекло, следя, чтобы не образовывались под мембраной пузыри; для лучшего пропитывания мембраны глицерином следует подождать несколько минут.
5.1.2. Флотационный метод исследования
Химреактивы
Один из флотационных растворов:
• 33%-й сульфат цинка семиводный ZnSO4·7H2O хч, уд. плотностью 1,26 - 1,30;
• 30%-й водный раствор сахарозы уд. плотностью 1,26 - 1,30;
• раствор тиосульфата натрия (гипосульфита натрия) Na2S2O3·5H2O хч, уд. Плотностью 1,3 - 1,4.
Вода дистиллированная; 40%-й раствор формалина; йод кристаллический хч, калий йодистый (KI) хч; метиленовый синий сухой хч; 1%-й раствор Люголя.
Приготовление флотационных растворов:
• 33 %-й раствор сульфата цинка семиводный ZnSO4·7H2O хч, уд. плотностью 1,26 - 1,30: 331 г вещества растворить в 0,5 л горячей дистиллированной воды, довести до 1 л и нагреть до кипения;
• 30%-й водный раствор сахарозы, уд. плотностью 1,26 - 1,30: 300 г сахарозы чда растворить в 0,5 л горячей дистиллированной воды, довести до 1 л и нагреть до кипения;
• раствор тиосульфата натрия (гипосульфита натрия) Na2S2O3·5H2O хч, уд. плотностью 1,3 - 1,4: 1 300 г вещества на 1 л горячей дистиллированной воды.
Любую из вышеперечисленных солей растворяют горячей водой в эмалированной посуде порциями при постоянном перемешивании до полного растворения, подогревая на медленном огне или электроплите. Контролируют удельную плотность флотационного раствора ареометром, когда температура раствора снизится до 18 - 20 °С.
Приготовление рабочих растворов химреактивов:
• 1%-й раствор Люголя: 5 мл 5%-ого маточного раствора Люголя + 20 мл физиологического раствора (срок хранения в темном стекле 14 дней);
• 5%-й маточный раствор Люголя: 10 г йодида калия растворить в 30 мл дистиллированной воды + 5 г кристаллического йода, размешать до полного растворения и долить до 100 мл дистиллированной водой (хранить в темном стекле);
• 2%-й водный раствор формалина: 1 часть 40%-го формальдегида растворяют в 20 частях дистиллированной воды.
Ход исследования
1. Пробу воды фильтруют на одном из фильтровальных приборов (в соответствии с паспортом и инструкцией) через мембранные фильтры типа МФАС-СПА или прозрачные аналитические трековые мембраны (ATM*), или порошковый фильтр гидробиологический (ПГФ).
2. Осадок с мембранных фильтров смывают кисточкой в 10 мл дистиллированной воды (на один фильтр) в химический стакан, чашку Петри или лоток. При использовании порошкового фильтра гидробиологического его необходимо отстаивать в течение 10 мин и исследовать надосадочную жидкость.
3. Весь полученный смыв с мембранных фильтров или после концентрации химреактивами, или надосадочную жидкость порошкового фильтра центрифугируют в пробирках емкостью 10 мл и более в течение 5 мин при 1500 об./мин.
4. Надосадочную жидкость осторожно удаляют.
5. В пробирку с осадком добавляют 6 - 8 мл дистиллированной воды или 2%-го водного раствора формалина (если не проводится исследование на жизнеспособность) и тщательно перемешивают стеклянной палочкой.
6. Суспензию вновь центрифугируют в течение 5 мин при 1500 об./мин.
7. Надосадочную жидкость осторожно удаляют или отсасывают пипеткой.
8. К осадку добавляют 3 мл одного из флотационных растворов с удельным весом 1,3 - 1,4, но не менее 1,26 и тщательно перемешивают стеклянной палочкой.
9. Центрифугируют в течение 5 мин при 2000 об./мин или 10 мин при 1500 об./мин.
10. Далее исследуют надосадочную жидкость, которую осторожно отсасывают пипеткой и переносят в центрифужную пробирку, разбавляя в 4 раза дистиллированной водой и центрифугируют в течение 5 мин при 1500 об./мин.
11. Надосадочную жидкость осторожно удаляют или отсасывают пипеткой.
12. Из осадка готовят препараты в виде мазка или капли (в зависимости от прозрачности осадка) на предметных стеклах, покрывают покровным стеклом и микроскопируют при увеличении микроскопа: объектив 10´ - 40´, окуляр 10´. Для исследования на цисты лямблий микропрепараты до нанесения покровного стекла окрашивают 1%-м раствором Люголя.
_____________________
* Концентрированный осадок, полученный на прозрачных аналитических трековых мембранах (ATM) после фильтрации воды, можно исследовать под микроскопом непосредственно без предварительного смыва (п. 5.2).
Применение метода:
1) для исследования концентрированного осадка (смыва) воды после фильтрации через мембранные или порошковые фильтры;
2) для выявления в воде яиц гельминтов и цист лямблий.
5.1.3. Метод последовательной фильтрации через систему прозрачных аналитических трековых мембран (ATM)
5.1.3.1. Исследование на яйца, личинки гельминтов и цисты лямблий
Химреактивы: дистиллированная вода, 50%-й раствор глицерина, 1%-й раствор Люголя.
Ход исследования
1. Предварительно на заборное устройство прибора для фильтрования ПВФ-142 крепят предфильтр в виде капроновой сетки с размерами ячейки 67 - 70 мкм (поставляется в комплекте с ATM).
2. Аналитическую трековую мембрану (ATM) с диаметром пор 5,0 мкм помещают на фритту фильтродержателя прибора для фильтрования и сверху укладывают фильтр с размером пор 25,0 мкм, уплотняют кольцом из эластичной резины. Для плотного (без складок) прилегания ATM к фритте рекомендуется смочить мембрану дистиллированной водой и плотно уложить на фритту фильтродержателя.
3. После фильтрации обе мембраны последовательно по одной осторожно снимают пинцетом с фритты фильтродержателя на заранее подготовленные тонкие пластмассовые квадратные пластинки размером 150 × 150 мм (поставляются в комплекте с ATM) и переносят в лоток.
4. Профильтрованную в отдельную емкость пробу воды повторно фильтруют с использованием ATM с диаметром пор 2,5 мкм, которую укладывают на фритту фильтродержателя между двумя уплотнительными кольцами из полиэтилена или обрезиненного лавсана (поставляются в комплекте с ATM).
5. После фильтрации ATM осторожно снимают пинцетом с фритты на пластиковый диск, который должен быть помещен в лоток. Со всех трех фильтров аккуратно и тщательно, придерживая диск с мембраной пинцетом за край, производят смыв осадка с обеих поверхностей мембран и с пластиковых дисков, на которых эти фильтры лежали. Смыв проводят плоской, средней жесткости кисточкой в лоток с дистиллированной водой. При этом периодически споласкивают мембраны и диски дистиллированной водой из химического стакана. Общий объем дистиллированной воды при смыве осадка со всех 3-х фильтров не должен превышать 300 - 500 мл.
6. Полученный концентрированный смыв сливают из лотка в воронки прибора для фильтрации типа ПВФ-35 или ПВФ-47 и фильтруют через аналитические мембраны ATM с диаметром пор 3,0 - 2,5 мкм. В зависимости от первоначальной загрязненности воды фильтруют последовательно, меняя мембраны.
7. После фильтрации мембраны ATM осторожно снимают пинцетом с фильтродержателя (фритты) фильтровального прибора и переносят на предметное стекло, предварительно обработав его 50%-м раствором глицерина (для этого на поверхность предметного стекла наносят 1 - 2 капли 50%-го раствора глицерина и стеклянной палочкой распределяют по всей поверхности тонким слоем), затем сверху мембраны наносят каплю 1%-го раствора Люголя и накрывают покровными стеклами (24 × 24 мм) всю поверхность мембраны.
8. Микроскопируют препарат при увеличениях: окуляр 7× или 10×; объектив 10×; для идентификации яиц гельминтов и исследования на цисты лямблий - объектив 40×.
5.1.3.2. Исследование на ооцисты криптоспоридий
Химреактивы: спирт 96%-й, дистиллированная вода, смесь Никифорова (равные пропорции этилового эфира и спирта 96%-го); краска по Циль-Нильсену промышленного изготовления или реактивы для ее приготовления (фенол кристаллический, фуксин основной, 5%-й раствор серной кислоты; 0,2%-й водный раствор метиленового синего или 5%-й раствор малахитовой зелени на 10%-м этиловом спирте); иммерсионное масло.
Приготовление раствора краски по Циль-Нильсену: фуксин основной 2 г растворить в 12 мл спирта 96%-го; фенола 5 г растворить в 50 мл дистиллированной воды; слить вместе растворы фуксина и фенола, долить дистиллированной воды до 100 мл и тщательно перемешать.
Ход исследования
1. После фильтрации пробы воды через прозрачную аналитическую трековую мембрану ATM диаметром пор 2,5 - 3,0 мкм на фильтровальном приборе или получения концентрированного смыва (п. 5.3.1) мембрану тщательно высушивают в лотке на воздухе.
2. Фиксируют в смеси Никифорова 5 мин.
3. После фиксации мембрану вновь тщательно высушивают в лотке на воздухе.
4. Затем окрашивают фильтр ATM в кювете (лотке, чашке Петри) карболовым фуксином (краска по Циль-Нильсену) в течение 20 мин.
5. После окраски фильтры промывают под проточной водой, предварительно закрепив ATM за край химического стакана, с таким расчетом, чтобы струя воды не попадала на поверхность мембраны, а закрепленный фильтр свободно плавал в воде. Фильтр считается промытым, когда из стакана польется прозрачная вода.
6. Обесцвечивают (дифференцируют) 5%-м раствором серной кислоты в течение 10 с и снова промывают (согласно п. 5).
7. Дополнительно окрашивают 0,2%-м водным раствором метиленового синего (входит в состав краски по Циль-Нильсену, промышленного приготовления) или 5%-м раствором малахитовой зелени (приготовленном на 10%-м этиловом спирте) в течение 3 - 5 мин. Промывают под струей проточной воды (согласно п. 5).
8. Пинцетом фильтр из воды переносят в кювету (лоток, чашку Петри) и тщательно высушивают на воздухе.
9. Сухой окрашенный фильтр (ATM) помещают на предметное стекло, предварительно смазанное тонким слоем иммерсионного масла (для лучшей адгезии), накрывают покровным стеклом и микроскопируют под иммерсией при увеличении микроскопа: окуляр 10×, объектив 90× или 100×.
Результат окрашивания: ооцисты криптоспоридий окрашиваются в разные оттенки яркокрасного (малинового, вишневого) цвета и имеют вид округлых образований диаметром 5 - 6 мкм с отчетливо видимой оболочкой и структурированным содержанием (можно наблюдать наличие 4 веретенообразных темноокрашенных спорозоитов) на синем (сиреневом) или зеленом основном фоне.
5.2. Исследование воды на цисты лямблий и ооцисты криптоспоридий методом иммуномагнитного разделения и мечения флуоресцирующими антителами (IMS)
Метод представлен двухэтапной реакцией, при которой обнаружение искомого антигена в комплексе антиген-антитело (AГ - AT) происходит с помощью иммуномагнитной суспензии (для выделения: ооцист криптоспоридий - Cryptosporidium Beads, цист лямблий - Giardia Beads.
Реагенты и химреактивы диагностического набора AquaGlo G/C:
иммунореагент (импортного производства) AquaGlo G/C концентрированный или в рабочем разведении;
фосфатный буфер в таблетках (PBS) или концентрированный солевой моющий буфер 20XWash Buffer;
защитная среда No-FadeТМ, M101 или Elvanol No-FadeТМ, M102;
контрастирующий реагент, С101 (Contersain);
контроль положительный (взвесь с цистами лямблий и ооцистами криптоспоридий) Positiv Control: G. lamblia, С. parvum.
Реагенты и химреактивы диагностического набора Aureon CG Kit:
иммуномагнитная суспензия Cryptosporidium Beads, специфичная к ооцистам криптоспоридий;
иммуномагнитная суспензия Giardia Beads, специфичная к цистам лямблий;
буфер для иммуномагнитной сепарации IMS BufferТМ
моющий буфер IT-Wash BufferТМ;
концентрированный раствор 2-меркаптоэтанола 14,3 М (2-меркаптоэтанола, готовый раствор 20 мМ готовить свежим непосредственно перед проведением анализа, разбавляя концентрированный 14,3 М раствор в отношении 1 : 700).
Примечание: возможно применение диагностических наборов, в состав которых могут входить, например, другие контрастирующие вещества - метящий раствор 4`,6-диамидино-2-фенилиндола (DAPI). Все изменения в проведении реакции регулируются инструкцией к применению диагностического теста.
Материалы и оборудование:
слайды SuperStick: S100-1 (одно окно), S100-2 (два окна), S100-3 (три окна);
покровные стекла;
бумажные салфетки;
стеклянные палочки;
ячейка влажности;
пастеровские пипетки стеклянные или разовые полистероловые;
инкубатор или водяная баня (37 и 50 °С);
наклонный штатив для слайдов;
фен или специальное устройство для подсушки слайдов;
магнитный штатив MagnetOn 4TТМ;
магнитная ручка SepPen;
наконечники для магнитной ручки;
автоматические пипетки на 100 - 1000 мкл;
наконечники для автоматических пипеток;
градуированная пипетка на 5 мл;
лабораторный вортекс;
лабораторный ротатор;
лабораторный таймер;
пробирки для иммуномагнитной сепарации (ИМС-пробирки с одной плоской стороной);
микроцентрифужные пробирки на 1,5 - 2,0 мл типа "Epindorf";
штатив для ИМС-пробирок;
штатив для микроцентрифужных пробирок;
люминесцентный микроскоп с набором необходимых фильтров и принадлежностей в рекомендованной комплектации;
канадский бальзам или бесцветный маникюрный лак.
Ход исследования
Этап I. Выделение ооцист криптоспоридий и цист лямблий из воды с помощью метода иммуномагнитной сепарации (IMS).
1) Подготовка проб к исследованию
После фильтрации воды осадок с фильтров смывают в 10 мл дистиллированной воды, переливают в центрифужную пробирку и центрифугируют 10 мин при 1 500 об./мин. Удаляют надосадочную жидкость и осадок исследуют. При этом осадок должен быть не более 1 мл. Если получился больший объем осадка, его необходимо ресуспендировать дистиллированной водой и далее обрабатывать как 2 и более порции.
Примечание: все иммунореагенты и буферные растворы диагностического набора перед использованием выдержите в течение одного часа при комнатной температуре.
2) Процедуры связывания и промывки цист лямблий и ооцист криптоспоридий
1. Внести 5 мл IMS-буфера из диагностического набора в пробирку для иммуномагнитной сепарации (ИМС-пробирку с плоской боковой поверхностью), закрыть пробирку крышкой и вращать пробирку, смачивая буфером ее внутренние стенки.
2. Перенести IMS-буфер в пробирку с осадком исследуемой пробы и ресуспендировать осадок.
3. Ресуспендированный осадок перенести обратно в ИМС-пробирку. Промыть пробирку, в которой был исследуемый осадок, 2,5 мл дистиллированной воды и перенести в ИМС-пробирку. Процедуру промывки повторить. После выполнения процедуры объем ресуспендированной пробы должен составить не более 10 мл.
4. Перемешать весь объем иммуномагнитной суспензии Crypto sporidium Beads и Giardia Beads диагностического набора на вортексе в течение 10 - 15 с, отобрать микродозатором из каждого флакона по 100 мкл (0,1 мл) суспензии и перенести ее в пробирку для ИМС, в которой уже находится порция пробы.
5. Закрепить ИМС-пробирку, закрытую крышкой, в штативе лабораторного ротатора и перемешать в течение одного часа при скорости 15 - 25 об./мин маятникообразными движениями (не переворачивая пробирку!).
6. Извлечь ИМС-пробирку из ротатора и поместить ее в магнитный штатив MagnetOn 4TТМ;, при этом плоская сторона пробирки должна быть обращена к магниту штатива.
7. Осторожно наклоняют пробирку вместе с магнитным штативом по направлению от дна к крышке пробирки и наоборот в течение 2 мин (не переворачивать пробирку с магнитным штативом!).
По мере движения на плоской стороне ИМС-пробирки будет образовываться осадок (налет).
8. Не вынимая ИМС-пробирку из магнитного штатива, открыть крышку и осторожно слить надосадочную жидкость из пробирки, при этом не повредив осадок (налет) на плоской стороне пробирки.
9. В пробирку добавить 1 мл моющего буфера IT-Wash Buffer (WB). Удалить пробирку из штатива и взболтать с таким расчетом, чтобы смыть в этот раствор осадок с плоской стороны пробирки.
10. Поместить в ИМС-пробирку магнитную ручку SepPen и собрать магнитную суспензию на наконечнике ручки, осторожно перемешивая содержимое пробирки в течение примерно 1 мин.
11. Удалить из ИМС-пробирки магнитную ручку SepPen, переворачивая ее, нажать на кнопку ручки, чтобы убрать магнитный сердечник из наконечника.
12. В микроцентрифужную пробирку Epindorf (объемом на 1,5 - 2 мл) поместить пипеточным дозатором 1 мл моющего буфера WB и перенести ранее собранную суспензию, вращая наконечник ручки SepPen в растворе буфера (при этом магнит убран из наконечника нажатием кнопки ручки).
Примечание: не сбрасывать наконечник! Этот же наконечник понадобится в п. 2.17 процедуры ИМС.
13. В ИМС-пробирку добавить 1 мл буфера WB (общий объем 2,0 мл), закрыть крышку и, осторожно переворачивая пробирку, промыть буфером внутренние стенки пробирки и крышки.
14. ИМС-пробирку поместить в магнитный штатив Magnet On4TТМ; и осторожно наклонять (вправо-влево) в течение 30 - 60 с, чтобы собрать остатки магнитной суспензии и промыть внутреннюю поверхность ИМС-пробирки.
15. Не вынимая ИМС-пробирку из магнитного штатива, слить моющий буфер WB из пробирки и добавить в пробирку новую порцию моющего буфера WB объемом 1 мл. Закрыть крышку и, осторожно вращая пробирку, промыть буфером внутренние стенки пробирки и крышки (ИМС-пробирка остается в магнитном штативе).
16. ИМС-пробирку удалить из штатива и взбалтыванием смыть суспензию с плоской стороны пробирки.
17. Открыть крышку ИМС-пробирки и поместить в нее магнитную ручку SepPen (для сбора остатков иммуномагнитной суспензии), с тем же наконечником, который использовался, и перенести в микроцентрифужную пробирку с моющим буфером WB и первой порцией осадка (п. 2.12), при этом пробирка должна быть установлена в магнитный штатив.
18. Микроцентрифужную пробирку периодически наклоняют вместе с магнитным штативом (вправо-влево) 1 мин. Затем оставить штатив вместе с пробиркой в покое на 15 с в вертикальном положении.
19. Не вынимая микроцентрифужную пробирку из магнитного штатива открыть крышку и слить моющий буфер WB из пробирки, добавить в пробирку 1 мл новой порции моющего буфера WB, при этом не повредив осадок (налет) на стенке пробирки со стороны магнита.
3) Процедуры диссоциации.
1. Приготовить рабочий раствор 2-меркаптоэтанола в концентрации 1 : 700: к 0,1 мл 2-меркаптоэтанола добавить 7 мл дистиллированной воды.
2. Не вынимая микроцентрифужную пробирку из магнитного штатива открыть крышку и слить моющий буфер из пробирки, добавить в пробирку 100 мкл рабочего раствора 2-меркаптоэтанола. Перемешать суспензию на вортексе в течение 30 с.
3. Поместить микроцентрифужную пробирку в термостат или водяную баню при 50 °С на 5 мин.
4. Перемешать суспензию в микроцентрифужной пробирке на вортексе в течение 30 с, установить пробирку в магнитный штатив на 10 - 15 с, не вынимая из магнитного штатива, отобрать супернатант и перенести его на слайд SuperStickТМ для последующего иммунофлуоресцентного мечения. (При этом осадок (налет) остается на стенке пробирки не исследуется.)
5. Во второе окно слайда S100-2 вносят каплю положительного контроля (взвесь с цистами лямблий и ооцистами криптоспоридий) Positiv Control: G. lamblia, С. parvum.
6. Перед началом процедуры мечения концентраты проб и контроль, нанесенные на слайды, необходимо подсушить в слабом токе теплого (не горячего!) воздуха или с помощью специального устройства для подсушки слайдов. Не допускается перегрев слайдов!
Этап II. Детекция (идентификация) ооцист криптоспоридий и цист лямблий методом иммунофлуоресцентного мечения.
1) Подготовка к мечению.
1. По одной капле (около 45 мкл) иммунореагента AquaGloТМ G/C* вносят в каждую лунку слайда с подсушенной пробой и контролем. При необходимости с помощью аппликатора или стеклянной палочки распределяют реагент по лунке. Не касаться поверхности лунок! Иммунореагент AquaGloТМ G/C рабочий раствор, поэтому не требует дополнительного разведения.
2. Слайды помещают в ячейку влажности в темноте и инкубируют не менее 30 мин при 37 °С или не менее 40 мин при комнатной температуре. (Допускается более длительное время инкубации.)
3. Нанести по одной капле фосфатного буфера (PBS) или солевого раствора в каждую лунку и выдерживать не менее 2 мин.
4. Наклонить каждый слайд на чистую фильтровальную бумагу и осторожно аспирировать излишек жидкости из нижней части лунки с помощью фильтровальной бумаги или пастеровской пипетки. Избегать перемешивания пробы. Не касаться пипеткой поверхности лунок!
2) Процедура мечения.
1. Чтобы снизить неспецифическую флуоресценцию и выделить фон для лучшего наблюдения яблочно-зеленой флуоресценции цист и ооцист, нанести по одной капле контрастирующего красителя в каждую лунку и выдержать 1 мин при комнатной температуре.
2. Нанести одну каплю фосфатного буфера (PBS) или солевого моющего буфера 20XWash Buffer (предварительно развести концентрированный солевой моющий буфер: 19 частей дистиллированной воды и 1 часть буфера) в каждую лунку и выдержать 1 мин при комнатной температуре.
3. Наклонить каждый слайд на чистую фильтровальную бумагу и осторожно аспирировать излишек жидкости из нижней части лунки с помощью фильтровальной бумаги или пастеровской пипетки. Избегать перемешивания пробы. Не касаться пипеткой поверхности лунок!
4. Разложить слайды на наклонном штативе и подсушить в слабом токе теплого воздуха.
5. Нанести 1 каплю монтирующей среды No-FadeТМ в каждую лунку. Покрыть покровным стеклом, края заклеить канадским бальзамом или бесцветным лаком и микроскопировать под масляной иммерсией на люминесцентном микроскопе.
Примечание. Меченые препараты должны храниться в темноте при температуре (5 ± 3) °С. Не допускать замораживания! Меченые препараты могут храниться в течение 72 часов от выполнения мечения до завершения исследования и подтверждения проб.
3) Люминесцентная микроскопия.
Исследуют препараты не менее чем при 200-кратном общем увеличении на наличие яблочно-зеленой флюоресценции, микроскопируя все поля зрения лунки слайда. Перед началом микроскопии препаратов исследуемых проб следует предварительно просмотреть препарат положительного контроля, прилагаемого в диагностическом наборе в виде контрольной суспензии с подсчитанными цистами лямблий и ооцистами криптоспоридий.
Результат:
• цисты лямблий - сверкающие и флюоресцирующие яблочно-зеленым светом объекты, от округлых до овальных (8 - 14 мкм в длину на 7 - 10 мкм в ширину), с ярко подсвеченными краями;
• ооцисты криптоспоридий - сверкающие и флюоресцирующие яблочно-зеленым светом объекты от овальных до сферических (от 3 до 5 мкм в диаметре), с ярко подсвеченными краями.
_______________________
* Концентрированный иммунореагент AquaGloТМ G/C разбавляют буфером DB в 20 раз. Например, если для работы нужен 1 мл готового рабочего раствора иммунореагента, смешивают 50 мкл концентрированного 20Х иммунореагента с 950 мкл разбавляющего буфера DB. Если нужно получить 20 мл готового иммунореагента, смешивают 1 мл концентрированного 20Х иммунореагента с 19 мл разбавляющего буфера DB. Хранится рабочее разведение иммунореагента при 4 °С
Применение метода:
1) для выявления специфических антигенов простейших: цист лямблий и ооцист криптоспоридий в воде;
2) реакцию можно проводить для выявления одного из антигенов, либо одновременно обоих.
5.3. Обнаружение цистных форм криптоспоридий и лямблий в питьевой воде методом полимеразной цепной реакции (ПЦР)
Метод ПЦР определяет специфические нуклеиновые кислоты ДНК или РНК, что позволяет провести прямое обнаружение инфекционного агента или генетической мутации.
Аналитическая чувствительность тест-систем для выявления ДНК (РНК) микроорганизмов методом ПЦР составляет 1×102-1×104 м.к. (гемэквивалент/мл), специфичность - более 85%:
5.3.1. Необходимое оборудование и инструментарий
Амплификатор типа "Терцик МС-2" со скоростью нагрева/охлаждения активного элемента не менее 1,5 °С/с.
Прибор для горизонтального электрофореза типа "Sub Cell GT System" с комплектом кювет и гребенок.
Источник напряжения типа "Power Рас 300" с диапазоном регулируемого напряжения 50 - 300 В.
Видеосистема типа "Gel Doc 2000ТМ", предназначенная для ввода в компьютер, анализа и документирования изображений люминесцирующих следов ДНК в гелях, окрашенных бромистым этидием: диапазон излучения 300 - 400 нм, чувствительность - не менее 10 нг ДНК (по бромистому этидию).
Холодильник бытовой или холодильный шкаф с морозильной камерой, обеспечивающей температуру минус 20 °С.
Микроцентрифуга настольная для пробирок типа Эппендорф (частота вращения не менее 13000 об./мин).
Термостат типа "TERMO 24-15" под пробирки типа Эппендорф вместимостью 0,5 и 1,5 мл, диапазон температур от 15 до 120 °С, количество гнезд - не менее 20 каждого типа, точность поддержания температуры - 0,2°С, разность температур между соседними ячейками - не более 0,5 °С.
Аппарат для встряхивания типа "Вортекс", скорость вращения 250-3000 об./мин.
Печь микроволновая (мощностью не менее 400 W).
Весы лабораторные общего назначения 2-го класса точности с наибольшим пределом взвешивания 200 г.
Анализатор потенциометрический, погрешность измерений рН = 0,01.
Стерилизатор паровой медицинский.
Дистиллятор, обеспечивающий качество дистиллированной воды по ГОСТ 6709-72.
Гомогенизатор перистальтического типа "Стомайкер".
Облучатель бактерицидный типа ОБН-150.
Дозаторы с переменным объемом дозирования:
0,2 - 2,0 мкл с шагом 0,01 мкл, с точностью = 1,2%;
0,5 - 10,0 мкл с шагом 0,01 мкл, с точностью = 0,8%;
2 - 20 мкл с шагом 0,01 мкл, с точностью = 0,8%;
20 - 200 мкл с шагом 0,1 мкл, с точностью = 0,6%;
100 - 1000 мкл с шагом 1 мкл, с точностью = 3%;
2 - 10 мл с шагом 0,1 мл, с точностью = 0,5%;
Пинцеты медицинские.
Лабораторная посуда и расходные материалы
Бумага фильтровальная лабораторная.
Посуда химическая стеклянная: воронки, колбы мерные плоскодонные конические (25, 50, 100, 200, 1000 мл), цилиндры мерные (25, 100, 1000 мл).
Пробирки микроцентрифужные типа Эппендорф (0,2; 0,5; 1,5 мл).
Наконечники полистироловые с фильтром для дозаторов с переменным объемом дозирования до: 10; 20; 200; 1000 мм3; 10 см3.
Химреактивы (хч):
Кислота соляная, кислота борная гидроокись натрия, хлористый натрий, этилендиаминтетрауксусная кислота (ЭДТА), гексадецилтриметиламмоний бромид (СТАВ). Корпорация "Сигма Алдрич" (Sigma).
Трис (оксиметил) аминометан, Альбумин бычий сывороточный сухой (БСА). Корпорация "Сигма Алдрич" (Sigma).
Этидий бромистый, спирт этиловый, спирт изопропиловый, масло вазелиновое, вода дистиллированная, вода деионизированная, хлороформ, 2-меркаптоэтанол.
Термостабильный фермент Taq-полимераза, оптимум работы в области 70 - 72 °С. Корпорация "Сигма Алдрич" (Sigma), кат. N Д 1806.
Буфер для ПЦР с MgCl2. Корпорация "Сигма Алдрич" (Sigma).
Агароза для электрофореза (тип П). Корпорация "Сигма Алдрич" (Sigma).
Маркер молекулярной массы ДНК. Корпорация "Сигма Алдрич" (Sigma).
Праймеры.
Допускается использование других реактивов с техническими характеристиками не хуже указанных выше. Препараты импортного производства должны иметь международный сертификат качества ИСО 9 000 или EN 29 000.
5.3.2. Приготовление растворов и буферов
Приготовление 1 М ТРИС - HCl (рН 7,5). В мерной колбе на 100 мл растворяют 12,11 г Трис (оксиметил) аминометана (молекулярный вес 121) в 80 мл дистилированной воды, доводят рН концентрированной соляной кислотой до 7,5, затем доводят объем раствора до метки деионизованной водой, перемешивают. Хранят при температуре - 20 °С не более года.
Приготовление 5М NaCl. Растворяют 29,22 г натрия хлористого (молекулярный вес 58,5) в 100 мл дистиллированной воды, перемешивают. Хранят в колбе с притертой пробкой при комнатной температуре до 1 года.
Приготовление 30%-й NaOH. Растворяют 3 г натрия гидроокиси (молекулярный вес 40) в 7 мл дистиллированной воды.
Приготовление 0,5М ЭДТА (рН 8,0). В мерной колбе на 100 мл растворяют 18,62 г этилендиаминтетрауксусной кислоты (молекулярный вес 372,2) в 80 мл дистиллированной воды. Раствором 30%-й натрия гидроокиси доводят рН раствора до 8,0; затем дистиллированной водой - объем раствора до метки, перемешивают. Хранят в колбе с притертой пробкой при комнатной температуре до 1 года.
Приготовленные растворы автоклавируют при 1 ати., 121 °С 15 - 20 мин или фильтруют через мембраны Millipore 0,4 мкм.
Приготовление хлороформа, насыщенного водой. Смешивают 100 мл хлороформа с 20 мл деионизированной воды и оставляют на 24 ч для насыщения. Срок хранения при температуре от 4 до 5 °С не более 6 мес.
Приготовление 70%-го раствора этилового ректификованного спирта. Смешивают 70 мл 96%-го этилового ректификованного спирта с 26 мл деионизированной воды. Срок хранения при температуре от 4 до 5 °С не более 2 мес.
Приготовление раствора БСА (20 мкг/мл). Растворяют 0,002 г сухого альбумина бычьего сывороточного в 1 мл деионизированной воды, 10 мкл полученного раствора смешивают с 990 мкл деионизированной воды. Срок хранения в морозильной камере при температуре минус 20 °С не более 6 месяцев.
Приготовление лизирующего буфера (2%-го "СТАВ"). Растворяют 0,5 г гексадецилтриметиламмония бромида в 10 мл деионизированной воды (при плохом растворении подогреть на водяной бане), добавляют 2,5 мл 1М Трис - HCl, 7 мл 5 М NaCl, 1 мл 0,5 М ЭДТА, доводят объем раствора деионизированной водой до 25 мл, перемешивают. Срок хранения при температуре от 4 до 5 °С не более 6 месяцев, допустимо образование осадка.
Перед использованием раствор выдерживают при комнатной температуре или подогревают в термостате при температуре 65 °С до полного растворения осадка.
Непосредственно перед использованием в приготовленный лизирующий буфер вносят меркаптоэтанол из расчета 4 мм3 на 1 см3 лизирующего буфера и перемешивают.
Приготовление 1х ТВЕ буфера для электрофореза. В мерной колбе на 1000 мл растворить 10,8 мг Трис (оксиметил) аминометана, 5,5 г борной кислоты и 0,92 г этилендиаминтетрауксусной кислоты, довести дистиллированной водой до метки, перемешать до полного растворения. Срок хранения 1х раствора - 10 дней, обычно готовят 10х и перед употреблением разбавляют до 1х, используют максимум три раза.
Приготовление 1х ТАЕ буфера для электрофореза. В мерную колбу вместимостью 1000 мл вносят 242 г Трис-основания, 57,1 мл ледяной уксусной кислоты, 10,0 мл 0,5 М ЭДТА, доливают деионизованной водой до метки. Полученный концентрированный раствор перед употреблением разводят в 50 раз. Используют для проведения электрофореза не более двух раз.
Приготовление раствора бромистого этидия - C21H20N3Br (10 мг/мл). Растворяют 1 г бромистого этидия в 100 мл дистиллированной воды. Срок хранения в посуде из темного стекла (обязательно при температуре от 4 до 5 °С) не более 12 мес.
Приготовление 2%-го раствора агарозного геля. Допускается хранение готового геля в 1х буфере для электрофореза в холодильнике при температуре от 4 до 5 °С - не более 2-х суток.
5.3.3. Проведение анализа ПЦР
5.3.3.1. Выделение ДНК с помощью набора Diatom DNA Prep 100/200
Порядок выполнения
Приготовление рабочего раствора солевого буфера. Содержимое флакона с 10-кратным солевым буфером, 10 мл, переносят в мерный цилиндр, доводят бидистиллированной водой до метки 100 мл и 96%-м этиловым спиртом до метки 300 мл и перемешивают. Готовый рабочий раствор солевого буфера в герметично закрытой посуде хранят при температуре 4 °С.
В пробирку объемом 1,5 мл вносят 100 мкл исследуемой пробы, добавляют 400 мкл лизирующего реагента и перемешивают содержимое пробирки переворачиванием (5 - 10 раз). Интенсивное встряхивание смеси не рекомендуется.
Термостатируют пробирку со смесью 5 - 7 мин при температуре 65 °С. Если выделение ДНК проводится из твердого сухого мелкоизмельченного материала, то следует термостатировать 30 - 40 мин.
После термостатирования центрифугируют пробирку со смесью 10 с при 5000 об./мин в том случае, если смесь содержит нерастворенные клеточные фрагменты или другой нерастворимый материал. Прозрачный супернатант целиком переносят в чистую пробирку.
В пробирку с чистой смесью добавляют 20 мкл суспензии сорбента NucleoSТМ (перед использованием NucleoSТМ следует интенсивно встряхнуть на вортексе).
Пробирку помещают на ротатор и перемешивают 10 мин (10 - 20 об./мин).
Центрифугируют 10 с при 5000 об./мин.
Осторожно, не задевая осадка, удаляют супернатант.
К осадку добавляют 200 мкл лизирующего реагента, тщательно перемешивают на вортексе до гомогенного состояния.
Примечание: если суспендирование затруднено (при большой нагрузке ДНК из-за сильного слипания сорбента), то его необходимо вначале осторожно суспендировать пипетированием, а затем перемешать на вортексе.
Добавляют в пробирку 1 мл рабочего раствора солевого буфера.
Перемешивают содержимое пробирки переворачиванием 5 - 10 раз.
Центрифугируют 10 - 20 с при 2000 об./мин.
Осторожно, не задевая осадка, удаляют супернатант.
Добавляют в пробирку 1 мл солевого буфера, перемешивают содержимое пробирки на вортексе, центрифугируют 10 с при 5000 об./мин и осторожно удаляют супернатант.
Подсушивают осадок при температуре 65 °С в течение 4 - 5 мин.
В эту же пробирку вносят 50 - 100 мкл Экстра ГенаТМ
Внимание! Экстра ГенТМ следует отбирать от общего объема при постоянном перемешивании!
1. Суспендируют содержимое пробирки на вортексе 5 - 10 с до получения гомогенной суспензии, затем термостатируют 4 - 5 мин при 65 °С.
2. Еще раз суспендируют содержимое пробирки на вортексе перед центрифугированием.
3. Цетрифугируют 1 мин при 10 000 об./мин.
4. Переносят супернатант с ДНК в чистую пробирку. ДНК хранят при температуре - 20 °С.
5.3.3.2. Амплификация
При проведении ПЦР обязательно готовят следующие пробы:
ДНК-матрица положительного контроля с праймерами к соответствующим возбудителям;
ДНК-матрица отрицательного контроля с праймерами к соответствующим возбудителям;
ДНК-матрица отрицательного контроля с теми же праймерами;
исследуемые образцы ДНК криптоспоридий и лямблий с праймерами.
Праймеры для идентификации:
криптоспоридий:
1 - CCG AGT TTG АТС САА AAA GTT ACG АА;
2 - CGT TAA CGG AAT TAA CCA GAC;
лямблий:
1 - AGG GCT CCG GCA TAA CTT TCC;
2 - GTA TCT GTG ACC CGT CCG AG.
Реакционная смесь для проведения полимеразной цепной реакции, рассчитанная на 10 проб, представлена в табл. 1.
Таблица 1
В пробирку типа Эппендорф вносят на холоде следующие реактивы:
|
№ |
Реактивы |
Объем реакционной смеси, нкл |
|
|
30 |
50 |
||
|
1 |
Деионизированная вода |
190 |
322 |
|
2 |
Буфер для полимеразной цепной реакции с НдС12 (10×) |
30 |
50 |
|
3 |
Смесь нуклеотидов |
30 |
50 |
|
4 |
Праймер 1 (5 пН/мкл) |
20 |
30 |
|
5 |
Праймер 2 (5 пН/мкл) |
20 |
30 |
|
б |
Taq-полимераза (5 ед./мкл) |
10 |
18 |
Примечание: реакционную смесь готовят на необходимое количество проб, но не менее 5.
Подготовка к проведению амплификации
Реакционную смесь разливают в пробирки для проведения ПЦР по 18 мкл в каждую.
В каждую пробирку с 18 мкл добавляют 2 мкл раствора ДНК.
Смесь перемешивают, центрифугируют (30 с при 3000 об./мин).
При использовании амплификатора с крышкой без подогрева в каждую пробирку добавляют каплю минерального масла.
Условия амплификации представлены в табл. 2.
Таблица 2
|
Стадия |
Криптоспоридии |
Лямблии |
|
Начальная денатурация |
95 °С - 5 мин |
95 °С - 5 мин |
|
Денатурация |
95 °С - 1 мин |
95 °С-45с |
|
Отжиг праймеров |
45 °С - 2 мин |
55 °С-30с |
|
Удлинение |
72 °С - 3 мин |
72 °С-45с |
|
Конечное удлинение |
72 °С-4 мин |
72 °С - 4 мин |
|
Количество циклов амплификации |
35 |
30 |
После проведения амплификации пробы готовы для проведения электрофореза в агарозном геле.
5.3.3.3. Проведение электрофореза в агарозном геле
Приготовление агарозного геля
Для приготовления 2%-й агарозы необходимо к 1 г агарозы добавить 50 мл буфера ТВЕ и тщательно перемешать.
Полученный раствор помещают в микроволновую печь (на 2 - 5 мин, в зависимости от мощности печи - следить за интенсивностью кипения суспензии!) или кипятят на водяной бане 15 мин до полного растворения агарозы.
Расплавленную агарозу охлаждают до 56 °С и добавляют 5 мкл бромистого этидия (концентрация 10 мг/мл), тщательно перемешивают.
Расплавленную агарозу с бромистым этидием разливают в подготовленную форму. Толщина геля 0,5 - 0,7 см.
Через 30 - 40 мин удаляют гребенку. Готовый гель можно использовать сразу, можно хранить в 1х буфере в холодильнике при 4 °С .
5.3.3.4. Проведение электрофореза
Смешивают в отдельной пробирке 2 мкл буфера для нанесения и 10 мкл реакционной смеси. Вносят смесь в лунки геля. (Можно использовать соотношение буфер-реакционная смесь - 2 : 8.) В одну из лунок (чаще в крайнюю) вносят маркер молекулярной массы (100 - 100 Вр). Помещают заполненный гель в камеру для электрофореза, заполненную буфером 1 × ТБЕ. Толщина слоя буфера над поверхностью геля примерно 2 - 3 мм.
В режиме постоянного напряжения 100 V электрофорез длится примерно 70 - 90 мин.
Гель (без формы) помещают на фильтр трансиллюминатора и просматривают в проходящем ультрафиолетовом свете.
При оценке результата ПЦР ожидаемый размер продукта (относительно маркера):
для С. parvum - 400 - 451 в. р., для Giardia lamblia - 161 в. p.
Документируют результат электрофореза - либо на фотопленку "Микрат Изопан" (изопанхроматическая фотопленка чувствительностью 3 ед. ГОСТ, фотографическая широта 10, разрешение - 300 линий/мм), либо при помощи гельдокументирующей системы. Фотокопия геля должна быть приложена к отчету по идентификации (при цифровой съемке распечатывается на принтере с разрешением не менее 300 dpi).
Приложение 1
(рекомендуемое)
Математическое определение вероятности выявления патогенов при санитарно-паразитологических методах исследования воды
1. В процессе выполнения любой методики исследования определяются не все паразитарные объекты, а только их доля Е от числа присутствующих в пробе. Эту долю, численно равную вероятности обнаружения присутствующего патогена, называют эффективностью выявления или эффективностью метода определения.
Необходимый для исследования объем воды определяют экспериментально на модельных жидкостях, выполняя исследования соответствующими методами. Модельные жидкости готовят, добавляя в воду суспензию с известным (подсчитанным количеством) паразитарных объектов, подготовленную в соответствии с методикой по МУК 4.2.1174-02 "Использование модельных тестов цист лямблий и ооцист криптоспоридий для гигиенической оценки эффективности водоочистки".
2. В суспензии должно содержаться (для обеспечения достаточной точности подсчета) порядка 500 патогенов. Подсчет ведется при микроскопии на стеклах, снабженных начерченной сеткой (число патогенов Хn), далее вычисления ведутся по следующей методике.
По результатам подсчетов патогенов в 3-х аликвотах n (n ≥ 3) вычисляют среднее число патогенов в аликвоте - X
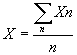
квадратическое отклонение числа патогенов в аликвоте
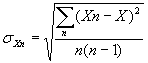
и относительную погрешность числа патогенов в аликвоте
![]()
Затем аликвоты калибровочной суспензии добавляют к ряду (n ≥ 3) модельных проб воды по 50 л, которые фильтруют и исследуют по соответствующей методике. По результатам определения числа патогенов в каждой модельной пробе - Yn подсчитывают среднее значение числа патогенов в модельной пробе - Y
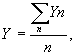
квадратическое отклонение числа патогенов в модельной пробе
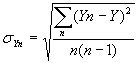
и относительную погрешность числа определяемых в модельной пробе патогенов
![]()
Эффективность метода определяют как отношение среднего числа патогенов в модельной пробе к среднему их числу в аликвоте модельной суспензии с патогенами
![]()
а относительную погрешность эффективности методики (характеризующую воспроизводимость) по формуле
![]()
Эта величина не должна превышать 0,12. Если превышает - для исследования пробы необходимо применить более высокочувствительный метод.
Приложение 2
Термины, определения и сокращения
Полимеразная цепная реакция (ПЦР) - метод обнаружения специфического участка НК в исследуемом биологическом материале путем амплификации in vitro.
Амплификация - процесс многократного копирования специфического участка ДНК (кДНК), ограниченного (фланкированного) праймерами.
НК - нуклеиновые кислоты (ДНК и РНК).
Генетические маркеры - нуклеотидные последовательности с известной первичной структурой, которые позволяют проводить идентификацию анализируемой НК.
Ампликоны - продукты ПЦР, синтезируемые в процессе амплификации копии ДНК-мишени.
Люминесцентная (флуоресцентная) микроскопия - метод наблюдения под микроскопом люминесцентного свечения микрообъектов при освещении их сине-фиолетовым светом или ультрафиолетовыми лучами. Возбуждение люминесценции микроскопических объектов, окрашенных флуорохромами, производится ультрафиолетовым, фиолетовым и синим светом.
Флуорохромы - вещества (красители), применяемые в люминесцентной или флуоресцентной микроскопии для обработки объектов, не обладающих природной способностью люминесцировать. При искусственном введении в организм флуорохромы адсорбируются клетками и придают им способность люминесцировать.
Сепарация - процесс разделения смесей разнородных частиц твердых материалов, смесей жидкостей разной плотности, эмульсий; взвесей твердых частиц или капелек в газе или паре. При сепарации разделяемые компоненты не изменяют своего химического состава. Сепарация основана на различии в физических или физико-химических свойствах компонентов смеси.
Иммунофлуоресценция - комплекс методов флуоресцентного анализа, применяемых в иммунологии, гистохимии, вирусологии, бактериологии, микологии, паразитологии и т. п. Сочетание иммунохимических реакций и флуоресцентной микроскопии позволяет выявлять тканевые и клеточные антигены, изучать закономерности синтеза антител и идентифицировать возбудителей многих вирусных и микробных заболеваний. При этом флуоресцируют только участки препарата, содержащие антиген.
Флуоресцирующие антитела - метод флуоресцирующих антител применяется для обнаружения белков или других антигенов в микроскопических объектах или биологических жидкостях с помощью антител, помеченных флуоресцирующими красителями (введение флуоресцирующей метки в антитела позволяет делать видимым их комплекс с антигенами). Специфические антитела метят флуоресцирующими красителями, которые меняют флуоресцентные свойства при соединении антител с антигеном.

Рис. 1. Люминесцентная микроскопия
«Ооцисты криптоспоридий и цисты лямблий, окрашенные иммунореагентом с
флуоресцентной меткой»
Слева направо: ооцисты криптоспоридий, окрашенные иммунореагентом Crypto-a-Glo
и циста лямблии, окрашенная иммунореагентом Giardi-a-Glo. Масляная иммерсия.