Государственное санитарно-эпидемиологическое
нормирование
Российской Федерации
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств
дифлуфензопира в воде, почве, зеленой массе,
зерне и масле кукурузы
методом высокоэффективной
жидкостной хроматографии
Методические
указания
МУК 4.1.3235-14
Москва 2015
1. Разработаны сотрудниками ФГБНУ «Всероссийский научно-исследовательский институт защиты растений» (В.И. Долженко, И.А. Цибульская, Т.Д. Черменская, А.С. Комарова, В.В. Человечкова).
2. Рекомендованы к утверждению Комиссией по государственному санитарно-эпидемиологическому нормированию Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (протокол от 6 ноября 2014 г. № 2).
3. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А.Ю. Поповой 22 декабря 2014 г.
4. Введены впервые.
СОДЕРЖАНИЕ
|
УТВЕРЖДАЮ Руководитель
Федеральной службы _______________________ А.Ю. Попова 22 декабря 2014 г. |
4.1. МЕТОДЫ КОНТРОЛЯ. ХИМИЧЕСКИЕ ФАКТОРЫ
Определение остаточных количеств дифлуфензопира
в воде, почве, зеленой массе, зерне и
масле кукурузы методом высокоэффективной
жидкостной хроматографии
Методические указания
МУК 4.1.3235-14
Свидетельство о метрологической аттестации № 01.5.04.183/01.00043/2014.
Настоящие методические указания устанавливают порядок применения метода высокоэффективной жидкостной хроматографии для определения массовой концентрации дифлуфензопира в диапазоне концентраций в воде 0,001 - 0,01 мг/дм3, в почве, зерне и масле кукурузы 0,01 - 0,1 мг/кг, зеленой массе 0,05 - 0,5 мг/кг.
Методические указания носят рекомендательный характер.
Дифлуфензопир
2-{(EZ)-1-[4-(3,5-difluorophenyl)semicarbazono]ethyl}nicotinic acid (ИЮИАК).
Структурная формула:
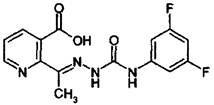
Брутто формула: C15H12F2N4O3.
Молекулярная масса: 334,28.
Химически чистое вещество представляет собой белое кристаллическое вещество.
Температура плавления: 135 °С.
Давление пара при 25 °С: 0,01 МПа.
Растворимость в воде: 5850 мг/дм3 (при 20 °С).
Константа диссоциации (рKа) при 25 °С: 3,18 (слабая кислота).
Стабильность к гидролизу при 20 °С: DT50 = 13 дней (pH 5), 24 дня (pH 7), 26 дней (pH 9). Период полураспада в почве: DT50 = 14 дней.
Краткая токсикологическая характеристика. Острая пероральная токсичность LD50 для млекопитающих более 5000 мг/кг, острая дермальная токсичность LD50 для млекопитающих превышает 5000 мг/кг. Оказывает раздражающее действие на слизистую глаз. Умеренно токсичен для пчел.
Область применения препарата: системный гербицид для борьбы с широким спектром сорняков в послевсходовый период.
Механизм действия: ингибирование транспорта ауксина.
Гигиенические нормативы для дифлуфензопира в России не установлены.
1. Погрешность измерений
При соблюдении всех регламентированных условий проведения анализа в точном соответствии с данной методикой погрешность (и ее составляющие) результатов измерений при доверительной вероятности Р = 0,95 не превышает значений, приведенных в табл. 1, для соответствующих диапазонов концентраций.
Метрологические параметры
|
Объект анализа |
Диапазон определяемых концентраций, мг/кг (мг/дм3) |
Показатель повторяемости (относительное среднеквадратическое отклонение повторяемости) σr, % |
Показатель внутрилабораторной прецизионности, σRл, % |
Показатель воспроизводимости, σR, % |
Показатель точности* (границы относительной почетности), ±δ, % |
|
Вода |
0,001 - 0,01 |
7 |
8 |
12 |
24 |
|
Почва |
0,01 - 0,1 |
8 |
9 |
11 |
22 |
|
Зерно |
0,01 - 0,1 |
8 |
9 |
11 |
22 |
|
Масло |
0,01 - 0,1 |
8 |
9 |
11 |
22 |
|
Зеленая масса |
0,05 - 0,5 |
7 |
9 |
12 |
23 |
|
* Соответствует расширенной неопределенности Uотн. при коэффициенте охвата k = 2 |
|||||
Полнота извлечения дифлуфензопира, стандартное отклонение,
доверительный интервал среднего результата для n = 20, Р = 0,95
|
Анализируемый объект |
Предел обнаружения, мг/кг (мг/дм3) |
Диапазон определяемых концентраций, мг/кг (мг/дм3) |
Полнота извлечения, % |
Стандартное отклонение, S |
Доверительный интервал среднего результата, ± % |
|
Вода |
0,001 |
0,001 - 0,01 |
83,8 |
5,14 |
7,21 |
|
Почва |
0,01 |
0,01 - 0,1 |
82,7 |
2,35 |
3,30 |
|
Зерно |
0,01 |
0,01 - 0,1 |
79,8 |
1,61 |
2,25 |
|
Масло |
0,01 |
0,01 - 0,1 |
83,6 |
3,18 |
4,45 |
|
Зеленая масса |
0,05 |
0,05 - 0,5 |
83,3 |
4,53 |
6,87 |
2. Метод измерений
Методика основана на определении дифлуфензопира методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием ультрафиолетового (УФ) детектора после его концентрирования из образцов воды на патроне с гидрофобным сорбентом с привитыми гексадецильными группами и извлечения из образцов почвы, зеленой массы, зерна и масла кукурузы щелочным водным ацетоном с последующей очисткой в системе несмешивающихся растворителей и на патронах для твердофазной экстракции.
Идентификация дифлуфензопира проводится по времени удерживания, количественное определение - методом абсолютной калибровки.
Избирательность метода обеспечивается сочетанием условий подготовки проб и хроматографирования.
3. Средства измерений, реактивы, вспомогательные
устройства и материалы
3.1. Средства измерений
|
Жидкостный хроматограф с быстросканирующим УФ-детектором, снабженный дегазатором, автоматическим пробоотборником и термостатом колонки |
номер в Госреестре средств измерений 42816-09 |
|
Весы аналитические с пределом взвешивания до 210 г и пределом допустимой погрешности 0,2 мг |
|
|
Весы технические с пределом взвешивания до 400 г и допустимой погрешностью 0,1 г |
|
|
Колбы мерные на 10, 100 и 250 см3 |
|
|
Микродозаторы одноканальные переменного объема от 200 до 1000 мм3 и от 1 до 5 см3 |
|
|
Цилиндры мерные на 50 и 100 см3 |
Примечание. Допускается использование средств измерения с аналогичными или лучшими характеристиками.
3.2. Реактивы
|
Ацетон, осч |
ТУ 2633-032-78119972-11 |
|
Ацетонитрил для ВЭЖХ |
ТУ 2634-002-04715285-12 |
|
Вода для лабораторного анализа (бидистиллированная. деионизованная) |
|
|
Дифлуфензопир с содержанием основного вещества 97,6 % |
|
|
Кислота ортофосфорная, хч |
|
|
Кислота соляная, хч |
|
|
Кислота трифторуксусная, хч, 99 % |
|
|
Метанол, хч |
|
|
Метилен хлористый, хч |
ТУ 2631-019-44493179-98 |
|
Натрий серно-кислый безводный, хч |
|
|
Натрий углекислый кислый, хч |
|
|
н-Гексан, хч |
ТУ 2631-003-05807999-98 |
|
Подвижная фаза для ВЭЖХ: смесь ацетонитрила и 0,005 М ортофосфорной кислоты в соотношении 30:70 |
|
|
Смесь № 1: этилацетат-метанол в соотношении 9:1 по объему |
|
|
Смесь № 2: этилацетат-метанол в соотношении 2:1 по объему |
|
|
Смесь № 3: трифторуксусная кислота-вода в соотношении 1:199 по объему. |
|
|
Этилацетат, хч |
Примечание. Допускается использование реактивов с более высокой квалификацией, не требующих дополнительной очистки растворителей.
3.3. Вспомогательные устройства и материалы
|
Аналитическая колонка, заполненная сорбентом с привитой фазой, включающей гидрофильную карбаматную группу в цепи С18, (100×2,1) мм, 1,7 мкм |
|
|
Вакуумный манипулятор для работы с патронами для твердофазной экстракции |
|
|
Воронки делительные вместимостью 250 см3 |
|
|
Колбы кругло донные на шлифе вместимостью 10, 25, 100 см3 |
|
|
Патроны для твердофазной экстракции: № 1 - заполненные гидрофильным слабокислотным сорбентом на основе силикагеля и № 2 - гидрофобным сорбентом с привитыми гексадецильными группами, по 0,4 г |
ТУ 4215-002-0545-931-94 |
|
Установка для отдувки растворителей током азота |
|
|
Устройство перемешивающее (50 - 200 колебаний в минуту) |
ТУ 4389-007-44330709-11 |
Примечание. Допускается применение оборудования с аналогичными или лучшими техническими характеристиками.
4. Требования безопасности
4.1. При выполнении измерений необходимо соблюдать требования техники безопасности при работе с химическими реактивами по ГОСТ 12.1.007-76, требования по электробезопасности при работе с электроустановками по ГОСТ 12.1.019-09, а также требования, изложенные в технической документации на жидкостный хроматограф.
4.2. Помещение лаборатории должно быть оборудовано приточно-вытяжной вентиляцией, соответствовать требованиям пожарной безопасности по ГОСТ 12.1.004-91 и иметь средства пожаротушения по ГОСТ 12.4.009-83. Содержание вредных веществ в воздухе не должно превышать ПДК (ОБУВ), установленных ГН 2.2.5.1313-03 и ГН 2.2.5.2308-07.
Организация обучения работников безопасности груда - по ГОСТ 12.0.004-90.
5. Требования к квалификации операторов
Измерения в соответствии с настоящей методикой может выполнять специалист-химик, имеющий опыт работы методом высокоэффективной жидкостной хроматографии, ознакомленный с руководством по эксплуатации хроматографа, освоивший данную методику и подтвердивший экспериментально соответствие получаемых результатов нормативам контроля погрешности измерений по п. 13.
6. Условия измерений
При выполнении измерений выполняют следующие условия:
- процессы приготовления растворов и подготовки проб к анализу проводят при температуре воздуха (20 ± 5) °С и относительной влажности не более 80 %;
- выполнение измерений на жидкостном хроматографе проводят в условиях, рекомендованных технической документацией к прибору.
7. Подготовка к определению
7.1. Кондиционирование колонки
Перед началом анализа аналитическую колонку кондиционируют в потоке подвижной фазы (0,1 - 0,2 см3/мин) до стабилизации нулевой линии.
7.2.
Кондиционирование патрона № 1 с гидрофильным
слабокислотным сорбентом с постоянной активностью
Патрон промывают 2 см3 смеси № 2, затем 3 см3 этилацетата.
7.3.
Кондиционирование патрона № 2 с гидрофобным сорбентом
с привитыми гексадецильными группами
Патрон последовательно промывают 2 см3 этилацетата, 2 см3 метанола, 3 см3 смеси № 3.
7.4. Приготовление растворов
7.4.1. 0,005 М раствор ортофосфорной кислоты: (0,5 ± 0,01) г 98 % ортофосфорной кислоты помещают в мерную колбу объемом 1 дм3, растворяют в бидистиллированной воде и доводят объем до метки.
7.4.2. Для приготовления подвижной фазы смешивают ацетонитрил с 0,005 М раствором ортофосфорной кислоты в соотношении 30:70 по объёму, используя мерные цилиндры.
7.4.3. 0,1 N раствор соляной кислоты: 1 см3 концентрированной соляной кислоты помещают в мерную колбу объемом 100 см3, растворяют в бидистиллированной воде и доводят объем до метки.
7.4.4. 0,5 % раствор натрия углекислого кислого: 0,5 г натрия углекислого кислого помещают в мерную колбу объемом 100 см3, растворяют в бидистиллированной воде и доводят объем до метки.
7.5. Приготовление основного и градуировочных растворов
7.5.1. Основной раствор с концентрацией 0,5 мг/см3: точную навеску дифлуфензопира (50 ± 0,5 мг) помещают в мерную колбу вместимостью 100 см3, растворяют в метаноле и доводят объем до метки метанолом.
7.5.2. Приготовление градуировочных растворов
Градуировочные растворы с концентрациями дифлуфензопира 0,05, 0,1, 0,2, 0,5 и 1,0 мкг/см3 готовят методом последовательного разбавления по объему, используя раствор подвижной фазы (смесь ацетонитрила и 0,005 М ортофосфорной кислоты в соотношении 30:70).
7.5.2.1. Раствор № 1 с концентрацией 1,0 мкг/см3: в мерную колбу вместимостью 100 см3 вносят 0,2 см3 основного раствора и доводят до метки подвижной фазой.
7.5.2.2. Раствор № 2 с концентрацией 0,5 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 5,0 см3 раствора № 1 и доводят объем до метки подвижной фазой.
7.5.2.3. Раствор № 3 с концентрацией 0,2 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 2 см3 раствора № 1 и доводят объем до метки подвижной фазой.
7.5.2.4. Раствор № 4 с концентрацией 0,1 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 1 см3 раствора № 1 и доводят объем до метки подвижной фазой.
7.5.2.5. Раствор № 5 с концентрацией 0,05 мкг/см3: в мерную колбу вместимостью 10 см3 помещают 0,5 см3 раствора № 1 и доводят объем до метки подвижной фазой.
Основной раствор можно хранить в холодильнике при температуре 0 - 4 °С в течение 5 дней, градуировочные растворы использовать в день приготовления.
При изучении полноты определения дифлуфензопира используют ацетоновые растворы вещества, приготовленные из основного раствора методом последовательного разбавления по объему ацетоном.
7.6. Построение градуировочного графика
Для установления градуировочной характеристики (площадь пика -концентрация дифлуфензопира в растворе) в хроматограф вводят по 10 мм3 градуировочных растворов (не менее 3 параллельных измерений для каждой концентрации, не менее 4 точек по диапазону измеряемых концентраций). Затем измеряют площади пиков и строят график зависимости среднего значения площади пика от концентрации дифлуфензопира в градуировочном растворе.
Методом наименьших квадратов рассчитывают градуировочный коэффициент (K) в уравнении линейной регрессии:
|
С = KS, где |
S - площадь пика градуировочного раствора.
Градуировку признают удовлетворительной, если значение коэффициента линейной корреляции оказывается не ниже 0,99.
Градуировочную характеристику необходимо проверять при замене реактивов, хроматографической колонки или элементов хроматографической системы, а также при отрицательном результате контроля градуировочного коэффициента.
Градуировочную зависимость признают стабильной при выполнении следующего условия:
|
|
С - аттестованное значение массовой концентрации дифлуфензопира в градуировочном растворе,
СK - результат контрольного измерения массовой концентрации дифлуфензопира в градуировочном растворе,
λконтр. - норматив контроля градуировочного коэффициента, %. (λконтр. = 10 % при Р = 0,95).
7.7. Проверка хроматографического поведения
дифлуфензопира на патроне № 1
В круглодонную колбу емкостью 10 см3 отбирают 1 см3 стандартного раствора дифлуфензопира с концентрацией 1 мкг/см3. Отдувают растворитель током азота. Остаток растворяют в 1 см3 этилацетата и переносят на подготовленный патрон (п. 7.2.). Колбу обмывают 1 см3 этилацетата и смыв тоже переносят на патрон. Промывают патрон 10 см3 смеси № 1, элюат отбрасывают. Затем элюируют дифлуфензопир смесью № 2 со скоростью 1 - 2 капли в секунду. Отбирают фракции по 2 см3, упаривают досуха, растворяют в 1 см3 подвижной фазы и анализируют по п. 9.6.
Фракции, содержащие дифлуфензопир, объединяют и вновь анализируют.
Устанавливают уровень вещества в элюате, определяют полноту вымывания с патрона и необходимый для очистки объем элюата.
7.8. Проверка хроматографического поведения
дифлуфензопира на патроне № 2
В кругло донную колбу емкостью 10 см3 отбирают 1 см3 стандартного раствора дифлуфензопира с концентрацией 1 мкг/см3. Отдувают растворитель током азота. Остаток растворяют в 10 см3 смеси № 3 и переносят на подготовленный патрон (п. 7.3). Колбу обмывают 5 см3 смеси № 3 и смыв тоже переносят на патрон. Патрон просушивают в течение 2 мин, затем элюируют дифлуфензопир порциями этилацетата по 2 см3 со скоростью 1 - 2 капли в секунду. Отбирают фракции, упаривают досуха, растворяют в 1 см3 подвижной фазы и анализируют по п. 9.6.
Фракции, содержащие дифлуфензопир, объединяют и вновь анализируют.
Устанавливают уровень вещества в элюате, определяют полноту вымывания с патрона и необходимый для очистки объем элюата.
Примечание. Проверку хроматографического поведения дифлуфензопира следует проводить обязательно, поскольку профиль вымывания может изменяться при использовании новой партии патронов и растворителей.
8. Отбор проб и хранение
Отбор проб производится в соответствии с «Унифицированными правилами отбора проб сельскохозяйственной продукции, пищевых продуктов и объектов окружающей среды для определения микроколичеств пестицидов» (№ 2051-79 от 21.08.79), а также в соответствии с ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб»; ГОСТ 28168-89 «Почвы. Отбор проб»; ГОСТ 13634-90 «Кукуруза. Требования при заготовках и поставках» и ГОСТ 8808-91 «Масло кукурузное. ТУ».
Зерно кукурузы хранят в полотняных мешочках при комнатной температуре. Для исследовательских целей допускается получение масла в лаборатории из проб измельчённого зерна методом экстракции органическим растворителем при температуре не выше 40 °С. Пробы масла хранят при 4 - 6 °С в закрытой стеклянной или полиэтиленовой таре не более 30 суток.
Для длительного хранения пробы почвы подсушиваются при комнатной температуре в отсутствие прямого солнечного света. Сухие почвенные образцы могут храниться в течение года. Перед анализом сухую почву доводят до стандартной влажности, просеивают через сито с отверстиями диаметром 1 мм.
Зеленую массу для хранения помещают в герметичной полиэтиленовой упаковке в морозильную камеру с температурой -18 °С.
9. Проведение определения
9.1. Экстракция дифлуфензопира из воды
К 50 см3 воды добавляют 0,25 см3 трифторуксусиой кислоты и наносят на подготовленный по п. 7.3 патрон № 2. Патрон просушивают 2 мин, затем элюируют дифлуфензопир тремя порциями этилацетата по 2 см3. Растворитель упаривают на ротационном вакуумном испарителе при температуре бани не выше 40 °С. Сухой остаток растворяют в 1 см3 подвижной фазы и 10 мм3 вводят в хроматограф.
9.2. Экстракция дифлуфензопира из почвы,
зеленой массы и зерна кукурузы
Навеску измельченной пробы (10 ± 0,1) г, зеленой массы 5 г помещают в полипропиленовую центрифужную пробирку вместимостью 50 см3, добавляют 10 см3 0,5 %-го раствора натрия углекислого кислого и 30 см3 ацетона. Пробирку плотно закрывают и помещают в перемешивающее устройство на 10 мин, затем центрифугируют. Надосадочную жидкость декантируют в круглодонную колбу. Экстракцию повторяют 5 см3 0,5 %-го раствора натрия углекислого кислого и 15 см3 ацетона. Объединенные фракции упаривают на ротационном вакуумном испарителе при температуре бани не выше 40 °С до водного остатка. Остаток доводят до 50 см3 0,5 %-м раствором натрия углекислого кислого, переносят в делительную воронку и очищают по п. 9.4.
9.3. Экстракция дифлуфензопира из масла кукурузы
К навеске масла (10 ± 0,1) г добавляют 10 см3 гексана и переносят в делительную воронку. Дифлуфензопир дважды экстрагируют порциями 0,5 %-го раствора натрия углекислого кислого по 25 см3. Объединенные щелочные экстракты очищают по п. 9.4.
9.4. Очистка в системе несмешивающихся растворителей
Щелочной экстракт последовательно промывают двумя порциями по 10 см3 гексана и двумя порциями по 10 см3 хлористого метилена. В случае плохого разделения слоев можно перенести эмульсию в центрифужную пробирку и центрифугировать в течение 5 мин при скорости 4000 об./мин. Водный слой подкисляют 0,1 N соляной кислотой до pH = 1 и дифлуфензопир экстрагируют двумя порциями по 30 см3 хлористого метилена. Метиленовые фракции собирают в круглодонную колбу, пропуская через слой безводного сульфата натрия, и растворитель упаривают на ротационном вакуумном испарителе при температуре бани не выше 40 °С. Сухой остаток подвергают очистке на патроне № 1 по п. 9.5.
9.5. Очистка на патроне № 1
Сухой остаток, полученный по п. 9.4, растворяют в 1 см3 этилацетата, наносят на предварительно кондиционированный патрон (п. 7.2), колбу ополаскивают 1 см3 этилацетата и также наносят на патрон. Патрон промывают 10 см3 смеси № 1, элюат отбрасывают. Дифлуфензопир элюируют 5 см3 смеси № 2, элюат собирают, упаривают досуха на ротационном вакуумном испарителе, остаток растворяют в 1 см3 подвижной фазы и 10 мм3 вводят в хроматограф.
Примечание. Ввиду нестабильности аналита хранение экстрактов подготовленных проб не допускается. Пробоподготовку и анализ следует проводить в один день.
9.6. Условия хроматографирования
Ультраэффективный жидкостный хроматограф с быстросканирующим УФ-детектором, снабженный дегазатором, автоматическим пробоотборником и термостатом колонки. Аналитическая колонка, заполненная сорбентом с привитой фазой, включающей гидрофильную карбаматную группу в цепи С18, (100×2,1) мм, 1,7 мкм. Температура колонки (30 ± 1) °С. Подвижная фаза: ацетонитрил и 0,005 М ортофосфорная кислота в соотношении 30:70 (от 0 до 1 мин); далее градиент от 30:70 до 70:30 (от 1 до 8 мин). Скорость потока элюента: 0,2 см3/мин. Рабочая длина волны УФ-детектора 287 нм. Объем вводимой пробы 10 мм3. Время удерживания дифлуфензопира (5,1 ± 0,1) мин.
10. Обработка результатов анализа
Количественное определение проводят методом абсолютной калибровки. Содержание дифлуфензопира в пробе (X, мг/кг) вычисляют по формуле:
|
|
Sx - площадь пика дифлуфензопира на хроматограмме испытуемого образца, мм2 (AU);
K - градуировочный коэффициент, найденный на стадии построения соответствующей градуировочной зависимости;
V - объём пробы, подготовленной для хроматографического анализа, см3;
Р - навеска анализируемого образца, г;
f - полнота извлечения дифлуфензопира, приведенная в табл. 2, %.
Содержание остаточных количеств дифлуфензопира в образце вычисляют как среднее из двух параллельных определений.
Образцы, дающие пики большие, чем стандартный раствор дифлуфензопира с концентрацией 1,0 мкг/см3, разбавляют подвижной фазой для ВЭЖХ.
11.
Проверка приемлемости результатов
параллельных определений
За результат анализа принимают среднее арифметическое результатов двух параллельных определений, расхождение между которыми не превышает предела повторяемости (1):
|
|
X1, Х2 - результаты параллельных определений, мг/кг;
r - значение предела повторяемости (r = 2,8σr).
При невыполнении условия (1) выясняют причины превышения предела повторяемости, устраняют их и вновь выполняют анализ.
12. Оформление результатов
Результат анализа представляют в виде:
|
|
![]() - среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
- среднее арифметическое результатов
определений, признанных приемлемыми, мг/кг;
Δ - граница абсолютной погрешности, мг/кг;
|
|
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
В случае если содержание компонента меньше нижней границы диапазона определяемых концентраций, результат анализа представляют в виде:
«содержание вещества в пробе «менее нижней границы определения» (например: менее 0,01 мг/кг*, где * - 0,01 мг/кг - предел обнаружения дифлуфензопира в почве).
13. Контроль качества результатов измерений
Оперативный контроль погрешности и воспроизводимости измерений осуществляется в соответствии с ГОСТ Р ИСО 5725-1-6-02 «Точность (правильность и прецизионность) методов и результатов измерений».
13.1. Стабильность результатов измерений контролируют перед проведением измерений, анализируя один из градуировочных растворов.
13.2. Плановый внутрилабораторный оперативный контроль процедуры выполнения анализа проводится с применением метода добавок.
Величина добавки Сд должна удовлетворять условию:
|
Сд = Δл,Х + Δл,Хʹ, где |
±Δл,Х (±Δл,Хʹ) - характеристика погрешности (абсолютная погрешность) результатов анализа, соответствующая содержанию компонента в испытуемом образце (расчетному значению содержания компонента в образце с добавкой, соответственно), мг/кг; при этом:
|
Δл = ±0,84Δ, где |
Δ - граница абсолютной погрешности, мг/кг:
|
|
δ - граница относительной погрешности методики (показатель точности в соответствии с диапазоном концентраций), %.
Результат контроля процедуры Кк рассчитывают по формуле:
|
Кк = Xʹ - X - Сд, где |
Xʹ, X, Сд - среднее арифметическое результатов параллельных определений (признанных приемлемыми по п. 11) содержания компонента в образце с добавкой, испытуемом образце, концентрация добавки, соответственно, мг/кг.
Норматив контроля К рассчитывают по формуле:
Проводят сопоставление результата контроля процедуры (Кк) с нормативом контроля (К).
Если результат контроля процедуры удовлетворяет условию
|
|Кк| ≤ К, |
(2) |
процедуру анализа признают удовлетворительной.
При невыполнении условия (2) процедуру контроля повторяют. При повторном невыполнении условия (2) выясняют причины, приводящие к неудовлетворительным результатам, и принимают меры к их устранению.
13.3. Проверка приемлемости результатов измерений, полученных в условиях воспроизводимости.
Расхождение между результатами измерений, выполненных в двух разных лабораториях, не должно превышать предела воспроизводимости (R):
|
|
(3) |
X1, Х2 - результаты измерений в двух разных лабораториях, мг/кг;
R - предел воспроизводимости (в соответствии с диапазоном концентраций), %.