МИНИСТЕРСТВО ПРИРОДНЫХ РЕСУРСОВ
И ЭКОЛОГИИ РОССИЙСКОЙ ФЕДЕРАЦИИ
Федеральная служба по гидрометеорологии
и мониторингу окружающей среды (Росгидромет)
|
РЕКОМЕНДАЦИИ |
Р 52.24.741-2010 |
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ
В УСЛОВИЯХ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ
МЕТОДОМ ЭКСПРЕССНОГО БИОТЕСТИРОВАНИЯ
Ростов-на-Дону
2010
Предисловие
1 РАЗРАБОТАНЫ Государственным учреждением Гидрохимический институт (ГУ ГХИ)
2 РАЗРАБОТЧИКИ Е.Н. Бакаева, д-р биол. наук, Н.А. Игнатова, канд. биол. наук
3 СОГЛАСОВАНЫ с ГУ «НПО «Тайфун» 04.10.2010
И УМЗА Росгидромета 11.10.2010
4 УТВЕРЖДЕНЫ Заместителем Руководителя Росгидромета 12.10.2010
5 ЗАРЕГИСТРИРОВАНЫ ЦМТР ГУ «НПО «Тайфун» за номером Р 52.24.741-2010 от 19.10.2010
6 ВВЕДЕНЫ ВПЕРВЫЕ
Введение
Метод биотестирования широко используется в последнее время для оценки токсичности и поверхностных вод, и донных отложений. Информация, получаемая в ходе биотестирования дает информацию о воздействии на гидробиоту всего комплекса находящихся в водном объекте веществ. В случаях экстремально высоких загрязнений и в условиях чрезвычайных ситуаций (ЧС) необходимо получение оперативной информации для принятия управленческих решений. В связи с чем необходимо использовать экспрессные методики биотестирования.
Настоящие рекомендации отвечают требованиям оперативности получения биологической информации: 1) реакция хемотаксиса позволяет практически за 1 ч получить ответную реакцию тест-объектов на воздействие исследуемой пробы воды; 2) выбранный тест-объект (Paramecium caudatum) является одним из центральных видов микрозоопланктеров практически во всех водных объектах, что позволяет использовать его во всех регионах страны; 3) методика биотестирования по выживаемости зоопланктеров позволяет использовать природные популяции исследуемого региона, отобранные в фоновых (незагрязненных участках) водных объектов. В связи с тем, что гидробионты реагируют на специфику гидрохимического состава водных объектов различных регионов предпочтительнее использовать в случаях ЧС природные популяции гидробионтов, отобранные из фоновых (условно чистых участков). Для этого в рекомендациях приведен список возможных тест-объектов с указанием их экологических особенностей в отношении температурного фактора, рН-среды, минерализации.
РЕКОМЕНДАЦИИ
ОЦЕНКА ТОКСИЧНОСТИ ПОВЕРХНОСТНЫХ ВОД СУШИ
В УСЛОВИЯХ ЧРЕЗВЫЧАЙНЫХ СИТУАЦИЙ
МЕТОДОМ ЭКСПРЕССНОГО БИОТЕСТИРОВАНИЯ
Дата введения - 2011-10-01
1 Область применения
Настоящие рекомендации устанавливают методику экспрессного биотестирования и порядок проведения оценки токсичности поверхностных вод суши (ПВС) в условиях чрезвычайных ситуаций (ЧС) и проведения оперативных работ в мониторинге ПВС в условиях ЧС.
Рекомендации предназначены для организаций наблюдательной сети Федеральной службы по гидрометеорологии и мониторингу окружающей среды (Росгидромета), осуществляющих организацию и проведение наблюдений за загрязнением ПВС в составе Государственной службы наблюдений за состоянием окружающей среды (ГСН) России.
Настоящие рекомендации могут быть использованы в качестве методического пособия специалистами и практическими работниками природоохранных организаций, осуществляющих наблюдения за загрязнением окружающей среды, а также для оценки токсического загрязнения поверхностных вод суши.
2 Нормативные ссылки
В настоящих рекомендациях использованы ссылки на следующие нормативные документы:
ГОСТ 19179-73 Гидрология суши. Термины и определения
ГОСТ 17.1.1.01-77 Охрана природы. Гидросфера. Использование и охрана вод. Основные термины и определения
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 27065-86 Качество вод. Термины и определения
Р 52.24.566-94 Рекомендации. Методы токсикологической оценки загрязнения пресноводных экосистем
РД 52.24.609-99 Организация и проведение наблюдений за содержанием загрязняющих веществ в донных отложениях
РД 52.24.635-2002 Проведение наблюдений за токсическим загрязнением донных отложений в пресноводных экосистемах на основе биотестирования
РД 52.24.309-2004 Организация и проведение режимных наблюдений за загрязнением поверхностных вод суши на сети Росгидромета
РД 52.24.662-2004 Рекомендации. Оценка токсического загрязнения природных вод и донных отложений пресноводных экосистем методами биотестирования с использованием коловраток
РД 52.24.670-2005 Унифицированный метод определения острой токсичности проб поверхностных вод суши, содержащих взвешенные вещества
Р 52.24.690-2006 Рекомендации. Оценка токсического загрязнения вод водотоков и водоемов различной солености и зон смешения речных и морских вод методами биотестирования
Р 52.24.695-2007 Рекомендации. Оценка токсического загрязнения природных вод и донных отложений водных экосистем по коэффициенту регенерации популяции
Примечание - Ссылки на остальные нормативные документы приведены в разделе 6, пунктах 7.2 и 8.2.
3 Термины, определения и обозначения
В настоящих рекомендациях использованы следующие термины и определения:
3.1
биотестирование (биологическое тестирование): Оценка качества объектов окружающей среды (воды и др.) по ответным реакциям живых организмов, являющихся тест-объектами
[ГОСТ 27065-86, статья 39]
3.2 биотест: Совокупность приемов получения информации о токсичности воды (донных отложений) для гидробионтов на основе регистрации реакций тест-объекта (Р 52.24.566).
3.3 водный объект: Сосредоточение природных вод на поверхности суши, либо в горных породах имеющее характерные формы распространения и черты режима (Р 52.24.566).
3.4 загрязнение токсическое: Загрязнение воды водоемов и водотоков токсичными веществами.
3.5 зоопланктеры: Представители зоопланктона (совокупность населяющих толщу воды беспозвоночных животных, пассивно переносимых течениями) [1].
3.6
качество воды: Характеристика состава и свойств воды, определяющая пригодность ее для конкретных видов водопользования
[ГОСТ 27065-86, статья 2]
3.7
контроль качества воды: Проверка соответствия показателей качества воды установленным нормам и требованиям
[ГОСТ 27065-86, статья 2]
3.8 критерий токсичности: Значение показателя токсичности, на основании которого судят о наличии токсического действия.
3.9 метрологическая характеристика метода: Характеристика чувствительности метода, определяемая для тест-объекта по LC50 при воздействии эталонного токсиканта (медь (II) сернокислая, калий двухромовокислый).
3.10 острое токсическое действие (острая токсичность); ОТД: Воздействие, вызывающее быструю ответную реакцию тест-объекта. Острое токсическое действие чаще всего определяют по тест-реакции «гибель» или «выживаемость» в условиях кратковременного биотестирования. При использовании коловраток и других организмов микрозоопланктона длительность воздействия составляет от 6 до 24 ч (РД 52.24.662).
3.11 показатель токсичности: Признак тест-объекта, используемый для оценки токсичности воды.
3.12 поверхностные воды суши; ПВС: Воды, находящиеся на поверхности суши в виде различных водных объектов (Р 52.24.566).
3.13 проба воды: Количество воды, предназначенное для исследования.
3.14 пункт наблюдений за загрязнением поверхностных вод суши Государственной сети наблюдений Росгидромета: Место на водоеме или водотоке, где проводят комплекс работ для получения данных о качестве воды или донных отложений. (РД 52.24.635).
3.15 результат биотестирования: Конечный вывод о токсичности водной среды, установленный в ходе биотестирования.
3.16 тест-объект: Организм, который используют при биотестировании (инфузории, дафнии и т.д.) (Р 52.24.566).
3.17 тест-показатель: Показатель жизнедеятельности (поведенческие реакции, размножение, выживаемость и т.д.) тест-объекта, используемый для определения токсичности ПВС.
3.18 токсичность воды: Свойство воды вызывать патологические изменения или гибель организмов, обусловленные присутствием в ней токсичных веществ (Р 52.24.566).
3.19 токсикологический эксперимент: Эксперимент, в ходе которого оценивают влияние на тест-объект испытываемой воды или химического соединения. Состоит из двух серий: опыт (с воздействием воды или химического соединения) и контроль (без воздействия, но в тех же условиях) (Р 52.24.566).
3.20 условно чистый участок водного объекта: Обычно это фоновый створ.
3.21 фоновый створ: Створ, расположенный на расстоянии не менее 1 км выше источника загрязнения (Р 52.24.566).
3.22 хемотаксис: Двигательные реакции свободно передвигающихся растительных и простейших животных организмов, а также клеток (зооспор, сперматозоидов, лейкоцитов и др.) под влиянием химических раздражителей [2].
3.23 чрезвычайная ситуация; ЧС: Обстановка на определенной территории, сложившаяся в результате аварии, опасного природного явления, катастрофы, стихийного или иного бедствия, которые могут повлечь или повлекли за собой человеческие жертвы, ущерб здоровью людей или окружающей природной среде, значительные материальные потери и нарушение условий жизнедеятельности людей [3].
3.24 чувствительность тест-объекта: Нижняя граница диапазона действия эталонного токсиканта, при которой обнаруживают параметры его токсичности на тест-объект.
3.25 эталонный токсикант: Токсическое вещество, используемое для проверки чувствительности биотеста или тест-объекта (Р 52.24.566).
3.26 LC50: Концентрация токсиканта, приводящая к гибели 50 % взятой для эксперимента выборки.
4 Общие положения
4.1 Настоящие рекомендации устанавливают требования и условия по проведению экспрессного биотестирования ПВС в условиях ЧС, обусловленного высоким уровнем загрязнения или присутствием опасных токсических веществ, поступающих в водные объекты в ходе аварий, залповых сбросов, с целью выяснения чрезвычайных экологических ситуаций.
4.2 Экспрессное биотестирование ПВС проводят с целью проверки соответствия качества отдельных исследуемых проб воды установленным нормам без идентификации загрязняющих веществ и их количественных характеристик [4].
4.3 Вода контрольного створа (природная вода) не должна оказывать токсического действия (хронического и, тем более, острого) на тест-объекты, используемые для биотестирования [4].
4.4 Биотестирование ПВС основано на определении показателей токсичности исследуемой пробы воды, отобранной в зоне влияния источника загрязнения, и их отличий от контрольной пробы, отобранной на условно чистом участке водного объекта и водопроводной водой исследуемого региона.
4.5 Экспрессное биотестирование токсичности ПВС в условиях ЧС дает возможность за короткий промежуток времени:
- оценить токсичность пробы воды;
- выявить точки (створы) и участки с чрезвычайной экологической ситуацией;
- оценить влияние источников загрязнения на состояние водной составляющей водного объекта;
- оценить экотоксикологический статус водного объекта или его участка;
- оценить эколого-токсикологическое состояние водного объекта в комплексе с методами биоиндикационных и физико-химических исследований.
4.6 Для оценки токсичности ПВС используют не менее трех биотестов с разными тест-объектами, либо трех тест-показателей одного тест-объекта. Набор биотестов и тест-показателей должен экологически соответствовать региону исследования согласно приложениям А, Б и (Р 52.24.690).
4.7 В составе системы мониторинга ПВС режимные наблюдения и наблюдения в условиях ЧС по токсикологическим показателям методом биотестирования проводят по программам работ оперативно-производственных подразделений территориальных управлений по гидрометерологии и мониторингу окружающей среды (УГМС) Росгидромета в соответствии с требованиями РД 52.24.309 - для поверхностных вод суши, РД 52.24.609 и РД 52.24.635 - для вод и донных отложений.
4.8 Результаты по оценке токсичности вод методом биотестирования в условиях ЧС, в зависимости от их масштаба, представляют в органы управления Единой государственной системы предупреждения и ликвидации ЧС (РСЧС) соответствующего уровня (региональный, территориальный и местный, объектовый).
5 Основные принципы биотестирования поверхностных вод суши в условиях ЧС
5.1 В ходе биотестирования ПВС в условиях ЧС устанавливают:
- наличие либо отсутствие токсического действия отдельных проб воды;
- острое токсическое действие отдельных проб воды;
- кратность разбавления вод., снимающую ОТД, в случае его обнаружения;
- район экологического неблагополучия исследуемой акватории.
5.2 Экспрессное биотестирование ПВС проводят с использованием различных тест-объектов: инфузорий, коловраток, ракообразных, микроводорослей, макрофитов, а также природных популяций гидробионтов, отобранных из условно чистых (фоновых) участков исследуемого водного объекта.
5.3 Использование природных популяций гидробионтов имеет преимущества:
- гидробионты из исследуемого водного объекта исключают реакцию на физико-химические особенности воды, которая может иметь место у лабораторных культур гидробионтов;
- возможность прогнозирования состояния конкретных популяций гидробионтов в исследуемом регионе в связи с произошедшим загрязнением.
Использование природных популяций гидробионтов имеет недостатки:
- адаптация к слабому постоянному воздействию загрязнения на фоновом участке, если оно имеет идентичную природу с воздействием на загрязненном участке;
- заранее нельзя предвидеть, какие именно организмы можно будет выделить на фоновом участке исследуемого водного объекта.
5.4 Оптимальным является проведение одновременного биотестирования на природных популяциях гидробионтов и лабораторных культурах тест-объектов с известными характеристиками и известной чувствительностью к загрязняющим веществам (проверка пригодности культуры к биотестированию по эталонному токсиканту).
5.5 Наиболее важным показателем, на основе которого можно дать прогноз развития популяции, является размножение. Время получения результатов по показателю размножения на общепринятом тест-объекте Daphnia magna составляет 30 сут. В условиях ЧС информация должна быть оперативной, поэтому преимущество среди тест-объектов нужно отдать короткоцикличным тест-объектам: инфузориям, коловраткам, микроводорослям.
5.6 Экспрессное биотестирование ПВС проводят:
а) с использованием экспрессных тест-показателей:
- скорость потребления пищи организмами-фильтраторами инфузориями, коловратками в соответствии с РД 52.24.662 (раздел 10) и РД 52.24.670;
- скорость фотосинтеза растительных тест-объектов, A-Z-Ph-тест на микроводорослях в соответствии с Р 52.24.566;
- поведенческие реакции - хемотаксис в соответствии с приложением В.
б) с использованием тест-показателей:
- выживаемость или гибель на тест-объектах, экологически соответствующих исследуемому водному объекту; выживаемость на тест-объектах из представителей крупного рачкового планктона можно наблюдать визуально без микроскопирования в соответствии с РД 52.24.662, Р 52.24.690, Р 52.24.695;
- размножение, позволяющее при использовании короткоцикличных тест-объектов (микроводоросли, инфузории, коловратки) в короткие сроки определить не только их выживаемость, но и размножение, и показывающее возможность сохранения популяции в соответствии с РД 52.24.662, Р 52.24.690, Р 52.24.695;
- комплекс показателей (выживаемость и размножение) в сопряженности со временем (24, 48, 72 ч), позволяющее при использовании короткоцикличных гидробионтов (инфузории, коловратки) дать прогноз развития популяции в соответствии с Р 52.24.566, РД 52.24.662.
5.7 Длительность биотестирования (продолжительность экспозиции) зависит от жизненного цикла выбранного тест-объекта. Микроводоросли за сутки дают до 8 поколений, инфузории - до 4 - 6, коловратки - до 3.
5.8 В ходе биотестирования используют два контроля: дехлорированную водопроводную воду региона и воду из условно чистого (фонового) участка исследуемого водного объекта.
5.9 Каждый биотест проводят не менее чем в трех повторностях.
5.10 Оценку токсичности ПВС проводят по набору биотестов (не менее трех). Например, с тест-объектами парамеции, коловратки, дафнии. Либо по двум тест-объектам (парамеции, дафнии) и нескольким тест-показателям одного из тест-объектов (хемотаксис и гибель парамеций).
5.11 Обязательным в условиях ЧС при обнаружении ОТД вод является определение кратности разбавления исследуемой пробы воды, снимающей токсическое воздействие. Кратность разбавления - 2; 10; 25; 50; 100 и 500 раз. Разбавление проводят водой, отобранной из фонового створа, или отстоянной дехлорированной водопроводной водой исследуемого региона.
5.12 Требования к порядку проведения и оценке результатов биотестирования проводят согласно РД 52.24.669.
6 Отбор, хранение и подготовка проб поверхностных вод суши для биотестирования
6.1 Пробы ПВС для биотестирования отбирают с учетом требований ГОСТ 17.1.5.05 и Р 52.24.566.
6.2 Объем пробы не менее 0,05 дм3 (при использовании в биотестировании тест-объектов из числа микрозоопланктона) и не менее 1,5 дм3 (при использовании микроводорослей и рачкового планктона).
6.3 Сосуды должны быть из материала, не содержащего токсичных примесей (полиэтиленовые емкости для пищевых продуктов, стеклянные баллоны и бутыли).
6.4 Сосуды необходимо маркировать.
6.5 Перед заполнением сосудов воду фильтруют через мельничный газ № 70-76 (для удаления природного планктона) и несколько раз ополаскивают сосуд. Заполняют водой полностью.
6.6 Анализ проб воды по определению токсичности проводят не позднее 6 ч после отбора проб.
6.7 В случае невозможности проведения исследований не позднее 6 ч после отбора пробы охлаждают до 4 °С или замораживают согласно РД 52.24.309 и хранят до 30 сут.
6.8 Консервирование проб химическими веществами не допускается.
6.9 Перед биотестированием измеряют концентрацию кислорода, значения рН (с целью дифференцирования токсического воздействия каких-либо загрязняющих веществ и измеренных значений рН и кислорода, если эти параметры не обеспечивают нормальной жизнедеятельности гидробионтов).
6.10 Пробу делят на две части для проведения биотеста на фильтрованной (пропущенной через бумажный фильтр для удаления взвешенных веществ) и нефильтрованной воде.
7 Биотест по реакции хемотаксиса парамеций
7.1 Принцип метода
Биотест по реакции хемотаксиса основан на способности зоопланктеров, в частности парамеций, перемещаться в направлении или от источника химического воздействия. Хемотаксис положителен, если движение парамеций направлено к источнику химического раздражителя (по градиенту его концентрации воде), и отрицателен, если движение направлено от источника. Влияние исследуемой воды оценивают по количеству переместившихся особей.
ОТД исследуемой воды на парамеций устанавливают за время экспозиции 2 часа.
Показателем реакции хемотаксиса служит среднее количество парамеций, переместившихся в исследуемую воду.
Критерием ОТД является положительный хемотаксис, когда средний процент исходного количества тест-объектов, переместившихся в исследуемую воду, составляет не более 25 %.
7.2 Необходимые материалы, оборудование, реактивы
7.2.1 Культура парамеций Paramecium caudatum. Описание основных характеристик вида, источники получения культуры и условий культивирования даны в приложениях Г и Д.
7.2.2 Микроскоп бинокулярный стереоскопический марки МБС по ГОСТ 8074-82.
7.2.3 Дрожжи пекарские сухие.
7.2.4 Пипетки выдувные капиллярные (пастеровские, укороченные с двух сторон или глазные с оттянутым носиком) по ГОСТ 29230-91.
7.2.5 Чашки Петри по ГОСТ 25336-82.
7.2.6 Фильтровальная бумага синяя лента.
7.2.7 Стаканы вместимостью 0,5 - 1,0 дм3 по ГОСТ 23932-90.
7.2.8 Вода дехлорированная водопроводная исследуемого региона.
7.3 Подготовка к биотестированию
Исходный материал для биотестирования получают за 1 - 3 сут до опыта. Для этого парамеций пересаживают в чистые чашки Петри с дехлорированной водопроводной водой, в которую предварительно вносят корм (один - два кусочка сухих пекарских дрожжей размером 1 мм3 на одну чашку Петри).
Биотестирование проводят при комнатной температуре без смены воды в нестерильных условиях, в защищенном от прямого солнечного света месте.
7.4 Проведение биотестирования
Общий объем воды для биотестирования одной пробы воды 50 см3.
Для проведения токсикологического эксперимента в чашку Петри вносят каплю (0,1 см3) культуральной среды с парамециями. Под микроскопом марки МБС подсчитывают исходное количество парамеций. Далее в эту же чашку Петри рядом с первой каплей вносят каплю исследуемой воды. С помощью пипетки делают перемычку из капли контрольной воды в исследуемую воду. Наблюдают за скоростью перехода парамеций из исходной капли в опыт.
Используют два контроля: дехлорированную водопроводную воду исследуемого региона и воду из фонового условно чистого участка исследуемого водного объекта.
Каждую пробу воды исследуют в трех повторностях с двумя контролями, т.е. необходимо 6 чашек Петри на одну исследуемую пробу. Постановку каждого варианта проводят через 5 мин, необходимых для учета исходного количества парамеций в контрольной капле под бинокулярной лупой.
7.5 Регистрация реакции хемотаксиса
Регистрация реакции хемотаксиса основана на учете численности переместившихся парамеций в каждом варианте. Для оценки реакции хемотаксиса учитывают количество особей, переместившихся из контрольной капли воды в исследуемую пробу воды.
Учет парамеций ведут под бинокулярной лупой (увеличение 4×12,4) через 15, 30, 60, 120 мин.
7.6 Обработка результатов, расчеты и оценка токсичности воды
В таблицу Е.1 (приложение Е) заносят дату проведения биотестирования, номер пробы, номер повторности, количество парамеций, переместившихся в исследуемую воду (в каждой повторности).
Результаты биотестирования оценивают по положительному хемотаксису, т.е. количеству парамеций, переместившихся из контрольной воды в исследуемую.
В каждом варианте токсикологического эксперимента рассчитывают процент парамеций, переместившихся в исследуемую воду. Затем подсчитывают средний процент переместившихся особей на основании результатов трех параллельных определений в контроле и в опыте.
Если количество переместившихся из контрольных вариантов в исследуемую воду парамеций составляет не более 25 %, то воду оценивают как оказывающую ОТД.
Полученные результаты биотестирования заносят в таблицу Е.1 (приложение Е).
7.7 Метрологическая характеристика метода
Диапазон перемещения парамеций из контрольной в исследуемую воду в случае положительного хемотаксиса составляет от 0 % до 100 % с внутрилабораторной прецизионностью 25 %.
8 Биотест по выживаемости зоопланктеров
8.1 Принцип метода
Методика основана на оценке влияния исследуемой воды, отобранной из водных объектов, на зоопланктеров. Тест-объектами могут служить лабораторные культуры парамеций, коловраток, дафний, цериодафний, а также природные популяции этих зоопланктеров, отобранные из фоновых (условно чистых) участков водного объекта. Природные популяции используют в экспедиционных условиях при ЧС. Принципы биотестирования на природных популяциях в основном те же, что и на лабораторных культурах.
В случае ЧС оценивают ОТД пробы воды по изменению показателя выживаемости тест-объектов при экспозиции в исследуемой воде. Показателем выживаемости служит среднее количество тест-объектов, выживших в исследуемой воде за время опыта.
Критерием ОТД является снижение выживаемости тест-объектов не менее чем на 50 % в исследуемой воде по сравнению с контролем. Выживаемость в контроле при этом должна быть не менее 90 %. Наблюдения за выживаемостью проводят через 15; 30; 60 мин, далее через каждый час. Продолжительность биотестирования 24 ч.
8.2 Необходимые материалы, оборудование, реактивы
8.2.1 Культура тест-объекта из представителей зоопланктеров (см. приложения А и Б).
8.2.2 Микроскоп бинокулярный стереоскопический марки МБС по ГОСТ 8074-82.
8.2.3 Пипетки выдувные капиллярные (пастеровские, укороченные с двух сторон или глазные с оттянутым носиком) по ГОСТ 29230-91.
8.2.4 Чашки Петри по ГОСТ 25336-82.
8.2.5 Стаканы вместимостью 0,5 - 1,0 дм3 по ГОСТ 23932-90.
8.2.6 Вода дехлорированная водопроводная исследуемого региона.
8.3 Проведение биотестирования
При использовании в качестве тест-объектов парамеций, коловраток берут по капле массовых культур этих зоопланктеров и помещают в чашку Петри. Фильтровальной бумагой отбирают излишки воды, добавляют 1 см3 исследуемой воды. Под микроскопом подсчитывают исходное количество парамеций. Через 15; 30; 60 и 120 мин подсчитывают количество выживших парамеций.
При использовании в качестве тест-объектов крупного рачкового планктона (дафнии, цериодафнии, симоцефалюсы), их отсаживают по 10 экземпляров в стаканы вместимостью 0,5 - 1,0 дм3 и добавляют 0,5 дм3 исследуемой воды.
При использовании в качестве тест-объектов бокоплавов их отсаживают по 10 экземпляров в чашки Петри.
В качестве контроля используют воду фонового (условно чистого) участка, на котором отловлены используемые в качестве тест-объектов виды, и дехлорированную водопроводную воду исследуемого региона. В контроле выживаемость должна быть не менее 90 %.
Все варианты опыта и контроля ставят не менее, чем в трех повторностях. Общее количество организмов в опыте должно быть не менее 30.
8.4 Регистрация показателя выживаемости и оценка токсичности воды
В качестве тест-показателя токсичности используют выживаемость тест-объектов. Количество живых зоопланктеров регистрируют через 15; 30; 60; 120 мин и через 24 ч.
ОТД исследуемой воды на зоопланктеров устанавливают при кратковременном биотестировании (24 ч). Критерием токсичности служит процент от контроля выживших тест-объектов (при расчете по средним значениям всех повторностей). В случае выживаемости не более 50 % тест-объектов от контроля исследуемую воду оценивают как оказывающую ОТД.
Выживаемость в контроле должна быть не менее 90 % от исходного количества зоопланктеров. В случае значения выживаемости тест-объектов в контроле ниже 90 % токсикологический эксперимент проводят на другой популяции тест-объектов.
Результаты заносят в таблицу Е.2 (приложение Е).
9 Определение кратности разбавления воды, снимающего острое токсическое действие воды
9.1 Биотест при разбавлении воды, снимающей ОТД
В случае обнаружения ОТД необходимо выявить кратность разбавления исследуемой воды, которая снимает токсическое действие.
Кратность разбавления - 2; 10; 25; 50; 100; 500 раз. Разбавление проводят водой, отобранной из фонового створа, или отстоянной дехлорированной водопроводной водой исследуемого региона.
Биотестирование проводят согласно разделам 7 и 8.
9.2 Оценка токсичности воды на основе кратности разбавления пробы
В случае ЧС и при оперативных работах токсическое состояние оценивают на конкретный момент времени исследования. В этом случае при установлении ОТД воды находят кратность разбавления исследуемой воды, при которой токсичность не проявляется.
Оценку токсичности воды и экотоксикологического статуса водного объекта или его участка с точки зрения благополучия водной экосистемы проводят согласно шкале таблицы 1.
Таблица 1 - Шкала оценки токсичности и экотоксикологического статуса водного объекта или его участка [5]
|
Класс токсичности |
Экотоксикологический статус |
|
|
До 1:1 включ. |
0 Нетоксичная |
Чистая |
|
Св. 1:1 до 1:25 включ. |
1 Слабо токсичная |
Олиготоксичная |
|
" 1:25 " 1:50 " |
2 Умеренно токсичная |
Бета-мезотоксичная |
|
" 1:50 " 1:100 " |
3 Остро токсичная |
Альфа-мезотоксичная |
|
" 1:100 " 1:500 " |
4 Весьма токсичная |
Политоксичная |
|
" 1:500 |
5 Чрезвычайно токсичная |
Гипертоксичная |
Результаты биотестирования заносят в таблицу Е.3 (приложение Е).
10 Оценка токсичности воды методом биотестирования с использованием набора биотестов
10.1 Оценку токсичности исследуемой воды проводят по набору биотестов (см. 5.10). Использование набора биотестов с разными по чувствительности тест-объектами и тест-показателями увеличивает вероятность обнаружения токсичности исследуемой воды.
10.2 Итоговая оценка токсичности ПВС является экспертной. Окончательную оценку проводят по тест-объекту и тест-показателю, проявившему наибольшую чувствительность к воздействию исследуемой воды.
10.3 Токсичность воды оценивается словесно: «оказывает» или «не оказывает острое токсическое действие».
11 Требования безопасности, охраны окружающей среды
11.1 При выполнении работ следует соблюдать общие требования к безопасности на водных объектах и в химических лабораториях, установленные в национальных стандартах и соответствующих нормативных документах.
11.2 Особых требований по экологической безопасности не предъявляется.
12 Требования к квалификации оператора
К выполнению экспериментальных работ по оценке токсичности ПВС методом экспрессного биотестирования допускаются лица, имеющие биологическое, экологическое образование, знакомые с основами водной токсикологии, методами полевых и лабораторных гидробиологических исследований.
Приложение.
А
(рекомендуемое)
Экологические характеристики гидробионтов, используемых в качестве тест-объектов при биотестировании
Таблица А.1 - Наименование гидробионтов, используемых в качестве тест-объектов, в связи с их экологическими особенностями
|
Наименование гидробионтов |
Экологические характеристики |
|||||||
|
Пресноводные |
Теплолюбивые |
Холодолюбивые |
||||||
|
PROTOZOA (Простейшие): |
||||||||
|
Paramecium caudatum |
+ |
+ |
+ |
+ |
||||
|
Paramecium putrinum |
+ |
+ |
+ |
|||||
|
+ |
+ |
+ |
+ |
+ |
||||
|
Colpidium sp. |
+ |
+ |
||||||
|
+ |
+ |
|||||||
|
+ |
+ |
|||||||
|
Euplotis vannus (бентический) |
Морской |
+ |
||||||
|
Cristira sp. (бентический) |
+ |
+ |
||||||
|
Uronema marinum (бентический) |
+ |
+ |
||||||
|
Pavella sp. (пелагический) |
+ |
+ |
+ |
|||||
|
Balanoin sp. (пелагический) |
+ |
+ |
+ |
|||||
|
ROTATORIA (Коловратки): |
||||||||
|
+ |
+ |
+ |
+ |
|||||
|
+ |
+ |
+ |
+ |
|||||
|
+ |
+ |
+ |
+ |
|||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
||||||
|
CRUSTACEA (Ракообразные): |
||||||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
|||||||
|
MOLLUSCA (Моллюски): |
||||||||
|
+ |
+ |
|||||||
|
+ |
+ |
|||||||
|
+ |
+ |
+ |
+ |
|||||
|
Crassostrea virginica устрицы |
+ |
+ |
+ |
+ |
||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
+ |
|||||
|
Mytilus edulis мидии |
+ |
+ |
+ |
|||||
|
+ |
+ |
+ |
||||||
|
+ |
+ |
+ |
||||||
|
Patella vulgata |
+ |
+ |
+ |
|||||
|
Rapana tomassina |
+ |
+ |
+ |
+ |
+ |
|||
|
OLIGOCHAETA (малощетинковые черви) |
||||||||
|
+ |
+ |
+ |
||||||
|
INSECTA (Насекомые): |
||||||||
|
Chironomus plumosus |
+ |
+ |
+ |
+ |
||||
|
Примечание - Знаком «+» обозначено наличие указанных экологических особенностей гидробионтов. |
||||||||
Приложение
Б
(рекомендуемое)
Гидробионты, используемые в качестве тест-объектов, и методы учета популяционных характеристик
Таблица Б.1 - Наименование гидробионтов и методы учета популяционных характеристик
|
Тест-объект |
Метод учета |
|
|
Молодь (ювенильные особи) |
Гибель (отмершие особи) |
|
|
PROTOZOA (Простейшие) родов Paramecium, Tetrachimena, Colpidium, Stylonichia |
Микроскопирование: - индивидуальные линии - подсчет численности |
Микроскопирование: подсчет количества погибших особей |
|
RОТАТОRIА (Коловратки) Brachionus calyciflorus, B. rubens, B. plicatilis, Philodina roseola, P. Acuticornis |
Микроскопирование: - индивидуальные линии - подсчет молоди |
То же |
|
CRUSTACEA (Ракообразные) Dapnia magna, Moina macrocopa, Ceriodaphnia recticulata, Artemia salina |
Визуально: - поведение - подсчет молоди |
Визуально подсчет количества погибших особей |
|
OLIGOCHAETA (Малощетинковые черви) Aeolosoma hemprichi |
Визуально: - поведение - наличие кладок |
То же |
|
Mollusca (Моллюски) Lymnaea stagnalis, Anadonta sp., p. Mytilis, p. Dreissena |
Визуально: - количество кладок - количество молоди |
-"- |
|
Рыбы Poecilia reticulate, Brachydanio rerio |
Визуально: количество молоди |
-"- |
|
Insecta (Насекомые) Chironomus plumosus |
Визуально: наличие коконов |
-"- |
Приложение
В
(справочное)
В.1 Хемочувствительность биоты возникла в истории жизни на Земле очень давно. С самого начала эволюции прокариоты были погружены в водную среду. Способность реагировать на химический состав среды была критичной для выживания. Хемотаксис - двигательные реакции свободно передвигающихся растительных и простейших животных организмов, а также клеток (зооспор, сперматозоидов, лейкоцитов и др.) под влиянием химических раздражителей. Хемотаксис может быть положительным - движение направлено к источнику химического раздражителя (по градиенту его концентрации в воздухе или воде), и отрицательным - движение направлено от источника. Явление хемотаксиса известно для ряда микроорганизмов и беспозвоночных животных.
В.2 Для возникновения хемотаксисов необходимо в среде создать градиент (неоднородность распределения) химического вещества, чтобы организм мог выбрать направление уменьшения вредного воздействия. Характеристиками таксиса служит концентрация организмов в исследуемой зоне через определенное время, которая измеряется оптическими приборами (бинокулярная лупа) (см. рисунок В.1)
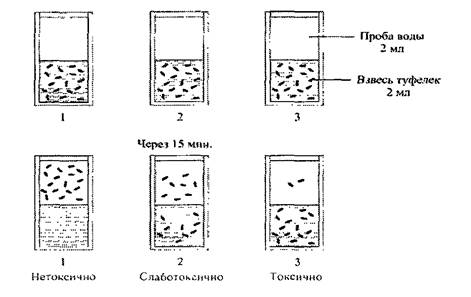
Рисунок В.1 - Реакция хемотаксиса на примере парамеций (туфелек) [2]
Приложение
Г
(справочное)
Характеристика тест-объекта инфузории Paramecium caudatum
Г.1 Систематическое положение
Тип - Ciliophora, подтип - Ciliata, класс - Oligohymenophora, отряд - Hymenostomatida, подотряд - Peniculina, род - Paramecium, вид - Paramecium caudatum Ehrenberg, 1838 (в дальнейшем - парамеция).
Инфузории данного вида как тест-объект обладают рядом достоинств: высокая чувствительность к токсикантам, короткий жизненный цикл, высокая скорость размножения, сочетание признаков эукариотной клетки и организма, ярко выраженные таксисы, достаточно широкая толерантность по отношению к температуре и солености, простота содержания в лабораторных условиях.
Г.2 Местообитание
P.caudatum - свободноживущая широко распространенная ресничная инфузория. Предпочитает альфа-мезосапробные условия, близкие к нейтральному значения рН = 6,5 - 7,5, температурный оптимум в пределах 24 - 28 °С. Обитает в пресных водоемах.
Г.3 Морфология, биология
Парамеции - наиболее сложно организованные простейшие, очень чувствительные к изменению химического состава среды. Парамеции, представляющие собой одноклеточные организмы. Имеют сигарообразное или веретенообразно вытянутое в поперечном сечении округлое тело. Ресничный покров густой, равномерный. Сзади чуть удлиненный. Длина тела составляет 180 - 300 мкм [6]. Клетка парамеций содержит два типа ядер: вегетативное и генеративное. Размножаются парамеции либо поперечным делением клеток (бесполое размножение), либо половым путем, носящим характер коньюгации. Клетки делятся 1 - 2 раза в сутки.
Приложение
Д
(справочное)
Получение исходного материала и содержание парамеций в лабораторных условиях
Д.1 Получение исходного материала для культуры парамеций
Получить исходный материал для культуры парамеций можно в институтах и учреждениях, занимающихся биотестированием с использованием парамеций (в том числе в ГХИ). Обычно этот вид встречается в местных водоемах, поэтому можно самостоятельно вырастить культуру парамеций.
Выделяют парамеций из природных вод методом концентрирования [7]. Для этого из водоема отбирают пробу воды объемом 5 л. Затем путем фильтрации ее через мембранный фильтр с размером пор 3 - 5 мкм получают концентрированную пробу объемом 0,04 дм3. Полученный концентрат пробы сливают в стакан. Затем осадок с фильтра смывают полученным концентратом в чашки Петри. Высота слоя воды в чашке составляет 0,5 - 0,8 см. В чашки Петри добавляют корм - сухие пекарские дрожжи (один - два кусочка размером 1 мм3). Полученные пробы оставляют на 1 - 3 сут. Часто уже через сутки начинается массовое развитие разных видов микрозоопланктона. В лаборатории специалист определяет нужный вид инфузорий (парамеций) под микроскопом. Заранее подготовленные чашки Петри наполняют дехлорированной водопроводной водой и в них переносят парамеций с помощью капиллярной пипетки. Такую пипетку используют в дальнейшем при пересадке инфузорий. Начальная плотность размещения парамеций - 5 - 10 особей на одну чашку Петри. В течение 1 - 3 сут инфузорий адаптируют к лабораторным условиям и используют полученную культуру как исходную.
Д.2 Содержание культуры, кормление
Культуру инфузорий выращивают в климатостате, боксе или в любом помещении, не содержащих токсических паров или газов. Оптимальная температура для культивирования и биотестирования 22 ± 2 °С. Дополнительного освещения не требуется. Не допускается освещать парамеций прямыми солнечными лучами. Стеклянную посуду для содержания инфузорий моют водопроводной водой, нельзя использовать для мытья синтетические моющие средства и органические растворители. В помещении, в котором находится культура парамеций, не хранят летучие вещества и не работают с ними.
Для культивирования парамеций используют водопроводную дехлорированную воду или природную воду из незагрязненного водоема. Вода для культивирования должна удовлетворять следующим требованиям: рН = 6,5 - 7,5, жесткость общая 3 - 4 ммоль/л. концентрация растворенного кислорода не менее 6,0 мг/л.
Оптимальная плотность культуры 10 - 20 особей на 1 см3 воды. Один раз в 7 - 10 сут культуру пересевают. Чтобы обеспечить стандартные условия культивирования, поддерживающие культуру парамеций в стационарной фазе роста.
В качестве корма для парамеций используют сухие пекарских дрожжей. Для содержания парамеций в одной чашке Петри достаточно 1 - 2 кусочков сухих пекарских дрожжей размером 1 мм3.
Д.3 Транспортировка культуры
Культуру парамеций транспортируют в пробирках, не допуская перегрева и переохлаждения. Хранить ее без пересева можно в холодильнике при температуре 8 - 10 °С в течение 2 - 3 нед. Период акклимации к лабораторным условиям составляет 24 ч.
Приложение
Е
(обязательное)
Формы представления результатов биотестирования
Е.1 Форма результатов биотестирования исследуемой воды по реакции хемотаксиса Paramecium caudatum
Таблица Е.1 - Результаты биотестирования исследуемой воды по реакции хемотаксиса Paramecium caudatum на территории деятельности _________ УГМС
|
Дата |
Номер пробы |
Положительный хемотаксис, % |
Оценка токсичности воды |
|||
|
Водного объекта |
Пункта наблюдений |
Отбора пробы |
Проведения биотестирования |
|||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Примечание - В графе 7 пишут: «Оказывает острое токсическое действие» или «Не оказывает острое токсическое действие». |
||||||
Е.2 Форма результатов биотестирования исследуемой воды по показателю выживаемости зоопланктеров
Таблица Е.2 - Результаты биотестирования исследуемой воды по показателю выживаемости ____________________ на территории деятельности ___________ УГМС
вид зоопланктера
|
Дата |
Номер пробы |
Выживаемость, % от контроля |
Оценка токсичности воды |
|||
|
Водного объекта |
Пункта наблюдений |
Отбора пробы |
Проведения биотестирования |
|||
|
1 |
2 |
4 |
||||
|
Примечания 1 В наименовании таблицы указывают вид использованного в качестве тест-объекта зоопланктера (парамеции, коловратки, дафнии, симоцефалюсы и т.д.). 2 В графе 7 пишут: «Оказывает острое токсическое действие» или «Не оказывает острое токсическое действие». |
||||||
Е.3 Форма результатов биотестирования по кратности разбавления исследуемой воды, снимающей острое токсическое действие
Таблица Е.3 - Результаты биотестирования по кратности разбавления исследуемой воды, снимающей острое токсическое действие, на территории деятельности _______________ УГМС
|
Дата |
Номер пробы |
Кратность разбавления |
Положительный хемотаксис, |
Оценка токсичности воды |
|||
|
Водного объекта |
Пункта наблюдений |
Отбора пробы |
Проведения биотестирования |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
Примечание - В графе 8 пишут: «Оказывает острое токсическое действие» или «Не оказывает острое токсическое действие». |
|||||||
Приложение Ж
(справочное)
Библиография
[1] Константинов А.С. Общая гидробиология. - М.: Высшая школа, 1986. - 470 с.
[2] Методика определения токсичности почвы и донных осадков по хемотаксической реакции инфузорий. - М., 1998. - 22 с.
[3] Федеральный закон РФ «О защите населения и территорий от чрезвычайных ситуациях природного и техногенного характера» от 21.12.94 № 68-ФЗ.
[4] Правила охраны поверхностных вод (типовые положения). - М.: Госкосмприрода СССР, 1991
[5] Брагинский Л.П. Некоторые принципы классификации пресноводных экосистем по уровням токсической загрязненности // Гидробиологический журнал. - 1985. - № 6, Т. 21. - С. 65 - 74.
[6] Банина Н.Н. Тип Инфузории //Фауна аэротенков. Атлас. - П.: Наука, Ленингр., 1984. - С. 136 - 186.
[7] Бакаева Е.Н., Никаноров А.М. Гидробионты в оценке качества вод. - М.: Наука, 2006. - 238 с.
Лист регистрации изменений
|
Номер изменения |
Номер листа (страницы) |
Номер документа (ОРН) |
Подпись |
Дата |
||||
|
измененного |
замененного |
нового |
аннулированного |
внесения изменений |
введения изменений |
|||
СОДЕРЖАНИЕ