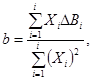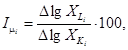ФЕДЕРАЛЬНОЕ АГЕНТСТВО
ПО ТЕХНИЧЕСКОМУ РЕГУЛИРОВАНИЮ И МЕТРОЛОГИИ
|
|
НАЦИОНАЛЬНЫЙ |
ГОСТ Р (ИСО 8692:2004) |
ВОДА
Определение
токсичности с использованием
зеленых пресноводных
одноклеточных водорослей
ISO 8692:2004
Water quality - Freshwater algal growth inhibition
test with unicellular green algae
(MOD)
|
|
Москва Стандартинформ 2012 |
Предисловие
Цели и принципы стандартизации в Российской Федерации установлены Федеральным законом от 27 декабря 2002 г. № 184-ФЗ «О техническом регулировании», а правила применения национальных стандартов Российской Федерации - ГОСТ Р 1.0-2004 «Стандартизация в Российской Федерации. Основные положения»
Сведения о стандарте
1 ПОДГОТОВЛЕН Обществом с ограниченной ответственностью «Протектор» (ООО «Протектор») и Федеральным государственным унитарным предприятием «Всероссийский научно-исследовательский институт рыбного хозяйства и океанографии» (ФГУП «ВНИРО») на основе аутентичного перевода на русский язык указанного в пункте 4 международного стандарта, находящегося в Федеральном информационном фонде
2 ВНЕСЕН Техническим комитетом по стандартизации ТК 343 «Качество воды»
3 УТВЕРЖДЕН и ВВЕДЕН В ДЕЙСТВИЕ Приказом Федерального агентства по техническому регулированию и метрологии от 14 ноября 2011 г. № 542-ст
4 Настоящий стандарт является модифицированным по отношению к международному стандарту ИСО 8692:2004 «Качество воды. Испытание на торможение роста водорослей в пресной воде с применением одноклеточных зеленых водорослей» (ISO 8692:2004 «Water quality - Freshwater algal growth inhibition test with unicellular green algae») путем:
- введения дополнительных положений, фраз и слов в текст настоящего стандарта для учета потребностей национальной экономики Российской Федерации и особенностей российской национальной стандартизации, выделенных в тексте настоящего стандарта курсивом; за исключением наименований тест-организмов;
- изменения структуры. Сравнение структуры настоящего стандарта со структурой указанного международного стандарта приведено в дополнительном приложении ДЛ;
- исключения отдельных пунктов указанного международного стандарта. Полный текст исключенных пунктов с обоснованиями исключения приведен в дополнительном приложении ДМ.
Наименование настоящего стандарта изменено относительно наименования указанного международного стандарта для приведения в соответствие с ГОСТ Р 1.5-2004 (подраздел 3.5).
Сведения о соответствии ссылочных национальных и межгосударственных стандартов международным стандартам, использованным в качестве ссылочных в примененном международном стандарте, приведены в дополнительном приложении ДП
5 ВВЕДЕН ВПЕРВЫЕ
Информация об изменениях к настоящему стандарту публикуется в ежегодно издаваемом информационном указателе «Национальные стандарты», а текст изменений и поправок - в ежемесячно издаваемых информационных указателях «Национальные стандарты». В случае пересмотра (замены) или отмены настоящего стандарта соответствующее уведомление будет опубликовано в ежемесячно издаваемом информационном указателе «Национальные стандарты». Соответствующая информация, уведомление и тексты размещаются также в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет
СОДЕРЖАНИЕ
НАЦИОНАЛЬНЫЙ СТАНДАРТ РОССИЙСКОЙ ФЕДЕРАЦИИ
ВОДА
Определение токсичности с использованием
зеленых пресноводных одноклеточных водорослей
Water. Determination of toxicity with use of green freshwater unicellular algae
Дата введения - 2013-01-01
1 Область применения
Настоящий стандарт распространяется на природные пресные воды (поверхностные и подземные); питьевые воды (централизованного и нецентрализованного питьевого водоснабжения); сточные воды (в том числе очищенные), а также на растворимые в воде вещества; отработанные буровые растворы; водные вытяжки донных отложений, твердых промышленных отходов, грунтов и почв и устанавливает методы лабораторного биологического тестирования воды и водных вытяжек (далее - тестирование) для определения их токсичности с использованием зеленых пресноводных одноклеточных водорослей по изменению:
- плотности (численности) клеток водорослей при тестировании в условиях переменного воздействия света и постоянной температуры (метод А);
- плотности (численности) клеток водорослей при тестировании в условиях постоянного воздействия света и постоянной температуры (метод Б);
- интенсивности флуоресценции клеток водорослей при тестировании в условиях переменного воздействия света и постоянной температуры (метод В).
Примечания
1 Метод Б применим для оценки токсичности сточных вод, не содержащих тяжелых металлов, так как комплексообразующая способность трилона Б, содержащегося в питательной среде искажает возможность тестирования сточных вод, загрязненных тяжелыми металлами.
2 Используемые в настоящем стандарте водоросли являются планктонными одноклеточными зелеными водорослями, принадлежащими к порядку Chlorococcales (Chlorophyta, Chlorophyceae).
Методы позволяют определять токсичность исследуемых объектов и следующие токсикологические показатели (относительно контрольной пробы):
- эффективную кратность разбавления (ЭКР50) пробы при которой плотность (численность) клеток водорослей (интенсивность флуоресценции) снижается на 50 %, а также безвредную кратность разбавления пробы (ЭКР10), при которой плотность (численность) клеток водорослей (интенсивность флуоресценции) снижается не более 10 % за 72 ч (96 ч) тестирования;
- эффективную концентрацию (ЭК50) растворов веществ, вызывающую снижение плотности (численности) клеток водорослей (интенсивности флуоресценции) на 50 %, и безвредную концентрацию (ЭК10) растворов веществ, вызывающую снижение плотности (численности) клеток водорослей (интенсивности флуоресценции) не более 10 % за 72 ч тестирования.
Примечания
1 Продолжительность тестирования 96 ч используют при определении токсичности и токсикологических показателей анализируемых проб отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов и почв (методы А и В).
2 Определение токсичности и токсикологических показателей для сточной воды по методу Б рекомендуется проводить при продолжительности тестирования не менее 48 ч. Пример приведен в приложении А.
3 Полученные в лабораторных условиях значения ЭКР и ЭК являются токсикологическими показателями и указывают на потенциальную опасность исследуемых объектов, но не могут быть использованы непосредственно для прогнозирования их воздействия на окружающую среду. Однако определенные свойства водорослей, установленные на основе тестирования (например, замедление начала роста клеток; хороший начальный рост, который не сохраняется), позволяют определить степень воздействия конкретного вещества.
4 Эффективную кратность разбавления (ЭКР50) за 72 ч тестирования обозначают как 72 ч ЭКР50, за 96 ч тестирования - соответственно 96 ч ЭКР50, за 48 ч тестирования - 48 ч ЭКР50; эффективную концентрацию (ЭК50) за 72 ч тестирования - как 72 ч ЭК50. При этом в протоколе испытаний допускается указывать унифицированное обозначение для эффективной кратности разбавления и для эффективной концентрации как ЕС50.
5 Тестирование должен выполнять обученный персонал.
6 Настоящий стандарт не предусматривает ознакомление персонала со всеми проблемами безопасности, связанными с его использованием. Пользователь стандарта несет ответственность за обеспечение соответствующих требований стандарта при проведении тестирования.
В помещении лаборатории, где проводят тестирование:
- окружающая среда не должна содержать пара или пыли, токсичной для водорослей;
- температура окружающего воздуха должна быть (23 ± 2) °С (только для помещения с регулируемой температурой по методу Б);
- относительная влажность воздуха должна быть не более 80 %;
- атмосферное давление должно быть 84 - 106 кПа (630 - 800 мм рт.ст.);
- должно быть обеспечено постоянное равномерное белое освещение в диапазоне 6000 - 10000 лк (только для помещения с регулируемой температурой по методу Б).
2 Нормативные ссылки
В настоящем стандарте использованы нормативные ссылки на следующие стандарты:
ГОСТ Р ИСО/МЭК 17025-2009 Общие требования к компетентности испытательных и калибровочных лабораторий
ГОСТ Р 51568-99 (ИСО 3310-1-90) Сита лабораторные из металлической проволочной сетки. Технические условия
ГОСТ Р 51592-2000 Вода. Общие требования к отбору проб
ГОСТ Р 51593-2000 Вода питьевая. Отбор проб
ГОСТ Р 52501-2005 (ИСО 3696:1987) Вода для лабораторного анализа. Технические условия
ГОСТ Р 53228-2008 Весы неавтоматического действия. Часть 1. Метрологические и технические требования. Испытания
ГОСТ Р 53857-2010 Классификация опасности химической продукции по воздействию на окружающую среду. Основные положения
ГОСТ Р 53858-2010 Классификация опасности смесевой химической продукции по воздействию на окружающую среду
ГОСТ Р 53910-2010 (ИСО 10253:2006) Вода. Методы определения токсичности по замедлению роста морских одноклеточных водорослей Phaeodactylum tricomutum Bohlin и Sceletonema costatum (Greville) Cleve
ГОСТ 17.1.5.01-80 Охрана природы. Гидросфера. Общие требования к отбору проб донных отложений водных объектов для анализа на загрязненность
ГОСТ 17.1.5.05-85 Охрана природы. Гидросфера. Общие требования к отбору проб поверхностных и морских вод, льда и атмосферных осадков
ГОСТ 17.4.3.01-83 Охрана природы. Почвы. Общие требования к отбору проб
ГОСТ 17.4.4.02-84 Охрана природы. Почвы. Методы отбора и подготовки проб для химического, бактериологического, гельминтологического анализа
ГОСТ 612-75 Реактивы. Марганец (II) хлористый 4-водный. Технические условия
ГОСТ 1770-74 Посуда мерная лабораторная стеклянная. Цилиндры, мензурки, колбы, пробирки. Общие технические условия
ГОСТ 2493-75 Реактивы. Калий фосфорнокислый двузамещенный 3-водный. Технические условия
ГОСТ 3118-77 Реактивы. Кислота соляная. Технические условия
ГОСТ 3773-72 Реактивы. Алюминий хлористый. Технические условия
ГОСТ 4147-74 Реактивы. Железо (III) хлорид 6-водный. Технические условия
ГОСТ 4167-74 Реактивы. Медь двухлористая 2-водная. Технические условия
ГОСТ 4198-75 Реактивы. Калий фосфорнокислый однозамещенный. Технические условия
ГОСТ 4201-79 Реактивы. Натрий углекислый кислый. Технические условия
ГОСТ 4209-77 Реактивы. Магний хлористый 6-водный. Технические условия
ГОСТ 4217-77 Реактивы. Калий азотнокислый. Технические условия
ГОСТ 4220-75 Реактивы. Калий двухромовокислый. Технические условия
ГОСТ 4234-77 Реактивы. Калий хлористый. Технические условия
ГОСТ 4328-77 Реактивы. Натрия гидроокись. Технические условия
ГОСТ 4461-77 Реактивы. Кислота азотная. Технические условия
ГОСТ 4523-77 Реактивы. Магний сернокислый 7-водный. Технические условия
ГОСТ 4525-77 Реактивы. Кобальт хлористый 6-водный. Технические условия
ГОСТ 4529-78 Реактивы. Цинк хлористый. Технические условия
ГОСТ 6709-72 Вода дистиллированная. Технические условия
ГОСТ 9147-80 Посуда и оборудование лабораторные фарфоровые. Технические условия
ГОСТ 9656-75 Реактивы. Кислота борная. Технические условия
ГОСТ 10652-73 Реактивы. Соль динатриевая эmuлeндиамин - N,N,N',N'-тетрауксусной кислоты 2-водная (трилон Б). Технические условия
ГОСТ 10931-74 Реактивы. Натрий молибденовокислый 2-водный. Технические условия
ГОСТ 12026-76 Бумага фильтровальная лабораторная. Технические условия
ГОСТ 12071-2000 Грунты. Отбор, упаковка, транспортирование и хранение образцов
ГОСТ 19126-2007 Инструменты медицинские металлические. Общие технические условия
ГОСТ 25336-82 Посуда и оборудование лабораторные стеклянные. Типы, основные параметры и размеры
ГОСТ 27065-86 Качество вод. Термины и определения
ГОСТ 27753.1-88 Грунты тепличные. Методы отбора проб
ГОСТ 27753.2-88 Грунты тепличные. Метод приготовления водной вытяжки
ГОСТ 28168-89 Почвы. Отбор проб
ГОСТ 28498-90 Термометры жидкостные стеклянные. Общие технические требования. Методы испытаний
ГОСТ 29227-91 (ИСО 835-1-1981) Посуда лабораторная стеклянная. Пипетки градуированные. Часть I. Общие требования
ГОСТ 30416-96 Грунты. Лабораторные испытания. Общие положения
Примечание - При пользовании настоящим стандартом целесообразно проверить действие ссылочных стандартов в информационной системе общего пользования - на официальном сайте Федерального агентства по техническому регулированию и метрологии в сети Интернет или по ежегодно издаваемому информационному указателю «Национальные стандарты», который опубликован по состоянию на 1 января текущего года, и по соответствующим ежемесячно издаваемым информационным указателям, опубликованным в текущем году. Если ссылочный стандарт заменен (изменен), то при пользовании настоящим стандартом следует руководствоваться заменяющим (измененным) стандартом. Если ссылочный стандарт отменен без замены, то положение, в котором дана ссылка на него, применяется в части, не затрагивающей эту ссылку.
3 Термины и определения
В настоящем стандарте применены термины по ГОСТ 27065, а также следующие термины с соответствующими определениями:
3.1 плотность (численность) клеток (cell density): Количество клеток в единице объема питательной среды или анализируемой пробы.
Примечание - Плотность (численность) клеток выражается количеством клеток на кубический сантиметр (клеток/см3).
3.2 скорость роста (specific growth rate): Увеличение плотности (численности) клеток водорослей в единицу времени.
Примечания
1 Термин в [1] указан как «удельная скорость роста» и для него приведена следующая формула
![]() (1)
(1)
где х - плотность (численность) клеток, клеток/см3;
t - время, сут.
2 Удельная скорость роста выражается в обратных сутках (сут-1).
3.3 питательная среда (growth medium): Смесь дистиллированной (деионизированной) воды и питательных веществ, которая используется для культивирования водорослей и приготовления контрольной пробы.
3.4 испытуемая проба (test specimen): Проба воды (например, сточной воды), проба вещества, донных отложений, отработанных буровых растворов, твердых промышленных отходов, грунтов и почв, для которой определяется ингибирующее действие на рост плотности (численности) клеток водорослей.
3.5 анализируемая проба (sample analyzed): Смесь дистиллированной (деионизированной) воды, питательной среды и испытуемой пробы, засеянная водорослями.
3.6 контрольная проба (control): Смесь питательной среды, засеянная водорослями, без испытуемой пробы.
3.7 эффективная концентрация, ЕСх [effective concentration (ECx)]: Концентрация вещества в анализируемой пробе, которая приводит к х %-ному снижению плотности (численности) клеток водорослей (замедлению скорости роста клеток водорослей) или изменению интенсивности флуоресценции клеток водорослей относительно контрольной пробы.
Примечания
1 Для термина «эффективная концентрация» в [1] указано обозначение ЕrСх.
2 Безвредная концентрация - эффективная концентрация вещества в анализируемой пробе, при которой плотность (численность) клеток водорослей (интенсивность флуоресценции) изменяется относительно контрольной пробы не более 10 % за 72 ч тестирования.
3.8 эффективная кратность разбавления, ЭКР (effective multiplicity of dilution): Степень разбавления пробы (например, сточной воды) питательной средой при подготовке анализируемой пробы, которая приводит к х %-ному снижению плотности (численности) клеток водорослей (замедлению скорости роста клеток водорослей или изменению интенсивности флуоресценции клеток водорослей) относительно контрольной пробы.
Примечание - Безвредная кратность разбавления - эффективная кратность разбавления анализируемой пробы, при которой плотность (численность) клеток водорослей (интенсивность флуоресценции) изменяется относительно контрольной пробы не более 10 % за 72 ч тестирования (или 96 ч тестирования в зависимости от исследуемого объекта).
4 Отбор проб
4.1 Отбор проб природной, питьевой и сточной воды проводят в соответствии с требованиями ГОСТ Р 51592, ГОСТ Р 51593, ГОСТ 17.1.5.05-85, [2] и [3], при этом объем пробы воды должен быть не менее 500 см3.
Условия и сроки хранения отобранных проб - по ГОСТ Р 51592 и ГОСТ Р 51593.
Примечание - Если отобранную пробу воды перед тестированием требуется отстаивать или фильтровать, то отстаивание и фильтрование должны предшествовать ее замораживанию.
4.2 Отбор проб донных отложений проводят в соответствии с требованиями ГОСТ Р 51592, ГОСТ 17.1.5.01 и [4] массой не менее 2 кг.
Срок хранения проб донных отложений - не более 12 ч после их отбора до проведения тестирования.
Допускается хранение отобранных проб до проведения их тестирования:
- не более 48 ч - при температуре от 0 °С до 4 °С;
- не более 14 сут - при температуре минус 18 °С.
4.3 Отбор проб отработанных буровых растворов проводят в соответствии с требованиями технической документации предприятия, на котором образуются отработанные буровые растворы, массой не менее 5,0 кг, при этом под крышкой емкости, в которую отобрана проба, должен оставаться слой воздуха высотой 2 см.
Отобранные пробы отработанных буровых растворов хранят в емкостях-холодильниках при температуре от 0 °С до 4 °С не более 3 мес.
После вскрытия емкостей-холодильников для подготовки проб отработанных буровых растворов к тестированию срок хранения не должен превышать 14 сут.
4.4 Отбор проб твердых промышленных отходов проводят в соответствии с требованиями технической документации предприятия, на котором образуются отходы, массой не менее 2 кг.
Срок хранения отобранных проб твердых промышленных отходов в емкостях с притертой или плотно закрытой крышкой при температуре от 0 °С до 4 °С - не более 7 сут.
4.5 Отбор проб веществ, условия и сроки их хранения должны соответствовать требованиям стандартов и другой документации на конкретную продукцию (группу однородной продукции).
4.6 Отбор проб грунтов проводят по ГОСТ 12071, ГОСТ 27753.1; почв - по ГОСТ 17.4.3.01, ГОСТ 17.4.4.02, ГОСТ 28168, [2], массой не менее 2 кг.
Срок хранения отобранных проб грунтов (почв) в емкостях с притертой или плотно закрытой крышкой при температуре от 0 °С до 4 °С - не более 7 сут.
4.7 Для отбора проб природной воды, отработанных буровых растворов, донных отложений используют емкости из полиэтилена, полиэтилентерефлата или политетрафторэтилена, а при наличии в воде нефтепродуктов, поверхностно-активных веществ и пестицидов - емкости из темного стекла.
Для отбора проб сточных вод, твердых промышленных отходов, грунтов и почв используют емкости из темного стекла или нержавеющей стали, при этом не допускается использовать емкости с хромовым покрытием.
Для отбора проб веществ используют емкости из полиэтилена, полиэтилентерефлата, политетрафторэтилена или темного стекла.
4.8 Сроки и условия хранения отобранной пробы указывают в протоколе испытаний.
4.9 Консервацию отобранных проб не проводят.
5 Метод А
5.1 Сущность метода
Сущность метода заключается в регистрации изменения плотности (численности) клеток зеленых пресноводных одноклеточных водорослей в анализируемой пробе исследуемого объекта относительно контрольной пробы, определении ее токсичности и токсикологических показателей при тестировании в течение 72 ч (96 ч) при переменном воздействии света и при постоянной температуре.
Продолжительность тестирования 72 ч указана для определения токсичности и токсикологических показателей анализируемых проб природной и сточной воды, а также анализируемых проб веществ.
Продолжительность тестирования 96 ч указана для определения токсичности и токсикологических показателей анализируемых проб отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов и почв.
5.2 Средства измерений, вспомогательное оборудование, реактивы, материалы
Флуориметр, спектрофлуориметр или люминесцентный анализатор жидкости (далее - прибор) с кварцевой кюветой 10 мм и детектором, позволяющим проводить измерения при возбуждении флуоресценции хлорофилла водорослей в диапазоне длин волн от 400 до 500 нм и регистрацию флуоресценции хлорофилла водорослей в диапазоне длин волн от 650 до 750 нм. Предел детектирования прибора - не менее 1000 клеток/см3 водорослей.
Климатостат любого типа, обеспечивающий поддержание температуры (20 ± 2) °С и белое люминесцентное освещение в диапазоне 3000 - 6000 лк.
Весы лабораторные высокого класса точности с ценой деления (дискретностью отсчета) не более 0,01 г, пределом взвешивания не более 210 г по ГОСТ Р 53228.
рН-метр любого типа, обеспечивающий измерения рН в диапазоне от 3 до 10 ед. рН с допускаемой погрешностью ±0,1 ед. рН.
Кондуктометр любого типа, обеспечивающий измерения удельной электропроводности дистиллированной (деионизированной) воды с допускаемой погрешностью ±2,0 мкСм/см.
Оксиметр любого типа, с допускаемой погрешностью измерения не более 0,5 мг О2/дм3.
Термометры жидкостные стеклянные с диапазоном измерения от 0 °С до 50 °С с ценой деления шкалы 0,5 °С по ГОСТ 28498.
Пипетки автоматические (дозаторы) любого типа вместимостью 0,1 - 0,2 см3 с относительной погрешностью измерений не более ±1,0 %.
Пипетки 1-1(2)-2-1, 1-1(2)-2-2, 1-1(2)-2-5, 1-1(2)-2-10 по ГОСТ 29227.
Микропипетки вместимостью 0,1; 0,2 см3 с ценой деления 0,01 см3.
Колбы мерные 2-25-2, 2-50-2, 2-100-2 по ГОСТ 1770.
Колбы стеклянные (конические) лабораторные вместимостью 0,25, 1 и 2 дм3 по ГОСТ 25336.
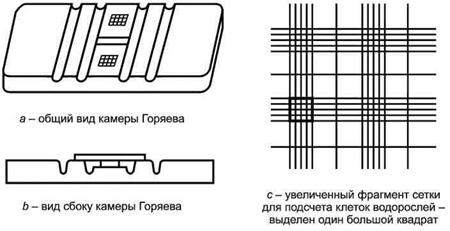
Счетная камера (камера Горяева).
Микроскоп биологический типа МБР или МБИ, обеспечивающий увеличение в 100 - 200 раз.
Мешалка магнитная.
Устройство для встряхивания любого типа (например, орбитальный шейкер, качалка-мешалка).
Сушильный электрический шкаф общелабораторного назначения, поддерживающий температуру от 50 °С до 200 °С с погрешностью не более ±5 °С.
Аквариумный микрокомпрессор любого типа, например АЭН-4.
Шпатели металлические по ГОСТ 19126.
Холодильник бытовой, обеспечивающий поддержание температуры от минус 18 °С до минус 20 °С и от 2 °С до 4 °С.
Ступки и пестики фарфоровые по ГОСТ 9147.
Бумага фильтровальная по ГОСТ 12026.
Фильтры обеззоленные «белая лента».
Фильтровальная установка любого типа.
Фильтры мембранные с диаметром пор 0,45 и 3,5 мкм.
Пробирки стеклянные вместимостью 10 см3 по ГОСТ 25336.
Цилиндры мерные вместимостью 25, 50, 100, 1000 см3, второго класса точности исполнений 1, 2, 2а, 3, 4 или 4а по ГОСТ 1770.
Сито с отверстиями диаметром 1 мм по ГОСТ Р 51568.
Насос водоструйный по ГОСТ 25336.
Баня водяная любого типа.
Стаканы стеклянные лабораторные вместимостью 50, 100, 500, 1000 см3 по ГОСТ 25336.
Вода для лабораторного анализа по ГОСТ Р 52501 или дистиллированная вода по ГОСТ 6709, или деионизированная вода с удельной электропроводностью не более 10 мкСм/см (далее - дистиллированная вода).
Модельный токсикант: калий двухромовокислый по ГОСТ 4220, ч.д.а.
Питательная среда [среда Прата, приготовленная в соответствии с требованиями ДА.1 (приложение ДА)].
Примечания
1 Емкости, используемые для приготовления питательной среды, должны быть изготовлены из стекла.
2 Питательную среду используют для культивирования водорослей, приготовления контрольной пробы и разбавления анализируемых проб.
Тест-объекты (тест-организмы): зеленые пресноводные одноклеточные водоросли Chlorella vulgaruis Beijer и Scenedesmus quadricauda (Turp) Breb.
Примечания
1 Методы культивирования водорослей приведены в ДБ.1 (приложение ДБ).
2 Допускается хранение водорослей Chlorella vulgaruis Beijer и Scenedesmus quadricauda (Turp) Breb на агаризованной питательной среде Прата при температуре от 2 °С до 4 °С не более 12 мес без потери их жизнеспособности.
Калий азотнокислый по ГОСТ 4217, х.ч.
Калий фосфорнокислый двузамещенный 3-водный по ГОСТ 2493, х ч.
Кальций хлористый, безводный, х.ч.
Магний сернокислый 7-водный по ГОСТ 4523, х.ч.
Натрий углекислый кислый по ГОСТ 4201.
Натрия гидроокись по ГОСТ 4328, х.ч.
Хлорид железа 6-водный по ГОСТ 4147, х.ч.
Кислота азотная по ГОСТ 4461, х.ч.
Кислота соляная по ГОСТ 3118, х.ч.
5.3 Подготовка к тестированию
5.3.1 Подготовка посуды
5.3.1.1 Емкости, используемые для тестирования, должны быть химически чистыми.
Для проведения тестирования используют только стеклянную посуду.
5.3.1.2 Стеклянную посуду для тестирования осторожно промывают 10 %-ным раствором азотной кислоты и выдерживают 2 - 3 ч при комнатной температуре, затем тщательно промывают водопроводной водой, обрабатывают 10 %-ным раствором натрия углекислого кислого, промывают водопроводной водой, после чего не менее трех раз ополаскивают дистиллированной водой.
При сильном загрязнении посуды, а также новую посуду промывают водопроводной водой, заполняют 10 %-ным раствором азотной кислоты и выдерживают в течение суток, после чего обрабатывают 10 %-ным раствором углекислого кислого натрия, затем тщательно промывают водопроводной водой и не менее трех-четырех раз ополаскивают дистиллированной водой.
5.3.1.3 Емкости и посуду для тестирования сушат на воздухе при комнатной температуре, затем стеклянную посуду, за исключением мерной, помещают в сушильный шкаф и выдерживают в течение одного часа при температуре 150 °С.
Чистую посуду (емкости) закрывают стеклянными притертыми пробками или крышками и хранят в шкафах или на полках.
5.3.1.4 Мембранные фильтры перед применением должны быть промыты и стерилизованы кипячением в дистиллированной воде не менее 10 мин.
Перед тестированием предварительно охлажденные или замороженные пробы доводят до температуры (20 ± 5) °С.
5.3.2.1 Подготовка исходных проб природной и питьевой воды
Отобранные пробы природной и питьевой воды непосредственно перед тестированием фильтруют через мембранные фильтры с порами диаметром 3,5 мкм или через обеззоленные фильтры «белая лента», после чего измеряют рН отфильтрованной пробы.
Не допускается для фильтрования использовать фильтр «синяя лента».
Примечание - Фильтр «синяя лента» задерживает коллоидные вещества, что занижает результаты тестирования.
5.3.2.2 Подготовка исходных проб сточной воды
Отобранные пробы сточной воды непосредственно перед тестированием фильтруют через мембранный фильтр с порами диаметром 3,5 мкм или через обеззоленный фильтр «белая лента», после чего измеряют рН и концентрацию растворенного кислорода отфильтрованной пробы.
5.3.2.3 Подготовка исходных проб отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов и почв
Из отобранных проб отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов и почв готовят водные вытяжки, затем измеряют рН и концентрацию растворенного кислорода подготовленных водных вытяжек.
Подготовка водных вытяжек из проб отработанных буровых растворов
Перед приготовлением водной вытяжки из пробы отработанных буровых растворов отобранную пробу тщательно перемешивают на магнитной мешалке со скоростью вращения 17 с-1 (1000 об/мин) в течение 5 мин и определяют рН отработанного бурового раствора. Пробу отработанного бурового раствора считают не пригодной для тестирования, если:
- рН пробы отработанного бурового раствора более 9,0 или ниже 6,0;
- на стенках сосуда с пробой отработанного бурового раствора появились черные пятна;
- проба отработанного бурового раствора имеет неприятный запах.
После перемешивания пробу отработанного бурового раствора смешивают с дистиллированной водой (см. 5.2) в соотношении 1:9 по объему и снова перемешивают на магнитной мешалке со скоростью вращения 17 с-1 (1000 об/мин) в течение 5 мин.
После окончания перемешивания смесь выдерживают при температуре (20 ± 5) °С в течение 1 ч, затем жидкость над осадком (водную вытяжку бурового раствора) осторожно переливают за один прием в другую колбу и перемешивают в течение 5 мин, после чего используют ее для подготовки анализируемой пробы.
Если отстоявшаяся смесь не имеет четкого раздела фаз, то весь объем подготовленной пробы используют для приготовления анализируемой пробы.
Не допускаются консервация и хранение подготовленных водных вытяжек проб отработанных буровых растворов.
Подготовка водных вытяжек из проб твердых промышленных отходов
Перед приготовлением водной вытяжки из твердых промышленных отходов отобранную пробу твердых промышленных отходов разрыхляют и тщательно осматривают. В случае обнаружения частиц размером более 10 мм их измельчают с помощью металлического шпателя до размера менее 10 мм. Не допускается измельчать смесь с помощью механизированных устройств.
Измельченную пробу отходов высушивают на воздухе при температуре (20 ± 5) °С до воздушно-сухого состояния в вытяжном шкафу или в хорошо проветриваемом помещении.
Водную вытяжку из высушенной пробы отходов готовят в соотношении - твердые промышленные отходы дистиллированная вода, соответственно 1:10, следующим способом.
В колбу вместимостью 1500 см3 вносят 100 г сухой массы пробы твердых промышленных отходов, добавляют 1000 см3 дистиллированной воды (см. 5.2) и перемешивают в течение 6 - 7 ч с использованием магнитной мешалки (или орбитального шейкера) с минимальной скоростью перемешивания, при которой проба твердых промышленных отходов поддерживается во взвешенном состоянии.
Примечание - Для приготовления 900 см3 водной вытяжки обычно требуется 100 г сухой массы пробы отходов.
Не допускается использовать для приготовления водной вытяжки менее 20 г сухой массы пробы отходов и менее 200 см3 дистиллированной воды.
После окончания перемешивания смесь выдерживают при температуре от 2 °С до 4 °С в течение 12 - 14 ч, затем жидкость над осадком осторожно переливают в другую колбу, после чего используют ее для подготовки анализируемой пробы.
Примечание - Жидкие промышленные отходы тестируют без разбавления, а также при разбавлениях в 10, 100, 1000 и 10000 раз.
Допускается хранение подготовленных водных вытяжек из твердых промышленных отходов при температуре от 2 °С до 4 °С не более 48 ч.
Подготовка водных вытяжек из проб донных отложений
Перед приготовлением водной вытяжки из донных отложений отобранную пробу донных отложений высушивают на воздухе при температуре (20 ± 5) °С до воздушно-сухого состояния, удаляют остатки растений, камешки и т.п., затем измельчают в ступке и просеивают через сито с отверстиями диаметром 1 мм.
После просеивания навеску пробы донных отложений вносят в колбу (стакан) и заливают дистиллированной водой (см. 5.2) в соотношении 1:4 по объему, перемешивают с использованием орбитального шейкера (или качалки-мешалки) в течение 2 ч. После окончания перемешивания смесь выдерживают в течение 1 ч при температуре (20 ± 5) °С, а затем в течение 12 - 14 ч выдерживают при температуре от 2 °С до 4 °С. Затем жидкость над осадком осторожно переливают в другую колбу и фильтруют, после чего используют для подготовки анализируемой пробы.
Допускается хранение подготовленных водных вытяжек донных отложений при температуре от 2 °С до 4 °С не более 72 ч.
Подготовка водных вытяжек из проб грунтов и почв
Перед приготовлением водной вытяжки из проб грунтов и почв отобранную пробу грунтов подготавливают в соответствии с требованиями ГОСТ 30416, ГОСТ 27753.2, почв - ГОСТ 17.4.4.02.
Водную вытяжку из пробы грунта (почвы) готовят следующим способом:
В колбу вместимостью 1000 см3 вносят 100 - 200 г высушенной подготовленной пробы грунта (почвы), заливают дистиллированной водой (см. 5.2) в соотношении 1:4 по объему и перемешивают с использованием орбитального шейкера (или качалки-мешалки) в течение 2 ч.
После окончания перемешивания смесь выдерживают при температуре (20 ± 5) °С в течение 30 мин, затем жидкость над осадком осторожно переливают в другую колбу и фильтруют.
Оставшуюся часть осадка в колбе встряхивают до взмучивания взвешенных частиц пробы и фильтруют через обеззоленные фильтры «белая лента» с применением вакуумного водоструйного
(или электрического) насоса при вакууме не более 2666,448 Па (20 мм рт.ст.). При этом, если первые порции фильтрата будут мутными, их несколько раз фильтруют через новый фильтр до получения прозрачного раствора.
Полученные фильтраты объединяют, после чего используют для подготовки анализируемой пробы.
Примечания
1 При наличии повышенной мутности отфильтрованных водных вытяжек их выдерживают при температуре 2 °С - 4 °С в течение 24 ч, затем жидкость над осадком осторожно переливают в другую колбу, фильтруют и только после этого используют для приготовления анализируемой пробы.
2 При наличии в отфильтрованной водной вытяжке диоксида углерода вытяжку кипятят на водяной бане в течение 30 мин, охлаждают до температуры (20 ± 5) °С и только после этого используют для приготовления анализируемой пробы.
Допускается хранение подготовленных водных вытяжек из грунтов (почв) при температуре от 2 °С до 4 °С не более 72 ч.
5.3.2.4 Подготовка исходных растворов веществ
Исходные растворы веществ, в зависимости от заданной концентрации, готовят в мерной колбе путем растворения определенного количества исследуемой пробы вещества в определенном объеме дистиллированной воды.
Исходные растворы веществ готовят непосредственно перед их тестированием, при этом, если известно, что вещества стабильны в растворе, исходные растворы допускается готовить заранее, но не более чем за 2 сут до тестирования.
Примечания
1 Для веществ, трудно растворимых в воде, при приготовлении их исходных растворов могут быть использованы ультразвуковые или другие устройства (шейкеры) для облегчения растворимости или диспергирования веществ.
2 Допускается использовать органические растворители, обладающие малой токсичностью в отношении тест-организмов (например, ацетон), при условии, что концентрация растворителя в анализируемой пробе не превышает 0,1 см3/дм3, при этом параллельно с основным тестированием проводят два контрольных тестирования, одно без растворителя и другое с максимальной концентрацией растворителя.
Для приготовления исходного раствора вещества заданной концентрации невозможно рекомендовать какую-либо единую методику. Например, используют следующую процедуру: в мерную колбу вместимостью 1000 см3 (или 100, 50, 25 см3) вносят 1 г вещества (или другое его количество, в зависимости от заданной концентрации раствора), затем осторожно добавляют небольшое количество дистиллированной воды (см. 5.2) и перемешивают до полного растворения вещества, затем содержимое колбы доводят до метки дистиллированной водой, снова перемешивают. Перед тестированием приготовленный раствор выдерживают при температуре (20 ± 5) °С не менее 2 ч.
Измеряют рН в исходном растворе вещества.
5.3.2.5 Исходные пробы (см. 5.3.2.1 - 5.3.2.3) и исходные растворы веществ (см. 5.3.2.4) должны иметь следующие характеристики:
a) Значение рН 7,0 - 8,3
Если значение рН исходной пробы (раствора) выше указанного предела, то в пробу (раствор) добавляют раствор соляной кислоты молярной концентрацией 1 моль/дм3, если ниже - раствор гидроокиси натрия молярной концентрацией 1 моль/дм3. После этого пробу (раствор) аэрируют с помощью аквариумного компрессора в течение 10 - 20 мин для стабилизации рН.
Примечание - Обычно тестирование должно выполняться без регулировки рН среды после добавления испытуемой пробы. Однако некоторые вещества могут оказывать токсическое действие вследствие повышенной кислотности или щелочности. Для определения токсичности пробы (если она не зависит от рН) регулируют значение рН исходной пробы (исходного раствора) до значения рН питательной среды.
Для исходных проб природной и питьевой воды проводят тестирование при имеющихся значениях рН.
Для исходных проб водных вытяжек из твердых промышленных отходов регулирование рН не допускается.
b) Концентрация растворенного кислорода не ниже 7 мг О2/дм3.
Если концентрация растворенного кислорода исходной пробы ниже указанного значения, пробу аэрируют с помощью аквариумного компрессора.
с) Минерализация менее 6,0 г/дм3, при этом:
- если исходная проба (раствор) имеет минерализацию выше 3,0 г/дм3, то проводят адаптацию культуры водорослей [см. ДБ.3 (приложение ДБ)] на приготовленной питательной среде минерализацией от 1,0 до 5,0 г/дм3,
- если исходная проба (раствор) имеет минерализацию 6,0 г/дм3 и выше, то используют тест-организмы по ГОСТ Р 53910.
Примечание - Зеленые пресноводные одноклеточные водоросли по 5.2 хорошо переносят осолонение (адаптацию к повышенной минерализации) до 6,0 г/дм3.
5.3.2.6 Подготовка анализируемых проб
Анализируемой пробой природной воды является подготовленная по 5.3.2.1 исходная проба природной воды.
Анализируемые пробы сточной воды для предварительного тестирования (см. 5.4.1) готовят следующим способом:
a) проводят разбавление исходной пробы сточной воды следующим способом: в конические колбы вместимостью 250 см3 вносят исходную пробу сточной воды (см. 5.3.2.2) и питательную среду Прата [см. ДА.1.2 (приложение ДА)] в следующих объемах:
- 100 см3 исходной пробы сточной воды (проба без разбавления);
- 50 см3 исходной пробы сточной воды и 50 см3 питательной среды (кратность разбавления: 50 %, в два раза);
- 10 см3 исходной пробы сточной воды и 90 см3 питательной среды (кратность разбавления 10 %, в 10 раз);
- 1 см3 исходной пробы сточной воды и 99 см3 питательной среды (кратность разбавления: 1 %, в 100 раз);
- 0,1 см3 исходной пробы сточной воды и 99,9 см3 питательной среды (кратность разбавления: 0,1 %, в 1000 раз);
b) затем в колбы с разбавленными пробами сточной воды добавляют исходные растворы питательной среды [см. таблицу ДА.1 (приложение ДА)], как указано ниже:
в колбы без разбавления исходной пробы последовательно добавляют исходные растворы питательной среды в следующих объемах: раствор № 1 - 0,2 см3; раствор № 2 - 0,05 см3; раствор № 3 - 0,1 см3; раствор № 4 - 0,1 см3;
в колбы с разбавлением исходной пробы сточной воды в два раза добавляют в той же последовательности (но в два раза меньше) исходные растворы питательной среды, соответственно: 0,1; 0,025; 0,05; 0,05 см3;
в колбы с разбавлением исходной пробы в 10 раз - соответственно: 0,02; 0,005; 0,01; 0,01 см3;
в колбы с разбавлениями исходной пробы в 100 и 1000 раз исходные растворы питательной среды не добавляют.
Анализируемые пробы отработанных буровых растворов, донных отложений, твердых промышленных отходов, грунтов и почв для предварительного тестирования (см. 5.4.1) готовят из их водных вытяжек (см. 5.3.2.3) путем разбавления водных вытяжек исходным раствором питательной среды, аналогично указанным в перечислениях а) и b) для анализируемой пробы сточной воды.
Анализируемые пробы вещества для предварительного тестирования (см. 5.4.1) готовят следующим способом: в конические колбы вместимостью 250 см3 вносят по 100 см3 питательной среды Прата [см. ДА.1.2 (приложение ДА)], затем добавляют рассчитанные объемы исходного раствора вещества (см. 5.3.2.4) для получения заданных концентраций вещества, отвечающих требованиям, установленным в 5.4.1.
5.3.2.7 Измеряют и регистрируют рН с анализируемой пробой.
5.3.3 Если для определения плотности (численности) клеток водорослей (интенсивности флуоресценции) используют прибор (см. 5.2) или, например, исследуемые пробы воды прозрачные, окрашенные или мутные, то для каждой анализируемой пробы готовят в отдельных колбах пробы контроля фона, представляющие собой концентрации анализируемого вещества (разбавлений проб) по 5.3.2.6, но без добавления водорослей (фоновый раствор), которые будут служить фоном при проведении измерений (тестировании).
5.3.4 Подготовку водорослей к тестированию проводят в соответствии с требованиями ДБ.1 (приложение ДБ) с учетом требований 5.3.5.
5.3.5 Проверка физиологической чувствительности тест-организмов
Периодически (не реже одного раза в месяц), а также непосредственно перед тестированием, культуру водорослей в экспоненциальной фазе роста проверяют на физиологическую чувствительность. Для этого определяют эффективную концентрацию (48 ч ЭК50) модельного токсиканта (см. 5.2) в следующей последовательности:
5.3.5.1 Готовят исходный раствор модельного токсиканта массовой концентрацией 1 г/дм3 следующим способом: в мерную колбу вместимостью 1000 см3 вносят 1 г двухромовокислого калия и растворяют в небольшом количестве дистиллированной воды (см. 5.2), затем доводят содержимое колбы до метки дистиллированной водой, тщательно перемешивают.
Срок хранения исходного раствора модельного токсиканта - не более 7 сут.
5.3.5.2 Готовят анализируемые растворы модельного токсиканта (калия двухромовокислого) заданной концентрации в следующей последовательности:
- приготавливают растворы двухромовокислого калия с массовой концентрацией от 0,1 до 2,5 мг/дм3 следующим способом: в семь мерных колб вместимостью 200 см3 вносят небольшое количество питательной среды Прата [см. ДА.1.2 (приложение ДА)], затем добавляют исходный раствор двухромовокислого калия массовой концентрацией 1 г/дм3 (см. 5.3.5.1), соответственно, в первую колбу - 0,02 см3, во вторую колбу - 0,05 см3, в третью колбу - 0,1 см3, в четвертую колбу - 0,2 см3, в пятую колбу - 0,3 см3, в шестую - 0,4 см3, в седьмую - 0,5 см3, доводят содержимое каждой колбы до метки питательной средой и перемешивают. При этом в каждой колбе массовая концентрация приготовленного раствора модельного токсиканта (двухромовокислого калия) составляет соответственно: 0,1; 0,25; 0,5; 1,0; 1,5, 2,0 и 2,5 мг/дм3;
- затем для каждой приготовленной концентрации модельного токсиканта (двухромовокислого калия) готовят в трех колбах вместимостью 100 см3 анализируемые растворы следующим образом: в каждую колбу добавляют по 50 см3 конкретного раствора модельного токсиканта (двухромовокислого калия), после чего вносят определенный объем суспензии водорослей, рассчитанный на объем 50 см3.
Анализируемые растворы двухромовокислого калия каждой концентрации готовят непосредственно перед определением физиологической чувствительности водорослей.
Для приготовления контрольной пробы используют среду Прата [см. ДА.1.2 (приложение ДА)].
Плотность (численность) клеток водорослей в начале тестирования должна находиться в пределах 2,0 ∙ 104 - 2,5 ∙ 104 клеток/см3.
5.3.5.3 Тестирование анализируемых растворов заданных концентраций модельного токсиканта (см. 5.3.5.2) проводят, как указано в 5.4.3, в течение 48 ч.
5.3.5.4 Подсчитывают плотность (численность) клеток водорослей одним из методов, приведенных в приложении ДВ, и на основании полученных результатов определяют по 5.5.4 значение 48 ч ЭК50 модельного токсиканта (двухромовокислого калия), при этом:
- если значение 48 ч ЭК50 данного модельного токсиканта находится в диапазоне от 1,3 до 2,5 мг/дм3, то считают, что подготовленные водоросли пригодны для тестирования;
- если значение 48 ч ЭК50 данного модельного токсиканта не входит в указанный диапазон, то считают, что подготовленные водоросли не пригодны для тестирования. Проверяют соблюдение правильности процедуры тестирования, условия подготовки водорослей к тестированию и, при необходимости, повторяют тестирование с использованием обновленной культуры водорослей.
Пример приведен в приложении ДГ
Примечание - Значение 48 ч ЭК50 раствора модельного токсиканта указывают в протоколе испытаний, имея в виду, что это значение в установленном диапазоне концентраций характеризует токсичность модельного токсиканта только для использованных водорослей, характеризует их физиологическую чувствительность, что позволяет (или не позволяет) проводить тестирование с данными водорослями.
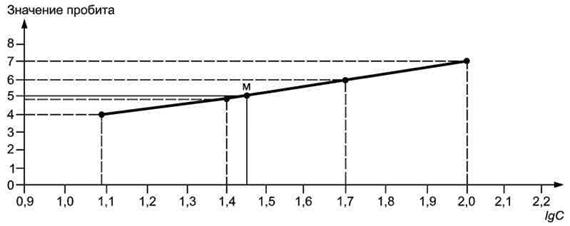
5.3.5.5 Если по результатам тестирования не удалось получить конкретное значение 48 ч ЭК50, то для определения 48 ч ЭК50 модельного токсиканта используют пробит-анализ. Аналогичный пример приведен в приложении ДД.
5.4 Проведение тестирования
Тестирование проводят в два этапа: предварительное и окончательное.
Примечание - Тестирование проб природной и питьевой воды проводят в один этап без предварительного тестирования.
5.4.1 Предварительное тестирование
Предварительное тестирование проводят для установления диапазона разбавлений (концентраций) проб, в пределах которого необходимо провести окончательное тестирование для определения значения 72 ч ЭКР50 (96 ч ЭКР50) или 72 ч ЭК50 в зависимости от анализируемых проб.
При предварительном тестировании исследуют широкую область разбавлений (не менее пяти) сточных вод, водных вытяжек и концентрации растворов вещества, выбираемых в геометрической прогрессии, при этом, как правило, используют коэффициент 10 между разбавлениями (концентрациями).
При предварительном тестировании применяют не менее двух колб на каждую заданную кратность разбавления (концентрацию) анализируемой пробы.
Процедура предварительного тестирования - по 5.4.3.
Пример проведения предварительного тестирования и установления диапазона концентраций вещества, в пределах которого необходимо проводить окончательное тестирование, приведен в приложении ДЕ.
5.4.2 Окончательное тестирование
По результатам предварительного тестирования (см. 5.4.1) по установлению диапазона разбавлений (концентраций) подготавливают анализируемые пробы для окончательного тестирования аналогично подготовке анализируемых проб по 5.3.2.6 для предварительного тестирования, но с использованием коэффициента между разбавлениями (концентрациями), как правило, 2,0 или 2,5.
Для окончательного тестирования используют не менее пяти разбавлений (концентраций) анализируемых проб, при этом кратность разбавления (концентрации) проб необходимо, по возможности, подбирать, основываясь на результатах предварительного тестирования, таким образом, чтобы обеспечить два уровня снижения плотности (численности) клеток водорослей ниже и выше предполагаемого значения ЭК50 (ЭКР50).
Для окончательного тестирования применяют не менее трех колб на каждую заданную кратность разбавления (концентрацию).
Процедура окончательного тестирования - по 5.4.3.
Пример проведения окончательного тестирования и установление значений эффективной концентрации 72 ч ЭК50 для вещества приведен в приложение ДЕ.
Примечание - Исходя из статистических данных, схема тестирования может быть изменена, например, уменьшено количество колб с анализируемыми пробами для каждого разбавления (концентрации) за счет увеличения количества тестируемых разбавлений (концентраций) пробы и сокращения коэффициента между разбавлениями (концентрациями) анализируемой пробы.
5.4.3.1 В каждую колбу (см. 5.4.1 и 5.4.2) вместимостью 250 см3 вносят по 100 см3 анализируемой пробы, затем в каждую колбу добавляют рассчитанный объем суспензии водорослей в экспоненциальной фазе роста (см. 5.3.4), перемешивают, выдерживают 30 мин при температуре и освещенности по 5.4.3.4 и определяют плотность (численность) клеток водорослей, соответствующую началу тестирования, одним из методов, приведенным в приложении ДВ.
Плотность (численность) клеток водорослей в начале тестирования должна находиться в пределах 2,0 ∙ 104 - 2,5 ∙ 104 клеток/см3.
5.4.3.2 Для каждой анализируемой пробы (разбавлений, концентраций) подготавливают контрольную пробу следующим способом: в конические колбы вместимостью 250 см3 вносят по 100 см3 питательной среды Прата [см. ДА.1.2 (приложение ДА)], добавляют по 1,0 см3 суспензии водорослей в экспоненциальной фазе роста (см. 5.3.4), перемешивают, выдерживают 30 мин при температуре и освещенности по 5.4.3.4 и определяют плотность (численность) клеток водорослей соответствующую началу тестирования одним из методов, приведенным в приложении ДВ.
Плотность (численность) клеток водорослей в контрольной пробе должна находиться в пределах 2,0 ∙ 104 - 2,5 ∙ 104 клеток/см3.
Примечания
1 Чтобы получить в начале тестирования плотность (численность) клеток водорослей в пределах от 2,0 ∙ 104 до 2,5 ∙ 104 клеток/см3, достаточно в каждую колбу внести 1,0 см3 суспензии водорослей из культуры, плотность (численность) которой находится в пределах от 2,0 ∙ 106 до 2,5 ∙ 106 клеток/см3.
2 При проведении тестирования контрольные пробы готовят в двух колбах - для предварительного тестирования; в трех колбах - для окончательного тестирования.
5.4.3.3 Колбы с пробами, подготовленными по 5.4.3.1, 5.4.3.2, закрывают ватно-марлевыми пробками, встряхивают и помещают в климатостат.
Примечание - Колбы с водорослями должны быть закрытыми для предотвращения снижения испарения раствора; однако колбы не следует закрывать герметично, чтобы обеспечить воздухообмен, поэтому рекомендуется применять ватно-марлевые пробки.
5.4.3.4 Тестирование (в зависимости от анализируемой пробы) проводят в течение 72 ч или 96 ч (см. 5.1) в климатостате при температуре (20 ± 2) °С и попеременном воздействии света и темноты:
- 16 ч - при равномерном белом освещении в диапазоне от 3000 до 6000 лк на расстоянии 0,35 м от поверхности проб в колбах,
- 8 ч - при отсутствии освещения.
Содержимое каждой колбы при проведении тестирования перемешивают один - два раза в сутки.
Примечание - Клетки водорослей необходимо поддерживать во взвешенном состоянии, путем легкого встряхивания каждой колбы (например, вручную), чтобы обеспечить единый уровень рН и газовый режим в различных слоях пробы.
5.4.3.5 Через каждые 24 ч тестирования определяют плотность (численность) клеток водорослей в каждой колбе (включая контрольную) одним из методов, приведенных в приложении ДВ.
5.4.3.6 После окончания тестирования:
- измеряют рН в каждой колбе с анализируемой и контрольной пробами, при этом значение рН контрольной пробы при тестировании не должно меняться более чем на ±1,5 ед. рН;
- визуально осматривают в каждой колбе состояние культуры водорослей (побурение, посветление, лизис и т.п.).
Любые обнаруженные отклонения регистрируют.
5.4.4 Результаты тестирования считают достоверными, если соблюдаются следующие условия:
a) плотность (численность) клеток водорослей в контрольной пробе в конце тестирования увеличилась не менее чем в три раза по сравнению с плотностью (численностью) клеток водорослей в начале тестирования;
b) коэффициент колебаний темпов роста клеток водорослей в контрольных пробах в каждой из трех колб тестируемой серии анализируемых проб в течение тестирования должен быть не более 5 % относительно среднеарифметического значения плотности (численности) клеток водорослей;
c) уровень рН в контрольной пробе изменился не более чем на 1,5 ед. рН в конце тестирования;
d) токсичность модельного токсиканта находится в пределах, указанных в 5.3.5.4.
Если условия перечислений а) - d) не соблюдаются, то находят причины, устраняют их и тестирование повторяют с новой культурой водорослей.
5.5 Обработка результатов
5.5.1 По результатам подсчета плотности (численности) клеток водорослей по ДВ.1 (приложение ДВ) для каждого заданного разбавления (концентрации) анализируемой пробы по трем колбам, в том числе контрольным, рассчитывают среднеарифметическое значение плотности (численности) клеток водорослей.
5.5.2 Определение токсичности анализируемых проб
5.5.2.1 Токсический эффект анализируемых проб определяют по снижению плотности (численности) клеток водорослей для каждого заданного разбавления (концентрации) анализируемой пробы, относительно контрольной пробы А, %, после 72 ч (96 ч) тестирования и рассчитывают по формуле
где ![]() - среднеарифметическое
значение плотности (численности) клеток водорослей
в контрольной пробе, клеток/см3;
- среднеарифметическое
значение плотности (численности) клеток водорослей
в контрольной пробе, клеток/см3;
![]() - среднеарифметическое значение
плотности (численности) клеток водорослей для
каждого заданного разбавления (концентрации) анализируемой
пробы, клеток/см3.
- среднеарифметическое значение
плотности (численности) клеток водорослей для
каждого заданного разбавления (концентрации) анализируемой
пробы, клеток/см3.
5.5.2.2 Если по результатам тестирования за 72 ч (96 ч) получают данные, указывающие на стимуляцию роста плотности (численности) клеток водорослей, то стимуляцию отмечают в протоколе испытаний и проводят расчет по формуле (2), используя данные для другой продолжительности тестирования (например, за 24 ч), когда эффекта стимуляции роста не наблюдается.
5.5.3 Определение эффективной кратности разбавления (концентрации)
5.5.3.1 Для каждого заданного разбавления (концентрации) анализируемой пробы рассчитывают процент снижения плотности (численности) клеток водорослей после 72 ч (96 ч) тестирования по отношению к плотности (численности) клеток водорослей в контрольной пробе, используя полученные по 5.5.1 среднеарифметические значения и формулу (2).
По полученным значениям процентов снижения плотности (численности) клеток водорослей определяют конкретное значение эффективной кратности разбавления (концентрации) пробы, вызывающее 50 %-ное снижение плотности (численности) клеток водорослей 72 ч ЭКР50 (96 ч ЭКР50) или 72 ч ЭК50 в зависимости от анализируемой пробы.
При необходимости определяют:
- минимальную кратность разбавления (концентрацию) пробы, соответствующую 100 %-ному снижению плотности (численности) клеток водорослей;
- максимальную кратность разбавления (концентрацию) пробы, соответствующую 0 %-ному снижению плотности (численности) клеток водорослей за 72 ч (96 ч).
Примечание - При тестировании сточных вод допускается определение коэффициента разбавления (LID). Коэффициент разбавления выражают в виде обратной величины объемной доли сточных вод в разбавлении, например, если разбавление проведено в соотношении сточная вода:питательная среда соответственно 1:4 (объемная доля 25 %), то коэффициент разбавления равен 4.
Если при разбавлении сточных вод значение замедления роста [снижения плотности (численности)] клеток водорослей анализируемой пробы с наибольшей концентрацией питательной среды отличается менее, чем на 5 % от контрольной пробы, то данное разбавление определяют как «наименьшее неэффективное разбавление».
5.5.3.2 Допускается определять значение эффективной кратности разбавления (концентрации) по замедлению скорости роста клеток водорослей как указано в 6.5.1 - 6.5.4. Аналогичный пример приведен в приложении ДЖ.
5.5.3.3 Если по результатам, полученным по 5.5.3.1 (5.5.3.2), не удалось определить конкретное значение эффективной кратности разбавления (концентрации) пробы, вызывающей 50 %-ное снижение плотности (численности) клеток водорослей за 72 ч (96 ч), то для определения этого значения используют пробит-анализ. Пример приведен в приложении ДД.
5.5.4 Определение степени токсичности анализируемых проб
5.5.4.1 Если значение токсического эффекта анализируемых проб, рассчитанное по формуле (2), составляет менее 10 %, то эффективную кратность разбавления (эффективную концентрацию) анализируемой пробы, при которой плотность (численность) клеток водорослей изменилась относительно контрольной пробы не более 10 % за 72 ч тестирования (или 96 ч тестирования в зависимости от исследуемого объекта), относят к безвредной кратности разбавления (безвредной концентрации).
5.5.4.2 Степень токсичности исследуемых объектов оценивают:
- природной и питьевой воды - по таблице 1;
- донных отложений - по таблице 2;
- отработанных буровых растворов - по таблице 3;
- химической продукции, смесевой химической продукции - по ГОСТ Р 53857, ГОСТ Р 53858; при необходимости оценки других водных растворов веществ - по таблице 4;
- сточной воды, твердых промышленных отходов, почв и грунтов - по стандартам и другим нормативным документам, утвержденным в установленном порядке.
Примечание - Под нормативным документом следует понимать документы, устанавливающие критерии отнесения исследуемых объектов к классу опасности для окружающей природной среды, разработанные в целях реализации федеральных законов (технических регламентов) в данной области.
Таблица 1 - Степень токсичности проб природной и питьевой воды
|
Степень токсичности проб природной и питьевой воды |
Значение токсического эффекта (см. 5.5.2.1) для проб природной и питьевой воды без разбавления А, % |
|
|
Общая |
Детализированная |
|
|
Токсичность отсутствует |
Нетоксичная |
До 10 включ. |
|
Не обладает острой токсичностью |
Слаботоксичная |
Св. 10 » 25 » |
|
Малотоксичная |
» 25 » 35 » |
|
|
Среднетоксичная |
» 35 » 50 » |
|
|
Обладает острой токсичностью |
Высокотоксичная |
» 50 » 100 » |
Таблица 2 - Степень токсичности проб донных отложений
|
Степень токсичности проб водных вытяжек донных отложений |
Значение токсического эффекта (см. 5.5.2.1) для проб донных отложений А, % |
|
|
Общая |
Детализированная |
|
|
Токсичность отсутствует |
Нетоксичная |
До 10 включ. |
|
Не обладает острой токсичностью |
Слаботоксичная |
Св. 10 » 35 » |
|
Среднетоксичная |
» 35 » 50 » |
|
|
Обладает острой токсичностью |
Высокотоксичная |
» 50 » 100 » |
|
Примечание - При необходимости более детальной оценки токсичности загрязненных проб донных отложений степень токсичности определяют по значению кратности разбавления (см. 5.5.3) 96 ч ЭКР50, приведенным в таблице 3. |
||
Таблица 3 - Степень токсичности проб отработанных буровых растворов, загрязненности проб донных отложений
|
Степень токсичности водных вытяжек проб отработанных буровых растворов (донных отложений) |
Значение кратности разбавления (см. 5.5.3) водных вытяжек проб отработанных буровых растворов (донных отложений) 96 ч ЭКР, разы |
|
Нетоксичные |
1,0 |
|
Слаботоксичная |
Менее 100 |
|
Среднетоксичная |
От 100 до 1000 |
|
Высокотоксичная |
» 1000 » 10000 |
|
Гипертоксичная |
Более 10000 |
Таблица 4 - Степень токсичности водных растворов веществ
|
Степень токсичности водных растворов веществ |
Значение эффективной концентрации вещества (см. 5.5.3) 72 ч ЭК50, мг/дм3 |
|
Нетоксичные |
Св. 1000 |
|
Практически нетоксичные |
От 1000 до 100 включ. |
|
Слаботоксичные |
Менее 100 » 10 » |
|
Среднетоксичные |
» 10 » 1,0 » |
|
Высокотоксичные |
» 1,0 » 0,01 » |
|
Гипертоксичные |
» 0,01 |
5.6 Оформление результатов тестирования
5.6.1 Результаты тестирования регистрируют в протоколе испытаний в соответствии с требованиями ГОСТ Р ИСО/МЭК 17025, при этом приводят:
a) ссылку на настоящий стандарт с указанием метода определения;
b) данные, необходимые для идентификации пробы или анализируемого вещества, прошедшего испытания;
c) тест-объекты (тест-организмы): род, вид, метод культивирования;
d) подробное описание тестирования:
- дата начала тестирования и продолжительность;
- для природной воды, сточных вод, водных вытяжек отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов, почв - кратность разбавления, способ и продолжительность хранения проб и, при необходимости, условия, в которых проводились отстаивание, фильтрование, а также размораживание пробы;
- для веществ - анализируемые концентрации, способ их приготовления;
- наименование, состав питательной среды и способ культивирования водорослей;
- значение рН анализируемых проб перед тестированием и после тестирования;
e) токсичность исследуемого объекта с указанием степени токсичности и результатов определения токсического эффекта, эффективной кратности разбавления 72 ч ЭКР50 (96 ч ЭКР50), эффективной концентрации 72 ч ЭК50 в зависимости от анализируемой пробы, метод расчета (при необходимости);
f) обнаруженные негативные эффекты (например, обесцвечивание клеток водорослей), а также другие обстоятельства и условия, не предусмотренные настоящим стандартом, способные повлиять на результат тестирования.
Примечание - Допускается включать в протокол следующую информацию:
- метод определения плотности (численности) клеток водорослей;
- плотность (численность) клеток водорослей в каждой колбе после окончания любой заданной продолжительности тестирования;
- среднеарифметическое значение плотности (численности) клеток водорослей для каждой кратности разбавления (концентрации) в анализируемых и контрольных пробах после окончания любой заданной продолжительности тестирования;
- зависимость между кратностью разбавления (концентрации) пробы и значениями плотности (численности) клеток водорослей в процентах в табличной или графической форме.
5.6.2 Значения 72 ч ЭКР50 (96 ч ЭКР50), 72 ч ЭК50 выражают:
- в процентах (%) или в кратности разбавления (разы) - для природной воды, сточных вод и водных вытяжек;
- в миллиграммах на кубический дециметр (мг/дм3) - для растворов веществ.
6 Метод Б
Сущность метода заключается в регистрации замедления скорости роста клеток зеленых пресноводных одноклеточных водорослей в анализируемой пробе исследуемого объекта относительно контрольной пробы, определении ее токсичности и токсикологических показателей при тестировании в течение 72 ч при постоянном воздействии света и температуры.
Примечание - Для проб сточных вод рекомендуемая процедура тестирования продолжительностью 48 ч приведена в приложении А.
6.2 Средства измерений, вспомогательное оборудование, реактивы, материалы - по 5.2 со следующими уточнениями:
Терморегулируемая камера (например, климатостат) или помещение с регулируемой температурой, обеспечивающее поддержание температуры (23 ± 2) °С и постоянное равномерное белое освещение в диапазоне 6000 - 10000 лк.
Примечание - Для светоизмерительных приборов, калиброванных в других единицах:
- сила света на среднем уровне контрольной пробы должна быть однородной в пределах ±10 % и в диапазоне от 60 до 120 мкВт/м-2с-1 при измерении в фотосинтетически эффективном диапазоне длин волн от 400 до 700 нм. При этом метод измерения и, в частности, тип приемника прибора, оказывают влияние на измеренное значение интенсивности света. Приемники со сферической геометрией (которые реагируют на прямой и отраженный свет под всеми углами над плоскостью измерения и ниже ее), а также «косинусоидальные» приемники (которые реагируют на свет под всеми углами над плоскостью измерения) являются предпочтительными для однонаправленных приемников и дают более высокие значения для многоточечного источника света;
- требуемая освещенность может быть достигнута с использованием от четырех до шести люминесцентных ламп универсального белого (естественного) света, то есть номинальный цвет эталона цвета 2 (цветовая температура 4300 К).
Фильтры мембранные с диаметром пор 0,2 мкм.
Автоклав, обеспечивающий рабочее давление пара (0,11 ± 0,02) МПа и температуру (120 ± 2) °С.
Тест-объекты (тест-организмы): зеленые пресноводные одноклеточные водоросли Desmodesmus subspicatus или Pseudokirchneriella subcapitata (Korshikov) Hindak.
Примечание - Методы культивирования водорослей приведены в ДБ.2 (приложение ДБ).
Модельный токсикант - по 5.2 или 3,5-дихлорфенол, х.ч.
Питательная среда, приготовленная в соответствии с требованиями ДА.2 (приложение ДА).
Аммоний хлористый по ГОСТ 3773, х.ч.
Калий хлористый по ГОСТ 4234, х.ч.
Калий фосфорнокислый однозамещенный по ГОСТ 4198, х.ч.
Кальций хлористый 2-водный, х.ч.
Кобальт хлористый 6-водный по ГОСТ 4525, х.ч.
Магний хлористый 6-водный, по ГОСТ 4209, х.ч.
Марганец (II) хлористый 4-водный по ГОСТ 612, х.ч.
Медь двухлористая 2-водная по ГОСТ 4167, х.ч.
Натрий молибденовокислый 2-водный по ГОСТ 10931, х.ч.
Цинк хлористый по ГОСТ 4529, х.ч.
Кислота борная по ГОСТ 9656, х.ч.
Соль динатриевая этилендиамин-N,N,N',N'-тетрауксусной кислоты 2-водная (трилон Б) по ГОСТ 10652, х.ч.
6.3 Подготовка к тестированию - аналогично 5.3 с использованием питательной среды по ДА.2.2 (приложение ДА) и тест-организмов по 6.2.
Примечание - При необходимости определения физиологической чувствительности водорослей по отношению к модельному токсиканту 3,5-дихлорфенолу ее определяют аналогично модельному токсиканту калию двухромовокислому (см. 5.3.5) в условиях тестирования по 6.4, при этом используют данные, приведенные в таблице ДИ.1 (приложение ДИ).
6.4 Проведение тестирования - аналогично 5.4 со следующими уточнениями.
6.4.1 Тестирование проводят в течение (72 ± 2) ч при температуре (23 ± 2) °С в помещении с регулируемой температурой (или в терморегулируемой камере), при постоянном воздействии равномерного белого освещения в диапазоне 6000 - 10000 лк на расстоянии 0,35 м от поверхности анализируемых проб в колбах, при непрерывном и легком взбалтывании или встряхивании на шейкере анализируемых проб (включая контрольную пробу).
6.4.2 При предварительном тестировании анализируемой пробы используют по одной колбе для каждой заданной кратности разбавления (концентрации) пробы (включая контрольную).
6.4.3 Окончательное тестирование проводят с анализируемыми пробами, которые приготовлены с использованием коэффициента между разбавлениями (концентрациями) не более 3,2 (например, 1,0; 1,8; 3,2; 5,6 и 10,0 мг/дм3).
Примечание - При предположении отсутствия токсичности у анализируемой пробы допускается проводить окончательное тестирование только при максимальной кратности разбавления (концентрации) анализируемой пробы. При этом тестирование проводят не в трех, а в шести колбах.
6.4.4 Количество добавленной во все колбы (включая контрольную пробу) суспензии водорослей в экспоненциальной фазе роста [см. ДБ.2.3 (приложение ДБ)] должно обеспечить начальную плотность (численность) клеток водорослей в пробе не более 104 клеток/см3.
Примечания
1 Начальная плотность (численность) клеток водорослей в начале тестирования должна быть достаточно низкой, чтобы обеспечить экспоненциальный рост в контрольной пробе за период проведения всего тестирования.
2 Определение начальной плотности (численности) клеток водорослей проводят аналогично 5.4.3.1 с учетом условий тестирования по 6.4.1 и подготовки водорослей по ДБ.2.2 (приложение ДБ).
3 Номинальная плотность (численность) клеток водорослей может быть использована в качестве начальной плотности (численности) клеток водорослей, и в таком случае не требуется подсчет (измерение) начальной плотности (численности) клеток водорослей перед тестированием.
6.4.5 Для приготовления контрольной пробы используют питательную среду по ДА.2.2 (приложение ДА).
6.5 Обработка результатов тестирования - по 5.5 с учетом расчетов эффективной кратности разбавления (эффективной концентрации), как указано ниже.
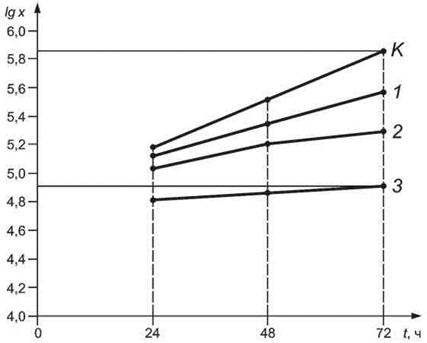
Для каждой кратности разбавления (концентрации) анализируемой пробы (в том числе и контрольной) строят график скорости роста клеток водорослей в виде зависимости логарифма среднеарифметических значений плотности (численности) клеток водорослей от продолжительности тестирования.
6.5.2 Определение скорости роста клеток водорослей
Для каждой кратности разбавления (концентрации) анализируемой пробы рассчитывают скорость роста клеток водорослей µi, клеток/ч, по формуле
где xL - среднеарифметическое значение плотности (численности) клеток водорослей в анализируемой пробе в конце тестирования, клеток/см3;
х0 - среднеарифметическое значение плотности (численности) клеток водорослей в анализируемой пробе в начале тестирования, клеток/см3;
t - продолжительность тестирования, ч.
Аналогично по формуле (3)
рассчитывают среднеарифметическое значение скорости роста клеток водорослей
в контрольной пробе ![]()
6.5.3 Замедление скорости роста клеток водорослей ![]() , %, для каждой заданной кратности разбавления
(концентрации) анализируемой пробы рассчитывают по формуле
, %, для каждой заданной кратности разбавления
(концентрации) анализируемой пробы рассчитывают по формуле
где ![]() - среднеарифметическое
значение скорости роста клеток водорослей в контрольной
пробе, клеток/ч;
- среднеарифметическое
значение скорости роста клеток водорослей в контрольной
пробе, клеток/ч;
![]() - среднеарифметическое значение
скорости роста клеток водорослей в анализируемой
пробе, клеток/ч.
- среднеарифметическое значение
скорости роста клеток водорослей в анализируемой
пробе, клеток/ч.
6.5.4 Определение эффективной кратности разбавления (концентрации)
Для каждой заданной кратности разбавления (концентрации) анализируемой пробы рассчитывают по формуле (4) значение замедления скорости роста клеток водорослей в процентах, с использованием формулы (3) или, используя график скорости роста (см. 6.5.2), определяют значение 72 ч ЭКР50 (72 ч ЭК50) в зависимости от анализируемой пробы.
Пример определения эффективной концентрации вещества по замедлению скорости роста клеток водорослей приведен в приложении ДЖ.
Если по полученным результатам не удалось определить конкретное значение 72 ч ЭКР50 (72 ч ЭК50), то для определения этого значения используют пробит-анализ. Аналогичный пример приведен в приложении ДД.
6.5.5 Результаты тестирования считают достоверными, если соблюдаются следующие условия:
a) плотность (численность) клеток водорослей в контрольной пробе возросла не менее чем в 67 раз через 72 ч тестирования.
Примечание - Такое увеличение плотности (численности) клеток водорослей соответствует скорости роста клеток 1,4 сут-1;
b) коэффициент колебаний темпов роста клеток водорослей в контрольных пробах в каждой из трех колб тестируемой серии анализируемых проб в течение тестирования должен быть не более 5 % относительно среднеарифметического значения плотности (численности) клеток водорослей;
c) уровень рН в контрольной пробе изменился не более чем на 1,5 ед. рН в конце тестирования;
d) токсичность модельного токсиканта находится в пределах, указанных в приложении ДИ.
Для сточных вод дополнительно учитывают результаты, полученные для пробы контроля фона на отсутствие интерферирующего воздействия анализируемой пробы на рост клеток водорослей (см. 5.3.3) в конце тестирования.
Если условия перечислений а) - d) не соблюдаются, то находят причины неудовлетворительных результатов, устраняют их и тестирование проводят с новой культурой водорослей.
6.6 Информация о проведенных межлабораторных испытаниях приведена в приложении ДИ.
6.7 Оформление результатов тестирования - по 5.6.
7 Метод В
7.1 Сущность метода
Сущность метода заключается в регистрации изменения интенсивности флуоресценции клеток зеленых пресноводных одноклеточных водорослей в анализируемой пробе исследуемого объекта относительно контрольной пробы, определении ее токсичности и токсикологических показателей при тестировании в течение 72 ч (96 ч) в условиях переменного воздействия света и постоянной температуры.
Примечания
1 Метод применяют для определения токсичности исследуемого объекта, используя значения быстрой или замедленной флуоресценции клеток водорослей, которая отражает интенсивность фотосинтеза и прямо зависит от плотности (численности) клеток водорослей в анализируемой пробе.
2 Преимущество метода заключается в том, что метод флуоресценции позволяет определять токсичность быстро распадающихся и летучих веществ (в водных растворах веществ, сточной воде или водных вытяжках).
3 Продолжительность тестирования 72 ч указана для определения токсичности и токсикологических показателей анализируемых проб природной и сточной воды, а также анализируемых проб веществ; продолжительность тестирования 96 ч - для определения токсичности и токсикологических показателей анализируемых проб отработанных буровых растворов, твердых промышленных отходов, донных отложений, грунтов и почв.
7.2 Средства измерений, вспомогательное оборудование, реактивы, материалы, тест-объекты (тест-организмы) - по 5.2.
7.3 Порядок подготовки к измерению
7.3.1 Подготовка посуды - по 5.3.1.
7.3.2 Подготовка проб - по 5.3.2.
7.3.3 Подготовка прибора к измерениям - по ДВ.2.2; градуировка прибора - по ДВ.2.3 - ДВ.2.6 (приложение ДВ) для метода А.
7.3.4 Подготовка тест-объектов (тест-организмов) - по ДБ.1.3.1 (приложение ДБ) с учетом требований 7.3.5 и 7.3.6.
7.3.5 Определение объема суспензии водорослей, необходимого для тестирования
7.3.5.1 Непосредственно перед тестированием колбу с подготовленными по ДБ.1.3.1. (приложение ДБ) водорослями закрывают ватно-марлевой пробкой, встряхивают вручную, выдерживают 30 мин при температуре и освещенности по 5.4.3.4, затем снова перемешивают, после чего из колбы автоматической пипеткой переносят в кварцевую кювету прибора объем аликвоты суспензии водорослей, равный объему кварцевой кюветы, затем кювету с аликвотой суспензии водорослей помещают в камеру прибора для измерения интенсивности флуоресценции водорослей.
Порядок проведения измерений - по ДВ.2.7.4 (приложение ДВ).
7.3.5.2 За значение интенсивности флуоресценции суспензии водорослей принимают среднеарифметическое из измеренных значений (за вычетом среднеарифметического из измеренных значений холостой пробы), если абсолютная величина разности между ними не превышает 5 % от среднего значения.
7.3.5.3 На основании полученного среднеарифметического значения интенсивности флуоресценции суспензии водорослей (см. 7.3.5.2) рассчитывают необходимый объем суспензии водорослей для внесения в заданный объем каждой колбы (100 см3) анализируемых разбавлений (концентраций), в том числе и для контрольной пробы, для проведения тестирования.
При этом значение интенсивности флуоресценции клеток водорослей в начале тестирования должно находиться в пределах 0,20 - 0,25, что соответствует плотности (численности) клеток 2,0 ∙ 104 - 2,5 ∙ 104 клеток/см3 (при коэффициенте пересчета 1 ∙ 106 клеток/см3).
Примечание - Коэффициент пересчета, принимают равным 1 ∙ 106 клеток/см3, если значение углового коэффициента (наклона) градуировочной характеристики составляет 0,99 [см. ДВ.2.3, ДВ.2.5 (приложение ДВ)].
7.3.6 Проверка физиологической чувствительности тест-объектов (тест-организмов)
Приготовление растворов модельного токсиканта (двухромовокислого калия) - по 5.3.5.1, 5.3.5.2.
Тестирование анализируемых растворов модельного токсиканта проводят по 5.4.3.4 в течение 48 ч, после чего измеряют по ДВ.2.7.4 (приложение ДВ) интенсивность флуоресценции каждого раствора модельного токсиканта. При этом измерения интенсивности флуоресценции каждой аликвоты (из каждой колбы) каждой концентрации раствора модельного токсиканта проводят не менее трех раз.
Обработка результатов измерений - по 7.5.4 с учетом требований 5.3.5.4. Пример приведен в приложении ДГ (см. таблицу ДГ.2).
Если по результатам тестирования не удалось получить конкретное значение 48 ч ЭК50, то для определения 48 ч ЭК50 модельного токсиканта используют пробит-анализ. Аналогичный пример приведен в приложении ДД.
7.3.7 Приготовление холостой пробы
Холостую пробу готовят следующим образом: в конические колбы вместимостью 250 см3 вносят 100 см3 питательной среды Прата, приготовленной в соответствии с требованиями ДА.1.2 (приложение ДА).
7.3.8 Приготовление пробы контроля фона - по 5.3.3.
Примечание - При тестировании окрашенных или мутных проб может возникнуть мешающее влияние, обусловленное ослаблением светового потока, необходимого для роста клеток водорослей в анализируемой пробе. В таком случае измеряют интенсивность флуоресценции пробы без водорослей (фоновые растворы) и полученное значение вычитают из значения интенсивности флуоресценции, полученного при измерении пробы с водорослями.
7.3.9 Подготовка контрольной пробы
Для каждой пробы анализируемых разбавлений (концентраций) подготавливают контрольную пробу следующим способом: в конические колбы вместимостью 250 см3 вносят по 100 см3 питательной среды Прата [см. ДА.1.2 (приложение ДА)], добавляют по 1,0 см3 суспензии водорослей в экспоненциальной фазе роста (см. 5.3.4), перемешивают, выдерживают 30 мин при температуре и освещенности по 5.4.3.4, затем снова перемешивают, после чего из колбы автоматической пипеткой переносят в кварцевую кювету прибора объем аликвоты контрольной пробы, равный объему кварцевой кюветы, кювету с аликвотой контрольной пробы помещают в камеру прибора для измерения интенсивности флуоресценции водорослей.
Порядок проведения измерений - по ДВ.2.7.4 (приложение ДВ).
Обработка результатов измерений аналогична процедуре, приведенной в 7.3.5.2 (с учетом числа колб, использованных для приготовления контрольных проб для предварительного или окончательного тестирования).
Значение интенсивности флуоресценции клеток водорослей в контрольной пробе в начале тестирования должно находиться в пределах 0,20 - 0,25, что соответствует плотности (численности) клеток 2,0 ∙ 104 - 2,5 ∙ 104 клеток/см3 (коэффициент пересчета равен 1 ∙ 106 клеток/см3).
Примечания
1 С целью получения в начале тестирования плотности (численности) клеток водорослей в пределах от 2,0 ∙ 104 до 2,5 ∙ 104 клеток/см3, достаточно в каждую колбу на 100 мл питательной среды внести 1,0 см3 суспензии водорослей из культуры, плотность (численность) которой находится в пределах от 2,0 ∙ 106 до 2,5 ∙ 106 клеток/см3, что соответствует интенсивности флуоресценции клеток водорослей в пределах 0,20 - 0,25.
2 При проведении тестирования контрольные пробы готовят в двух колбах - для предварительного тестирования; в трех колбах - для окончательного тестирования.
7.4 Проведение измерений
Тестирование подготовленных проб (см. 7.3.2, 7.3.7 - 7.3.9) проводят аналогично требованиям, установленным в 5.4, при этом через каждые 24 ч проводят измерение интенсивности флуоресценции аликвот анализируемых проб, отобранных из каждой колбы, включая контрольные, холостые пробы и, если использовались пробы контроля фона, как указано в ДВ.2.7.4 (приложение ДВ).
Примечание - При необходимости определения токсичности исследуемого объекта, содержащего легколетучие вещества, или если исследуемые вещества быстро распадаются, то допускается оценивать токсичность исследуемых объектов в динамике, проводя измерения интенсивности флуоресценции аликвот анализируемых проб, например, через каждые 15 мин после начала тестирования проб.
Примеры предварительного и окончательного тестирования и определения эффективной концентрации вещества по изменению интенсивности быстрой флуоресценции клеток водорослей приведены в приложении ДК.
7.5 Обработка результатов
7.5.1 При наличии компьютерной системы сбора и обработки информации порядок обработки результатов измерений устанавливают в соответствии с руководством (инструкцией) по эксплуатации прибора.
7.5.2 При отсутствии компьютерной системы сбора и обработки информации обработку результатов проводят следующим образом.
7.5.2.1 Рассчитывают значение интенсивности флуоресценции анализируемой пробы для каждой заданной кратности разбавлений (концентраций), в том числе и контрольной пробы, по формуле
В = Bпр - Bx, (5)
где Впр - среднеарифметическое значение измеренных значений интенсивности флуоресценции аликвоты анализируемой пробы заданной кратности разбавления (концентрации), отн. ед.;
Вх - среднеарифметическое значение измеренных значений интенсивности флуоресценции холостой пробы, отн. ед.
При необходимости из среднеарифметических значений интенсивности флуоресценции каждого заданного разбавления (концентрации), за исключением контрольной пробы, вычитают среднеарифметическое значение интенсивности флуоресценции пробы контроля фона.
За результат измерений интенсивности флуоресценции анализируемой пробы заданной кратности разбавления (концентрации), в том числе и контрольной пробы, принимают среднеарифметическое результатов измерений (для аликвот из двух колб - при предварительном тестировании; из трех колб - при окончательном тестировании), если абсолютная величина разности между ними не превышает 5 % от среднего значения.
7.5.2.2 Токсический эффект А, %, оцениваемый по снижению интенсивности флуоресценции для каждого заданного разбавления (концентрации) анализируемой пробы относительно контрольной пробы, в процентах, рассчитывают по формуле
где Вк - среднеарифметическое значение интенсивности флуоресценции контрольной пробы, рассчитанное с использованием формулы (5), отн. ед.;
В - среднеарифметическое значение интенсивности флуоресценции анализируемой пробы, рассчитанное по формуле (5), отн. ед.
7.5.3 Оценка токсичности - аналогична установленной в 5.5.4 с учетом расчета токсического эффекта по формуле (6).
7.5.4 Определение эффективной кратности разбавления (концентрации) - аналогично 5.5.3 с использованием формулы (6). Пример приведен в приложении ДК.
Если в результате тестирования не удается установить точное значение ЭК50 (ЭКР50), то для его определения применяют пробит-анализ, аналогичный пример приведен в приложении ДД.
7.6 Результаты считают достоверными, если соблюдаются следующие условия:
a) значение интенсивности флуоресценции водорослей в контрольной пробе в конце тестирования увеличилось не менее чем в три раза по сравнению со значением интенсивности флуоресценции водорослей, измеренным в начале тестирования;
b) коэффициент колебаний значений интенсивности флуоресценции водорослей в контрольных пробах в каждой из трех колб в серии анализируемых проб в течение тестирования должен быть не более 5 % относительно их среднеарифметического значения;
c) уровень рН в контрольной пробе изменился не более чем на 1,5 ед. рН в конце тестирования;
d) токсичность модельного токсиканта находится в пределах, указанных в 5.3.5.4.
Если условия перечислений а) - d) не соблюдаются, то находят причины неудовлетворительных результатов, устраняют их и для тестирования используют новую культуру водорослей.
7.7 Оформление результатов - аналогично 5.6.
Приложение А
(рекомендуемое)
Определение
эффективной кратности разбавления сточной воды
при тестировании в течение 48 ч
Метод применяют для проведения тестирования очищенных сточных вод, сточных вод и других водных проб из окружающей среды с использованием различных типов испытательных емкостей.
А.2 Отбор проб и их хранение - по 4.1.
Примечание - Тестирование необходимо провести как можно скорее после отбора проб или после замораживания и оттаивания, фильтрования (центрифугирования).
А.3 Емкости для тестирования водорослей
Для тестирования водорослей используются емкости соответствующего объема, при этом материал и конфигурация емкостей должны выбираться таким образом, чтобы избежать при тестировании:
a) выделения потенциально токсичных веществ;
b) адсорбции компонентов из питательной среды в контрольной пробе;
c) потерь из-за испарения существенных компонентов анализируемых сточных вод;
d) неоднородности освещения между емкостями при тестировании и при обработках результатов тестирования.
Примечание - Наиболее подходящими емкостями для тестирования являются конические колбы вместимостью 250 см3 (см. 5.2).
А.4 Выбор диапазона анализируемых разбавлений (концентраций)
Готовят серию разбавлений пробы анализируемой воды, как описано в А.5. Необходимо, чтобы кратность разбавлений соответствовала геометрической прогрессии, охватывающей требуемый диапазон замедления роста плотности (численности) клеток водорослей. При использовании микрочашек или автоматизированных систем рекомендуется увеличить число анализируемых разбавлений, чтобы обеспечить соответствие этому требованию. Для определения необходимой кратности разбавлений проводят предварительное тестирование для выявления диапазона кратности разбавлений (концентраций).
Используют, по меньшей мере, по три колбы на каждое заданное разбавление (концентрацию), включая контрольную пробу, при этом исследуют пять кратностей разбавлений (концентраций), если отсутствует достаточное обоснование для другого планирования эксперимента. На основании статистических данных можно сократить число колб на каждое заданное разбавление (концентрацию) за счет увеличения числа заданных кратностей разбавлений (концентраций) и уменьшения интервала (коэффициента) между разбавлениями (концентрациями).
А.5 Приготовление анализируемых проб - аналогично 5.3.2.6 с учетом 6.4.3, при этом готовят серию анализируемых проб таким образом, чтобы все пробы имели одни и те же концентрации вводимых питательных веществ и плотность (численность) клеток водорослей. Этого можно достигнуть, например, добавлением в пробу анализируемой воды исходных растворов питательной среды [см. таблицу ДА.2 (приложение ДА)], как указано в ДА.2.2 (приложение ДА), или путем добавления в пробу анализируемой воды соответствующих объемов приготовленной питательной среды [см. ДА.2.2 (приложение ДА)], с последующим добавлением рассчитанных объемов суспензии культуры водорослей. Это позволяет проводить тестирование при разбавлениях (концентрациях) до 98 %.
А.6 Контроль фона - по 5.3.3, при этом в конце тестирования не должно быть интерферирующего воздействия на рост клеток водорослей.
Примечание - Пробы контроля фона (разбавления сточных вод без добавления водорослей) необходимы для определения возможного влияния на результаты подсчета (измерения) плотности (численности) клеток водорослей (см. А.9) и внесения соответствующих поправок на фон или выбора подходящего метода подсчета (измерения).
А.7. Проверка физиологической чувствительности водорослей - по 6.3, при этом, если процедурой тестирования предусмотрено определение плотности (численности) клеток водорослей только по двум измерениям (в начале и конце тестирования) или если в качестве начальной плотности (численности) клеток водорослей используют номинальную плотность (численность) клеток водорослей и определение плотности (численности) клеток водорослей проводят только по подсчету (измерению) в конце тестирования, то тестирование с модельным токсикантом может выполняться по этой упрощенной схеме.
А.8 Тест-объекты (тест-организмы) - по 6.2.
А.9 Подсчет (измерение) плотности (численности) клеток водорослей - по приложению ДВ, при этом методы подсчета плотности (численности) клеток водорослей в камере Горяева (под микроскопом) и электронный подсчет являются предпочтительными (контрольными) методами. Однако могут использоваться другие (косвенные) методы, такие как флуориметрия (см. ДВ.2), а также турбидиметрия или фотометрия, при условии их достаточной чувствительности и довольно хорошей корреляции с плотностью (численностью) клеток водорослей. Если испытуемая проба мутная, рекомендуется флуориметрия вследствие существенно меньшего мешающего влияния мутности пробы.
А.10 Продолжительность тестирования
Продолжительность тестирования должна составлять не менее 48 ч, но может продолжаться до 72 ч.
А.11 Периодичность подсчета (измерений) плотности (численности) клеток водорослей - по 5.4.3.4, при этом для анализируемых проб сточных вод плотность (численность) клеток водорослей допускается подсчитывать (измерять) только в начале и в конце тестирования. Альтернативно допускается использовать номинальную плотность (численность) клеток водорослей в качестве их начальной плотности (численности), в этом случае подсчет (измерение) плотности (численности) клеток водорослей проводят только в конце тестирования.
Значение рН допускается измерять в одной емкости с контрольной пробой в конце тестирования. При проведении тестирования в микрочашках для измерения рН может потребоваться объединение контрольных проб.
А.13 Обработка результатов тестирования - по 6.5
Обработка результатов тестирования по замедлению скорости роста клеток водорослей в процентах (см. 6.5.1 - по 6.5.3) рекомендуется для данного метода тестирования, поскольку оно достаточно независимо от уровня биомассы, условий роста клеток водорослей и продолжительности тестирования.
А.14 Определение значения ЭКР и LID
Значения ЭКР определяют по 6.5.4 и выражают, как указано в 5.6.2.
Результаты также могут быть выражены в виде значения коэффициента разбавления LID (наименьшее неэффективное разбавление) - см. 5.5.3.1.
А.15 Критерии достоверности - по 6.5.5
А.16 Оформление результатов тестирования
В протокол испытаний (см. 5.6.1) дополнительно включают:
- природу испытуемой пробы (сточные воды, очищенные сточные воды, продукт выщелачивания и т.д.) и данные о ее происхождении;
- данные маркировки;
- метод отбора проб, дату отбора, срок хранения до проведения тестирования;
- внешней вид пробы до и после тестирования;
- данные предварительной обработки (осаждение, фильтрование, центрифугирование, регулировка рН).
Приложение ДА
(обязательное)
Приготовление питательной среды
ДА.1 Приготовление питательной среды для методов А и В
ДА.1.1 Приготовление исходных растворов для питательной среды Прата
Исходные растворы № 1 - № 4 для питательной среды Прата готовят на дистиллированной воде (см. 5.2) из реактивов в массовых концентрациях, приведенных в таблице ДА.1.
Исходные растворы хранят при температуре 2 °С - 4 °С не более года.
ДА.1.2 Приготовление питательной среды Прата
Питательную среду Прата готовят следующим способом: в мерную колбу вместимостью 1000 см3 вносят дистиллированной воды до метки, затем переливают в колбу вместимостью 2000 см3 и добавляют по 1 см3 исходных растворов № 1, № 2 и № 3 (см. таблицу ДА.1), перемешивают, плотно закрывают ватно-марлевой пробкой и колпачком, кипятят на водяной бане в течение 15 мин, после чего содержимое охлаждают. После охлаждения через 24 ч добавляют 1 см3 исходного раствора № 4, снова перемешивают, плотно закрывают новой ватно-марлевой пробкой и колпачком.
Таблица ДА.1 - Питательная среда Прата для методов А и В
|
Номер исходного раствора |
Реактив |
Массовая концентрация реактива в исходном растворе, мг/дм3 |
Массовая концентрация реактива в питательной среде, мг/дм3 |
|
1 |
Азотнокислый калий по ГОСТ 4217 (KN03) |
100000 |
100,0 |
|
2 |
Магний сернокислый 7-водный по ГОСТ 4523 (MgSO4 ∙ 7Н2O) |
10000 |
10,0 |
|
3 |
Калий фосфорнокислый двузамещенный 3-водный по ГОСТ 2493 (К2НРO4 ∙ 3Н2O) |
10000 |
10,0 |
|
4 |
Хлорид железа 6-водный по ГОСТ 4147 (FeCl3 ∙ 6Н2O) |
1000 |
1,0 |
Приготовленную питательную среду Прата хранят в условиях, исключающих воздействие света, при температуре (20 ± 5) °С не более одного года.
ДА.2 Приготовление питательной среды для метода Б
ДА.2.1 Приготовление исходных растворов
Исходные растворы № 1 - № 4 для питательной среды готовят на деионизированной воде или воде альтернативной чистоты (см. 5.2). Состав исходного раствора и массовая концентрация реактивов приведены в таблице ДА.2.
Таблица ДА.2 - Питательная среда для метода Б
|
Номер исходного раствора |
Состав раствора |
Массовая концентрация реактива в исходном растворе, мг/дм3 |
Массовая концентрация реактива в питательной среде, мг/дм3 |
|
1 |
Аммоний хлористый по ГОСТ 3773 (NH4Cl) |
1500 |
15,0 |
|
Магний хлористый 6-водный по ГОСТ 4209 (MgCl3 ∙ 6Н2O) |
1200 |
12,0 |
|
|
Кальций хлористый 2-водный (CaCl2 ∙ 2Н2O) |
1800 |
18,0 |
|
|
Магний сернокислый 7-водный по ГОСТ 4523 (MgSO4 ∙ 7Н2O) |
1500 |
15,0 |
|
|
Калий фосфорнокислый однозамещенный по ГОСТ 4198 (КН2РO4) |
160 |
1,6 |
|
|
2 |
Хлорид железа 6-водный по ГОСТ 4147 (FeCl3 ∙ 6Н2O) |
64 |
0,64 |
|
Соль динатриевая этилендиамин-N,N,N',N'-тетрауксусной кислоты 2-водная (трилон Б) по ГОСТ 10652 |
100 |
0,10 |
|
|
3 |
Борная кислота по ГОСТ 9656 (Н3ВO3)* |
185 |
0,185 |
|
Марганец хлористый 4-водный по ГОСТ 612 (MnCl2 ∙ 4Н2O) |
415 |
0,415 |
|
|
Цинк хлористый по ГОСТ 4529 (ZnCl2) |
3,0 |
0,003 |
|
|
Кобальт хлористый 6-водный по ГОСТ 4525 (CoCl2 ∙ 6Н2O) |
1,5 |
0,0015 |
|
|
Медь двухлористая 2-водная по ГОСТ 4167 (CuCl2 ∙ 2Н2O) |
0,01 |
0,0001 |
|
|
Натрий молибденовокислый 2-водный по ГОСТ 10931 (Na2MoO4 ∙ 2Н2O) |
7,0 |
0,007 |
|
|
4 |
Натрий углекислый кислый по ГОСТ 4201 (NaHCO3) |
50000 |
50,0 |
|
* Борную кислоту растворяют при добавлении раствора гидроокиси натрия (NaOH) по ГОСТ 4328 молярной концентрацией 0,1 моль/дм3. |
|||
Приготовленные исходные растворы фильтруют через мембранный фильтр с диаметром пор 0,2 мкм.
Примечание - Исходные растворы № 1 - № 3 допускается стерилизовать в автоклаве при температуре 120 °С в течение 15 мин. Исходный раствор № 4 не стерилизуют в автоклаве, чтобы избежать потерь от разложения натрия углекислого кислого (NaHCO3).
Исходные растворы хранят при температуре 2 °С - 4 °С не более года.
ДА.2.2 Приготовление питательной среды
Питательную среду готовят следующим способом: в мерную колбу вместимостью 1000 см3 вносят около 500 см3 деионизированной воды (см. 5.2), добавляют 10 см3 исходного раствора № 1 и по 1,0 см3 исходных растворов № 2, № 3 и № 4 (см. таблицу ДА.2), после чего мерную колбу доводят до метки деионизированной водой.
Если необходимо автоклавирование раствора питательной среды, то исходный раствор № 4 добавляют после автоклавирования.
Питательную среду хранят в емкости из темного стекла с притертой крышкой (вместимостью до 10 дм3) при температуре (20 ± 2) °С - не более года.
Перед использованием приготовленную питательную среду выдерживают на воздухе в течение 7 ч или аэрируют очищенным воздухом в течение 30 мин с использованием микрокомпрессора. Затем, при необходимости, доводят рН питательной среды до значения (8,1 ± 0,2) путем добавления раствора соляной кислоты молярной концентрацией 1,0 моль/дм3 или раствора гидроокиси натрия молярной концентрацией 1,0 моль/дм3.
Приложение ДБ
(обязательное)
Методы культивирования водорослей
ДБ.1 Культивирование водорослей для методов А и В
ДБ.1.1. Культивирование водорослей Chlorella vulgaruis Beijer и Scenedesmus quadricauda (Turp.) Breb проводят в конических колбах вместимостью 250 см3 на питательной среде Прата [см. ДА.1.2 (приложение ДА)] в условиях по 5.4.3.3.
ДБ.1.2 Обновление культуры водорослей
Периодически в процессе культивирования обновляют культуру водорослей, пересевая ее на свежую питательную среду Прата не реже одного раза в 7 сут.
Обновление культуры водорослей проводят следующим способом: в стерильную колбу вместимостью 250 см3 со свежей питательной средой объемом 150 см3 над пламенем спиртовки вносят 15 - 20 см3 верхнего ростового слоя маточной культуры (содержимое маточной культуры при этом не перемешивают). Затем колбу закрывают стерильной ватно-марлевой пробкой и бумажным колпачком, перемешивают и выдерживают в условиях по 5.4.3.3 (метод А) или по 6.4.1 (метод Б). В процессе культивирования культуру водорослей в колбе периодически перемешивают, встряхивая один - два раза в сутки.
ДБ.1.3 Подготовка водорослей к тестированию
ДБ.1.3.1 Для тестирования культуру водорослей готовят в экспоненциальной фазе роста с заданной плотностью (численностью) клеток следующим способом: за 3 сут до начала тестирования в колбу вместимостью 250 см3 над пламенем спиртовки добавляют 100 см3 питательной среды Прата, вносят, не перемешивая, 20 см3 верхнего ростового слоя водорослей из маточной культуры после культивирования в течение 7 сут (плотность 4 ∙ 106 - 5,0 ∙ 106 клеток/см3). Затем колбу закрывают ватно-марлевой пробкой и колпачком, содержимое перемешивают и выдерживают в условиях по 5.4.3.3 в течение 3 сут. При этом культуру водорослей в колбе периодически перемешивают, встряхивая один - два раза в сутки.
ДБ.1.3.2 Через 3 сут, непосредственно перед тестированием определяют плотность (численность) клеток водорослей в полученной культуре одним из методов, приведенных в приложении ДВ, и рассчитывают объем суспензии водорослей, необходимый для внесения в каждую колбу при тестировании.
При использовании прибора для подсчета плотности (численности) клеток водорослей полученное значение интенсивности флуоресценции в отн. ед. умножают на коэффициент пересчета (см. 7.3.5.3) и получают соответствующую этому значению плотность (численность) клеток [см. ДВ.2 (приложение ДВ)].
ДБ.2 Культивирование водорослей для метода Б
ДБ.2.1. Культивирование водорослей Desmodesmus subspicatus Chodat или Pseudokirchneriella subcapitata (Korshikov) Hindak проводят в конических колбах вместимостью 250 см3 на питательной среде, приготовленной по ДА.2.2 (приложение ДА) в условиях по 6.4.1.
ДБ.2.2 Обновление культуры водорослей - по ДБ.1.2.
ДБ.2.3 Подготовка водорослей к тестированию
ДБ.2.3.1 Для тестирования культуру водорослей готовят в экспоненциальной фазе роста с достаточно низкой плотностью (численностью) клеток водорослей (например, от 5 ∙ 103 до 104 клеток/см3) следующим способом: за 2 - 4 сут до начала тестирования в колбу вместимостью 250 см3 над пламенем спиртовки вносят 700 см3 питательной среды [см. ДА.2.2 (приложение ДА)], добавляют не перемешивая необходимое количество суспензии водорослей из маточной культуры после культивирования (см. ДБ.2.1), для того чтобы получить начальную плотность (численность) клеток водорослей примерно от 5 ∙ 103 до 104 клеток/см3. Затем колбу закрывают ватно-марлевой пробкой и колпачком, содержимое перемешивают и выдерживают в условиях по 6.4.1 в течение 3 сут.
ДБ.2.3.2 Определение плотности (численности) клеток водорослей - по ДБ.1.3.2.
ДБ.3 Адаптация культуры водорослей к минерализации от 3 до 6 г/дм3
ДБ.3.1 Адаптацию культуры водорослей к минерализации исследуемого объекта от 3 до 6 г/дм3 проводят заранее к питательной среде с минерализацией 5 г/дм3 и содержат ее в заданных условиях для культивирования.
Питательную среду с минерализацией 5 г/дм3 готовят на искусственной морской воде по ГОСТ Р 53910.
ДБ.3.2 Адаптацию водорослей проводят в течение 20 сут, постепенно заменяя в культуре водорослей питательную среду по ДА.1 на питательную среду с минерализацией 5 г/дм3.
ДБ.3.3 Через каждые 5 сут меняют соотношение адаптируемой культуры водорослей и питательной среды с минерализацией 5 г/дм3 в последовательности:
ДБ.3.3.1 В стерильную колбу вместимостью 250 см3 над пламенем спиртовки вносят 80 см3 суспензии водорослей в экспоненциальной фазе роста (в возрасте 3 сут) и добавляют 20 см3 питательной среды с минерализацией 5 г/дм3. Культивируют водоросли в течение 5 сут в условиях по 5.4.3.3 - для методов А и В, в условиях по 6.4.1 - для метода Б. При этом общий объем (адаптируемая культура водорослей и питательная среда) должен составлять 100 см3.
ДБ.3.3.2 В стерильную колбу вместимостью 250 см3 над пламенем спиртовки вносят 60 см3 адаптированной по ДБ.3.3.1 культуры водорослей, добавляют 40 см3 питательной среды с минерализацией 5 г/дм3 и культивируют водоросли в условиях по ДБ.3.3.1.
ДБ.3.3.3 В стерильную колбу вместимостью 250 см3 над пламенем спиртовки вносят 40 см3 адаптированной по ДБ.3.3.2 культуры водорослей, добавляют 60 см3 питательной среды с минерализацией 5 г/дм3 и культивируют водоросли в условиях по ДБ.3.3.1.
ДБ.3.3.4 В стерильную колбу вместимостью 250 см3 над пламенем спиртовки вносят 20 см3 адаптированной по ДБ.3.3.3 культуры водорослей, добавляют 80 см3 питательной среды с минерализацией 5 г/дм3 и культивируют водоросли в условиях по ДБ.3.3.1.
ДБ.3.2 Адаптированную по ДБ.3.3.4 культуру водорослей пересевают на свежеприготовленную питательную среду (см. ДБ.3.1) и культивируют в течение 5 сут в условиях по 5.4.3.3 - для методов А и В, по 6.4.1 - для метода Б, после чего проверяют физиологическую чувствительность адаптированной культуры водорослей в соответствии с требованиями 5.3.5.
Примечание - Адаптированная культура водорослей к питательной среде с минерализацией 5 г/дм3 позволяет проводить тестирование исследуемых объектов минерализации от 3 до 6 г/дм3.
Приложение ДВ
(обязательное)
Методы подсчета плотности (численности) клеток водорослей
ДВ.1 Определение плотности (численности) клеток водорослей методом прямого подсчета в камере Горяева
Подсчет плотности (численности) клеток водорослей в камере Горяева (см. рисунок ДВ.1) проводят следующим способом:
Содержимое колбы с водорослями перемешивают вручную, затем пипеткой отбирают суспензию водорослей (аликвоту) и наносят по одной капле на верхнюю и нижнюю части сетки счетной камеры Горяева. Затем камеру накрывают покровным стеклом, которое притирают по бокам до появления колец интерференции.
Примечания
1 Взятую в пипетку каплю суспензии водорослей необходимо очень быстро нанести на поверхность сетки, пока клетки водорослей не успели осесть в нижней части пипетки.
2 Нанесенную на поверхность сетки каплю суспензии водорослей следует быстро накрыть покровным стеклом и притереть его во избежание оседания клеток водорослей из капли.
3 После притирания покровного стекла и при подсчете клеток водорослей под микроскопом необходимо следить за тем, чтобы жидкость под покровным стеклом была распределена равномерно.
4 Камеры Горяева обычно имеют две сетки, разделенные желобком. В таких камерах наносят параллельно две капли суспензии водорослей.
Капли суспензии водорослей наносят не подряд из одной пипетки, а при двукратном взятии суспензии в пипетку из одной и той же колбы.
Через 1 - 2 мин после оседания клеток водорослей камеру Горяева помещают под объектив микроскопа и подсчитывают количество клеток водорослей во всех 25 больших квадратах сетки.
Примечания
1 После подсчета клеток водорослей камеру Горяева сразу же тщательно моют водопроводной водой и протирают мягкой тканью (например, фланелью).
2 Подсчет числа клеток водорослей в камере Горяева рекомендуется проводить при плотности (численности) клеток (1,0 - 2,5) ∙ 106 клеток/см3, так как при большей плотности (численности) клеток водорослей в суспензиях подсчет трудоемок и менее точен.
Допускается при подсчете численности клеток водорослей разбавление суспензии культуры водорослей питательной средой (например, разбавление в 10 раз при большой плотности клеток в исходной культуре, тогда численность клеток, полученную при подсчете в камере Горяева, умножают на коэффициент разбавления 10).
Рисунок ДВ.1 - Счетная камера Горяева
Плотность (численность) клеток водорослей X в 1 см3 суспензии водорослей рассчитывают по формуле
Х = т ∙ 104, (ДВ.1)
где т - суммарное количество клеток водорослей в учтенных больших квадратах сетки;
104 - коэффициент пересчета кубических миллиметров в кубические сантиметры.
Плотность (численность) клеток водорослей подсчитывают в каждой колбе, отбирая по две аликвоты.
За результат подсчета плотности (численности) клеток водорослей принимают среднеарифметическое значение не менее двух определений для каждой заданной кратности разбавления (концентрации) анализируемой пробы, в том числе и контрольной пробы, если абсолютная величина разности между ними не превышает 5 % от среднего значения.
ДВ.2 Определение плотности (численности) клеток водорослей с использованием метода флуориметрии
ДВ.2.1 Приготовление проб
ДВ.2.1.1 Приготовление холостой пробы
Холостую пробу готовят следующим образом: в конические колбы вместимостью 250 см3 вносят 100 см3 питательной среды, приготовленной в соответствии с требованиями приложения ДА (для метода А - питательная среда Прата по ДА.1.2; для метода Б - питательная среда по ДА.2.2).
ДВ.2.1.2 Приготовление пробы контроля фона - по 5.3.3.
Для каждой анализируемой пробы подготавливают пробу контроля фона, представляющую собой концентрацию анализируемого вещества (кратности разбавления) по 5.3.2.6, но без добавления водорослей.
Примечание - При тестировании окрашенных или мутных проб может возникнуть мешающее влияние, обусловленное ослаблением светового потока, необходимого для роста клеток водорослей в анализируемой пробе. В таком случае измеряют интенсивность флуоресценции пробы без водорослей (фоновые растворы) и полученное значение вычитают из значения интенсивности флуоресценции, полученного при измерении пробы с водорослями.
ДВ.2.1.3 Приготовление контрольной пробы Приготовление контрольной пробы проводят
- для метода А - по 5.4.3.2;
- для метода Б - аналогично 5.4.3.2, но с использованием питательной среды по ДА.2.2 (приложение ДА).
ДВ.2.2 Подготовка прибора к измерениям
Прибор готовят к работе в соответствии с руководством (инструкцией) по эксплуатации.
Устанавливают следующие параметры работы прибора:
- температура 20 °С (при наличии термостатирования);
- область длин волн для возбуждения флуоресценции 400 - 500 нм; область длин волн для регистрации интенсивности флуоресценции 650 - 750 нм.
ДВ.2.3 Градуировка прибора
Градуировку прибора выполняют с использованием средств программного обеспечения прибора (или с использованием компьютерных систем обработки данных) с применением градуировочных растворов по ДВ.2.4. При этом коэффициент линейной корреляции полученных градуировочных характеристик должен быть не менее 0,99.
ДВ.2.4 Приготовление градуировочных растворов
Градуировочные растворы готовят следующим образом: подготовленную культуру водорослей (см. приложение ДБ) вносят в колбы вместимостью 250 см3 и разбавляют питательной средой, приготовленной в соответствии с требованиями приложения ДА (для метода А - среда Прата по ДА.1.2, для метода Б - питательная среда по ДА.2.2) в соотношении:
- 50 см3 суспензии водорослей и 50 см3 питательной среды (разбавление в два раза);
- 25 см3 суспензии водорослей и 75 см3 питательной среды (разбавление в четыре раза);
- 16,6 см3 суспензии водорослей и 83,4 см3 питательной среды (разбавление в шесть раз);
- 12,5 см3 суспензии водорослей и 87,5 см3 питательной среды (разбавление в восемь раз);
- 10 см3 суспензии водорослей и 90 см3 питательной среды (разбавление в 10 раз);
- 5 см3 суспензии водорослей и 95 см3 питательной среды (разбавление в 20 раз);
- 2,5 см3 суспензии водорослей и 97,5 см3 питательной среды (разбавление в 40 раз);
- 1,66 см3 суспензии водорослей и 98,34 см3 питательной среды (разбавление в 60 раз);
- 1,25 см3 суспензии водорослей и 98,75 см3 питательной среды (разбавление в 80 раз);
- 1,0 см3 суспензии водорослей и 99 см3 питательной среды (разбавление в 100 раз);
- 0,1 см3 суспензии водорослей и 99,9 см3 питательной среды (разбавление в 1000 раз).
ДВ.2.5 Установление градуировочной характеристики
Колбы с подготовленными по ДВ.2.4 градуировочными растворами закрывают ватно-марлевыми пробками, встряхивают, помещают в люмностат или климатостат и выдерживают 15 мин при температуре (20 ± 2) °С и освещенности 3000 - 6000 лк (для метода А) или (23 ± 2) °С и освещенности 6000 - 10000 лк (для метода Б), после чего содержимое каждой колбы (включая холостую пробу) тщательно перемешивают.
Затем, используя счетную камеру Горяева, под микроскопом подсчитывают (см. ДВ.1) в каждой колбе не менее чем в двух повторностях плотность (численность) клеток водорослей и рассчитывают их среднеарифметическое значение xi. После этого, в соответствии с инструкцией (руководством) по эксплуатации прибора, в каждой соответствующей колбе измеряют не менее трех раз значения интенсивности флуоресценции Вi и подсчитывают среднеарифметическое значение.
Примечание - Измерения флуоресценции необходимо проводить сразу после подсчета клеток каждого заданного разведения (концентрации) в камере Горяева.
По полученным значениям хi и Вi строят градуировочный график в виде функциональной зависимости Вi от xi, используя компьютерную систему сбора и обработки данных.
При отсутствии компьютерных систем сбора и обработки данных функциональную зависимость Вi от Xi устанавливают по угловому коэффициенту (наклону) b (отн. ед.) ∙ см3/клеток, рассчитываемому по формуле
где Xi - плотность (численность) клеток водорослей в i-м градуировочном растворе, клетки/см3;
ΔВi - разница между значениями Вi интенсивности флуоресценции i-го градуировочного раствора за вычетом среднеарифметического значения интенсивности флуоресценции холостой пробы;
i - число использованных градуировочных растворов (см. ДВ.2.4).
Примечание - Градуировочный график должен иметь линейную зависимость, в противном случае следует установить причину, заново приготовить градуировочные растворы и повторить градуировку.
ДВ.2.6 Контроль стабильности градуировочной характеристики
Периодически, но не реже двух раз в год, проводят контроль градуировочной характеристики с использованием градуировочных растворов по ДВ.2.4.
Градуировочную характеристику считают стабильной, если сохраняются угол наклона градуировочного графика и линейная зависимость интенсивности флуоресценции от плотности (численности) клеток градуировочных растворов.
ДВ.2.7 Проведение измерений
ДВ.2.7.1 Определение плотности (численности) клеток водорослей после культивирования
Колбу с подготовленными по приложению ДБ водорослями (для метода А - по ДБ.1.3; для метода Б - по ДБ.2.3), закрывают ватно-марлевой пробкой, встряхивают вручную, выдерживают 30 мин при температуре: (20 ± 2) °С (для метода А) или (23 ± 2) °С (для метода Б) и освещенности: 3000 - 4000 лк (для метода А) или 6000 - 7000 лк (для метода Б), затем снова перемешивают и из колбы автоматической пипеткой переносят в кварцевую кювету прибора аликвоту суспензии водорослей, равную объему кварцевой кюветы, кювету с аликвотой суспензии водорослей помещают в камеру прибора для измерения интенсивности флуоресценции суспензии водорослей.
Порядок проведения измерений - по ДВ.2.7.4.
Определение значений плотности (численности) клеток водорослей - по ДВ.2.8.
ДВ.2.7.2 Определение начальной плотности (численности) клеток водорослей перед тестированием
Конические колбы с пробами, подготовленными по 5.4.3.1 и 5.4.3.2, а также с пробами, подготовленными по ДВ.2.1, закрывают ватно-марлевыми пробками, встряхивают вручную, после чего помещают в климатостат и выдерживают 15 мин при температуре: (20 ± 2) °С (для метода А) или (23 ± 2) °С (для метода Б) и освещенности: 3000 - 4000 лк (для метода А) или 6000 - 7000 лк (для метода Б).
После выдерживания колб в климатостате, каждую колбу (включая колбы с холостой и контрольной пробами) встряхивают вручную. Затем из конкретной колбы отбирают автоматической пипеткой аликвоту пробы, равную объему кварцевой кюветы прибора, кювету с аликвотой пробы помещают в камеру прибора для измерения интенсивности флуоресценции клеток водорослей.
Порядок проведения измерений - по ДВ.2.7.4.
Определение значений плотности (численности) клеток водорослей - по ДВ.2.8.
ДВ.2.7.3 Определение плотности (численности) клеток водорослей после тестирования
После проведения тестирования каждую колбу (включая колбы с холостой и контрольной пробами) встряхивают вручную. Затем из конкретной колбы с пробой отбирают автоматической пипеткой аликвоту пробы, равную объему кварцевой кюветы прибора, кювету с аликвотой пробы помещают в камеру прибора для измерения интенсивности флуоресценции клеток водорослей.
Порядок проведения измерений - по ДВ.2.7.4.
Определение значений плотности (численности) клеток водорослей - аналогично ДВ.2.8.
ДВ.2.7.4 Порядок проведения измерений
Измерения интенсивности флуоресценции клеток водорослей в пробах проводят в соответствии с руководством (инструкцией) по эксплуатации прибора с учетом условий проведения градуировки прибора по ДВ.2.5.
Измерение значений интенсивности флуоресценции водорослей каждой аликвоты пробы проводят не менее трех раз в последовательности:
- измеряют значения интенсивности флуоресценции холостой пробы (см. ДВ.2.1.1);
- измеряют значения интенсивности флуоресценции клеток водорослей контрольной пробы (см. ДВ.2.1.3);
- измеряют значения интенсивности флуоресценции клеток водорослей каждой заданной кратности разбавления (концентрации) анализируемой пробы, начиная с меньших концентраций (больших разбавлений);
- измеряют значения интенсивности флуоресценции пробы контроля фона (см. ДВ.2.1.2).
Примечание - После измерения интенсивности флуоресценции клеток водорослей контрольной пробы и затем после каждого измерения анализируемой концентрации (разбавления) пробы, кювету ополаскивают питательной средой.
ДВ.2.8 Обработка результатов измерений
ДВ.2.8.1 При наличии компьютерной системы сбора и обработки данных порядок обработки результатов измерений устанавливают в соответствии с руководством (инструкцией) по эксплуатации прибора или обработки данных на компьютере.
ДВ.2.8.2 При отсутствии компьютерной системы сбора и обработки информации значение интенсивности флуоресценции аликвоты пробы В рассчитывают по формуле
В = Впр - Вх, (ДВ.3)
где Впр - среднеарифметическое измеренных значений интенсивности флуоресценции клеток водорослей анализируемой пробы, отн. ед.;
Вх - среднеарифметическое измеренных значений интенсивности флуоресценции холостой пробы, отн. ед.
ДВ.2.8.3 Плотность (численность) клеток водорослей Хап, клеток/см3, в аликвоте анализируемой пробы определяют по соответствующей градуировочной характеристике, используя значение В, рассчитанное по формуле (ДВ.3), либо рассчитывают по формуле
где b - угловой коэффициент (наклон) градуировочной характеристики, рассчитанный по формуле (ДВ.2), (отн. ед.) ∙ см3/клеток.
ДВ.2.8.4 Если полученное значение, найденное по ДВ.2.8.3, превышает верхнюю границу диапазона градуировочной характеристики, то анализируемую пробу разбавляют так, чтобы значение в разбавленной пробе укладывалось в диапазон градуировочной характеристики, либо анализируют меньший объем пробы.
ДВ.2.8.5 Плотность (численность) клеток водорослей в анализируемой пробе X, клеток/см3, рассчитывают по формуле
![]() (ДВ.5)
(ДВ.5)
где Хап - плотность (численность) клеток водорослей в аликвоте анализируемой пробы, рассчитанная по формуле (ДВ.4), клеток/см3;
Vм.к - вместимость мерной колбы, использованной для подготовки анализируемой пробы, см3;
Vпр - объем аликвоты анализируемой пробы, см3;
f - коэффициент разбавления анализируемой пробы, при этом, если пробу не разбавляли, то f принимают равным единице, если разбавляли (см. ДВ.2.8.4), то f рассчитывают по формуле
![]() (ДВ.6)
(ДВ.6)
где Vк - вместимость мерной колбы, использованной при разбавлении анализируемой пробы, см3;
Va - объем аликвоты анализируемой пробы, взятый для разбавления, см3.
ДВ.2.8.6 За результат измерений плотности (численности) клеток водорослей принимают среднеарифметическое результатов не менее двух определений, если абсолютная величина разности между ними не превышает 5 % от среднего значения при доверительной вероятности 95 %.
ДВ.3 Для определения плотности (численности) клеток водорослей допускается использовать турбодиметрию и фотометрию, при условии их достаточной чувствительности и корреляции с плотностью (численностью) клеток водорослей. При этом используемый прибор должен быть способен измерять такие низкие плотности (численности) клеток водорослей как 104 клеток/см3, а также отличать эффект роста плотности (численности) клеток водорослей от эффекта мешающего воздействия, например, присутствия твердых частиц и цвета пробы. Спектрофотометры обладают достаточной чувствительностью для измерения плотности (численности) клеток водорослей 104 клеток/см3 при достаточной длине оптического пути (до 10 см), однако этот метод особенно чувствителен к мешающему влиянию суспендированного материала и окрашенных веществ при низких плотностях клеток водорослей. Для мутных проб предпочтительна флуориметрия (см. ДВ.2).
Приложение ДГ
(справочное)
Пример определения 48 ч ЭК50 модельного токсиканта
ДГ.1 Результаты определения физиологической чувствительности одноклеточных водорослей Scenedesmus quadricauda (Turp) Breb в растворе модельного токсиканта (калий двухромовокислый) приведены для метода А - в таблице ДГ.1, для метода В - в таблице ДГ.2.
Таблица ДГ.1 - Результаты тестирования модельного токсиканта для метода А
|
Продолжительность тестирования, ч |
Массовая концентрация раствора модельного токсиканта, мг/дм3 |
Плотность (численность) клеток водорослей, п ∙ 104 клеток/см3, подсчитанная после тестирования, в колбах |
Среднеарифметическое значение плотности (численности) клеток водорослей, п ∙ 104 клеток/см3 |
Снижение плотности (численности) клеток водорослей, % |
||
|
№ 1 |
№ 2 |
№ 3 |
||||
|
48 |
0 (контрольная проба) |
7,0 |
7,2 |
7,1 |
7,1 |
- |
|
0,10 |
7,1 |
7,0 |
7,2 |
7,1 |
0 |
|
|
0,25 |
6,4 |
7,1 |
6,7 |
6,7 |
6 |
|
|
0,50 |
6,2 |
6,1 |
6,0 |
6,1 |
14 |
|
|
1,00 |
4,9 |
4,7 |
4,8 |
4,8 |
32 |
|
|
1,50 |
3,5 |
3,7 |
3,6 |
3,6 |
50 |
|
|
2,00 |
2,5 |
2,6 |
2,4 |
2,5 |
65 |
|
|
2,50 |
0,5 |
0,3 |
0,4 |
0,4 |
94 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение плотности (численности) клеток водорослей недопустимо (см. 5.4.4). В контрольной пробе установлено увеличение плотности (численности) клеток водорослей по сравнению с плотностью (численностью) клеток водорослей, соответствующей началу тестирования, в 3,6 раза. 2 Снижение плотности (численности) клеток водорослей рассчитано по 5.5.3.1 настоящего стандарта. |
||||||
Таблица ДГ.2 - Результаты тестирования модельного токсиканта для метода В
|
Продолжительность тестирования, ч |
Массовая концентрация раствора модельного токсиканта, мг/дм3 |
Среднеарифметическое измеренных значений интенсивности флуоресценции клеток водорослей, отн. ед., после тестирования, в колбах |
Среднеарифметическое значение интенсивности флуоресценции клеток водорослей, отн. ед. |
Снижение интенсивности флуоресценции клеток водорослей, % |
||
|
№ 1 |
№ 2 |
№ 3 |
||||
|
48 |
0 (контрольная проба) |
0,70 |
0,72 |
0,71 |
0,71 |
- |
|
0,10 |
0,70 |
0,70 |
0,72 |
0,71 |
0 |
|
|
0,25 |
0,64 |
0,71 |
0,67 |
0,67 |
6 |
|
|
0,50 |
0,62 |
0,61 |
0,60 |
0,61 |
14 |
|
|
1,00 |
0,49 |
0,47 |
0,48 |
0,48 |
32 |
|
|
1,50 |
0,35 |
0,37 |
0,36 |
0,36 |
50 |
|
|
2,00 |
0,25 |
0,26 |
0,24 |
0,25 |
65 |
|
|
2,50 |
0,05 |
0,03 |
0,04 |
0,04 |
94 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение значений интенсивности флуоресценции клеток водорослей недопустимо (см. 7.6). В контрольной пробе установлено увеличение значений интенсивности флуоресценции клеток водорослей по сравнению со значениями интенсивности флуоресценции клеток водорослей, соответствующей началу тестирования, в 3,6 раза. 2 Снижение интенсивности флуоресценции клеток водорослей рассчитано в соответствии с требованиями 7.5.4 настоящего стандарта с использованием формулы (6). |
||||||
ДГ.2 По результатам тестирования модельного токсиканта, приведенным в таблицах ДГ.1 и ДГ.2, 50 %-ное снижение плотности (численности) клеток водорослей (см. таблицу ДГ.1) [50 %-ное снижение интенсивности флуоресценции водорослей (см. таблицу ДГ.2)] за 48 ч зарегистрировано в концентрации 1,5 мг/дм3, которая входит в диапазон концентраций, указанный в 5.3.5.4 настоящего стандарта. Следовательно, водоросли пригодны для тестирования.
Приложение ДД
(обязательное)
Пример обработки результатов тестирования с использованием пробит-анализа
ДД.1 Если по результатам тестирования не зарегистрировано конкретное значение эффективной кратности разбавления (концентрации) пробы, то результаты тестирования обрабатывают с применением метода математической статистики - пробит-анализа. Значения пробитое, соответствующие снижению плотности (численности) клеток водорослей в диапазоне от 0 % до 99 %, приведены в таблице ДД.1.
Таблица ДД.1
|
Снижение плотности (численности) клеток водорослей, % |
Значение пробитов |
|||||||||
|
0 |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
|
0 |
- |
2,67 |
2,95 |
3,12 |
3,25 |
3,35 |
3,45 |
3,52 |
3,59 |
3,66 |
|
10 |
3,72 |
3,77 |
3,82 |
3,83 |
3,92 |
3,96 |
4,01 |
4,05 |
4,08 |
4,12 |
|
20 |
4,16 |
4,19 |
4,23 |
4,26 |
4,29 |
4,33 |
4,36 |
4,39 |
4,42 |
4,45 |
|
30 |
4,48 |
4,50 |
4,53 |
4,56 |
4,59 |
4,61 |
4,64 |
4,67 |
4,69 |
4,72 |
|
40 |
4,75 |
4,77 |
4,80 |
4,82 |
4,85 |
4,87 |
4,90 |
4,92 |
4,95 |
4,97 |
|
50 |
5,00 |
5,03 |
5,05 |
5,08 |
5,10 |
5,13 |
5,15 |
5,18 |
5,20 |
5,23 |
|
60 |
5,25 |
5,28 |
5,31 |
5,33 |
5,36 |
5,39 |
5,4 |
5,44 |
5,47 |
5,50 |
|
70 |
5,52 |
5,55 |
5,58 |
5,61 |
5,64 |
5,67 |
5,71 |
5,74 |
5,77 |
5,81 |
|
80 |
5,84 |
5,88 |
5,92 |
5,95 |
5,99 |
6,04 |
6,08 |
6,13 |
6,18 |
6,23 |
|
90 |
6,28 |
6,34 |
6,41 |
6,48 |
6,55 |
6,64 |
6,75 |
6,88 |
7,05 |
7,33 |
ДД.2. Результаты тестирования по определению эффективной кратности разбавления пробы методом пробит-анализа на примере сточной воды приведены в таблице ДД.2.
Таблица ДД.2 - Пример результатов тестирования пробы сточной воды методом пробит-анализа
|
Кратность разбавления сточных вод С, % |
Десятичный логарифм кратности разбавления (lg С) |
Снижение плотности (численности) клеток водорослей, % |
Значения пробитов по таблице ДД.1 |
|
3,12 |
0,494 |
0 |
- |
|
6,25 |
0,796 |
0 |
- |
|
12,50 |
1,097 |
19 |
4,72 |
|
25,00 |
1,398 |
43 |
4,82 |
|
50,00 |
1,699 |
85 |
6,04 |
|
100,00 |
2,000 |
97 |
6,88 |
|
Примечание - Данные, приведенные в таблице, получены в результате тестирования сточной воды по методу А в течение 72 ч. |
|||
ДД.3 По значениям пробитое и десятичных логарифмов кратности разбавлений (см. таблицу ДД.2), строят график линейной зависимости, откладывая по оси ординат значения пробитое, по оси абсцисс - значения десятичных логарифмов кратности разбавлений концентраций (lg С) анализируемой пробы.
Пример построения графика линейной зависимости на примере анализируемой пробы сточной воды приведен на рисунке ДД.1.
Рисунок ДД.1 - График линейной
зависимости значений пробитое от lg С
анализируемой пробы сточной воды
ДД.4 На графике (см. рисунок ДД.1) на оси ординат из точки, соответствующей значению пробита пять, что соответствует 50 %-ному снижению плотности (численности) клеток водорослей, проводят прямую параллельно оси абсцисс до пересечения с графиком. Из точки пересечения прямой с графиком (точка М) опускают перпендикуляр на ось абсцисс и получают значение lg С (равно 1,46), соответствующее 72 ч ЭКР50.
Используя таблицу антилогарифмов, определяют соответствующее значению lg С (1,46) значение процентной концентрации (равно 28,84 %). Затем устанавливают значение кратности разбавления 72 ч ЭКР50, соответствующее 50 %-ному снижению плотности (численности) клеток водорослей, которое равно 3,47 раза.
Аналогично устанавливают значение ЭКР10 (безвредную кратность разбавления), при этом получают значение lg С (равно 1,09) и, используя таблицу антилогарифмов, определяют соответствующее значению lg С (1,09), значение процентной концентрации, равное 12,30 % (что соответствует кратности разбавления 8,13 раза).
Приложение ДЕ
(справочное)
ДЕ.1 Пример проведения предварительного тестирования
Пример для выбора диапазона концентраций вещества, в пределах которого необходимо провести окончательное тестирование, по результатам предварительного тестирования по 5.4.1 настоящего стандарта, приведен в таблице ДЕ.1.
Таблица ДЕ.1 - Пример результатов предварительного тестирования
|
Продолжительность тестирования, ч |
Массовая концентрация раствора вещества, мг/дм3 |
Плотность (численность) клеток водорослей, п ∙ 104 клеток/см3, подсчитанная после тестирования в колбах |
Среднеарифметическое значение плотности (численности) клеток водорослей, п ∙ 104 клеток/см3 |
Снижение плотности (численности) клеток водорослей, % |
|
|
№ 1 |
№ 2 |
||||
|
72 |
0,0 (контрольная) |
7,40 |
7,30 |
7,35 |
- |
|
0,1 |
7,30 |
7,40 |
7,35 |
0 |
|
|
1,0 |
5,80 |
5,90 |
5,85 |
20 |
|
|
10,0 |
0,65 |
0,67 |
0,66 |
91 |
|
|
100,0 |
0,00 |
0,00 |
0,00 |
100 |
|
|
1000,0 |
0,00 |
0,00 |
0,00 |
100 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение плотности (численности) клеток водорослей недопустимо (см. 5.4.4). В контрольной пробе установлено увеличение плотности (численности) клеток водорослей по сравнению с плотностью (численностью) клеток водорослей, соответствующей началу тестирования, в 3,7 раза. 2 Снижение плотности (численности) клеток водорослей рассчитано по 5.5.3.1 настоящего стандарта. |
|||||
Из данных таблицы ДЕ.1 следует, что диапазон концентраций вещества, в пределах которого необходимо проводить окончательное тестирование, составляет от 0,1 до 10,0 мг/дм3.
ДЕ.2 Пример проведения окончательного тестирования
Результаты проведения окончательного тестирования по 5.4.2 настоящего стандарта приведены в таблице ДЕ.2.
Таблица ДЕ.2 - Пример результатов окончательного тестирования
|
Продолжительность тестирования, ч |
Массовая концентрация раствора вещества, мг/дм3 |
Плотность (численность) клеток водорослей, п ∙ 104 клеток/см3, подсчитанная после тестирования в колбах |
Среднеарифметическое значение плотности (численности) клеток водорослей, п ∙ 104 клеток/см3 |
Снижение плотности (численности) клеток водорослей, % |
||
|
№ 1 |
№ 2 |
№ 3 |
||||
|
72 |
0,00 (контрольная) |
9,8 |
9,9 |
9,7 |
9,8 |
- |
|
0,10 |
9,7 |
9,8 |
9,9 |
9,8 |
0 |
|
|
0,25 |
9,2 |
9,4 |
9,3 |
9,3 |
5 |
|
|
0,50 |
8,8 |
8,7 |
8,9 |
8,8 |
10 |
|
|
1,00 |
7,7 |
7,8 |
7,6 |
7,7 |
21 |
|
|
2,50 |
5,4 |
5,5 |
5,3 |
5,4 |
45 |
|
|
5,00 |
1,1 |
1,0 |
0,9 |
1,0 |
90 |
|
|
7,50 |
0,0 |
0,0 |
0,0 |
0 |
100 |
|
|
10,00 |
0,0 |
0,0 |
0,0 |
0 |
100 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение плотности (численности) клеток водорослей недопустимо (см. 5.4.4). В контрольной пробе установлено увеличение плотности (численности) клеток водорослей по сравнению с плотностью (численностью) клеток водорослей, соответствующей началу тестирования, в 4,9 раза. 2 Снижение плотности (численности) клеток водорослей рассчитано по 5.5.3.1 настоящего стандарта. |
||||||
Из данных таблицы ДЕ.2 видно, что не зарегистрированы значения массовой концентрации вещества, которые соответствуют 50 %-ному снижению плотности (численности) клеток водорослей при тестировании в течение 72 ч, поэтому 72 ч ЭК50 определяют, используя пробит-анализ аналогично примеру, приведенному в приложении ДД, и находят значение 72 ч ЭК50, равное 2,78 мг/дм3.
Из данных таблицы ДЕ.2 видно, что 10 %-ному снижению плотности (численности) клеток водорослей при тестировании в течение 72 ч (72 ч ЭКЮ) соответствует значение массовой концентрации вещества 0,5 мг/дм3.
Приложение ДЖ
(справочное)
Пример
определения эффективной концентрации вещества
по замедлению скорости роста клеток водорослей
ДЖ.1 По результатам тестирования анализируемой пробы и подсчета плотности (численности) клеток водорослей каждые 24 ч на протяжении 72 ч тестирования в каждой из колб для каждой заданной концентрации вещества и контрольной пробы рассчитывают среднеарифметические значения плотности (численности) клеток водорослей XL, клеток/см3, и определяют соответствующие им значения логарифма (lg XL).
Пример обработки результатов тестирования анализируемой пробы вещества приведен в таблице ДЖ.1.
Таблица ДЖ.1
|
Массовая концентрация вещества Y, мг/дм3 |
Среднеарифметическое значение плотности (численности) клеток водорослей, подсчитанное после тестирования анализируемой пробы вещества в течение |
|||||
|
24 ч |
48 ч |
72 ч |
||||
|
XL, клеток/см3 |
lg XL |
XL, клеток/см3 |
lg XL |
XL, клеток/см3 |
lg XL |
|
|
0,0 (контрольная проба) |
15,0 ∙ 104 |
5,18 |
31,5 ∙ 104 |
5,50 |
67,2 ∙ 104 |
5,83 |
|
1,0 |
13,2 ∙ 104 |
5,12 |
21,8 ∙ 104 |
5,34 |
36,3 ∙ 104 |
5,56 |
|
2,5 |
10,7 ∙ 104 |
5,03 |
15,9 ∙ 104 |
5,20 |
19,4 ∙ 104 24 |
5,29 |
|
5,0 |
6,6 ∙ 104 |
4,82 |
7,2 ∙ 104 |
4,86 |
8,1 ∙ 104 |
4,91 |
|
Примечание - Начальная плотность (численность) клеток водорослей в начале тестирования Х0 = 104 клеток/см3, lgХ0 = 4,00. |
||||||
ДЖ.2 Замедление скорости роста клеток водорослей в процентах определяют одним из способов:
- графическим методом (см. ДЖ.2.1);
- расчетным методом (см. ДЖ.2.2).
ДЖ.2.1 Графический метод определения замедления скорости роста клеток водорослей
На основании полученных результатов (см. таблицу ДЖ.1) строят график скорости роста клеток водорослей для контрольной пробы и каждой заданной кратности разбавления (концентрации) анализируемой пробы в виде зависимости логарифма плотности (численности) клеток (lg xL) от продолжительности тестирования, откладывая на оси ординат значение lg xL, а на оси абсцисс - продолжительность тестирования (t, ч).
Пример графика скорости роста клеток водорослей Pseudokirchneriella subcapitata (Korshikov) Hindak для контрольной пробы и каждой заданной концентрации вещества анализируемой пробы по результатам тестирования в течение 72 ч (см. таблицу ДЖ.1) приведен на рисунке ДЖ.1.
Замедление скорости роста клеток
водорослей ![]() , %, после 72 ч
тестирования определяют графически для каждой
заданной концентрации вещества анализируемой пробы
относительно контрольной пробы следующим образом:
, %, после 72 ч
тестирования определяют графически для каждой
заданной концентрации вещества анализируемой пробы
относительно контрольной пробы следующим образом:
a) на ось ординат из точки, соответствующей значению 72 ч логарифма скорости роста клеток водорослей в контрольной (lg XL) и в анализируемой пробе (lg XJ каждой кратности разбавления (концентрации), проводят прямые линии параллельно оси абсцисс до пересечения с осью ординат (например, см. рисунок ДЖ.1 для линии К и линии З);
b) рассчитывают разность между значениями логарифмов для контрольной пробы (lg XК) и анализируемых проб (lg XL).
|
К - скорость роста клеток водорослей в контрольной пробе; 1 - скорость роста клеток водорослей в анализируемой пробе при Y = 1,0 мг/дм3; 2 - скорость роста клеток водорослей в анализируемой пробе при Y = 2,5 мг/дм3; 3 - скорость роста клеток водорослей в анализируемой пробе при Y = 5,0 мг/дм3 |
Рисунок ДЖ.1 - Пример
графика среднеарифметических значений скорости роста
клеток водорослей Pseudokirchneriella subcapitata (Korshikov) Hindak в контрольной
пробе и при различных концентрациях вещества
в течение тестирования
Например, за 72 ч (см. рисунок ДЖ.1) значение lg XK для контрольной пробы (линия К) равно 5,83, для анализируемой пробы концентрацией Y = 5,0 мг/дм3 (линия 3) значение lg XL равно 4,91; разность этих логарифмов ΔХ3 составляет 0,92;
c) рассчитывают среднюю скорость роста клеток водорослей в контрольной пробе за 72 ч по разности между значениями lg ХК в конце тестирования и в начале тестирования. Например, значение lg XK (см. рисунок ДЖ.1) в конце тестирования равно 5,83, а в начале тестирования равно 4,0 (см. таблицу ДЖ.1). Разность этих логарифмов ΔХК составляет 1,83, что соответствует средней скорости роста клеток водорослей в контрольной пробе;
d) рассчитывают замедление средней скорости
роста клеток водорослей ![]() , %,
для каждой заданной кратности разбавления (концентрации)
относительно контрольной пробы по формуле
, %,
для каждой заданной кратности разбавления (концентрации)
относительно контрольной пробы по формуле
где ![]() - значение
разности логарифмов контрольной пробы и анализируемой
пробы, полученное по перечислению b);
- значение
разности логарифмов контрольной пробы и анализируемой
пробы, полученное по перечислению b);
![]() - значение
разности логарифмов для контрольной пробы, полученное
по перечислению с). Например, используя формулу
(ДЖ.1) для линии
3, замедление скорости роста клеток водорослей
в процентах относительно контрольной пробы (линия
К) составляет
- значение
разности логарифмов для контрольной пробы, полученное
по перечислению с). Например, используя формулу
(ДЖ.1) для линии
3, замедление скорости роста клеток водорослей
в процентах относительно контрольной пробы (линия
К) составляет
![]() (ДЖ.2)
(ДЖ.2)
таким образом получаем, что замедление средней скорости роста клеток водорослей на 50 % за 72 ч тестирования соответствует концентрации вещества Y = 5,0 мг/дм3 анализируемой пробы.
Примечание - Если в контрольной пробе отмечается снижение скорости роста клеток водорослей в конце тестирования, то скорость роста клеток водорослей в одной из заданных концентраций в анализируемой пробе может не отличаться от скорости роста в контрольной пробе. Это ошибочно указывает на отсутствие воздействия. В этом случае расчеты скорости роста и замедления скорости роста клеток водорослей проводят на основе последних измерений (например, через 24 ч).
Увеличение скорости роста клеток водорослей в анализируемой пробе заданной кратности разбавления (концентрации) относительно контрольной пробы указывает на стимулирующий эффект, что отмечают в протоколе испытаний.
ДЖ.2.2 Расчетный метод определения замедления скорости роста клеток водорослей
По полученным результатам тестирования (например,
см. таблицу ДЖ.1),
замедление скорости роста клеток водорослей,
![]() , %,
рассчитывают по формуле (4) с учетом использования формулы
(3) настоящего стандарта
для каждого заданного разбавления (концентрации) анализируемой пробы
и контрольной пробы. При этом учитывают
начальную плотность (численность) клеток водорослей
в начале тестирования Х0.
, %,
рассчитывают по формуле (4) с учетом использования формулы
(3) настоящего стандарта
для каждого заданного разбавления (концентрации) анализируемой пробы
и контрольной пробы. При этом учитывают
начальную плотность (численность) клеток водорослей
в начале тестирования Х0.
ДЖ.2.3 Пример определения скорости роста и замедления скорости роста клеток водорослей по ДЖ.2.1 или ДЖ.2.2 приведен в таблице ДЖ.2.
Таблица ДЖ.2 - Пример результатов тестирования
|
Массовая концентрация вещества Y, мг/дм3 |
Среднеарифметическое значение скорости роста клеток водорослей в конце тестирования µi, клеток/ч |
Замедление скорости роста
клеток водорослей в конце тестирования |
|
0 (контрольная проба) |
0,0254 |
- |
|
1,0 |
0,0217 |
15 |
|
2,5 |
0,0179 |
30 |
|
5,0 |
0,0126 |
50 |
|
Примечания 1 Начальная плотность (численность) клеток водорослей в начале тестирования (Х0) составляет 104 клеток/см3, lgХ0 = 4,0. 2 Знак «-», проставленный для контрольной пробы, означает, что снижение плотности (численности) клеток водорослей недопустимо (см. 5.4.4). |
||
ДЖ.3 Определение эффективной концентрации вещества
По результатам, полученным по ДЖ.2.1 или ДЖ.2.2 по значению замедления скорости роста клеток водорослей, определяют значение эффективной концентрации вещества, соответствующее 50 %-ному замедлению скорости роста клеток водорослей 72 ч ЭК50 (72 ч ЭК50). Пример приведен в таблице ДЖ.2.
Из примера, приведенного в таблице ДЖ.2, видно, что концентрация вещества, которая соответствует 50 %-ному замедлению скорости роста клеток водорослей при тестировании в течение 72 ч ЭК50, равна 5,0 мг/дм3.
Приложение ДИ
(справочное)
ДИ.1 Результаты тестирования, проведенные в 1980 - 1981 годах при межлабораторных испытаниях модельных токсикантов, представлены в таблице ДИ.1.
Таблица ДИ.1
|
Число лабораторий |
Число выбросов |
Среднеарифметическое значение ЭК50 (ЕС50), мг/дм3 |
Среднеквадратическое отклонение, мг/дм3 |
Коэффициент вариации, % |
|
|
Тест-организм: Desmodesmus subspicatus Chodat |
|||||
|
Бихромат калия |
20 |
4 |
0,84 |
0,12 |
14 |
|
3,5-дихлорфенол |
18 |
2 |
6,42 |
2,38 |
37 |
|
Тест-организм: Pseudokirchneriella subcapitata (Korshikov) Hindak |
|||||
|
Бихромат калия |
9* |
4 |
1,19 |
0,27 |
23 |
|
3,5-дихлорфенол |
9* |
4 |
3,38 |
1,30 |
38 |
|
* Высокое число выбросов при тестировании с Pseudokirchneriella subcapitata происходит из-за использования разных питательных сред (с различными значениями рН). Примечание - Под коэффициентом вариации понимают стандартное отклонение в относительных единицах относительно общего среднеарифметического значения. |
|||||
Примечание - При межлабораторных испытаниях тестирования контрольных проб средние скорости роста водорослей составили 1,74 сут-1 (коэффициент вариации 27 %) -для Desmodesmus subspicatus и 1,91 сут-1 (коэффициент вариации 23 %) - для Pseudokirchneriella subcapitata.
Приложение ДК
(справочное)
ДК.1 Результаты измерений по 7.4 настоящего стандарта на основе предварительного тестирования (см. 5.4.1) для выбора диапазона концентраций вещества, в пределах которого необходимо провести окончательное тестирование, приведены в таблице ДК.1
Таблица ДК.1 - Пример результатов измерений на основе предварительного тестирования
|
Продолжительность тестирования, ч |
Массовая концентрация раствора вещества, мг/дм3 |
Среднеарифметическое измеренных значений интенсивности флуоресценции клеток водорослей, отн. ед., после тестирования в колбах |
Среднеарифметическое значение интенсивности флуоресценции клеток водорослей, отн. ед. |
Снижение интенсивности флуоресценции клеток водорослей, % |
|
|
№ 1 |
№ 2 |
||||
|
72 |
0,0 (контрольная) |
0,740 |
0,730 |
0,735 |
- |
|
0,1 |
0,730 |
0,740 |
0,735 |
0 |
|
|
1,0 |
0,580 |
0,590 |
0,585 |
20 |
|
|
10,0 |
0,065 |
0,067 |
0,066 |
91 |
|
|
100,0 |
0,00 |
0,00 |
0,00 |
100 |
|
|
1000,0 |
0,00 |
0,00 |
0,00 |
100 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение значений интенсивности флуоресценции клеток водорослей недопустимо (см. 7.6). В контрольной пробе интенсивность флуоресценции клеток водорослей в конце 72 ч тестирования увеличивается в 3,7 раза по сравнению с начальным значением. 2 Снижение интенсивности флуоресценции клеток водорослей рассчитано в соответствии с требованиями 7.5.4 настоящего стандарта с использованием формулы (6). |
|||||
Из данных таблицы ДК.1 следует, что диапазон концентраций вещества, в пределах которого необходимо проводить окончательное тестирование, составляет от 0,1 до 10,0 мг/дм3.
ДК.2 Результаты измерений по 7.4 настоящего стандарта окончательного тестирования вещества (см. 5.4.2) приведены в таблице ДК.2.
Таблица ДК.2 - Пример результатов измерений на основе окончательного тестирования
|
Продолжительность тестирования, ч |
Массовая концентрация раствора вещества, мг/дм3 |
Среднеарифметическое значение интенсивности флуоресценции клеток водорослей, отн. ед., в колбах |
Среднеарифметическое значение интенсивности флуоресценции клеток водорослей по показаниям в трех колбах, отн. ед. |
Снижение интенсивности флуоресценции клеток водорослей, % |
||
|
№ 1 |
№ 2 |
№ 3 |
||||
|
72 |
0,00 (контрольная) |
0,98 |
0,99 |
0,97 |
0,98 |
- |
|
0,10 |
0,97 |
0,98 |
0,99 |
0,98 |
0 |
|
|
0,25 |
0,92 |
0,94 |
0,93 |
0,93 |
5 |
|
|
0,50 |
0,88 |
0,87 |
0,89 |
0,88 |
10 |
|
|
1,00 |
0,77 |
0,78 |
0,76 |
0,77 |
21 |
|
|
2,50 |
0,54 |
0,55 |
0,53 |
0,54 |
45 |
|
|
5,00 |
0,11 |
0,10 |
0,09 |
0,10 |
90 |
|
|
7,50 |
0,00 |
0,00 |
0,00 |
0,00 |
100 |
|
|
10,00 |
0,00 |
0,00 |
0,00 |
0,00 |
100 |
|
|
Примечания 1 Знак «-», проставленный для контрольной пробы, означает, что снижение интенсивности флуоресценции клеток водорослей недопустимо (см. 7.6). В контрольной пробе интенсивность флуоресценции клеток водорослей в конце 72 ч тестирования увеличивается в 4,9 раза по сравнению с начальным значением. 2 Снижение интенсивности флуоресценции клеток водорослей рассчитано в соответствии с требованиями 7.5.4 настоящего стандарта с использованием формулы (6). |
||||||
Из данных таблицы ДК.2 видно, что при 72 ч тестировании 50 %-ное снижение интенсивности флуоресценции клеток водорослей не установлено ни для одной массовой концентрации раствора вещества. Поэтому 72 ч ЭК50 определяют, используя пробит-анализ аналогично примеру, приведенному в приложении ДД. Полученное значение 72 ч ЭК50, равно 2,78 мг/дм3.
Из данных таблицы ДК.2 видно, что 10 %-ному снижению интенсивности флуоресценции клеток водорослей при тестировании в течение 72 ч (72 ч ЭК10) соответствует значение массовой концентрации вещества 0,5 мг/дм3.
Приложение ДЛ
(справочное)
ДЛ.1 Сопоставление структуры настоящего стандарта со структурой примененного международного стандарта ИСО 8692:2004 приведено в таблице ДЛ.1. Указанное в таблице ДЛ.1 изменение структуры национального стандарта Российской Федерации относительно структуры примененного международного стандарта обусловлено приведением в соответствие требований, установленных в ГОСТ Р 1.7, и включением дополнительного к ИСО 8692:2004 метода определения токсичности для учета потребностей национальной экономики Российской Федерации.
Таблица ДЛ.1
|
Структура настоящего стандарта |
|||||
|
Раздел 1 |
Раздел 1 |
||||
|
Раздел 2 |
Раздел 2 |
||||
|
Раздел 3 |
Раздел 3 |
||||
|
Подразделы |
Пункты |
Подпункты |
Разделы |
Подразделы |
Пункты |
|
3.1 |
- |
- |
- |
||
|
3.2 |
- |
- |
- |
||
|
3.3 |
- |
- |
- |
||
|
3.4 |
- |
- |
- |
||
|
3.5 |
- |
- |
- |
- |
|
|
3.6 |
- |
- |
- |
||
|
3.7 |
- |
- |
- |
||
|
3.8 |
- |
- |
- |
||
|
Раздел 4 |
Подраздел 6.1 |
||||
|
Раздел 5 |
|||||
|
Подразделы |
Пункты |
Подпункты |
Разделы |
Подразделы |
Пункты |
|
5.1 |
- |
- |
- |
||
|
Приложение ДН |
- |
||||
|
5.2 |
- |
- |
- |
||
|
5.3 |
- |
- |
- |
||
|
Приложение ДА |
|||||
|
Раздел 6 |
|||||
|
Подразделы |
Пункты |
Подпункты |
Разделы |
Подразделы |
Пункты |
|
6.1 |
- |
- |
- |
||
|
6.2 |
- |
- |
- |
||
|
6.3 |
- |
- |
- |
||
|
6.4 |
- |
- |
- |
||
|
Раздел 7 |
|||||
|
Подразделы |
Пункты |
Подпункты |
Разделы |
Подразделы |
Пункты |
|
6.5 |
- |
- |
- |
||
|
6.6 |
- |
- |
- |
||
|
7.1 |
- |
- |
Приложение ДА |
||
|
7.2 |
- |
- |
Приложение ДБ |
||
|
7.3 |
- |
- |
- |
||
|
7.4 |
- |
- |
- |
||
|
7.5 |
- |
- |
- |
||
|
7.6 |
- |
- |
- |
||
|
- |
|||||
|
7.7 |
- |
- |
- |
||
|
Раздел 8 |
Пункт 6.5.5 |
||||
|
Раздел 9 |
|||||
|
Подразделы |
Пункты |
Подпункты |
Разделы |
Подразделы |
Пункты |
|
9.1 |
- |
- |
- |
||
|
9.2 |
- |
- |
- |
||
|
9.3 |
- |
- |
- |
||
|
Раздел 10 |
Пункт 5.6.2 |
||||
|
Раздел 11 |
Раздел 1, примечание 3 |
||||
|
Раздел 12 |
Приложение ДИ |
||||
|
Раздел 13 |
Подраздел 5.6 |
||||
|
Приложение А |
А.1 |
Приложение А |
|||
|
А.2 |
|||||
|
A.3 |
|||||
|
А.4 |
|||||
|
А.5 |
|||||
|
А.6 |
|||||
|
А.7 |
|||||
|
А.8 |
|||||
|
А.9 |
|||||
|
А.10 |
|||||
|
А.11 |
|||||
|
А.12 |
|||||
|
А.13 |
|||||
|
А.14 |
|||||
|
А.15 |
|||||
|
А.16 |
|||||
|
- |
Приложение ДА |
||||
|
- |
Приложение ДБ |
||||
|
- |
Приложение ДВ |
||||
|
- |
Приложение ДГ |
||||
|
- |
Приложение ДЕ |
||||
|
- |
Приложение ДЖ |
||||
|
- |
Приложение ДИ |
||||
|
- |
Приложение ДК |
||||
|
- |
Приложение ДЛ |
||||
|
- |
Приложение ДМ |
||||
|
- |
Приложение ДН |
||||
|
- |
Приложение ДП |
||||
|
Библиография |
Библиография |
||||
|
Примечания 1 Знак «-», проставленный для подраздела 3.5 ИСО 8692:2004, означает, что указанный термин не включен в настоящий стандарт. Полный текст подраздела 3.5 ИСО 8692:2004 с обоснованиями невключения в настоящий стандарт приведен в приложении ДМ. 2 Пункт 5.1 ИСО 8692:2004 содержит требования, предназначенные только для информации пользователей стандарта. Полный текст этих требований из пункта 5.1 приведен в дополнительном приложении ДН. |
|||||
Приложение ДМ
(справочное)
Требования международного стандарта, не вошедшие в настоящий стандарт
ДМ.1 Требования ИСО 8692:2004, не вошедшие в настоящий стандарт
В настоящий стандарт не включен термин 3.5 в связи с тем, что он дублирует термин 3.6, а также имеет противоречие, так как контрольная среда не должна содержать тестируемой матрицы.
Полный текст термина 3.5 приведен ниже:
«3.5 контрольная питательная среда (the control culture media): Смесь воды, питательных веществ и испытуемой пробы».
Приложение ДН
(справочное)
Информация для пользователей стандарта
ДН.1 В пункте 5.1 ИСО 8692:2004 приведена следующая информация для пользователей стандартом, при этом ИСО 8692:2004 обращает особое внимание на то, что коммерческие наименования штаммов и коллекций культур (гранул водорослей) даются только в качестве примеров подходящих штаммов (гранул водорослей), имеющихся в продаже. Эта информация приводится только для удобства пользователей настоящим стандартом и не означает поддержки этих продуктов со стороны ИСО:
а) в части обозначения водорослей:
Desmodesmus subspicatus (86.81 SAG) и указывается, что этот вид обычно известен как Scenedesmus subspicatus Chodat;
Pseudokirchnehella subcapitata (Korshikov) Hindak (ATCC 22662, CCAP 278/4 или 61.81 SAG) и указывается, что этот вид обычно известен как Selenastrum capricomutum Prinz.
б) в части рекомендуемых штаммов водорослей, которые имеются в альгологически чистых нестерильных культурах из следующих коллекций:
- SAG: Collection of Algal Cultures
Inst. Plant Physiology
University of Gottingen
Nikolausberger Weg 18
D-37073 Gottingen
Germany
- ATCC: Amerikan Type Culture Collection
12301 Parklane Drive
Rockville
Maryland 20852
USA
- CCAP: Culture Centre of Algae and Protozoa
Freshwater Biological Association
The Ferry House
Ambleside
Cumbria LA22 OLP
United Kingdom
Algotheque du laboratorie de cryptogamie
Musèum National d'Historie Naturelle
12, rue Buffob
75005 Paris
France
Чистые культуры, как указано в ИСО 8692:2004, могут храниться на питательной среде, приведенной в настоящем стандарте, однако необходимо периодическое обновление культуры водорослей. Исходная культура водорослей может храниться в течение длительных периодов времени на обогащенных средах, рекомендуемых коллекцией культур. Альтернативно водоросли могут храниться в течение нескольких месяцев в альгинатных гранулах без потери их жизнеспособности. Водоросли могут быть легко высвобождены из гранул, когда необходимо провести тестирование на токсичность.
Гранулы водорослей, поставляются MICROBIOTESTS Ins., Venecoweg 19, 9810 Nazareth, Belgium. Могут также использоваться эквивалентные продукты, если их применение приводит к таким же результатам тестирования.
ДН.2 В Российской Федерации штаммы водорослей имеются в альгологически чистых нестерильных культурах из следующих коллекций, при этом коммерческие наименования штаммов и коллекций культур даются только в качестве примеров подходящих штаммов, имеющихся в продаже, а также данная информация приводится только для удобства пользователей настоящим стандартом и не означает поддержки только этих продуктов:
Институт физиологии растений им. К.А. Тимирязева РАН,
Коллекция одноклеточных водорослей (IPPAS)
Номер коллекции по базе данных: 50
Почтовый адрес: 127276, Москва, Ботаническая ул., 35
Число родов 60, число видов 150, число штаммов 350
Тел. (095) 977-93-72, 903-93-46
Факс: (095) 977-80-18, 977-93-72
URL: http://WWW.ippas.ru
Институт биологии внутренних вод им. И.Д. Папанина
РАН (ИБВВ)
Коллекция зеленых водорослей (ВОРОК)
Номер коллекции по базе данных: 31
Почтовый адрес: 152742 Ярославская обл., Некоузский р-н, п. Борок, 45-8.
Число родов 6, число видов 11, число штаммов 11
Тел. 24-6-59
Факс: нет
E-mail: elys@ibiw. Yaroslavl.ru
Институт биологии моря РАН (ИБМ РАН)
Почтовый адрес: 690041, Владивосток-41, ул. Пальчевского, 16
Коллекция культур микроводорослей
Номер коллекции по базе данных: 34
Число родов 15, число видов 22
Тел. (4232) 310-905
Факс (4232)-310-900
E-mail: inmarbio@mail.primorye.ru
Санкт-Петербургский государственный университет,
Биологический Институт, коллекция водорослей - CALU
Номер коллекции по базе данных: 95
Почтовый адрес: 198504, Старый Петергоф, Ораниенбаумское шоссе, 2
Наименование коллекции: CALU
Число родов 48, число видов нд, число штаммов 396
Тел. (812) 427-97-40
Факс: (812) 427-73-10
E-mail: aleksander.Pinevich@paloma.spbu.ru
ДН.3 В государствах - участниках Содружества Независимых Государств также имеются штаммы водорослей в альгологически чистых нестерильных культурах из следующих коллекций, при этом коммерческие наименования штаммов и коллекций культур даются только в качестве примеров подходящих штаммов, имеющихся в продаже, а также данная информация приводится только для удобства пользователей настоящим стандартом и не означает поддержки только этих продуктов:
Институт биологии южных морей им. А.О. Ковалевского
Национальная академия наук Украины
Почтовый адрес: 99011, Украина, Севастополь, пр. Нахимова, 2
Крым, Украина
Коллекция культур микроводорослей
Видов 57, 72 штамма
Тел. +38-0692-55-07-95, +38-068-47-53-790
Факс +38-0692-557813
Одесский филиал ИАН Украины
Почтовый адрес: 65044, Украина, Одесса, Французский бульвар, 29
Коллекция культур микроводорослей
Тел.(048) 722-08-81
Приложение ДП
(справочное)
Таблица ДП.1
|
Обозначение ссылочного национального, межгосударственного стандарта |
Степень соответствия |
Обозначение и наименование ссылочного международного стандарта |
|
IDT |
ИСО/МЭК 17025-2005 «Общие требования к компетентности испытательных и калибровочных лабораторий» |
|
|
ГОСТ Р 51568-99 (ИСО 3310-1-90) |
MOD |
ИСО 3310-1:1990 «Сита лабораторные. Технические требования и методы испытаний Часть 1. Сита лабораторные из металлической проволочной сетки» |
|
NEQ |
ИСО 5667-1:1982 «Качество воды. Отбор проб. Часть 1. Руководство по составлению программы отбора проб»1 |
|
|
ИСО 5667-2:1991 «Качество воды. Отбор проб. Часть 2. Руководство по методам отбора проб»1 |
||
|
ИСО 5667-3:1994 «Качество воды. Отбор проб. Часть 3. Руководство по хранению и обращению с пробами»2 |
||
|
NEQ |
ИСО 5667-5:1991 «Качество воды. Отбор проб. Часть 5. Руководство по отбору проб питьевой воды и воды, используемой в технологии производства пищевых продуктов и напитков»3 |
|
|
ГОСТ Р 52501-2005 (ИСО 3696:1987) |
MOD |
ИСО 3696:1987 «Вода для лабораторного анализа. Технические требования и методы испытаний» |
|
MOD |
MP 60 «Метрологическое регулирование весоизмерительных датчиков» |
|
|
- |
* |
|
|
- |
* |
|
|
ГОСТ Р 53910-2010 (ИСО 10253:2006) |
MOD |
ИСО 10253:2006 «Качество воды. Испытание на замедление роста морских водорослей Sceletonema costatum и Phaeodactylum tricomutum» (Greville) Cleve» |
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
NEQ |
ИСО 1042:1998 «Посуда лабораторная стеклянная. Мерные колбы с одной меткой» |
|
|
ИСО 4788:1980 «Посуда лабораторная стеклянная. Градуированные мерные цилиндры»4) |
||
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
NEQ |
ИСО 6353-1:1982 «Реактивы для химического анализа. Часть 1. Общие методы испытаний» |
|
|
ИСО 6353-3:1987 «Реактивы для химического анализа. Часть 3. Технические условия. Вторая серия» |
||
|
NEQ |
ИСО 6353-3:1987 «Реактивы для химического анализа. Часть 3. Технические условия. Вторая серия» |
|
|
NEQ |
ИСО 6353-1:1982 «Реактивы для химического анализа. Часть 1. Общие методы испытаний» |
|
|
ИСО 6353-2:1983 «Реактивы для химического анализа. Часть 2. Технические условия. Первая серия» |
||
|
- |
* |
|
|
- |
* |
|
|
NEQ |
ИСО 6353-1:1982 «Реактивы для химического анализа. Часть 1. Общие методы испытаний» |
|
|
ИСО 6353-3:1987 «Реактивы для химического анализа. Часть 3. Технические условия. Вторая серия» |
||
|
- |
* |
|
|
NEQ |
ИСО 6353-2:1983 «Реактивы для химического анализа. Часть 2. Технические условия. Первая серия» |
|
|
- |
* |
|
|
NEQ |
ИСО 6353-1:1982 «Реактивы для химического анализа. Часть 1. Общие методы испытаний» |
|
|
ИСО 6353-3:1987 «Реактивы для химического анализа. Часть 3. Технические условия. Вторая серия» |
||
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
NEQ |
ИСО 6353-2:1983 «Реактивы для химического анализа. Часть 2. Технические условия. Первая серия» |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
MOD |
ИСО 1773:1976 «Посуда лабораторная стеклянная. Узкогорлые колбы для кипячения»5 |
|
|
ИСО 3819:1985 «Посуда лабораторная стеклянная. Стаканы» |
||
|
ИСО 4797:1981 «Посуда лабораторная стеклянная. Колбы с коническими шлифами»6 |
||
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
- |
* |
|
|
NEQ |
ИСО 386:1977 «Термометры жидкостные стеклянные лабораторные. Принципы проектирования, конструирования и использования» |
|
|
ИСО 1770:1981 «Термометры палочные общего назначения» |
||
|
ИСО 1771:1981 «Термометры с закрытой шкалой общего назначения» |
||
|
MOD |
ИСО 835-1-81 «Посуда лабораторная стеклянная. Мерные пипетки градуированные. Часть 1. Общие требования»7 |
|
|
1) Заменен на ИСО 5667-1:2006. 2) Заменен на ИСО 5667-3:2003. 3) Заменен на ИСО 5667-5:2006. 4) Заменен на ИСО 4788:2005. 5) Заменен на ИСО 1773:1997. 6) Заменен на ИСО 4797:2004. 7) Заменен на ИСО 835:2007. * Соответствующий международный стандарт отсутствует. Примечание - В настоящей таблице использованы следующие условные обозначения степени соответствия стандартов: - IDT - идентичные стандарты; - MOD - модифицированные стандарты; - NEQ - неэквивалентные стандарты. |
||
Библиография
|
ИСО 8692:2004 |
Качество воды. Испытание на торможение роста водорослей в пресной воде с применением одноклеточных зеленых водорослей |
|
|
(ISO 8692:2004) |
(Water quality - Freshwater algal growth inhibition test with unicellular green algae) |
|
|
[2] |
ПНД Ф 12.1:2:2.2:2.3.2-03* |
Отбор проб почв, грунтов, осадков биологических очистных сооружений, шламов промышленных сточных вод, донных отложений искусственно созданных водоемов, прудов-накопителей и гидротехнических сооружений. Экологический Центр аналитического контроля, М., 2003 |
|
[3] |
ПНД Ф 12.15.1-08* |
Методические указания по отбору проб для анализа сточных вод. Утверждены ФГУ «Федеральный центр анализа и оценки техногенного воздействия» Ростехнадзора, от 18 апреля 2008 г. |
|
[4] |
НВН 33-5.3.01-85* |
Инструкция по отбору проб для анализа сточных вод. Утверждена приказом Минводхоза СССР от 13 июля 1985 г. |
_______________
* Действует до утверждения аналогичного национального стандарта.
Ключевые слова: вода, природная пресная вода, питьевая вода, сточная вода, поверхностная вода, подземная вода, вещества, отработанные буровые растворы, твердые промышленные отходы, донные отложения, грунты, почвы, водные вытяжки объектов исследования, водные растворы веществ, зеленые водоросли, пресноводные водоросли, токсичность, испытание, тестирование